血清清蛋白/球蛋白比值联合血小板/淋巴细胞比值预测食管鳞状细胞癌预后的价值
2022-11-10陈赛华施民新樊怿辉居冠军郑丽云
陈赛华,施民新,樊怿辉,居冠军,郑丽云
江苏省南通市肿瘤医院/南通大学附属肿瘤医院胸外科,江苏南通 226361
食管癌是全球第七大常见的恶性肿瘤,也是导致癌症相关死亡的第六大常见原因,具有恶性程度高、侵袭性强、预后差等特点[1-3]。最近的统计数据表明,临床Ⅱ~Ⅲ期食管癌患者在接受新辅助化疗和根治性手术切除后的5年总体生存率为10%~30%[4-6]。食管癌主要包括食管鳞状细胞癌(ESCC)和食管腺癌两种组织学类型,其中ESCC在我国占90%以上。结合我国食管癌的发病特点,寻找预测患者复发与预后的生物标志物,以帮助临床医生制订更有效的个体化治疗策略具有极为重要的临床意义。除了肿瘤最大径、浸润深度、淋巴结转移等肿瘤生物学特征外,全身营养免疫状态与慢性炎症反应的相互作用在癌症的进展与转移中也起着至关重要的作用[7-8]。近年来,越来越多的研究发现,反映机体炎症-免疫-营养的血液学参数,如中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR)和单核细胞/淋巴细胞比值(MLR)等对包括食管癌在内的多种恶性肿瘤的预后具有潜在的预测价值[9-14]。此外,作为人类血清中的两种主要蛋白质——清蛋白和球蛋白分别反映了个体的营养状况与免疫状态。相关研究已表明,血清清蛋白/球蛋白比值(AGR)可以作为宫颈癌[15]、膀胱癌[16]、肾癌[17]、非小细胞肺癌[18]等恶性肿瘤患者预后的预测因子。然而,很少有研究报道AGR在ESCC中的临床意义。本研究分析了接受手术治疗的ESCC患者的临床信息与术前相关血液学参数,旨在探讨AGR与其他炎症、免疫指标作为预测患者预后标志物的价值。
1 资料与方法
1.1一般资料 选择2014年3月至2017年3月因食管癌于本院接受根治性手术治疗的125例ESCC患者为研究对象。纳入标准:(1)所有患者行根治性食管癌R0切除+标准淋巴结清扫,并经术后组织病理学检查证实为ESCC;(2)术前未行新辅助放疗、化疗;(3)术前影像学检查证实无远处转移;(4)无其他系统的原发性恶性肿瘤,无其他可能严重影响血常规、血生化指标检测的慢性疾病,如自身免疫性疾病、血液系统疾病、终末期肝病、慢性肾功能不全等。排除标准:(1) 临床病理资料、实验室检查结果或随访数据缺失;(2)术后出现严重并发症或院内死亡。纳入的研究对象男75例(60.0%),女50例(40.0%);平均(62.6±9.6)岁;上段食管癌41例(32.8%),中段食管癌63例(50.4%),下段食管癌21例(16.8%);高、中、低分化癌分别为19例(15.2%)、29例(23.2%)和77例 (61.6%);淋巴结转移率为39.2%(49/125);根据美国癌症联合委员会(AJCC)第7版病理学TNM分期标准分期,Ⅰ期16例(12.8%),Ⅱ期65例(52.0%),Ⅲ期44例 (35.2%)。所有研究对象均自愿参与本研究,并签署知情同意书。本研究严格遵守患者隐私保密准则,并通过本院医学伦理委员会审查批准(LW2022008)。
1.2方法 收集所有患者的人口学资料、临床及病理特征资料,主要包括年龄、性别、肿瘤位置、组织学分化程度及TNM分期情况等。收集患者所有实验室检查数据,包括术前1周的血常规及生化指标检测结果。所有患者术后根据病理分期及肿瘤位置,选择接受45.0~50.4 Gy剂量的放疗或以顺铂和5-氟尿嘧啶为基础的辅助化疗。患者术后定期至本院门诊随访,每3~6个月进行血清肿瘤标志物检测及胸、腹、盆腔CT扫描,如发现疑似肿瘤复发或转移,需行正电子发射断层PET-CT扫描或胃镜下活检,以进一步明确诊断。患者的随访结果及术后生存状态通过查阅门诊和住院的医疗记录,并结合电话探访确定。本研究以患者手术之日为随访起点,观察总体生存期(OS),即患者手术之日至术后因任何原因死亡或末次随访的时间总长。
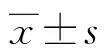
2 结 果
2.1ROC曲线确定不同血液学指标对ESCC患者预后的预测效能 所有研究对象术前血清清蛋白水平为(38.9±5.4)g/L,球蛋白水平为(28.7± 5.3)g/L,外周血中性粒细胞计数为(4.20±1.59)×109/L,淋巴细胞计数为(1.66±0.62)×109/L,单核细胞计数为0.35(0.23,0.44)×109/L。ROC曲线分析结果显示AGR、NLR、PLR和MLR预测ESCC患者OS的cut-off值分别为1.57、1.93、126.80和0.21,AUC分别为0.653 (95%CI:0.556~0.750)、0.587(95%CI:0.591~0.766)、0.647(95%CI:0.548~0.747)和0.612(95%CI:0.511~0.712)。AGR的AUC明显大于其他3项指标的AUC(P<0.05)。见图1。

图1 4项血液学指标预测ESCC患者OS的ROC曲线
2.2不同血液学指标ESCC患者的生存情况 所有研究对象的中位随访时间为24.0个月(13.0~40.0),中位OS为36.0个月(95%CI:26.4~45.6)。4项血液学指标与ESCC患者预后关系的Kaplan-Meier曲线见图2。基于AGR的cut-off值,将所有ESCC患者分为AGR≤1.57组(52例)与AGR>1.57组(73例),生存分析表明两组患者的OS分别为22.0个月(95%CI:14.2~29.8)和43.0个月(95%CI:36.1~49.9),AGR≤1.57组的OS明显短于AGR>1.57组,差异有统计学意义(χ2=10.743,P=0.001),见图2A。基于NLR的cut-off值,将所有患者分为NLR>1.93组(70例)与NLR≤1.93组(55例),生存分析表明两组患者的OS分别为25.0个月(95%CI:13.5~36.5)和45.0个月(95%CI:32.8~57.2),NLR>1.93组的OS明显短于NLR≤1.93组,差异有统计学意义(χ2=4.612,P=0.032),见图2B。基于PLR的cut-off值,将所有ESCC患者分为PLR≤126.80组(50例)与PLR>126.80组(75例),生存分析表明两组患者的OS分别为43.0个月(95%CI:36.2~49.8)和23.0个月(95%CI:10.9~35.1),PLR>126.80组的OS明显短于PLR≤126.80组(χ2=8.983,P=0.003),见图2C。基于MLR的cut-off值,将所有ESCC患者分为MLR≤0.21组(58例)与MLR>0.21组(67例),生存分析表明两组患者的OS分别为38.0个月(95%CI:20.9~55.1)和29.0个月(95%CI:15.6~42.4),差异无统计学意义(χ2=2.369,P=0.124),见图2D。
2.3Cox回归分析ESCC患者OS的预测因素 单变量、多变量Cox回归分析结果显示,年龄≥60岁、TNM分期为Ⅲ期、AGR≤1.57和PLR>126.80是ESCC患者OS短的独立预测因素(P<0.05)。单变量、多变量Cox回归分析赋值表见表1,单变量、多变量Cox回归分析结果见表2、3。

表1 单变量、多变量Cox回归分析赋值

注: A、B、C、D分别为AGR、NLR、PLR和MLR预测ESCC患者OS的Kaplan-Meier曲线。

表2 单变量Cox回归分析ESCC患者OS的预测因素

表3 多变量Cox回归分析ESCC患者OS的预测因素
2.4AGR联合PLR对ESCC患者OS的预测价值 根据AGR和PLR的cut-off值,设计了一个AGR联合PLR评分(APS评分)。具体计分标准如下:AGR>1.57且PLR≤126.80为 0分;AGR≤1.57且PLR>126.80为1分;AGR≤1.57且PLR>126.80为2分。生存分析证实APS评分越高,ESCC患者预后越差,0、1、2分组OS分别为49.0个月(95%CI:36.0~60.9)、36.0个月(95%CI:22.1~49.9)和13.0个月(95%CI:9.1~16.9),组间差异均有统计学意义(0分组与1分组:χ2=4.306,P=0.038;1分组与2分组:χ2=9.717,P=0.002;0分组与2分组:χ2=20.822,P<0.001)。见图3。
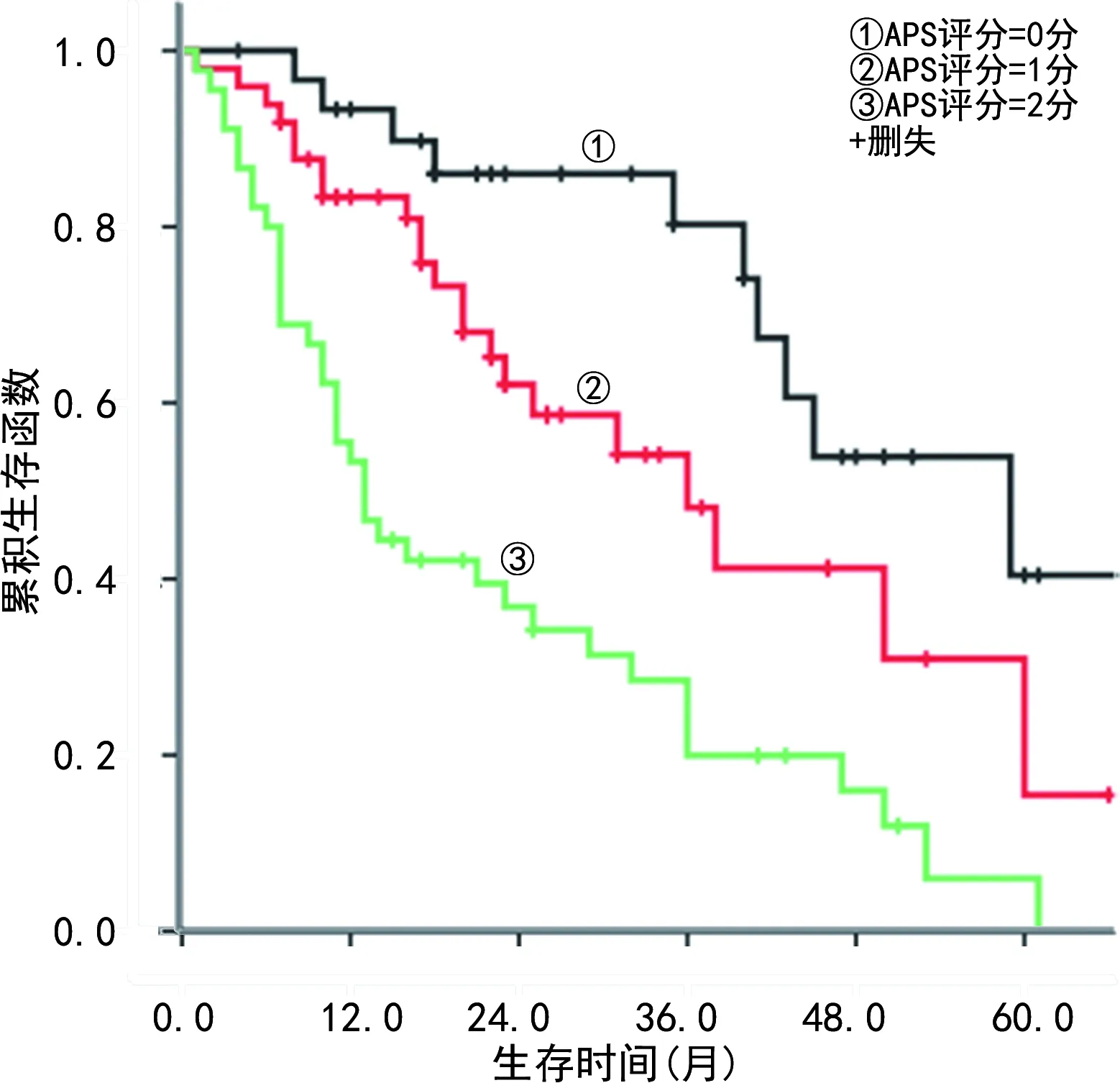
图3 APS评分预测ESCC患者OS的Kaplan-Meier曲线
3 讨 论
无法准确预后分层是目前限制肿瘤个体化治疗发展的主要障碍,寻找简便、可靠的血液学标志物对于肿瘤患者的临床决策有着重要的意义。近年来,越来越多反映机体炎症-免疫-营养状态的血液学指标被报道可以预测食管癌等多种恶性肿瘤患者的复发、转移与长期生存,并展示了一定的临床应用前景[9-10,12-13]。本研究主要探讨了AGR、NLR、PLR、MLR这4种血液学指标与ESCC患者预后的关系。结果表明,术前AGR和PLR是预测ESCC患者预后的有效指标,二者联合能够进一步分层分析ESCC患者的预后。
ROC曲线分析结果显示,与NLR、PLR和MLR相比,AGR具有更大的AUC,提示其在预测ESCC患者预后方面优于其他3项指标。AGR结合了患者血清清蛋白与球蛋白水平,是一项综合评估机体全身炎症-免疫-营养状态的代表性指标。血清清蛋白由肝脏合成,被广泛用于机体营养状况与营养消耗的评价,与恶性肿瘤患者的复发、转移及不良预后关系密切[20-21]。此外,有研究结果表明,血清清蛋白还可以通过调控白细胞介素-6(IL-6)、肿瘤坏死因子(TNF)等炎症因子参与机体的炎症反应[22]。相比之下,血清球蛋白则包含了免疫球蛋白、补体、急性时相反应蛋白和细胞因子等多种蛋白质,它们在机体炎症与免疫反应中具有极为重要的作用[23-24]。血清球蛋白水平升高可以被认为是机体慢性炎症反应的标志,反映了各种炎症细胞因子的积累情况。与其他血液学指标相比,AGR更加全面地体现了肿瘤患者的全身炎症反应与免疫营养状况,因此,AGR或许可作为评估肿瘤患者预后更为有效、可靠的预测指标。目前,已有多项研究证实了AGR对肝细胞癌、胃癌、肺癌等患者预后的预测价值[25-27]。MIURA等[28]以1.40作为AGR的cut-off值,分析了术前AGR对尿路上皮癌患者预后的预测价值,结果显示AGR降低与进展期肿瘤及不良临床结局有关,是患者术后复发与长期生存的独立预测因素。ATSUMI等[29]报道了AGR在105例接受根治性手术切除的Ⅰ~Ⅲ期ESCC患者中的预测作用,基于确定的cut-off值将所有患者分为AGR≤1.48组和AGR>1.48组,发现两组患者的术后并发症总发生率比较,差异无统计学意义(P>0.05),但AGR≤1.48组的5年OS与无复发生存期(RFS)均明显短于AGR>1.48组。尽管AGR的cut-off值有所不同,但本研究进一步证实了之前的发现,表明术前低AGR预示着ESCC患者预后不良。
PLR作为一项可靠的血液学指标,其在ESCC患者肿瘤进展与预后预测中的作用已被证实。既往研究结果近乎一致地显示术前血清PLR升高与ESCC患者术后复发、转移及不良预后有关[12,30-32]。本研究通过ROC曲线发现,PLR对ESCC患者OS的预测价值仅次于AGR,Kaplan-Meier曲线进一步证实根据确定的PLR cut-off值,能够较好地区分不同患者的预后。基于以上这些结果,本研究也尝试探索了AGR联合PLR对ESCC患者OS的预测价值。结果表明,二者联合检测进一步提高了对ESCC患者OS的预测效能,为患者提供了更为精确的预后分层。
综上所述,术前AGR和PLR是预测ESCC患者预后的可靠血液学指标,二者联合可以更为准确地识别预后不良患者,有望成为有临床应用前景的预后指标。
