白洋淀沉积物重金属潜在生态风险及生物可利用性分析*
2022-11-09古小治陈开宁
刘 成,黄 蔚,古小治,张 雷, 陈开宁,2**
(1:中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,南京 210008) (2:苏州科技大学,江苏水处理技术与材料协同创新中心,苏州 215009)
近二十多年来,我国在河流、湖泊等水环境治理中取得了诸多重要进展,尤其是在水体富营养化控制方面取得了显著成效,全国地表水环境质量不断提升,水质不达标断面比例逐渐降低,多个富营养化湖泊水质状况总体好转[1-2]. 然而,根据Huang等[3]对我国142个湖库的研究表明,虽然富营养化状况总体逐渐改善,但水体重金属污染依然较为突出,部分区域甚至呈现加重趋势. 湖泊水体中重金属大多以颗粒物形式沉降至沉积物中[4],由此导致沉积物中重金属不断富集,成为水体重金属重要的“汇”. 而在沉积物-水界面环境发生改变时,重金属又可能以离子扩散、再悬浮等形式向上覆水体中释放[5-6],导致沉积物成为水体重金属污染重要的“源”. 因此,在湖泊水体重金属迁移转化过程中,沉积物同时扮演着重金属的汇和源的角色,并不断发生着转变.
沉积物中重金属的源-汇转换现象在浅水湖泊中尤为突出,一方面,浅水湖泊沉积物-水界面环境极易在人为和自然因素下随季节发生转变,如藻类和水生植物大量降解期间水体及沉积物氧消耗加剧[7-8],由此可能导致一些Fe/Mn氧化物结合态金属溶解释放[9];另一方面,浅水湖泊长期存在的风浪、底栖等扰动过程导致大量沉积物再悬浮,进入水体的沉积物颗粒由还原环境向氧化环境转变,从而可能导致一些有机物及硫化物结合态金属释放[10]. 此外,浅水湖泊相比深水湖泊更易发生富营养化,我国浅水湖泊大多处于中营养至富营养状态[11],在富营养化发展过程中,藻类和水生植物大量繁殖、降解导致水体及沉积物中有机质含量上升,近三十年来我国多个湖库呈现有机质污染不断加重趋势[12],不断升高的有机质进一步加剧了沉积物颗粒与重金属的耦合和释放过程[13]. 浅水湖泊中不断发生的上述沉降、再悬浮、释放等过程以及不断发展的富营养化进程使得其沉积物重金属更加容易被生物利用,从而威胁水生态安全. 因此,在对重金属污染状况进行评估的同时,还需要对其生物可利用性进行更加深入地研究.
使用潜在生态风险指数法等基于背景值的评估方法可以较为直观地反应沉积物重金属污染状况[14],而沉积物重金属对水环境的影响及对水生生物的威胁则需要进一步研究. 如通过对沉积物重金属形态的解析,可以揭示其中可交换态和易受氧化-还原环境影响的结合态赋存特征及释放潜力[9]. 此外,湖泊水体及沉积物中多种常见有害重金属(主要包括Cd、Cu、Ni、Pb、Zn等)可与还原态硫结合,从而降低其生物可利用性,减小对水生态的威胁. 因而,研究人员进一步提出基于酸可挥发性硫(acid volatile sulfide, AVS)和同步可提取金属(simultaneously extracted metals, SEM)的重金属生物可利用性评价方法,该方法可用于评价与沉积物重金属生物可利用性直接相关的底栖动物可能受到的潜在毒性影响,在国内外沉积物重金属生物可利用性研究中获得了大量应用[15-17].
白洋淀是华北平原最大的浅水湖泊湿地,素有“华北之肾”之称,对区域气候调节、水利调控、生物多样性保护等具有重要的作用. 自1960s以来,由于经济发展和人类活动的影响,白洋淀水生态环境质量逐渐退化[18]. 研究人员针对白洋淀水生态环境退化及恢复做了大量工作,包括水环境质量[19]、生物资源[20]、内源污染[21]、有机污染[22]等方面. 在重金属污染方面,多位研究人员对白洋淀水体及沉积物重金属分布特征及潜在生态风险等进行了研究,如高秋生等[23]和白红军等[24]的研究均表明,白洋淀沉积物中As和Cd污染相对较为突出,且北部烧车淀等区域污染较重;李必才等[25]认为沉积物具有一定的Pb和Zn污染;赵钰等[26]则发现沉积物中Cd的可交换及碳酸盐结合态和Fe/Mn氧化物结合态比例较高;薛培英等[27]的研究进一步揭示As在间隙水中浓度较高. 以上研究为白洋淀沉积物重金属研究及整治提供了丰富的数据和坚实的支撑. 然而,目前对白洋淀沉积物重金属的研究远少于氮、磷营养盐等方面的研究[18],已有研究多集中于部分重金属的污染分析,仍需要在此基础上更加深入地分析多种重金属污染赋存总量、形态及其对水环境的影响,剖析典型污染重金属的生物可利用性及其对水生态的潜在威胁. 因此,本研究在对白洋淀多个区域沉积物重金属表层及垂向分布和潜在生态风险研究的基础上,结合重金属形态和AVS-SEM分析,进一步解析其生物可利用性,以期为白洋淀沉积物重金属研究及整治提供进一步支撑.

图1 白洋淀沉积物柱样采样点位分布Fig.1 Distribution of the sediment column sampling sites in Lake Baiyangdian
1 材料与方法
1.1 柱状样品采集及预处理
为研究白洋淀沉积物重金属潜在生态风险及生物可利用性,于2017年5月在白洋淀主要水域设置了11个采样点位,采样点位所在区域包括烧车淀区域(B1~B4)、郭里口区域(B5、B6)、王家寨区域(B7、B8)和南部淀区(B9、B10、B11),点位具体分布状况见图1. 使用柱状重力采样器(Φ90 mm×500 mm)原位采集了每个点位柱状沉积物样品,柱样深度均达到20 cm以上. 柱样采集后立即密封,并保持原状转运至实验室进行分析.
沉积物柱样转运至实验室后,按照0~2、2~4、4~6、6~8、8~10、10~15、15~20 cm间隔对柱状样品进行切割分层,分层后的样品立即置于聚乙烯样品袋混匀. 随后,立即取部分0~2 cm新鲜样品置于50 mL离心管,离心获取表层沉积物间隙水样品,使用0.45 μm滤膜过滤后,置于10 mL离心管,加一滴浓硝酸(优级纯)保存备测. 此外,分取0~2、2~4、4~6、6~8、8~10 cm部分新鲜样品立即在厌氧条件下分析AVS和SEM. 所有剩余分层样品置于真空冷冻干燥机进行干燥,干燥后的沉积物样品使用玛瑙研钵研磨,并过0.15 mm尼龙分样筛备测.
1.2 分析测试方法
1.2.1 AVS和SEM分析 对表层10 cm沉积物样品按照2 cm分层后,分析了其中AVS和SEM含量. 首先使用冷扩散法分析了AVS含量[28]:取新鲜表层泥样(5±0.5) g加入具塞敞口瓶中,将装有5 mL碱性乙酸锌的比色管(10 mL)置于瓶中,使用氮气吹脱形成无氧环境,加入6 mol/L盐酸15 mL和0.1 mol/L抗坏血酸溶液2 mL,充分提取16 h后,使用对氨基二甲基苯胺光度法分析碱性乙酸锌提取液中的S2-[29],进而获得AVS含量. 将沉积物浸提后的溶液经0.45 μm滤膜过滤后,分析其重金属(Cd、Cu、Ni、Pb、Zn)含量得到SEM含量.
1.2.2 沉积物重金属形态分级 参照BCR金属形态分级方法[30]对表层2 cm沉积物样品重金属形态进行了分析,将As、Cd、Cr、Cu、Ni、Pb、Zn 7种常见有害重金属形态分级为:F1,可交换态及碳酸盐结合态(0.11 mol/L 醋酸提取);F2,铁/锰氧化物结合态(0.1 mol/L 盐酸羟胺提取);F3,有机物及硫化物结合态(1 mol/L醋酸铵提取);F4,残渣态. 其中,F1、F2和F3形态总体上为可转化态,分别在酸性、还原性和氧化性增强时有可能溶解释放至间隙水及上覆水中[9],从而增强金属的生物可利用性,F4形态则较为稳定.
1.2.3 沉积物和水样重金属及总有机碳(TOC)分析 经冻干过筛后的沉积物样品置于PTFE消解器皿中,使用盐酸、氢氟酸、硝酸、高氯酸消解后,用电感耦合等离子体光谱仪(ICP-AES,PerkinElmer DV4300,USA)分析Fe、Mn、Ti、V和Zn,检测限分别为5、0.5、1、2和2 mg/kg;使用电感耦合等离子体质谱仪(ICP-MS; Agilent 7700x, USA)分析Cr、Co、Ni、Cu、As、Mo、Cd、Sb、Tl和Pb,检测限分别为0.1、0.01、0.05、0.02、0.1、0.05、0.01、0.05、0.02和0.01 mg/kg. 沉积物中Hg的测定使用Hydra-c型全自动测汞仪(Teledyne Leeman Labs,USA)完成(检测限0.005 mg/kg). 共计分析了沉积物中16种重金属(其中As为类金属),并着重分析了As、Cd、Cr、Cu、Hg、Ni、Pb、Zn这8种常见有害重金属在间隙水中的浓度分布(ICP-MS,水样中各金属检测限分别为0.05、0.005、0.05、0.01、0.02、0.03、0.01、0.1 μg/L). 研究区域沉积物及间隙水中各重金属含量均高于所用方法检测限. 沉积物重金属分析过程中,每个消解批次随即抽取10%的样品进行平行样质量控制,平行样相对偏差确保在5%以内,大于5%时对整个批次样品重新进行消解及分析. 每个消解批次使用水系沉积物成分分析标准物质(GSD-9)保证精确度,并同步处理2份空白样品. 以上分析方法参考美国环境保护署(USEPA)的标准方法(Method 200.7、6020B)[31-32],并得到中国合格评定国家认可委员会认可(CNAS L 1628),样品分析由中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室公共技术服务中心完成. 此外,使用重铬酸钾容量法对沉积物TOC进行了分析[29].
1.3 沉积物重金属风险及生物可利用性分析
1.3.1 潜在生态风险分析 潜在生态风险指数(RI)分析参考Håkanson[14]于1980年提出的方法,基于该方法,结合我国《土壤环境质量:农用地土壤污染风险管控标准(试行)》(GB 15618—2018)和《农用污泥污染物控制标准》(GB 4284-2018)等土壤及沉积物重金属污染整治过程中常用参考标准,着重分析了我国沉积物及土壤中8种常见有害重金属(As、Cd、Cr、Cu、Hg、Ni、Pb和Zn)的潜在生态风险,分析过程中使用河北省土壤重金属背景值[33]作为参考. 沉积物重金属RI值范围所对应的潜在生态风险为:RI<150,低潜在生态风险; 150≤RI<300,中潜在生态风险; 300≤RI<600,高潜在生态风险; 600≤RI<1200,很高潜在生态风险;RI≥1200,极高潜在生态风险.
1.3.2 生物可利用性分析 一方面,针对前述8种有害重金属在沉积物中的赋存形态及在间隙水中的分布进行了解析,研究重金属潜在释放形态特征;另一方面,针对这些有害重金属中易与还原态硫结合的Cd、Cu、Ni、Pb、Zn等[15],使用ΣSEM-AVS、ΣSEM/AVS及ΣSEMx,oc(ΣSEM-AVS/fOC)值评估其生物可利用性[15,34],其中,ΣSEM-AVS<0 μmol/g(dw)或ΣSEM/AVS<1表示沉积物重金属无毒性;ΣSEM-AVS>0 μmol/g(dw)或ΣSEM/AVS>1表示沉积物重金属可能对底栖生物或其他生物具有一定的潜在毒性;ΣSEM-AVS>5 μmol/g(dw)或ΣSEM/AVS>2表示沉积物重金属具有显著毒性;此外,鉴于有机质与重金属的耦合特征,当ΣSEMx,oc(ΣSEM-AVS/fOC)超过147.5 μmol/g(OC)时表示沉积物中重金属具有较大生物可利用性.
1.4 数据分析方法
点位图由Surfer软件(Golden software, Golden, CO, USA)进行绘制;数据图的绘制和Spearman相关性图制作使用Origin 2021(Origin Lab, Northampton, MA, USA)软件完成;使用Kruskal-Wallis单因素方差分析方法对沉积物重金属剖面差异性进行分析,使用聚类分析法(平方欧氏距离)对重金属关系及来源进行统计分析,以上统计分析使用SPSS 26(IBM, New York, NY, USA)软件完成.
2 结果与分析
2.1 沉积物重金属含量空间分布及垂向变化特征
对各点位表层10 cm沉积物中重金属含量均值进行分析发现(附表Ⅰ),各金属在沉积物中含量均值高低次序依次为Fe (29630.50 mg/kg)>Ti (3213.07 mg/kg)>Mn (539.44 mg/kg)>Zn (104.01 mg/kg)>V (76.63 mg/kg)>Cr (52.60 mg/kg)>Cu (43.49 mg/kg)>Ni (35.83 mg/kg)>Pb (26.75 mg/kg)>Co (10.32 mg/kg)>As (8.96 mg/kg)>Mo (2.06 mg/kg)>Sb (1.57 mg/kg) >Tl (0.43 mg/kg)>Cd (0.31 mg/kg)>Hg (0.16 mg/kg). 其中,Cr、Ni、Cu、Zn、Cd、Hg、Pb、Fe、V、Co等在沉积物中的含量总体呈现出明显的自北向南逐渐降低趋势,Mo、Sb呈现出自北向南升高的趋势,而As、Mn、Ti、Tl在各点位的分布则无明显变化趋势. 通过与区域重金属背景值[33]对比发现,研究淀区Cr、As、Mn、Ti、Co、Tl含量均值低于各自背景值,而这几种金属变异系数(CV)均低于0.20. 以上分布趋势表明,Cr、As、Mn、Ti、Co、Tl等低于或接近区域背景值的金属在各淀区沉积物中分布总体较为均匀,其余均值超过相应背景值的各金属CV多大于0.20,呈现较大空间异质性. 各金属空间CV与其和背景值的偏差比例间呈现显著相关性(P<0.01,R2=0.760),可见,重金属在沉积物中较大的空间异质性主要由不同淀区污染输入的差异所致. 其中,北部烧车淀区域(B1~B4)沉积物重金属含量明显高于其他淀区,尤其是位于白沟引河入湖区域的B1~B3点位,可能由白沟引河入淀污染所致,河流输入的金属污染物随着颗粒物不断吸附、沉降至河口区域[35],导致该区域各金属含量显著高于其他区域.
对20 cm内各点位、各重金属的剖面分布特征进一步进行分析,结果发现,各重金属在不同点位间的垂向剖面分布存在显著差异(P<0.01),同样存在较大异质性. 其中,较为典型的8种有害重金属(As、Cd、Cr、Cu、Hg、Ni、Pb、Zn)剖面分布状况如附图I所示. 由图可见,各区域重金属含量自表层2 cm往下至20 cm 变化趋势相差较大,部分呈现出常见的自表层往下逐渐降低趋势,同时,亦有部分点位沉积物重金属含量自表层往下总体相近甚至上升. 表层10 cm内重金属含量总体相近,大多变化发生在10 cm以下的沉积物中,部分点位表层0~10 cm重金属含量呈现出逐渐上升的趋势,如B2、B3点位Cr、Cu、Zn、As、Cd、Hg、Pb等金属含量.
2.2 沉积物重金属潜在生态风险分析
使用潜在生态风险指数法对8种常见有害重金属(As、Cd、Cr、Cu、Hg、Ni、Pb和Zn)在沉积物中的生态风险进行分析,结果表明(附图Ⅱ),表层 10 cm沉积物重金属RI均值高低次序依次为:B3 (1431.1)>B7 (262.2)>B6 (261.2)>B2 (239.9)>B11 (206.5)>B1 (153.3)>B8 (152.3)>B9 (148.5)>B5 (146.6)>B4 (103.3)>B10 (100.2). 从各金属对RI的平均贡献看,单个金属风险值占RI的比例高低次序为:Hg (43.5%)>Cd (41.2%)>Cu (4.3%)>As (3.7%)>Ni (3.1%)>Pb (2.7%)>Cr (0.9%)>Zn (0.6%). 总体上,北部的烧车淀、郭里口、王家寨等区域RI值高于南部淀区,与各金属含量趋势相近,但由于各金属毒性响应系数的差异,导致RI趋势有一定的波动. 其中,除位于烧车淀核心区域的B3点位外,其余各点位表层10 cm沉积物重金属RI均值均小于300,生态风险较低,仅在B6点位的4 cm和6 cm处和B7点位的10 cm 处具有中等风险,RI分别为440.7、314.8和384.3. B3点位沉积物重金属RI均值达到极高水平,Hg和Cd两种金属的RI分别达到1110.9和247.8,占比分别达到70.7%和21.5%,是潜在生态风险较高的2种金属. 结合前述重金属含量分析结果,该点位各金属含量均较高,尤其是对潜在生态风险贡献较大的Hg和Cd 2种金属,含量显著高于其他点位,且2种金属的毒性响应系数较高[14],由此导致该点位潜在生态风险尤为突出.
2.3 沉积物重金属形态特征
表层沉积物通常对氧化还原状况变化较为敏感,当表层沉积物被氧化时,可能导致金属硫化物的氧化;而当表层沉积物由于沉降颗粒有机质快速降解等导致耗氧及还原性加强时,则可能导致铁/锰氧化物结合态金属被还原[9]. 这些过程均可能导致表层沉积物中重金属溶解至间隙水,进而释放至上覆水[6,36-37],而重金属的赋存形态变化则在此过程中具有重要影响. 因此,为了进一步研究重金属在沉积物中的赋存形态,对表层2 cm典型有害重金属进行了形态分析. 其中,Cr主要以残渣态为主(图2),可转化态(F1、F2和F3)比例总和最高在30%左右;Ni、Cu、Zn、As、Cd和Pb的可转化态比例较高,最高达到90%,而这3种形态又分别在酸性、还原性和氧化性增强时有可能溶解释放至间隙水及上覆水中,具有较高生物可利用潜力[9]. 此外,从空间分布上看,Cr、Ni、Cu、Zn可转化态比例呈现出明显的自北往南逐渐降低的趋势,Cd、Pb的可交换态及碳酸盐结合态(F1)比例也呈现出这一趋势. 由此可见,北部烧车淀区域污染输入的重金属不仅含量较高,且可转化态比例较高. 这些较高比例的可转化态重金属可能更加容易受到沉积物-水系统环境变化的影响,从而溶解释放,由此导致表层沉积物中最新沉积的重金属具有更高的生物可利用潜力.
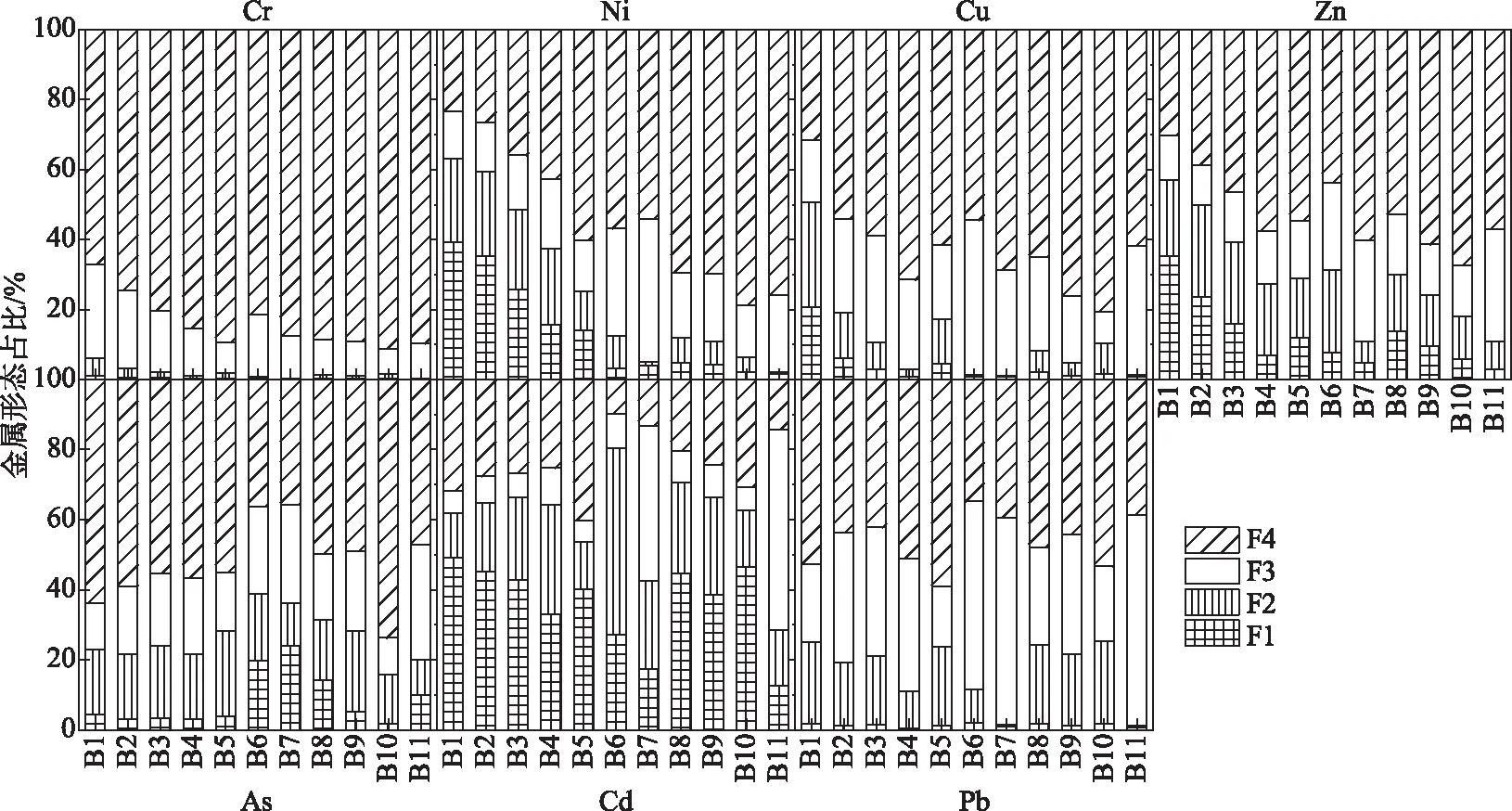
图2 沉积物典型重金属形态特征Fig.2 Fraction characteristics of typical heavy metals in the sediment

图3 白洋淀沉积物间隙水重金属浓度Fig.3 Concentrations of heavy metals in the pore water of Lake Baiyangdian
2.4 间隙水重金属浓度分布特征
鉴于表层沉积物在沉积物-水界面重金属迁移转化过程中的关键作用,对表层沉积物间隙水中As、Cd、Cr、Cu、Hg、Ni、Pb、Zn 8种常见有害重金属浓度进行分析,结果表明(图3),间隙水各金属浓度高低次序依次为:As((17.07±0.23) μg/L)>Hg((2.39±0.94) μg/L)>Ni((2.04±1.48) μg/L)>Cu((1.97±0.92) μg/L)>Zn((1.45±0.75) μg/L)>Cr((0.42±0.23) μg/L)>Pb((0.20±0.12) μg/L)>Cd((0.02±0.01) μg/L). 间隙水中Hg浓度约为地表水V类标准限值(1 μg/L)(GB 3838-2002)的3倍左右,其余金属均值均在地表水I类限值浓度以下. 其中,浓度较高的As和Hg在沉积物中含量相对低于其他多个金属,Hg在沉积物中含量远低于其他金属,As含量也显著低于区域背景值(附表Ⅰ). 可见,白洋淀沉积物中As和Hg与其他金属相比更加容易溶解至间隙水中,从而可能增加其生物可利用性. 然而,除了Hg外,其他金属在间隙水中的浓度相对仍处于较低水平,间隙水中溶解态金属的风险总体较低. 如Cu的浓度远低于10 μg/L,根据Strom等[13]的研究结果,对底栖生物基本无暴露风险.
2.5 沉积物AVS及SEM分布特征


图4 白洋淀沉积物酸可挥发性硫(AVS)分布特征Fig.4 Distribution characteristics of acid volatile sulfide (AVS) in the sediments of Lake Baiyangdian
对SEM的分析结果表明(图5),与沉积物重金属含量分布相似,烧车淀区域B1~B3点位沉积物中ΣSEM含量显著高于其他点位,表层10 cm均值分别为3.30、3.19和6.25 μmol/g(dw),B3点位8 cm处最高达到了8.81 μmol/g(dw). 其余点位ΣSEM含量均在2 μmol/g(dw)以下,各淀区均值为(2.23±1.53) μmol/g(dw),略高于太湖沉积物ΣSEM均值(1.65 μmol/g(dw))[39]. 其中,各金属对ΣSEM的贡献率大小依次为:SEMZn(56.0%)>SEMNi(20.1%)> SEMCu(19.3%)> SEMPb(4.4%)> SEMCd(0.1%). 与太湖、巢湖等长江中下游湖泊相似的是[39],对沉积物重金属潜在生态风险贡献较大的Cd对ΣSEM的贡献却较小,在一定程度上降低了Cd的生物有效性. 此外,沉积物中ΣSEM含量大多低于AVS含量,有利于还原态硫对金属的固定[15].

图5 白洋淀沉积物同步可提取金属(SEM)分布特征Fig.5 Distribution characteristics of simultaneously extracted metals (SEM) in the sediments of Lake Baiyangdian
3 讨论
3.1 浅水湖泊高有机质含量沉积物重金属赋存形态对生物可利用性的影响
根据对沉积物重金属含量及潜在生态风险的分析,虽然多个重金属呈现明显的污染特征,但除了B3点位外,其余点位潜在生态风险总体较低. 重金属潜在生态风险虽然在一定程度上反映了沉积物中重金属的污染及生态危害,但其基于区域背景值的计算方法往往忽视了重金属的生物有效性及毒性. 因此,在重金属含量及潜在生态风险研究的基础上,进一步研究其生物有效性,更能全面地反映重金属污染及其对水生态环境健康的威胁. 前述对重金属形态特征的分析结果表明,多个金属可转化态含量较高,具有较大的生物可利用潜力. 浅水湖泊通常水柱交换性较好,总体上水柱至水底边界层区域氧化条件较好,因此,可氧化态(有机物及硫化物结合态)金属的生物可利用性受到了更多关注[45]. 在此过程中,与上覆水柱直接接触的表层沉积物尤为重要,其中重金属也更容易被生物利用[10]. 对白洋淀表层10 cm沉积物AVS和SEM的分析表明,沉积物中ΣSEM值大多低于AVS(2.5节),因此,ΣSEM-AVS值大多低于0,由此导致ΣSEMx,oc大多为负值,远低于147.5 μmol/g(OC). 仅在B3、B6、B10、B11点位部分层位沉积物中发现ΣSEM-AVS>0,但均小于5 μmol/g(dw)(图6),说明大部分区域沉积物重金属尚无明显毒性. 在ΣSEM-AVS>0的点位中,位于郭里口区域的B6点位ΣSEM/AVS值较高,范围在0.79~9.05之间,表层10 cm均值为5.05;其ΣSEMx,oc均值为17.48 μmol/g(OC),远低于147.5 μmol/g(OC). 以上分析表明,基于AVS-SEM方法可以发现,各研究淀区中仅郭里口区域B6点位沉积物重金属具有一定的生物毒性,且并不突出. 造成这一现象的主要原因是白洋淀沉积物中AVS含量较高. 根据对白洋淀沉积物TOC含量的分析结果(附表I),表层10 cm沉积物中TOC含量显著高于巢湖、太湖等典型富营养化湖泊中的含量均值[45-46]. 从沉积物TOC平面分布看,并未发现大部分重金属所呈现的北部高于南部的现象. 由于白洋淀水生植物生长茂盛,植物衰亡后大量碎屑沉降至沉积物中[47],导致沉积物TOC含量总体较高,可能主要来源于内生性植物碎屑的沉降,在一些河口区域可能会部分来源于陆源有机质输入[48]. 因此,分析的16种重金属中,仅As、Cd、Hg、Pb、Mo和Sb与TOC含量呈显著正相关(P<0.01,附图Ⅲ),大多金属并未呈现出其他湖泊中常见的与TOC显著相关性[45]. 沉积物中如此高的内生性TOC含量使得表层沉积物长期存在着大量有机质的降解过程,从而加剧沉积物-水界面处氧的消耗[49]. 这一过程进而导致表层沉积物中长期存在着高含量的还原态硫,并与金属结合,降低其生物有效性[15]. 此外,白洋淀内部河淀纵横交错,有143个淀泊且大多水域面积较小[18],难以出现太湖、巢湖等大型浅水湖泊中常见的频繁水动力扰动及沉积物再悬浮现象[50]. 重金属与厌氧沉积物中还原态硫结合后,经再悬浮氧化释放的现象应没有其他大型浅水湖泊突出. 因此,对于白洋淀高有机质含量的沉积物,SEM及有机物和硫化物结合态金属的生物可利用性总体不突出.
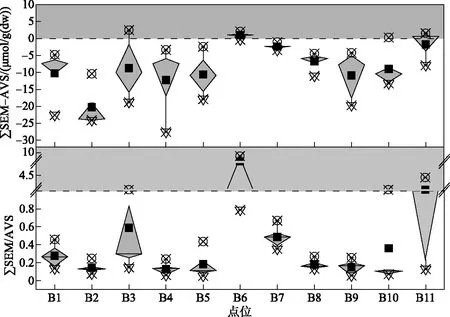
图6 沉积物ΣSEM-AVS和ΣSEM/AVS值分布特征Fig.6 Distribution characteristics of ΣSEM-AVS and ΣSEM/AVS in the sediment
前述2.3节的分析结果表明,沉积物中Cd、Pb等金属的可交换态及碳酸盐结合态(F1)和铁/锰氧化物结合态(F2)比例较高. 其中,F2在还原态沉积物中很可能会发生溶解释放,但由于沉积物中AVS含量较高,Cd、Cu、Ni、Pb、Zn等F2形态较高的金属即使发生了溶解也会被还原态硫快速固定,因而这几种金属在间隙水中的浓度并不突出. 将沉积物中易与还原态硫结合的几种金属各形态及总量与AVS、SEM含量及金属在间隙水中的浓度进行了相关性分析(附图IV),并未发现AVS含量与各金属有机物及硫化物结合态(F3)之间显著的相关性,其原因可能是由于沉积物中AVS含量较高,远超出SEM含量. 然而,各金属SEM含量与F3形态之间均呈现出显著的相关性(P<0.01),说明还原环境下硫化物对金属的固定作用,从而降低其生物可利用性. 此外,As不仅F2形态比例较高,且在还原态条件下容易溶解并释放[51],这一现象在其他厌氧沉积物中也时常发生[4]. 由此导致沉积物间隙水中As浓度较高,与薛培英等[27]的研究结果一致. 在高有机质导致的还原态界面环境下,缺少了铁/锰氧化物的固定作用,Hg也更加容易溶解释放至间隙水和上覆水中[52]. 因此,虽然As和Hg在沉积物中的总量并不突出,但在间隙水中的浓度较高,从而可能具有更高的生物可利用性. 白洋淀沉积物有机质多来源于水生植物腐烂降解[47],在植物快速降解期间,水体会发生显著的pH和溶解氧降低过程[53],进而加剧铁/锰氧化物结合态以及可交换态和碳酸盐结合态金属的溶解,在这些环境过程变化下,As和Hg等易溶解释放的金属更应得到重视.
3.2 沉积物重金属来源及其对生物可利用性的影响
对沉积物中各金属进行了聚类分析和相关性分析,结果显示(附图Ⅲ),除Fe外,其余金属均呈现出明显的同源性,各重金属污染来源总体相近. 相关性分析结果也显示,大部分金属之间呈现显著正相关关系(P<0.05),其中,Mo、Sb和Ti与其他金属相关性不显著,甚至出现负相关. Mo和Sb这2种金属含量呈现自北向南逐渐上升的趋势,与其他大部分金属趋势相反;Ti在各点位间无明显趋势,且含量多低于背景值,污染相对较轻. 根据前述重金属含量分析结果,研究淀区沉积物大部分重金属含量呈现出自北往南逐渐降低的趋势,且各金属在空间分布的差异性主要由污染所致而非背景值差异(2.1节). 已有研究也表明[19,21,23],北部烧车淀、郭里口和王家寨等淀区营养盐、重金属等各类污染状况总体要重于南部淀区. 因而,各金属主要污染来源应集中于北部各淀区附近. 根据白洋淀周边水系分布及入淀流量特征[18],大部分入淀河流分布在北部,且自1960s以来,由于多个水利工程的实施以及区域内水资源短缺影响,导致多条河流断流或干涸,实际入淀河流仅有6条,多集中于北部,如白沟引河和府河. 北部白沟引河、府河等河流是主要的入淀污染来源,由此导致北部淀区承接着大部分入淀污染[18]. 因此,大部分入淀污染随北部河道输入,导致北部烧车淀等淀区重金属含量总体显著高于南部淀区. 以上分析即表明,北部入淀污染是白洋淀重金属污染的主要来源. 北部烧车淀区域附近是重金属含量最高的区域,尤其是位于区域核心的B3点位,重金属含量及潜在生态风险均较高,这一方面是由于入淀河流导致的颗粒污染物输入以及水动力因素的改变,导致该区域重金属污染沉降较大,与已有多个河口区域研究结果相近[54-55];另一方面,根据已有研究结果[23-24],该区域内还存在一定的生活污水、渔业和养殖业历史污染,均可能加剧沉积物重金属的污染.
北部入淀污染不仅导致烧车淀等区域沉积物中重金属含量较高,且其中可转化态重金属的比例亦显著高于南部淀区. 前述2.3节的结果表明,Cr、Ni、Cu、Zn等多个金属的可转化态呈现自北往南逐渐降低的趋势. 其中,潜在生态风险贡献率较高的Cd可交换态及碳酸盐结合态比例尤其高,且亦呈现出北部高于南部的趋势. 重金属形态分析所针对的表层沉积物主要为近期沉积的水体颗粒污染物,已有研究表明[56],这些沉降颗粒物通常粒径较小,多小于63 μm,极易吸附重金属,且其中吸附的重金属比历史沉积中的重金属具有更高的生物可利用性. 本研究中对表层沉积物金属形态的分析也反映出最新沉积的重金属可转化态比例大多比较高,且可转化态比例由北向南逐渐降低的趋势与重金属含量变化趋势一致. 由此表明,北部入淀污染不仅是淀区重金属污染的主要来源,更显著增加了表层沉积物重金属生物可利用潜力. 毛欣等[57]的研究表明,白洋淀的沉积速率约为1 cm/a,在1990年之前的沉积物中污染累积一直处于接近背景值的水平,大部分污染累积发生在2000年以后,即本研究所关注的20 cm深度范围内的沉积物. 根据2.1节重金属剖面分布特征的研究结果,表层10 cm内各重金属变化总体较小,甚至出现表层往下升高的趋势. 这一趋势表明,近10年来白洋淀沉积物重金属富集污染总体趋于稳定并逐渐降低的趋势,在一定程度上反映了整个流域近年来各类污染控制措施不断完善,从而削减了重金属污染的汇入及在沉积物中的富集. 而北部淀区近10年来周边污染的输入不仅增加了该区域沉积物重金属污染累积量,也是提升该区域重金属生物可利用性的主要原因.
4 结论
对白洋淀多个淀区沉积物重金属含量、分布、潜在生态风险及生物可利用性进行了分析,结果发现:
1)沉积物重金属含量呈现自北向南逐渐降低的趋势,北部烧车淀区域是主要的重金属污染富集区域. 研究的16种重金属中,大多呈现出由污染输入差异所导致的空间分布异质性,大部分污染累积发生在2000年以后,近10年来沉积物重金属污染总体趋于稳定并逐渐降低的趋势.
2)沉积物重金属潜在生态风险总体较低,呈现出自北往南生态风险总体降低的趋势. 北部烧车淀区域部分点位潜在生态风险较高,RI值最高达到1431.1,Hg和Cd是对潜在生态贡献最高的2种金属,在各淀区平均贡献率分别达到43.5%和41.2%.
3)各重金属污染来源相近,北部入淀污染不仅是重金属富集总量较高的主要原因,也提升了该区域重金属生物可利用潜力. 沉积物可转化态重金属比例大多在30%~90%之间,且各金属可转化态比例总体呈现出自北往南逐渐降低的趋势.
4)高有机质含量导致沉积物中AVS含量远高于SEM,AVS和ΣSEM均值分别为(10.59±6.37)和(2.23±1.53) μmol/g(dw). Cd、Cu、Ni、Pb、Zn等金属由于还原态硫的固定而生物可利用性较低. 然而,As和Hg在这样的环境下更容易溶解和释放,在间隙水中的浓度分别达到(17.07±0.23)和(2.39±0.94) μg/L,是潜在生物可利用性相对较高的金属,在白洋淀这样高有机质含量的沉积物中应给予更多关注.
5 附录
附图Ⅰ~Ⅳ和附表Ⅰ见电子版(DOI: 10.18307/2022.0614).
