基于网络药理学和分子对接研究紫藤瘤对胃癌的作用机制及初步验证
2022-11-09王文君徐泽荣黄宇飞刘劲松王国凯
杨 辉,王文君,徐泽荣,黄宇飞,程 卉,刘劲松,4,5,王国凯,4,5
(1.安徽中医药大学第一附属医院,安徽 合肥 230031;2.安徽中医药大学药学院,安徽 合肥 230012;3.安徽中医药大学科研技术中心,安徽 合肥 230038;4.中药研究与开发安徽省重点实验室,5.药物制剂技术与应用安徽省重点实验室,安徽 合肥 230012)
近年来,我国胃癌总体发病率呈上升趋势,在我国,胃癌是仅次于肺癌的第二大高发癌症,且胃癌患病率以及死亡率均超过世界平均水平的2倍[1]。紫藤瘤(Wisteriasinensistumor)是由细菌侵染紫藤茎,植物应激反应后,在茎体上寄生的病变组织。当前西医治疗胃癌的手段仍为手术、放疗以及化疗,易损伤机体正常组织细胞,若胃癌手术未能完全切除肿瘤容易复发,具有一定的弊端和局限性。中医药治疗胃癌已成为目前国内外研究的热点[2]。紫藤瘤具有止痛、解毒、杀虫以及抗肿瘤作用,在日本民间一直被用作抗胃癌的药物使用。课题组前期对紫藤瘤的化学成分进行了系统研究[3-11],在此基础上,本研究拟通过网络药理学和分子对接技术探讨紫藤瘤抗胃癌潜在的有效成分和作用机制并通过体外实验验证,为后续研究及临床应用提供参考。
1 材料与方法
1.1 紫藤瘤药物靶点筛选使用化学专业数据库以及查找文献收集紫藤瘤的所有化学成分;利用中药系统药理学分析平台(Traditional Chinese Medicine System Pharmacological,TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)计算这些化学成分的ADME值并对口服生物利用度(OB)、类药指数(DL)值进行评估,选取OB≥30%,DL≥0.18的活性较高的化合物作为紫藤瘤候选活性成分,在有机小分子生物活性数据库PubChem (https://pubchem.ncbi.nlm.nih.gov/)中检索经过筛选的活性较高的化合物,保存化合物的Canonical SMILES号,然后使用在线靶标预测网站SwissTargetPrediction数据库(http://www.swisstargetprediction.ch/),检索保存的Canonical SMILES号得到化合物的潜在靶点。
1.2 胃癌疾病靶点筛选通过人类孟德尔遗传综合数据库 (online mendelian inheritance in man,OMIM)(http://www.omim.org)以及DrugBank数据库(https://go.drugbank.com/)对胃癌潜在靶点进行预测,搜索已报道的与胃癌相关的基因,并搜索文献验证。
1.3 药物靶点与疾病靶点的标准化以及共有靶点的映射将得到的紫藤瘤靶点和胃癌疾病靶点分别导入到UniProt数据库(https://www.uniprot.org/)中得到UniProt数据库识别码格式,筛选得到物种种属为“Homo sapiens(Human)”相应的靶点,得到紫藤瘤药物靶点数据集和胃癌疾病靶点数据集。将上述已经标准化的紫藤瘤药物靶点和胃癌疾病靶点上传至Venny2.1.0平台(https://bioinfogp.cnb.csic.es/tools/venny/index.html),得到紫藤瘤靶点与胃癌靶点的映射,筛选紫藤瘤靶点与胃癌靶点的共有靶点,获得紫藤瘤治疗胃癌的潜在靶点的Venny图。
1.4 PPI网络构建与分析为进一步明确紫藤瘤潜在靶点与胃癌疾病靶点之间的相互作用关系,将筛选得到的共有靶点导入STRING数据库(https://string-db.org/),在“Multiple proteins”条件下将种类定义为Homo sapiens进行分析,建立药物靶蛋白-疾病靶蛋白相互作用(protein-protein interaction,PPI)网络,且最低相互作用阈值取中等“medium confidence”(≥0.4)获得靶蛋白相互作用核心网络关系,导入Cytoscape3.7.2软件制作药物靶蛋白-疾病靶蛋白相互作用网络图并进行可视化分析。
1.5 GO富集分析与KEGG通路注释分析为说明药物的靶点在基因功能中的作用,将上述筛选出的紫藤瘤与胃癌的共有靶点导入Metascape数据库(https://metascape.org/)中,将种属选为人(“H.sapiens”),选择自定义分析(Custom Analysis),设定P值为0.01,最小计数为3,富集因子>1.5(富集因子是观察到的计数与偶然期望的计数之比的术语),得到富集分析结果,分别从功能、参与的生物途径及细胞中的定位对基因产物进行标准化描述,并得到GO富集分析柱状图和KEGG通路注释分析柱状图。
1.6 靶点-信号通路网络的构建为进一步明确紫藤瘤活性成分、共有靶点与信号通路之间相互作用关系,将上述KEGG通路注释分析所得到的通路与紫藤瘤活性成分以及共有靶点之间相互匹配,制作紫藤瘤候选活性成分-胃癌靶点-通路网络表,将紫藤瘤候选活性成分-胃癌靶点-通路信息导入Cytoscape3.7.2软件构建紫藤瘤候选活性成分-靶点-信号通路网络图,以实现紫藤瘤治疗胃癌作用机制的可视化。
1.7 成分与治疗胃癌关键靶点分子对接选择紫藤瘤治疗胃癌的蛋白相互作用(PPI)网络中度值较高的5个关键靶点与其对应的潜在活性成分进行分子对接,查找相关文献或者检索pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)获得活性成分的2D结构式,利用ChemBio3D Ultra 14.0绘制其3D结构,进行能量最小化处理后保存为mol 2格式。在PDB数据库(https://www.rcsb.org/structure)中下载关键靶点pdb格式,利用Pymol Win软件进行去水去配体处理后保存。利用Autodock Vina软件将治疗胃癌的关键靶点与相应的活性化合物进行分子对接。分子对接成功后,其结果用Pymol Win软件进行可视化处理。
1.8 细胞实验验证
1.8.1细胞株 人胃癌细胞SGC-7901购自中国科学院(上海细胞生物学研究所)培养库。
1.8.2试剂 MTT(1212U054)、PBS (726P022) 购自北京索莱宝公司;青霉素-链霉素溶液( 080421211018)、0.25%胰酶细胞消化液( L112421211204)购自上海碧云天公司;胎牛血清(FBS,RB39736)购自美国Hyclone公司;RPMI-1640(WH0021F141)购自武汉普诺赛公司;DMSO(EZ7890A253)购自德国BioFroxx公司;化合物由课题组从紫藤瘤中分得,经质谱及核磁确定其纯度和结构。
1.8.3仪器 CO2培养箱、-80 ℃冰箱购自日本Sanyo公司;CK2型倒置显微镜购自日本Olympus公司;生物安全柜购自浙江苏净净化设备有限公司;低速离心机购自安徽中科中佳科学仪器有限公司;恒温水浴锅购自常州国华电器有限公司;多功能酶标仪购自美国MD公司;细胞培养瓶、培养板购自美国Corning公司;液氮罐购自成都金凤液氮容器公司。
1.8.4细胞培养 快速从液氮罐中取出冻存的细胞置于37 ℃恒温水浴锅中解冻,融化后迅速进入生物安全柜中无菌操作,将冻存管中的细胞悬液吸入装有5 mL完全培养基的15 mL的离心管内,1 000r·min-1,5 min,离心后弃去上清,加入6 mL完全培养基,吹打混匀后,将细胞悬液接种培养瓶,置于37 ℃、5% CO2培养箱中培养。
1.8.5MTT比色法 取对数期生长的人胃癌细胞SGC-7901,调整细胞浓度为2×108个·L-1,接种于96孔板中,每孔细胞培养液100 μL,每组设6个复孔,设空白组(只加完全培养基100 μL,不加细胞悬液)、对照组(细胞悬液只加完全培养基,即药物浓度为0)和不同浓度药物组(10、20、40、80、160、320、640 μmol·L-1),细胞培养过夜,待贴壁后吸去对照组和药物组培养基。加入不同浓度的药物培养基100 μL,培养24 h,吸去旧培养基,每孔加入10 μL MTT,操作过程避光,并用锡纸将96孔板包裹避光继续培养4 h。吸去培养基,每孔加入150 μL DMSO,操作过程避光,并用锡纸将96孔板包裹避光置于摇床上缓慢振摇15 min后。在酶标仪490 nm波长下测吸光值。计算细胞存活率公式如下:
细胞存活率/%=(药物组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%
1.8.6AV-PI 染色流式细胞仪检测芒柄花素诱导SGC-7901细胞凋亡的作用 对数生长期的SGC-7901细胞,以2×105个/孔接种于96孔板中,每孔含完全培养基2 mL,孵育过夜后弃去原培养基,换成含不同浓度的芒柄花素培养液。继续培养24 h后,用不含 EDTA-Na2的胰酶消化液消化离心并收集细胞。4 ℃预冷的PBS缓冲液清洗细胞2遍,1 800 r·min-1离心5 min。加入500 μL预冷的PBS重悬细胞,加入Annexin V-FITC 5 μL,用移液器吹打均匀,避光15 min,吸取5 μL PI加入继续吹打使之充分混合,于室温下避光孵育约5 min。流式细胞仪上FL1和FL3通道进行检测。
1.8.7钙离子水平检测 对数生长期的SGC-7901细胞,以2×105个/孔接种于96孔板中,每孔加入完全培养基 2 mL,37度培养箱孵育过夜后弃去原培养基,换成含不同浓度的芒柄花素完全培养基。继续培养24 h后,用胰酶消化液消化离心并收集细胞。4 ℃预冷的PBS缓冲液清洗细胞2遍,1 800 r·min-1离心5 min。加入100 μL预冷的PBS重悬细胞,加入FIuo-3AM染料避光染色15 min,于倒置荧光显微镜下拍照。
1.8.8统计学方法 使用Graph Pad Prism 6等软件进行数据统计分析,组间差异均使用单因素方差分析,两两比较用LSD-t检验。
2 结果
2.1 紫藤瘤候选活性成分的获取使用化学专业数据库以及查找文献收集紫藤瘤的所有化学成分;在TCMSP数据库中筛选所有化学成分,经筛选符合要求的成分共有8个,分别是异豆素、美迪紫檀素、芒柄花素、豆甾醇、α-菠甾醇、蒲公英赛醇、β-谷甾醇棕榈酸酯、(22E,24R)-5α,8α-过氧麦角甾-6,22-二烯-3β-醇,见Tab 1。
2.2 紫藤瘤药物靶点及胃癌疾病靶点的获取从PubChem中检索上述成分Canonical SMILES号,通过SwissTargetPrediction数据库检索得到上述成分的潜在靶点,去掉重复,最终得到308个靶点;通过OMIM数据库和DrugBank数据库筛选胃癌疾病的相关靶点,最终得到269个胃癌疾病靶点。
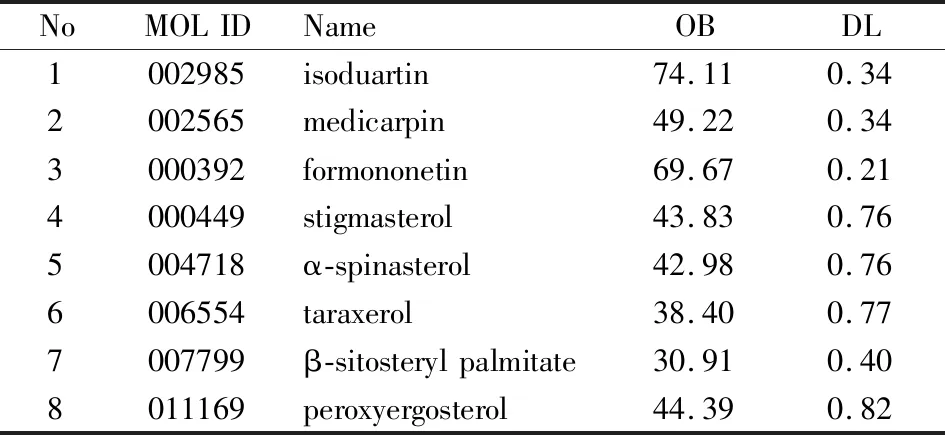
Tab 1 Screening results of active ingredients from
2.3 紫藤瘤治疗胃癌的潜在靶点预测通过UniProt数据库将上述靶点和胃癌疾病靶点转化为UniProt数据库识别码格式。使用Venny2.1.0在线平台,将紫藤瘤药物靶点与胃癌疾病靶点进行映射取交集,见Fig 1。预测到紫藤瘤候选活性成分的胃癌潜在靶点即紫藤瘤药物靶点与胃癌疾病靶点的交集,共19个,分别为MET、EGFR、PIK3CA、CCND1、BRAF、KIT、MTOR、CHEK2、RET、ESR1、FGFR1、RAF1、MDM2、PTGS2、MAP2K1、CBR1、AKR1C3、PTPRF以及NOS2。

Fig 1 Venn diagram of Wisteria sinensis tumor targets
2.4 紫藤瘤治疗胃癌的蛋白相互作用(PPI)将共有靶点上传至STRING数据库,导入Cytoscape 3.7.2软件,得到靶蛋白相互作用网络图。可知度值较高的靶点是苏氨酸蛋白激酶(MTOR)、磷脂酰肌醇4,5-二磷酸-3-激酶催化亚单位α异构体(PIK3CA)、雌激素受体(ESR1)、S-特异性细胞周期蛋白-D1(CCND1)、表皮生长因子受体(EGFR)。

Fig 2 PPI protein interaction network diagram
2.5 KEGG和GO分析筛选出19个直接作用靶点作为本次KEGG通路注释分析的参与靶点。将符合筛选条件的直接作用靶点呈递到Metascape数据库进行KEGG通路注释分析和GO功能分析。KEGG分析结果表明,紫藤瘤治疗胃癌的相关信号通路主要有7条:恶性肿瘤通路、甲状腺激素信号通路、甲状腺癌通路、黏着小带通路、小细胞肺癌通路、花生四烯酸代谢通路以及p53信号通路,见Fig 3。另外,恶性肿瘤通路是KEGG通路富集分析中与胃癌相关靶点最多的通路,以紫藤瘤活性成分参与恶性肿瘤通路为例,利用R语言clusterProfiler程序包绘制靶点在关键通路中发挥作用过程可视化图,见Fig 4,红色靶点代表紫藤瘤中活性成分的关键靶点在该信号通路中所参与的过程,这些靶点在该信号通路中起着关键作用。这表明紫藤瘤活性成分可以通过参与多种通路协调发挥治疗胃癌的作用。
GO富集分析包括GO生物过程(biological process,BP)分析、分子功能(molecular function,MF)分析和细胞组分(cellular component,CC)分析。GO-BP分析结果见Fig 5,共得到18条结果,进行统计学分析并按照相关度排列,主要通过调节3个生物过程进而发挥对胃癌的治疗作用,包括蛋白激酶B信号通路的正向调节、激酶活性的正向调节、肽酰丝氨酸磷酸化;GO-MF分析结果见Fig 6,发现紫藤瘤活性成分主要通过蛋白激酶活性、蛋白酪氨酸激酶活性、激酶结合等分子功能发挥治疗胃癌的作用;GO-CC分析结果见Fig 7,发现紫藤瘤活性成分主要通过受体复合物、核膜、细胞器外膜等细胞组分发挥治疗胃癌的作用。
2.6 成分-胃癌靶点-信号通路网络将KEGG通路注释分析的结果与成分和共有靶点之间相互匹配,得成分-胃癌靶点-通路网络表,将信息导入Cytoscape3.7.2软件构建网络图,见Fig 8。

Fig 3 KEGG pathway barplot diagram
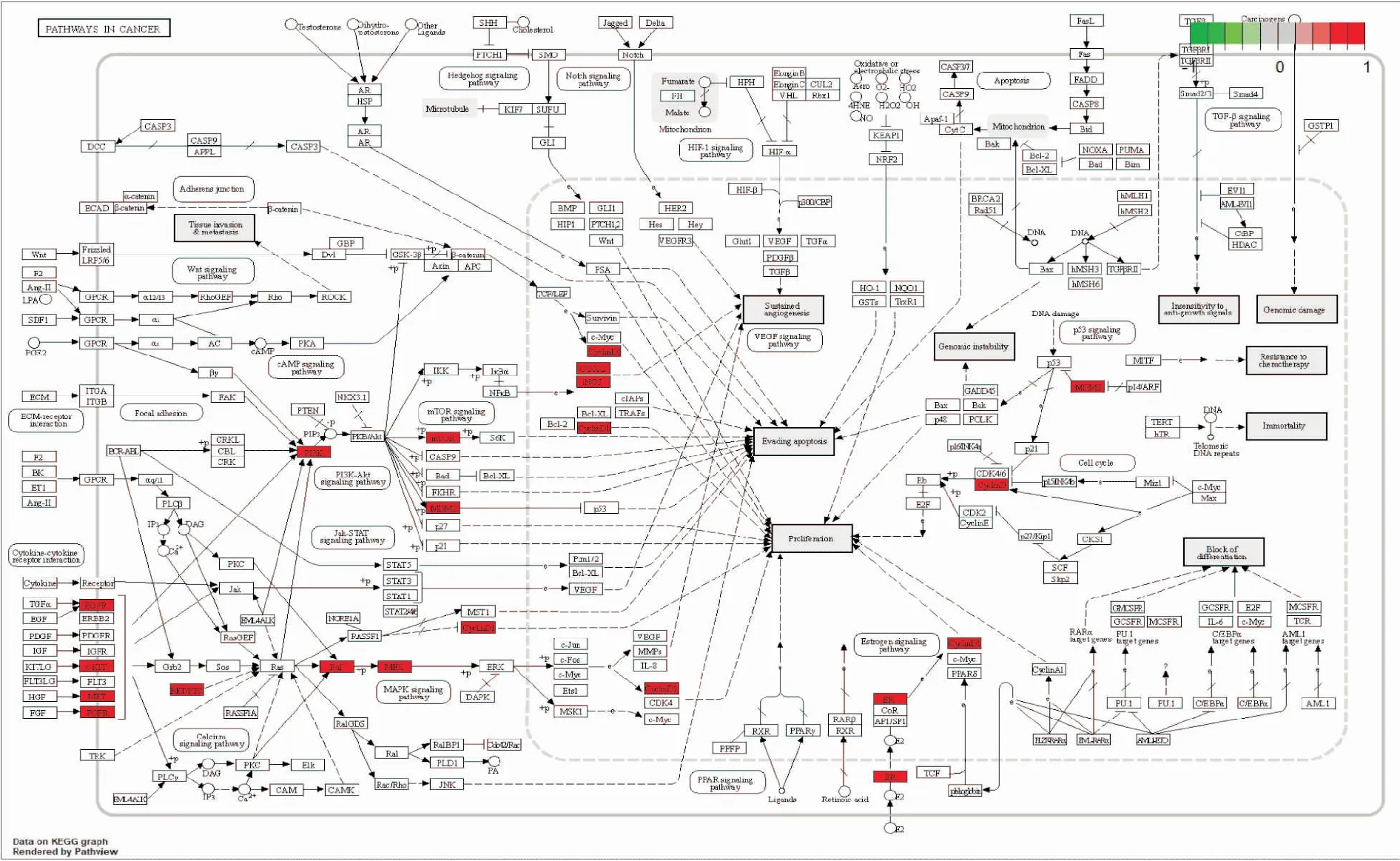
Fig 4 Process of target playing a role in critical pathway

Fig 5 Functional analysis of GO biological process
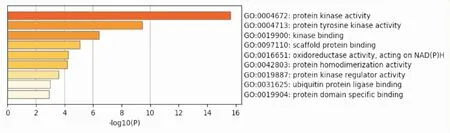
Fig 6 GO molecular function analysis
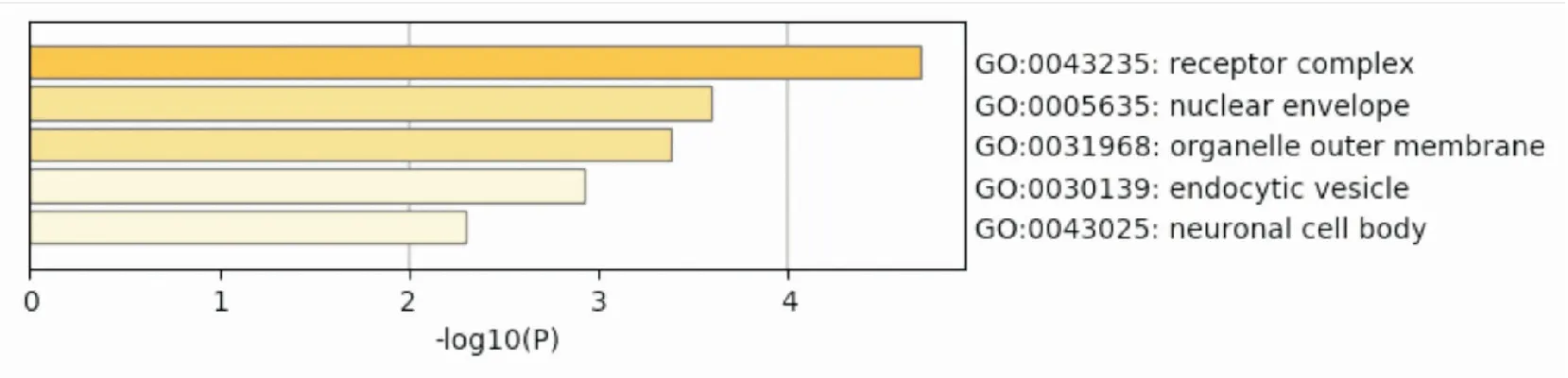
Fig 7 GO cell component analysis

Fig 8 Medicinal-disease-component-target-pathway
图中蓝色圆形节点代表8个成分,红色菱形节点代表19个潜在靶点,绿色正六边形节点代表可能涉及的7条信号通路,边代表它们之间的相互关联,节点的大小和颜色的深浅代表度值的大小,节点越大,颜色越深代表相关性越大。从图中可以看出,美迪紫檀素(medicarpin)和异豆素(isoduartin)治疗胃癌的潜在靶点最多,一氧化氮合酶(NOS2)、雌激素受体(ESR1)、S-特异性细胞周期蛋白-D1(CCND1等靶点)参与紫藤瘤治疗胃癌的关联度最大,发挥作用最大的通路是恶性肿瘤通路。从图中可看出同一活性成分可对应于不同的靶点,同一靶点也可对应于不同的活性成分,充分体现了紫藤瘤治疗胃癌多成分、多靶点的作用特点。
2.7 成分-靶点分子对接结果筛选度值较高的5个关键靶点和其对应的潜在活性化合物进行了分子对接验证,见Tab 2。结合能小于0,说明受体分子与配体分子能自发结合,结合能绝对值越高,对接能力越强,对接后分子的稳定性越高。对接结果显示化合物与治疗胃癌的受体蛋白的结合能均小于-7 kcal·mol-1,说明成分与关键靶点分子均能较稳定的结合。分子对接的可视化结果见Fig 9。
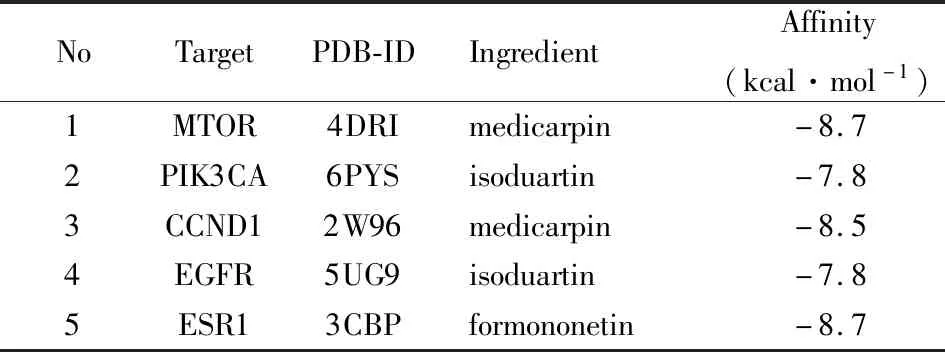
Tab 2 Binding energy of compounds and top

Fig 9 Visual results of molecular docking of compounds
2.8 化合物抑制胃癌细胞SGC-7901的作用利用MTT法检测不同浓度的化合物抑制胃癌细胞SGC-7901增殖的影响,见Fig 10。与空白对照组相比,芒柄花素能显著抑制人胃癌细胞SGC-7901的增殖。

Fig 10 Effect of formononetin on viability of SGC-7901
*P<0.05,**P<0.01vscontrol
2.9 AV-PI染色流式细胞仪检测芒柄花素诱导SGC-7901细胞凋亡的作用芒柄花素作用于SGC-7901细胞4 h后,Fig 11结果显示,正常对照组细胞凋亡率为(3.47±0.92)%,随着芒柄花素浓度的增加细胞凋亡率明显增加,对SGC-7901的细胞凋亡率分别为(7.12±1.36)%、(27.65±4.12)%,与空白组相比,差异有统计学意义(P<0.01)。
2.10 芒柄花素对SGC-7901细胞钙离子水平的影响通过FIuo-3AM检测芒柄花素作用SGC-7901细胞前后钙离子水平的变化,Fig 12可见,空白组细胞呈现均一暗淡的绿色荧光,而随着芒柄花素药物浓度的增加,绿色荧光水平呈浓度依赖性增加,在芒柄花素80 μmol·L-1浓度组中可见明亮的绿色荧光。表明芒柄花素可以浓度依赖性增加细胞钙离子的水平。
3 讨论
本研究采用网络药理学方法和分子对接探讨紫藤瘤治疗胃癌的可能有效成分及潜在作用机制,并通过细胞实验进行验证。结果挖掘了紫藤瘤治疗胃癌的8个候选活性成分和相应的19个靶点及7条信号通路,证明紫藤瘤确实具有一定的抗胃癌潜力。
在8个活性成分当中,美迪紫檀素、异豆素以及芒柄花素治疗胃癌的潜在靶点最多,提示其在紫藤瘤治疗胃癌中可能会发挥重要作用。在此基础上,选取了这3个成分与MTOR、PIK3CA、CCND1等关键靶点进行分子对接验证,结果表明,其结合能均小于-7.0 kcal·mol-1,提示有较好的结合活性。利用体外实验进行验证,结果表明芒柄花素能显著抑制人胃癌细胞SGC-7901的增殖。董陈诚等[12]研究表明,芒柄花素可能会通过激活NF-κB信号通路抑制人胃癌MKN-45细胞株的增殖、促进细胞凋亡。李伟东等[13]研究美迪紫檀素对人肝癌细胞Hep2有抑制和杀灭的作用,本研究结果也为后续研究提供了思路。
成分-靶点-通路图中表明了紫藤瘤通过多成分、多靶点、多通路治疗胃癌。通过图中关联度比较可以看出,NOS2、ESR1、CCND1、EGFR等靶点可能是紫藤瘤抗胃癌的核心靶点。NOS2一氧化氮合酶,其在胃癌组织中的表达水平高于正常胃旁组织。梁春艳[14]研究表明通过诱导AGS细胞凋亡,可以抑制NOS2的表达,从而提高胃癌患者的总生存率。ESR1为雌激素受体,它可以通过多种途径与其他信号分子相互作用,在胃癌中,其与细胞增殖、转移和侵袭相关[15]。CCND1是S-特异性细胞周期蛋白-D1,刘久鹏等[16]通过实验证实通过降低胃癌MGC-803细胞增殖,抑制细胞生长,下调CCND1的表达可以将人胃癌MGC-803细胞阻滞于G0/G1期。EGFR是表皮生长因子受体,缪鹏飚等[17]研究发现,干扰EGFR的表达能够调节基因组变化来抑制胃癌细胞的生长达到治疗胃癌的目的。

Fig 11 Effect of formononetin on apoptotic rate of SGC-7901 cells detected by flow cytometry**P<0.01 vs control

Fig 12 Effect of anthocyanin on calcium level of SGC-7901 cells detected by Fluo-3AM staining(×100)**P<0.01 vs control
KEGG通路结果显示,恶性肿瘤信号通路富集靶点最多,提示其可能是紫藤瘤治疗胃癌较显著的通路,在靶点参与通路的可视化图中,EGFR、MET等基因参与了调节恶性肿瘤通路发挥作用。另外,研究也发现p53信号通路在治疗胃癌中的影响作用愈发明显[18]。
综上所述,本研究探讨了紫藤瘤治疗胃癌的可能活性成分及潜在作用机制,为进一步研究及临床应用提供了参考。
