苹果和梨抗病相关基因的诱导与表达分析
2022-11-09闫文萍余宏强左存武
孙 娥,闫文萍,余宏强,赵 丹,朵 虎,左存武*
(1 甘肃农业大学 园艺学院,兰州 730070;2 临泽县林业和草原局,甘肃张掖 734200)
腐烂病俗称“烂皮病”、“臭皮病”,由腐生真菌黑腐皮壳菌(Valsamali)引起,是苹果和梨生产中的重大真菌性病害[1]。腐烂病病原菌是苹果和梨树上的习居菌,主要以菌丝、子座及孢子角在田间病株(病斑)及病残体上越冬;从分生孢子器渗出的分生孢子可持续一年,甚至在冬季树皮潮湿时也会发生,分生孢子感染果树后可在一年中的不同时间诱发树体腐烂病变,特别是在冬季。故初冬修剪可能会促进果树被黑腐皮壳菌感染,加速该病害在田间的传播[2]。生产中常采用刮除发病组织并涂抹化学药剂来防治该病,但在大面积推广应用时该方法仍存在劳动力投入成本高等限制因素故无法有效防治。此外,因病斑皮层外缘木质部带菌深度可达1.5 cm致防治过程中刮除不干净导致复发[3],增大防控难度。目前抗性育种已成为苹果和梨育种中最为有效且环保的方法,但育种进程仍受限于育种周期长、抗性育种材料稀缺和抗病机理研究不深入等因素。
长期进化的过程中,植物为抵御病原微生物入侵在体内形成了复杂的免疫系统。首先,当植物遭遇病原侵袭后,病原体相关的分子模式(pathogen associated molecular patterns,PAMPs)可被植物细胞膜上的模式识别受体(pattern recognition receptor,PRRs)所识别,激发第一层免疫反应,即PAMP激发的免疫反应(PAMPs triggered immunity,PTI)[4]。为有效侵染植物,病原物可分泌寄主特异效应子(effectors)抑制植物PTI反应,其信号可被位于寄主胞质的抗性基因识别,引发效应子激发的免疫反应(effector triggered immunity,ETI)[5-6]。此后,诱发植物整体的抗性反应,称为系统获得抗性(systemic acquired resistance,SAR)反应[7]。正常条件下,植物需要依靠PTI和ETI共同作用来检测入侵病原菌并激活植物体内防御机制,且PTI和ETI反应的进行都需要PTI和ETI中的重要成分来实现更强的植物防御[8]。除此之外,植物激素、活性氧(reactive oxygen species,ROS)、钙离子等多种信号分子也参与调控植物的免疫反应。其中,水杨酸(salicylic acid,SA)和ROS分别是启动植物SAR和局部细胞超敏反应(hypersensitivity reaction,HR)的重要信号物质,贡献于植物对寄生菌的抗性[9]。腐生致病菌侵染植物过程中,茉莉酸(jasmonic acid,JA)和乙烯(Ethylene,ET)信号及WRKY转录因子也被激活,调控植物对腐生菌的免疫反应[10-11]。近年来还发现植保素、胼胝质等多种具有物种特异性的次生代谢产物都具有广谱抑菌活性并积极参与植物的生物防御响应[12]。
模式植物中,已陆续鉴定出多种免疫信号通路的Marker基因,为研究寄主对特定病原菌的抗性机制提供了极大的方便。NPR1(nonexpressor of pathogenesis related genes 1)蛋白和PR(Pathogenesis-Related)蛋白作为SAR信号传导途径上的关键调控因子,是调节植物抗病性的重要基因,故在判断植物体内SAR反应是否被激活时可通过检测NPR1、PR1、PR2、PR4和PR5等Marker基因的表达量来判断[13-15]。此外,陆续发现免疫反应中多种信号分子的Marker基因,如PR1(或PR5)、ACS1或ACS6(arabidopsis cysteine synthase 1 or 6)、LOX1、EDS1(enhanced disease susceptibility 1)和RboHD(respiratory burst oxidase homologue D)分别可作为SA、ET、JA、抗性基因和ROS的Marker基因[16-18]。但Marker基因在非模式植物中的应用仍不够广泛。本研究结合同源序列检索、保守区域筛选和表达验证筛选了免疫反应中重要信号通路的Marker基因,并对上述基因在抗性资源杜梨和东北山荆子响应腐烂病过程中的表进行达分析。
1 材料和方法
1.1 材 料
杜梨和东北山荆子悬浮细胞为本实验室经愈伤组织诱导后悬浮培养获得。苹果和梨腐烂病病原菌菌株Vm-A-003、Vp-P-002均由本实验室分离获得,经分子鉴定确定为典型的苹果和梨腐烂病菌[19]。将菌株分别接种至PDA(potato dextrose agar)培养基,活化培养4 d后,各菌株分别取10个菌饼接种至100 mL PDB(potato dextrose broth)液体培养基,黑暗、静置培养3 d,经离心和过滤除菌,获得菌株代谢物。
收集杜梨和东北山荆子悬浮细胞,利用40目细胞过滤去除大细胞团,收集并取500 μL小细胞团(细胞密实体积)转入至16 mL MS液体培养基,黑暗、25 ℃、120 r/min悬浮培养48 h备用。激素处理:悬浮细胞中分别加入JA和SA溶液,终浓度为50 μmol/L。腐烂病菌代谢物处理:取Vm和Vp代谢物原液各4 mL,分别加入至东北山荆子和杜梨悬浮细胞,终浓度为20%(V/V)。对照组细胞中,用MS液体培养基代替腐烂病菌代谢物原液或激素溶液。于处理1、3和6 h后,收集对照和处理组细胞用于基因表达分析。以上试验设3次生物学重复。
1.2 方 法
1.2.1 序列检索及多序列比对通过查阅文献,确定拟南芥、烟草等模式植物中抗性反应关键通路的Marker基因。根据基因登录号在拟南芥在线信息资源(Arabidopsis information resource,TAIR,http:// www. arabidopsis. org)或美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)下载目标基因的CDS序列。将序列依次输入至蔷薇科基因组在线数据资源(Genome database of rosaceae species,GDR,https://www.rosaceae.org/)进行序列比对,获得各候选基因在苹果(Malusdomestica)、山荆子(Malusbaccata)、西洋梨(Pyruscommunis)和杜梨(Pyrusbetulifolia)基因组中的同源基因。将各目标基因在以上4个物种中的同源基因进行多序列比对,获得保守区域。将各目标基因同源序列的保守区域输入至在线软件Primer 3(http://primer3.ut.ee/)进行实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)引物设计。
1.2.2 表达分析样品RNA提取采用RNAout试剂盒(160906-50,Tiandz,北京),凝胶电泳和超微量分光光度计进行RNA质量检测。取1 μg RNA,采用试剂盒Prime S-cript TM RT reagent Kit with gDNA Eraser(RR047,TaKaRa,大连)进行cDNA合成。利用SYBR Green Pro Taq HS预混型qPCR试剂盒在实时荧光定量PCR(RT-qPCR)仪(Mx3005p,Stratagene,美国)上进行基因表达的定量分析。内参基因Actin引物参考Zuo等[20]的报道,反应结束后分析荧光值变化曲线及熔解曲线,并采用2-ΔΔCT计算基因的相对表达量。
1.2.3 ROS测定取对照和不同处理细胞,分别用10 μmol/L的ROS特异荧光染料H2DCFDA溶液在37 ℃黑暗中孵育10 min,然后对标记后的细胞利用多功能酶标仪(TECAN,Spark,瑞士)对ROS进行定量分析。测定激发波长和发射波长分别为488和525 nm。
1.3 统计分析
原始数据用Excel整理,差异显著性分析用T-test(P<0.05)法,图形可视化采用软件OriginPro 8.0进行,所有数值均表示为平均数±标准差。
2 结果与分析
2.1 序列筛选及保守区域确定
经检索文献[16-18,21-22]初步确定来自拟南芥、烟草等模式植物共15个基因,涉及SA、ET、JA、PTI、SAR、ROS、R基因、防御相关和植保素等9个免疫反应相关的信号通路(表1)。通过多序列比对和保守结构域分析从苹果、山荆子、西洋梨和杜梨基因组中均获得以上基因的同源基因,序列相似性均在71.53%~96.00%之间,且含有相同的保守结构域。
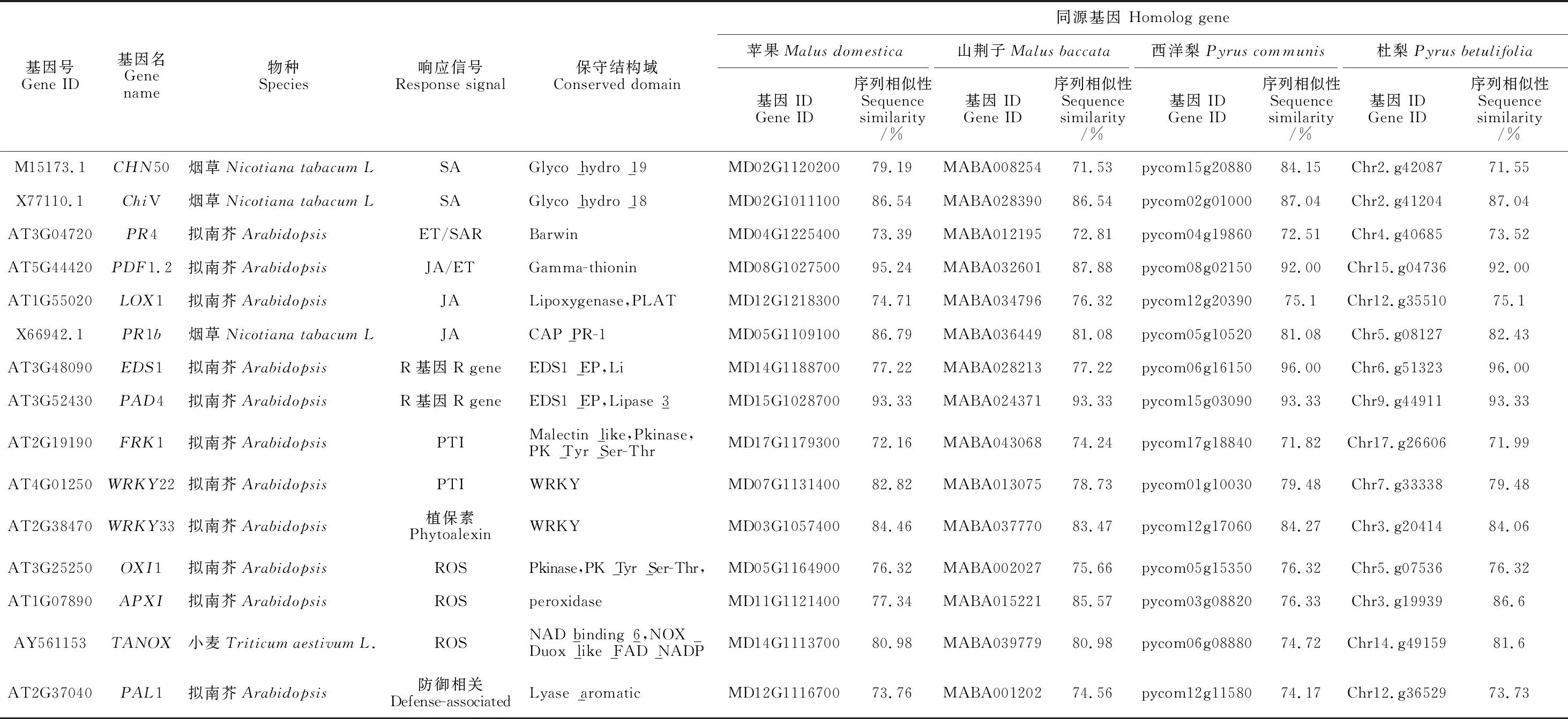
表1 目标基因的同源基因
2.2 序列比对和引物设计
为获得在苹果和梨中通用的引物,将来自4个物种的同源基因进行多序列比对,在保守区域设计备用引物2对。对来自各处理样品不同浓度的cDNA进行了荧光定量发现,各基因在5倍稀释液(100 ng·μL-1)时Cq值均介于18~25(图1),以cDNA 5倍稀释液(100 ng·μL-1)为模板,对所有引物进行了扩增,确定扩增效率较高的引物15对(图2,表2)。

表2 目标基因所用引物
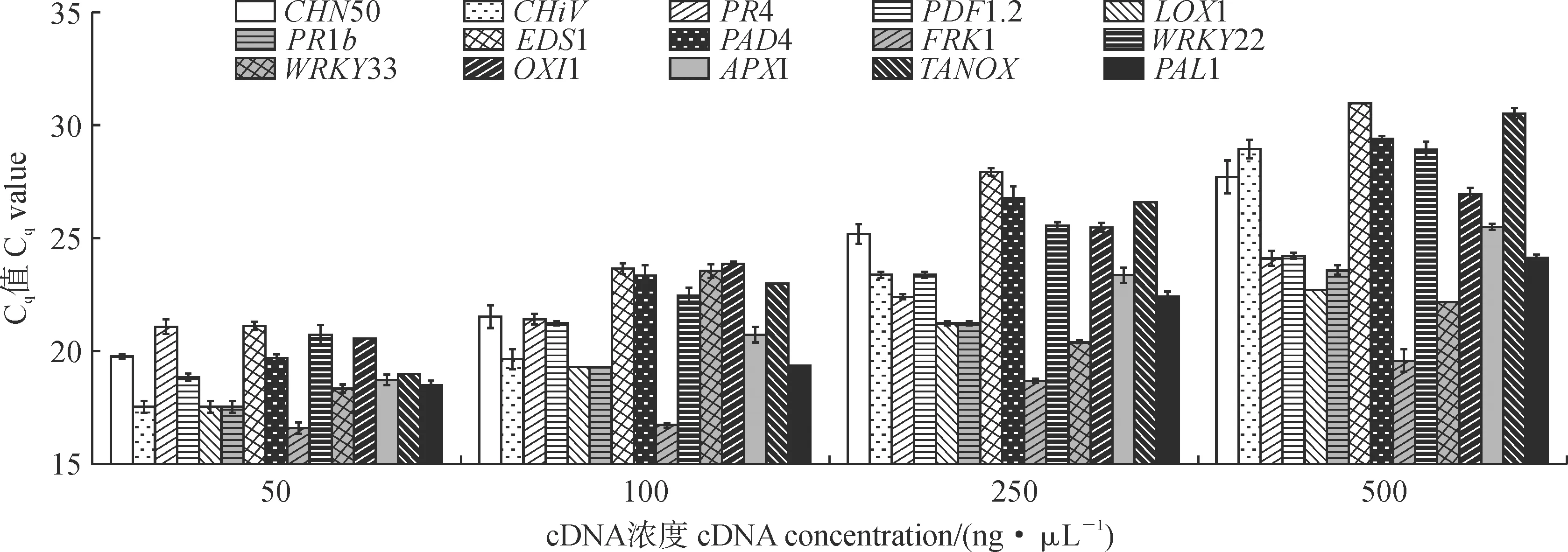
图1 不同cDNA浓度下Marker基因的表达
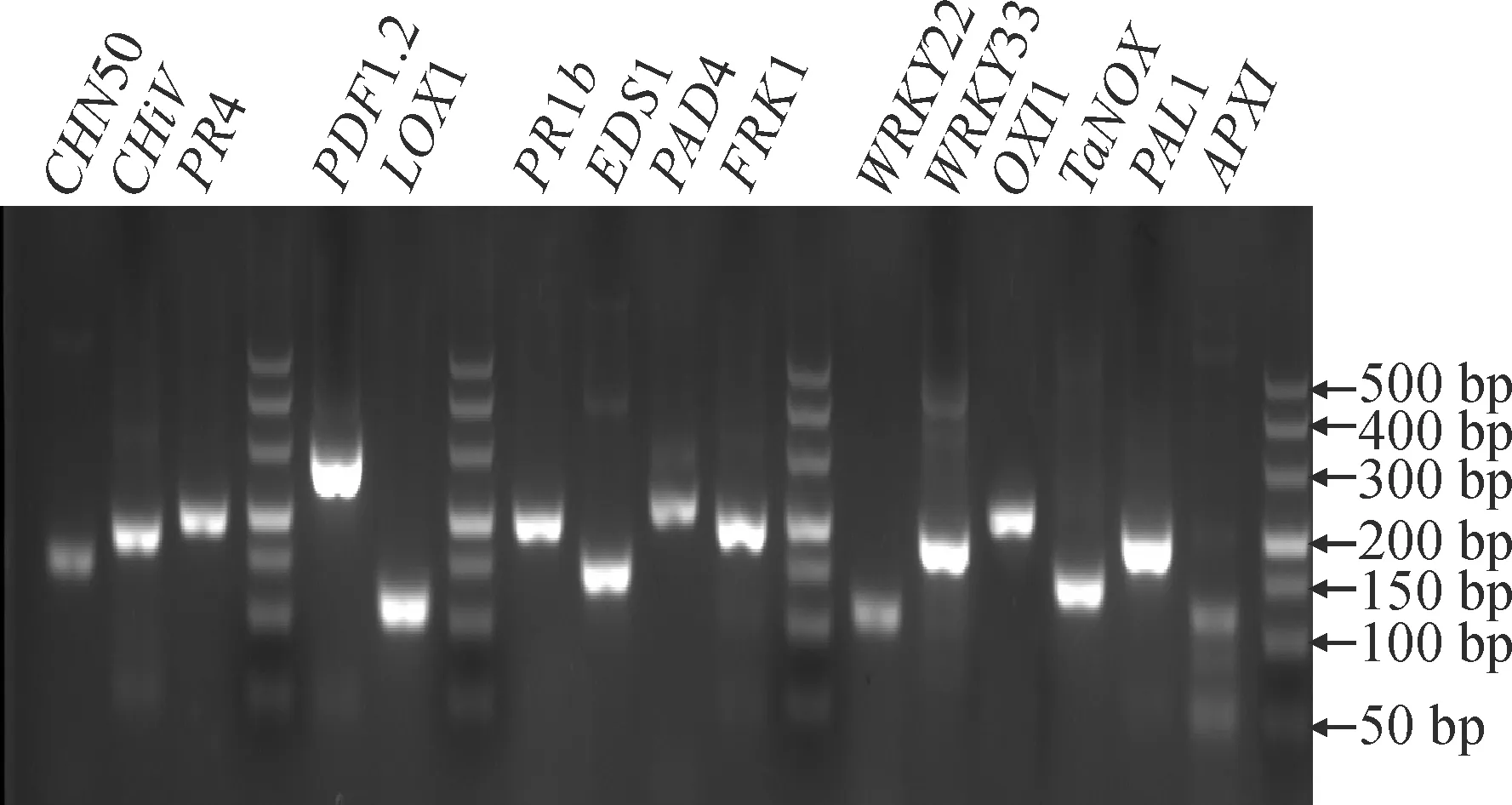
图2 Marker基因PCR扩增胶图
2.3 SA和JA通路Marker基因表达
图3显示,JA和SA诱导后,各处理均可诱导各自通路Marker基因上调表达。SA处理后,该通路Marker基因CHN50和ChiV在杜梨和东北山荆子悬浮细胞均为上调表达(图3,A、B),且随着处理时间的增加,CHN50和ChiV在2个物种中的相对表达模式都为上调表达趋势。杜梨细胞中,SA处理可致CHN50和ChiV的表达量上调至对照的8和5倍(图3,B)。JA处理后该通路Marker基因都为上调表达。其中,PR1b在东北山荆子中上调最为明显,最高可至对照的181倍(图3,C)。LOX1和PDF1.2(Plant Defensin 1.2)在杜梨中上调最为明显,最高可上调至对照的585和5 699倍(图3,D),且在杜梨中上述基因的表达远高于在东北山荆子中的表达。以上结果表明,如上2个信号通路候选Marker基因的表达均可被外源信号激活,可作为各自信号通路的Marker基因,同时为其余通路Marker基因的表达提供了可靠性。
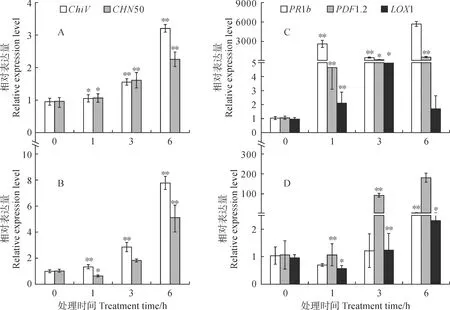
* P < 0.05,** P < 0.01表示同时期处理相对于对照的差异显著水平,下同
2.4 SA处理后SAR通路和R基因的表达模式
由图4可知,外源SA处理下SAR通路关键基因PR4和R基因EDS1、PAD4(Phytoalexin Deficient 4)在杜梨(图4,A)和东北山荆子(图4,B)中相对表达量都呈显著上升,且表达趋势几乎趋于一致。其中,PR4在东北山荆子中的表达量在6 h达到了对照的1 538倍,在杜梨中仅上调了7.6倍。杜梨中PAD4的表达量在处理6 h时其表达量达到对照的387倍,而在东北山荆子中其表达量最高仅上调至对照的2.7倍。EDS1在杜梨和东北山荆子中的表达几乎一致,最大上调倍数分别是对照的3.4倍和3.5倍。综上,所选的SA信号及相关通路基因的表达可被SA激活,进一步说明所选的Marker基因引物可反映该信号通路是否被激活。
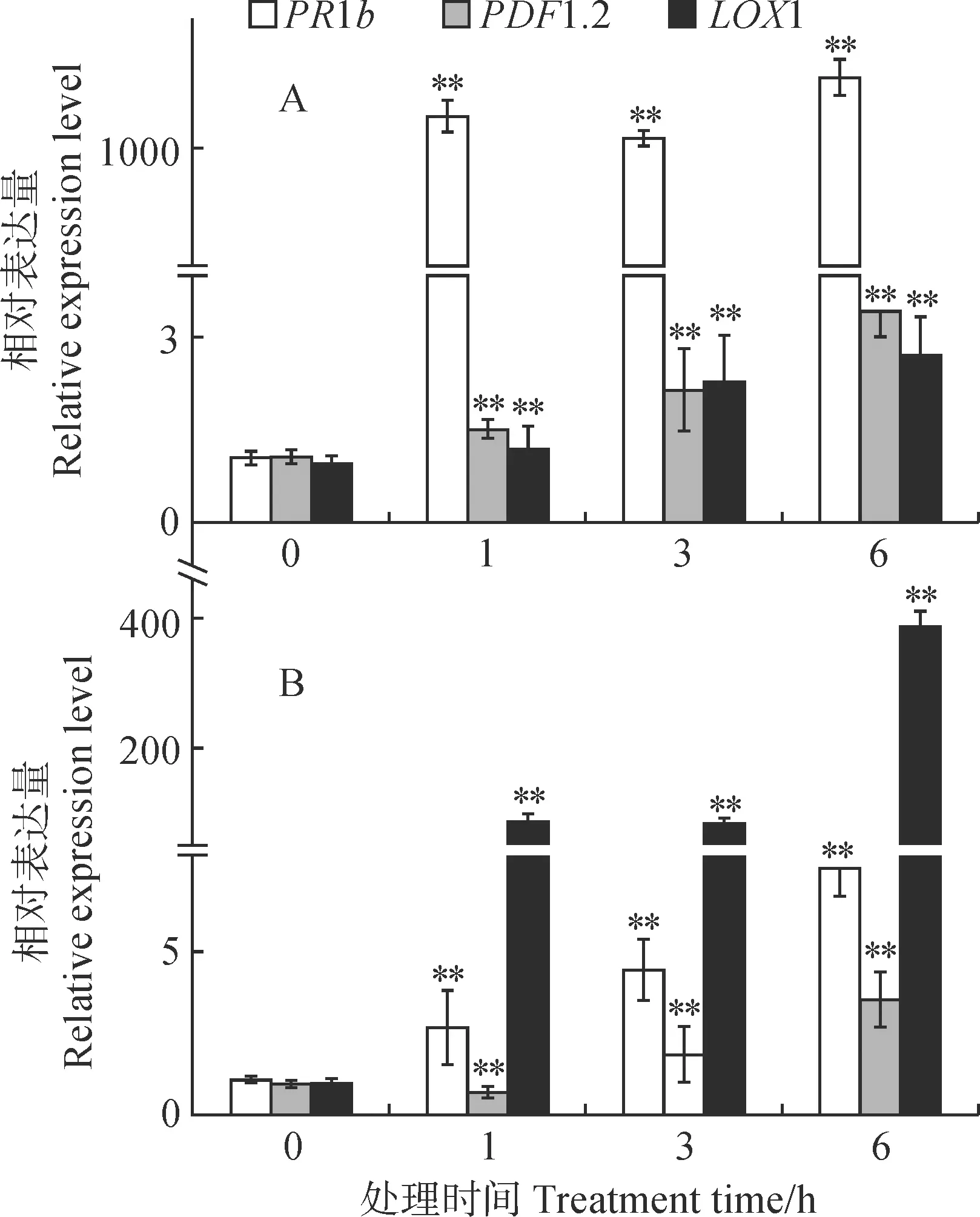
图4 外源SA处理下SAR和R基因在东北山荆子(A)和杜梨(B)中的表达
2.5 ROS含量测定及通路基因表达验证
与对照相比,Vp代谢物处理后杜梨悬浮细胞中ROS的积累呈逐渐上升的趋势。处理1 h、3 h和6 h时,其信号值分别由对照时的1 689上升至2 313、4 524.8和5 443.8(图5,A)。此外,Vp代谢物处理还增加了在杜梨细胞ROS响应基因的表达水平。其中,OXI1(oxidative signal-inducible1)的最高表达量达到了对照的25.2倍,APX1(ascorbate peroxidase 1)和TANOX(triticum aestivum NADPH Oxidase)的表达最高仅上调了对照的5.6和6.3倍(图5,B)。表明杜梨在受到Vp代谢物胁迫时,会激活体内PTI反应,进而导致植物体内ROS的爆发。
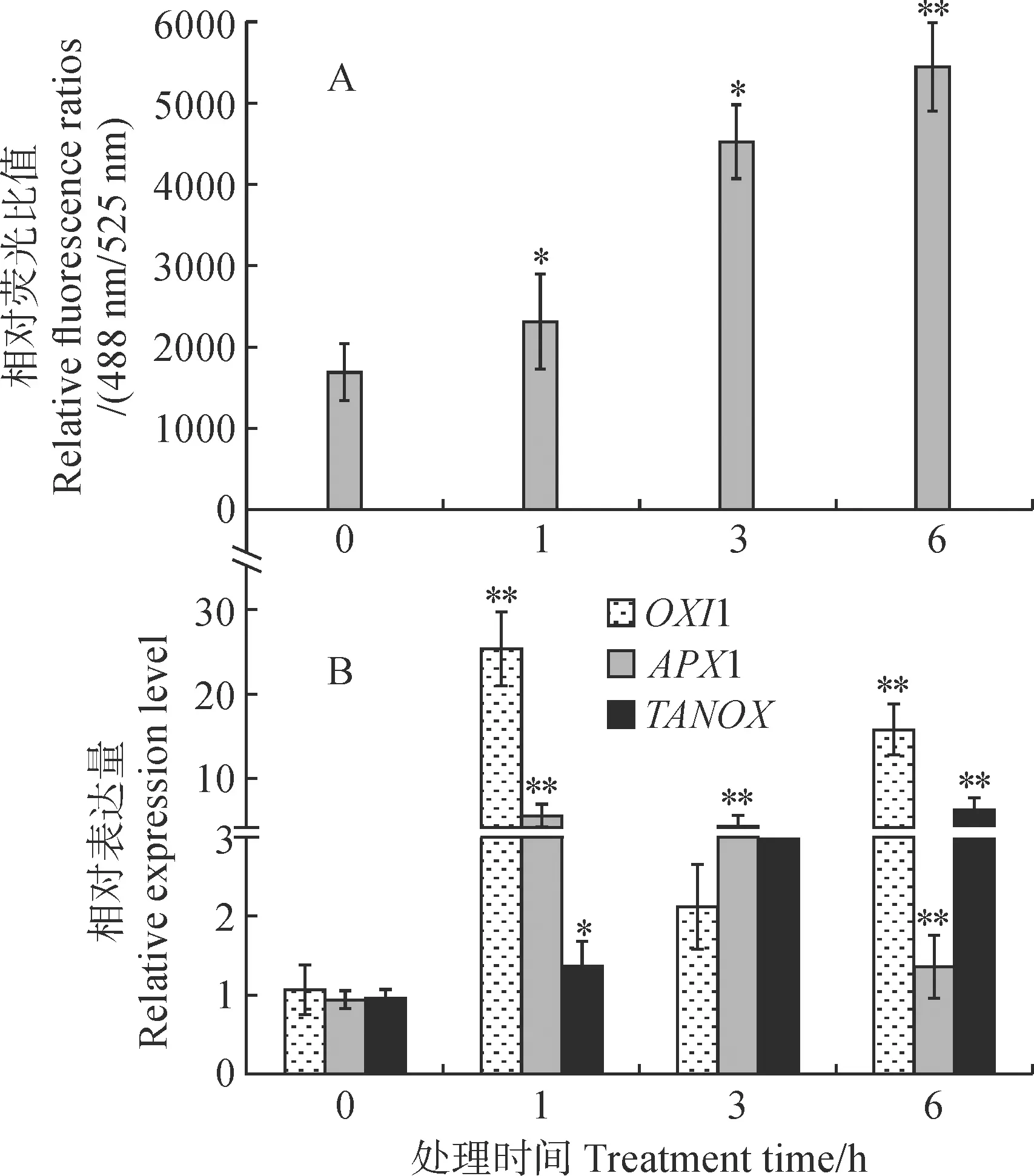
图5 腐烂病菌(Vp)代谢物处理下ROS 含量测定(A)及通路相关基因在杜梨中的表达(B)
2.6 杜梨响应腐烂病信号的免疫反应相关基因表达模式
为了解高抗资源杜梨响应腐烂病信号的抗性机制,进一步测定了各通路Marker基因在杜梨悬浮细胞响应Vp代谢物过程中的表达模式,发现各通路Marker基因都呈不同程度上调表达(图6)。其中,JA通路中Marker基因PDF1.2和LOX1上调最为显著,最高上调倍数分别达到对照的369和6 916倍(图6,A)。防御相关基因PAL1在处理1 h后表达水平达到了对照的1 072倍,随后又缓慢降低。SAR通路基因PR4在处理6 h后达到了对照的6 369倍,其表达量相比其他信号通路Marker基因更为显著(图6,B)。SA通路中Marker基因ChiV上调最为明显,最高表达量在处理3 h后达到了对照的1 718倍(图6,C)。此外,在Vp代谢物处理下PTI通路Marker基因、R基因和植保素相关Marker基因也呈上调表达,但表达量相比其他通路Marker基因相差甚大(图6,D、E)。以上结果表明在受到病原微生物侵袭后,主要激活了植物体内的SA、JA、SAR和防御相关信号,继而抵御病原的进一步入侵。
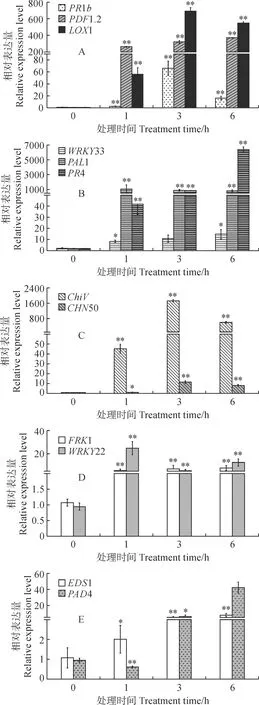
图6 腐烂病菌(Vp)代谢物处理下病程相关基因在杜梨中的表达
3 讨 论
本研究结合同源比对和基因表达分析,筛选出苹果和梨抗性反应相关信号中的Marker基因及检测其表达模式的引物。同时,利用如上Marker基因,研究了高抗砧木杜梨对腐烂病菌的防卫机制,发现多个抗性反应信号参与其抗病性,且在响应腐烂病的过程中呈上调表达,其中表达量较高的基因有:ChiV、LOX1、PR4和PAL1。
植物在应对病原真菌的过程中,许多防御相关信号通路的Marker基因都参与了植物的抗性反应。JA通路防御标记基因PDF1.2可增强拟南芥对病原体的抗性[23],腐生型病原真菌或共生真菌可通过抑制茉莉素途径、降低茉莉素介导的植物抗性,进而促进腐生型病原真菌的侵染或共生真菌与植物共生[21];与此同时,茉莉素可通过调控次生代谢产物的合成和诱导防御基因的表达来调控植物对腐生真菌的抗性反应[24]。烟草在疫霉菌侵染后可诱发ROS的迸发和PTI反应相关基因WRKY33和FRK1(Flg22-induced Receptor-like Kinase 1)的表达[25],ROS在植物与腐生型真菌相互作用过程中也起着关键作用[26]。SAR信号通路基因PR4能够编码具有抗真菌活性的蛋白,特别是对镰刀菌活性的蛋白[27]。EDS1在植物的2层免疫防线中均发挥着非常重要的作用,尤其在第2层免疫防线中,植物大多数TIR-NB-LRR(Toll-Interleukin1 Receptor-nucleotide binding-leucine-rich repeat)类抗病基因功能的正常发挥都需要EDS1的参与[28]。EDS1不仅可以与病原菌效应蛋白发生相互作用,还可以与植物体内TIR-NB-LRR类蛋白形成复合体,从而实现抗病信号通路的正常传递[29]。此外,EDS1和PAD4可通过SA依赖性和非依赖性机制对白粉病的抗性做出重大贡献[30]。本研究对同源性较低的基因(CHN50、PR4和FRK1等)进行了表达验证,发现了其与模式植物中相似的表达模式。同时,发现随着ROS含量上升,相关Marker基因的表达量也随着上升。因此,本实验所得的基因及相关引物可准确反应抗性反应是否被激活,可作为各自通路的Marker基因。
SA和JA作为植物防御反应中的重要信号分子,在植物防御中有着很大的贡献,且因入侵病原体的不同防御机制不同。研究发现外源施用防御激素SA或其合成类似物可诱导植物SAR反应[31]。本研究结果显示当外源施加SA后东北山荆子和杜梨中PR4的表达量都呈显著上调。另有研究表明,SA信号途径和JA信号途径既存在协同作用,也存在拮抗作用[32],JA能够抑制依赖SA途径标志基因PR1的表达[33]。然而,在田间实验中观察到,由细菌性枯萎病菌诱导黄瓜产生JA介导的ISR并不影响SAR标志基因PR1的表达[34]。此外,JA作为MeSA上游的信号分子与其协同激发SAR反应[35]。本实验结果显示,腐烂病菌胁迫时SA通路基因和JA基因表达都呈显著上调,并未受到相互抑制。由此可推测,JA和SA在抗病过程中由于它们含量变化的异时性可能产生相互依赖,未发生JA对SA的抑制作用。
综上所述,本研究所获得的15个抗性反应Marker基因的引物可用于抗性反应的快速分析。此外,响应腐烂病信号过程中,抗性砧木杜梨中SA、JA、PTI、SAR、R基因、防御相关和植保素等多个免疫反应被激活,推断这些信号通路可相互作用共同调节杜梨对腐烂病的抗性响应,但仍需要对这些信号通路基因的生物学功能及相互间的调控关系进行进一步的详细研究。
