生物培育肉补充传统养殖业肉类供应的可行性及挑战分析
2022-11-08杨峰李莹莹李石磊王守伟
杨峰,李莹莹,李石磊,王守伟
(中国肉类食品综合研究中心,北京食品科学研究院,北京 100068)
中国的畜牧业经历了巨大的转变[1],从生产方式、科学技术水平、国内和全球粮食供应、资源利用、氮和磷的损失以及温室气体(GHG)的排放等方面均产生了深远的影响。在过去的三十年中国牲畜单位数量增加了2 倍,动物源蛋白质的产量增加了2.1 倍,新品种供应、新技术和政府支持推动了该变化。于此同时,动物饲料进口量增加了49 倍,氨气和温室气体排放增加了1 倍,水中的氮损失增加了3 倍(中国统计年鉴)[2]。此外,在健康方面,动物农业产业互联,食源性疾病,饮食有关的疾病,抗生素耐药性和感染性疾病问题加剧,同时加剧了包括温室气体排放,土地利用和水利用等环境问题。这预示着,在未来的几十年中,随着人口增加,粮食和动物蛋白的生产将无法满足全球人类的基本需求。这一结果表明,未来传统粮食生产及肉类供应方法将面临重大的不确定性和需求危机。
生物培育肉,即通过细胞体外培养、分化、生肌形成的具有肌肉结构组织的肉类产品。目前已成为国际肉类食品研究的热点,受到美国、欧盟、日本、以色列等主要发达国家或地区的高度重视。其特点是清洁、卫生、成分可知并可调节,最重要的是生物培育肉没有传统动物过程中使用的抗生素及各种环境污染,并且不存在动物福利问题。生物培育肉被认为是一种最有可能解决未来肉品供应问题的新型肉类生产方式。生物培育肉通过动物肌肉干细胞的体外大规模、低成本组织培养实现,生产过程主要包括种子干细胞的分离获取、细胞的大规模培养增殖、细胞的诱导分化、培育肉的收获和分离、食品化加工等诸多步骤,有望补充传统肉类的供应不足甚至在未来替代传统肉类的生产模式。
1 传统肉类现状分析
由于畜禽相关养殖技术及科技水平存在差异,西方国家在畜禽品种的技术水平明显高于国内技术现状,导致国内目前优质种畜禽严重依赖进口。主要通过国外优质品种与国内地方品种杂交获得杂交优势,但传统育种周期较长,加上西方国家垄断行为,尽管国内现在加大科研技术投入,突破了部分领域的垄断行为。但随着人口增加和经济提高,肉类蛋白依赖进口越来越严重(图1a),其中大型动物中的牛肉进口数量由2013 年到2019 年逐年增加,并且2019 年进口量(175.93 万t)是2013 年(34.1 万t)的5 倍,而出口量对比变化不大(2.2 万t~3.4 万t)。同时,作为一个猪肉消费大国,我国猪肉进口数量近年呈持续上升趋势[3],进出口比例失衡。以2020 年1 月~7 月为例(图1b),猪肉进出口比例严重失衡,2020 年7 月当月进口猪肉数量为55.58 万t,而出口猪肉仅为11.33万t,主要进口国家分布为进口数量大于60 万t 的国家有美国、西班牙;进口数量在30 万t 到60 万t 的国家有丹麦、荷兰、加拿大、德国;进口数量在10万t 到30 万t 的国家有巴西、智利、法国、英国。出口国分布为1 万t 以上出口国日本;0.01 万t 到1 万t国家新加坡以及小于0.01 万t 出口国刚果、澳大利亚、印度尼西亚等,总体而言,猪肉存在严重进口依赖问题。同时国内生猪存出栏量统计结果可以看出(图1c),从2012 年开始到2018 年肉猪出栏量、期末存栏量、能繁母猪存栏量均呈现平稳下降趋势。2019年非洲猪瘟和2020 年新冠病毒爆发引发猪肉产量和消费量骤减,导致猪期末存栏量、能繁母猪存栏量大幅度降低。这一结果将导致后疫情时代猪肉产量低和消费量骤增的矛盾更为突出,因此对进口猪肉量的依赖将进一步提升,而这将进一步加剧传统肉类生产方式供应生产源头面临的不确定性。此外,我国肉羊养殖主要集中在内蒙、东三省、青海及新疆等地区,但随着过度放牧,环境治理等因素,我国肉羊饲养总量逐渐减少,并且从羊肉进口数量来看(图1d),从2015年开始随着我国经济发展的快速提升,羊肉进口量逐年上升,尽管进出口量较我国总产量比例较小,但该趋势同样预示了我国肉羊总产能的饱和以及对进口羊肉依赖性的提升。这一结果进一步的显示出传统肉类生产方式达到临界点进而加剧了我国未来传统生产方式的不确定性。从全球范围来看,2019 年全球牛的平均库存量约10 亿[4];鸡的平均库存量估计为190 亿;羊和猪的平均库存量约10 亿。受经济发展的影响,预计到2050 年全球对动物性产品的需求将翻一倍[5]。同时受饮食偏好的变化,预计全球牛饲养量将在2030年增加到24 亿,到2050 年增加到26.4 亿[6]。

图1 我国主要肉类进出口现状统计Fig.1 Statistics on China's meat import and export status
全球粮食安全和粮食生产和消费的可持续性很大程度上取决于如何管理畜牧业生产和动物源食品消费。牲畜生产系统占用了世界重要比重的资源,例如土地和水(占比例3%~5%),并且导致CO2为主源的温室气体(GHG)和NH3(空气中的)以及氮(N)和磷(地表水源中)的排放[7]。最近的全球评估机构对不同牲畜生产系统的生物量使用,饲料转化率和生产率进行了系统的量化。畜牧生产方式的变化,转向更高效的单胃动物和无地生产系统(饲养动物,从其他农场和国家进口饲料,而粪便仅部分流向耕地),已在动物的水平为节省大量资源和减少排放做出了贡献。然而,由于畜牧业生产的总体影响较大,尽管通过提高生产水平和农场饲料和动物生产的效率,但对粮食、土地、水资源等的依赖依旧是影响环境和能源的重要指标。从近几年数据看,农业用地及耕地面积近年变化不大,并且受温室效应影响,整个陆地面积甚至在减少,全球粮食产量相对稳定,并且在科技水平提高的基础上,相对产量有所提高。但从近几年的粮食总产量看(图2),全球粮食总产量维持在相对恒定的比例,意味着全球粮食供应在未来也不会发生特别大的变化,即未来畜产品供应在当前已经趋于饱和状态,尽管畜产品供应主要受市场供求关系影响,但从侧面来看,随着人口数量的增加,畜产品的供应可能无法得到满足。
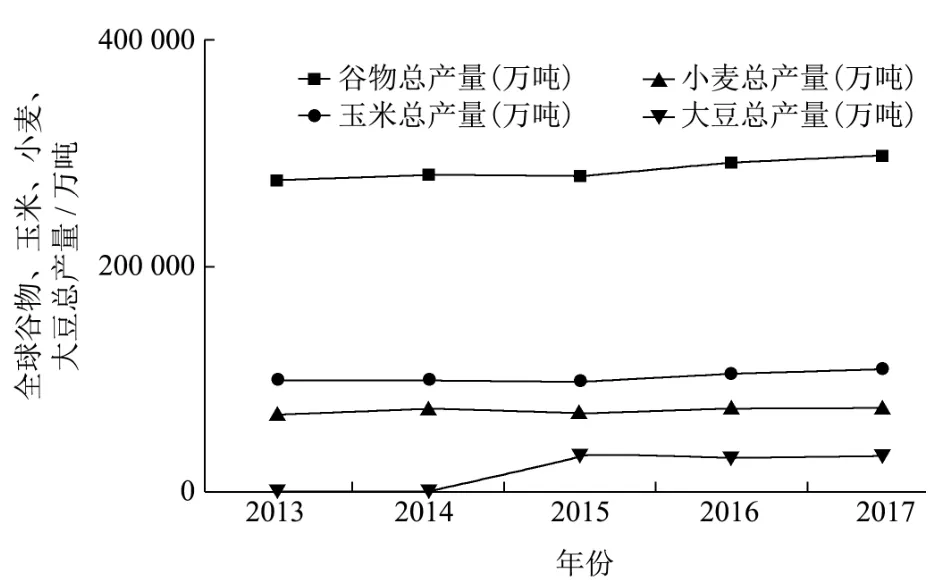
图2 全球粮食总产量变化趋势Fig.2 Trends in global food production
牲畜将地球整个陆地表面的30%用作永久牧场;33%的耕地用于生产牲畜饲料[8],因此牲畜业对全球的环境影响很大[9]。Pelletier 和Tyedmers(2010 年)预计,到2050 年,畜牧业将在气候变化、活性氮损耗及食用性植物占用规模三个问题上对环境产生更大的影响[10]。与此同时,畜牧业消耗了全球8%的可食用淡水资源[11],对清洁水和卫生设施产生了重大影响。世界上近三分之一的农业总水食用与动物产品有关[12]。除了水,畜牧业温室气体排放导致了很大程度的气候问题。由于其重要性,气候变化与畜牧业之间的相互作用现已得到广泛认可。畜牧业造成了很大一部分农业排放[13]。农业约占当前人为排放的10%~12%。一些人估计,在2010 年所有人为排放造成的0.81 ℃的总模拟升温中,畜牧业的直接非二氧化碳排放约占19%[14]。由于CH4和N2O 具有较高的全球变暖潜能值,反刍动物单位畜产品的温室气体排放量高于单胃动物[15]。总体而言,畜牧业对全球土地、水、粮食的消耗产生巨大影响。同时排放了大量的温室气体及对环境造成了重大污染。
2 生物培育肉的形成过程及其特点
在肌肉组织中,肌纤维占干物质90%的比重,结缔组织和脂肪组织占比10%[16]。肌肉中细胞种类可以分为成肌细胞、肌卫星细胞、神经细胞、脂肪细胞和支持细胞。生物工程学的进步实现了不同种类细胞在体外的共培养,并进一步实现了体外组织的类器官模拟再生[17,18]。基于这一技术的发展,生物培育肉技术应运而生,通过成肌细胞、内皮细胞、脂肪细胞及可以产生细胞外基质的支持细胞等共培养,实现在3D支架材料中生成具有组织结构的骨骼肌。从技术角度来看,生物培育肉的特点是通过细胞培养的,在体外形成肌肉纤维蛋白的一种肉类生产方法[19]。
生物培育肉的制造中,主要通过两种途径进行细胞的制备:1、通过肌卫星细胞分化为成肌细胞,成肌细胞扩增后进入分化途径进而产生肌纤维组织;2、通过间充质干细胞诱导成肌细胞、成纤维细胞以及脂肪前体细胞,进而进行细胞的增殖,最后通过细胞诱导,促使成肌细胞形成肌纤维,成纤维细胞形成细胞外基质,脂肪前体细胞诱导形成脂肪细胞进而形成脂肪组织。其整个过程主要分为三个主要阶段(图3):细胞增殖阶段,这个阶段的目的是通过细胞增殖产生大量的生物培育肉的基本元件-细胞,为形成更多的肌纤维做前提准备;之后是分化阶段,成肌细细胞分化之后形成肌管,为产生肌肉蛋白做准备。脂肪细胞分化生脂,为生物培育肉的脂肪生成做准备,成纤维细胞进行表达调控,产生诸如胶原、透明质酸等细胞外基质,支持其他细胞的形态及结构;最后是肌肉形成阶段,这个阶段的复杂性最高,因为这个阶段是肌纤维组织、肌内外脂肪组织以及细胞外基质进行生物学的融合,进而形成真正意义上的生物培育肉,其过程受包括基因、蛋白、激素等多种条件控制,是产生的生物培育肉与体内形成的肉相似性最关键的一步,同时也是目前最亟待解决的技术难题。因此多类型细胞共培养在生物培育肉的制造过程中将成为未来发展的主要方向和趋势。然而,生物培育肉的制造在国内目前研究只是处于实验室水平上形成的鸡肉、猪肉、鸽子汤等产品(如南京农业大学生产的猪肉糜及中国肉类食品综合研究中心生产的鸡肉排、养生鸽子汤及猪肉排等),尚无上市售卖的生物培育肉产品。根本原因在于目前的研究水平尚无法做到在规模化生产过程中有效的控制培育肉制造成本,尽管新加坡目前已经具有上市的培育肉产品,其相对产量较低,仍无法满足市场需求,同时,在国内没有针对生物培育肉的相关食品安全方面的法律法规出现,行业标准等也需要相关部门的努力中积极推进。
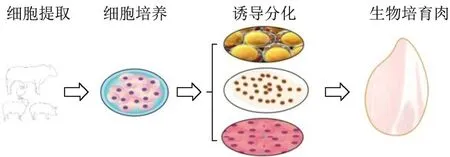
图3 生物培育肉形成过程Fig.3 The formation process of biologically cultivated meat
尽管生物培育肉目前已经在实验室水平上进行的大量的研究,但若将其推上市场,仍需要较长时间的准备,其主要受限于制造成本,而成本中主要包括种子细胞的来源,廉价的针对生物培育肉制造的培养基的研究以及胎牛血清的替代产品的研究。
3 生物培育肉的关键细胞及功能
作为生物培育肉制造起始材料,种子细胞的选择起到至关重要的作用。通过实验验证,细胞随着物种年龄的增加,在体外增殖的效率逐渐降低,而在胚胎中,胚龄越小细胞活性越强。但如果胚胎周期过早,将会导致提取的细胞处于分化前期,细胞具有一定干性,比如肢体发育之前,体节细胞可以分化成多种肌肉和骨骼相关的细胞,因此选取准确的细胞提取样本和提取时间是影响后期生物培育肉制造效率的关键。此外,生物培育肉的种子细胞来源主要有三个方向(图4):1、干细胞,作为生物体最原始的细胞,干细胞作为祖细胞群,可以进行增殖以增加细胞群数量,同时可以分化成具有专一功能的细胞。干细胞研究是动物科学领域的一个固有领域[20],而专注于成肌和成脂干细胞的研究对于生物培育肉技术具有重要的意义。Yuan 等[21]对牛胚胎干细胞进行培养,获得了一个稳定培养物,总结了骨骼肌发育所需要的细胞类型[22-25]。但干细胞作为生物培育肉种子细胞的缺点是细胞具有不定向分化,培养过程中细胞的分化方向控制难度大;2、间充质干细胞,作为胚胎发育过程中中胚层的主要细胞类型,在肌肉发育过程中起到至关重要的作用[22],并且可以分化为成肌细胞、脂肪细胞、成纤维细胞和内皮细胞[26-31]。在肌肉发育过程中,间充质干细胞参与肌源性过程,分化出成肌细胞和肌卫星细胞。其他间充质干细胞参与成肌细胞纤维化、成脂祖细胞谱系[22],产生肌纤维和成脂祖细胞。间充质干细胞在特定培养条件下,可以有效增殖并保持其分化潜能[32-35]。3、诱导多能干细胞也可以作为生物培育肉重要的细胞来源,诱导多能干细胞特点是容易获取。这一特点决定了诱导多能干细胞在培养成本和开发稳定的干细胞系方面具有较大的优势。此外,诱导多能干细胞可以从普遍存在的组织类型中获取[36],但是诱导多能干细胞的使用需要通过基因编辑、生物改造,并且其产量较低,存在基因层面的无法预料的风险[37],并且作为食品类科学,在监管程序和消费者接受程度上存在一定的不确定性。因此,目前全球范围内生物培育肉制造过程中主要使用的细胞来源为肌卫星细胞和间充质干细胞。

图4 生物培育肉细胞来源及肌肉形成过程Fig.4 The source of biologically cultivated meat cells and the process of muscle formation
肌卫星细胞是成体干细胞,具有干细胞特性,但细胞分化方向单一,只能分化为成肌细胞。肌卫星细胞主要存在于骨骼肌组织中,其功能是参与肌肉损伤的修复[38,39]。细胞的获取过程为首先通过从胚胎或畜体分离肌肉组织[40,41],通过粉碎组织,胰蛋白酶消化,预铺板富集细胞,然后通过CD56 抗体、CD29 抗体进行细胞纯度验证,进而对进行细胞纯化最终获得肌卫星细胞[42]。研究表明生长因子可以调节卫星细胞的增殖和分化,LIF,TGF-β和胰岛素样生长因子1 可以提高细胞的增殖效率[43-46],TGF-β1 在平面培养环境中抑制成肌细胞的肌生成,而在3D 培养环境中可以促进成肌细胞的肌生成[47],这为体外肌肉组织发育中肌生成提供了新的研究方向。细胞外基质形成同样可以诱导促进肌生成[48],IGF 和肌原性miRNA 通过抑制细胞产生的肌原性生长因子从而抑制肌纤维的形成[49]。这些关键因子和基因的调控未来将成为生物培育肉技术中的研究重点。
成纤维细胞可以产生细胞外基质,即细胞外无细胞组分,是机体组织的重要组成,胞外基质增加组织弹性,提供细胞粘附的粘附点,同时为细胞提供三维微环境,并调节细胞的增殖、分化、迁移、形态以及组织形成方式[50]。此外,胞外基质包含营养成分,包括多种成分的蛋白质及多聚糖等,可以通过调节影响肌肉组织的理化性质[51]。肌肉胞外基质具有三个上升的结缔组织层:填充肌纤维之间间隙的内胚层,将肌束分隔开的包膜肌层和包裹整个肌肉的上皮层。Kadler 等[52]通过研究阐述了不同种类的胶原蛋白的生物学功能及在组织中分布状态,为生物培育肉在支架及机械性能上提供了重要指导。支持细胞作为分泌胞外基质的功能性细胞起到重要作用,在肌肉组织中,绝大多数的胞外基质是由成纤维细胞产生。已有研究显示成纤维细胞和成肌细胞可以促进组织工程构建中肌肉发育,同时该研究对生物培育肉的制造过程中具有重要的作用。成纤维细胞增殖周期短,细胞增殖速度快,但细胞浓度控制相对较难,并且非常容易受到基因调控的影响,这意味着成纤维细胞和成肌细胞的共培养不容易实现,需要新方法新思路寻求突破(比如以微囊化的方式对细胞进行共培养以及细胞产物作为添加因子再培养等方式)。
脂肪细胞和肌内脂肪的生成:在肌肉脂肪中,肌内脂肪约占80%,肌纤维内部脂肪约占20%。肌内脂肪和脂肪酸的含量是影响肉风味的重要指标,影响肉的水分、风味、嫩度及营养价值[53]。肌内脂肪是通过脂肪生成形成的,在形成过程中,间充质干细胞分化为脂肪前体细胞,脂肪前体细胞成熟后形成脂肪,成脂细胞来源于间充质干细胞和成脂祖细胞,受Zfp423基因调节的命运决定[51,22]。脂肪前体细胞在CCAAT增强子结合蛋白家族的转录因子调节过程中进一步分化为脂肪细胞,在通过过氧化物酶受体诱导激活PPARG-γ受体诱导细胞形成脂滴。在体外可以通过抗糖尿病药等诱导细胞成脂。有研究证实了成肌细胞及成纤维细胞向脂肪细胞分化的方案。在脂肪生成代谢途径中,甘油三酯是长链脂肪酸(LCFA)和3-磷酸甘油酯从头合成的。这个过程中脂肪酸合酶、脂肪酸结合蛋白4 和PPARG 等起到了促进脂肪细胞成熟的作用[54],并且可以作为脂肪生成的标记物,而追踪脂肪形成和生成的方法包括定量比色油红O 染色,荧光尼罗红染色,FABP4 免疫标记等。体外产生肌内脂肪的研究仍需深入研究,目前脂肪组织工程学研究主要针对肌肉外部的脂肪。Hausman 研究了细胞外基质对动物脂肪形成的影响表明,层粘连蛋白、胶原V 和胶原VI 是肌肉内脂肪形成中关键的细胞外基质成分[55]。
4 生物培育肉的关键技术
4.1 无血清培养基的技术突破
生物培育肉相关技术已经取得了一定的研究进展,但从未来商业化生产的角度来看,仍然存在着一些特殊的技术挑战,这些挑战成为了阻碍培育肉商业化进程的主要障碍,尤其在低成本、规模化生产以及肉类产品的市场化进程上。目前尚没有专门针对生物培育肉而设计出的培养基产品,而是通过基础培养基加血清的方式进行细胞培养。在大多数其他动物细胞培养应用中,血清在培养基配方中起着重要的作用。胎牛血清是从屠宰怀孕母牛胎儿体内提取的血液中的血清部分。首先是胎牛血清价格昂贵,其次不同批次产生的胎牛血清之间的固有成分及含量存在很大的差异性,同时细胞因子的浓度差异非常显著,无法做到成分含量的统一。并且很多成分是目前尚未研究彻底的、未知的细胞生长相关因子,不同批次的胎牛血清之间的这些差异可以导致肌肉表型发生变化,从而显著的改变不同批次生物培育肉的肉质。此外,在生物培育肉应用中使用的血清成分,增加了不确定的技术挑战。因此,血清替代物或其他细胞生长因子的使用仍然是生物培育肉细胞培养基(包括细胞增殖和分化[56,57])的主要挑战。在未来研究过程中,研究开发成分明确的,可以用来控制不同细胞分裂、分化以及成肌细胞肌管形成的培养基将成为解决生物培育肉规模化生产或商业化的重中之重。此外,如何通过使用不同培养基来影响培育肉产品的感官和营养品质也是生物培育肉未来发展的一个重要技术方向。另一方面,如何通过培养基和不同细胞特点来尽可能的节约细胞培养中培养基使用[58],或者通过分子试验替换血清将成为未来最主要的发展方向之一。
而针对无血清培养基的建立,可以通过以下几个方向研究血清替代物。包括血清提取物、组织提取物或水解产物、生长因子、激素、载体蛋白(如白蛋白和转铁蛋白)、脂质、金属、维生素、多胺和还原剂等[56]。这些因子的含量及组合数量几乎是无限的,而且它们之间的使用配比又会相互影响。因此,不同成分的选择以及搭配将会耗费巨大的工作量、时间和成本。并且在使用无血清培养系统时,有两点需要注意。首先,可以在传代培养过程中选择无血清以来的细胞株进行细胞增殖培养,因为无血清培养基比血清培养基更能促进这类特定细胞或细胞亚型的增殖[59]。其次,由于血清中缺乏毒素中和活性,无血清培养基中不可避免的杂质对培养细胞的影响可能比含血清的培养基强,因此培养过程需要时刻关注细胞的生长状态。此外,对于无血清培养,还有其他需要注意的事宜,如胰蛋白酶的使用浓度及粘附因子得选择等。同时还需要注意细胞培养的实时pH 变化,营养供应,细胞的氧化应激等[60,61]。
4.2 基因调控转化技术的突破
肌发生是指以修复组织损伤或从头形成为目标的肌肉组织的发育。在体内,这是在胚胎发育和成年肌肉再生中发生的一系列复杂事件,涉及各种分子机制和不同细胞类型的发育阶段[62]。增殖的细胞是在成人或胚胎的卫星细胞和成肌细胞,它能够分化和融合形成新肌管(从细胞原始状态形成新的肌管)或加入现有的肌纤维从而实现细胞增殖、分化和肌管融合的过程,而这个过程与几种已知的生长因子、转录因子和信号通路的活性有关。从啮齿动物到人类,已在几种不同动物模型中研究了这些信号传导因子及其功能[63]。
在一般情况下,生物培育肉制造过程中的培养基需要提供细胞外信号因子,它可以调节成肌细胞的活性。大量研究已经确定了许多生长因子和细胞因子在肌卫星细胞的激活和增殖中的重要作用,例如成纤维细胞生长因子(FGFs)[62]、肝细胞生长因子(HGF)、胰岛素样生长因子(IGFs)、转化生长因子β(TGF-β)和其他细胞因子[64]。其中FGF 基因家族中,尤其是FGF2,是成肌细胞增殖的有效激活剂和成肌细胞分化的抑制剂。HGF 在肌卫星细胞的激活和化学趋化以促进肌肉修复的过程中起主要作用,因此对于生物培育肉的应用同样存在一定意义。已知FGF 在体外可诱导增殖并抑制分化。IGF 通过刺激成肌细胞的增殖和分化,以及通过刺激发育中的肌管内的蛋白质合成来促进肌肉发育。此外,肿瘤坏死因子(TNFα)可能促进成肌细胞分化[65],而白血病抑制因子(LIF)促进成肌细胞增殖[53]。而TGF-β配体可抑制成肌细胞和肌管的增殖,分化和生长。与成纤维细胞共培养的过程中,成纤维细胞的存在可有效促进成肌细胞的增殖,分化和融合[44,66]。
同许多生长因子受体一样,IGF-1 受体是酪氨酸激酶相关信号(如磷脂酰肌醇-3 激酶(PI3K)-Akt 和细胞外信号相关激酶(MAPK/ERK)信号传导途径)级联传导的主要激活剂[67,68]。这些途径可以协同雷帕霉素蛋白复合物1(mTORC1)的靶标激活下游转录因子,促进细胞增殖并增加蛋白质合成,从而推动肌肉组织发育[68,69]。同样的,许多细胞因子受体如IL-6 受体,可以调用JAK-STAT 信号通路,在MAPK 信号通路的串扰作用下抑制肌发生[70],而TGF-β受体是丝氨酸/苏氨酸激酶受体,可以激活其自身涉及SMAD 的独特信号通路蛋白质磷酸化,相反的,几种miRNA 在肌肉细胞中发挥重要功能进而抑制该通路,同时促进p38/MAPK通路。多种Wnt 蛋白信号传导途径也通过G 蛋白偶联受体的卷曲家族在肌发生中起作用。β-catenin 介导的Wnt3a 途径通过拮抗Notch 信号从而对肌原性细胞增殖和分化产生刺激作用,而Wnt7a 可以激活非经典Wnt极化(PCP)途径[71],综上所述,这些信号因子可以对成肌细胞增殖、分化起到促进和抑制作用,在新的培养基设计过程中,合理的搭配这些因子的使用将会在培育肉的培养过程中起到重要的作用,同时为未来培养基高效率、低成本的实现提供可能。
传统的细胞合成蛋白质的应用主要有疫苗以及各种抗体的生产,其成本相对较高;但通过成肌细胞产生食源性动物蛋白的方法相比而言成本较低。肌纤维的形成是通过mTOR 介导的信号来调节的,氨基酸既可以作为蛋白质本身的组成部分,也可以作为调节剂[72]。考虑到用于体外成肌和蛋白质合成的许多纯化的生长因子和信号分子相关的成本,非常有必要研究刺激细胞所需的信号通路的更节约的方法。有研究提出通过与动物具有高度同源性氨基酸序列的植物或真菌提取物在肌肉细胞培养中的使用的方法解决该问题。比如通过大豆肽提取物刺激胰岛素相关的细胞信号通路[73]。同时有研究表示小麦和棉蛋白中的一些因子有可能替代牛血清白蛋白[74]。
4.3 多种细胞共培养的技术突破
细胞培育肉的最终产品将是由多种类型的细胞进行协调包括增值分化及分泌蛋白、脂肪等多组分肉类。即在体外模拟机体环境进而形成更具有肌肉理化性质的培育肉。对于目前而言是生物培育肉的一个技术挑战。对工业生产最重要的细胞类型包括肌卫星细胞或肌前体细胞,成肌细胞,肌纤维,脂肪前体细胞,脂肪细胞和成纤维细胞[75]。生物培育肉生产的主要技术障碍是如何同时生长和控制所有这些细胞类型,从而实现不同细胞在共培养的前提下能够各自实现的分裂、分化、成肌、成脂、成型而不受其他细胞的影响。
尽管脂肪形成是一个高度受控的调控的过程,调节脂肪形成的细胞外因子比控制肌发生的相关因子复杂性低。胰岛素和IGF 可刺激多能干或脂肪干细胞分化为脂肪细胞,并可通过其刺激转录因子-过氧化物酶增殖物激活受体γ(PPARγ)和CCAAT 增强子结合蛋白(C/EBP)。相反,Wnt/β-catenin 信号传导可抑制脂肪生成[43]。
成纤维细胞的分化和增殖在生物培育肉中不是最为迫切的问题,因为在大多数情况下它们不是主要的所需细胞类型,而是在更进一步的完善生物培育肉细胞培养的过程中起到强化作用。成纤维细胞在生物培育肉中的作用不是提供大量的肉,而是支持肌细胞和脂肪细胞的生长,并制造足够的细胞外基质以产生更真实的肉制品。总体而言,生物培育肉细胞培养过程中需要提供一些上述重要的生长因子或其替代物,以允许所需细胞类型的适当增殖和分化。
尽管目前有大量的研究探索细胞共培养系统和技术,比如血脑屏障永生化血管内皮/胶质瘤细胞共培养模型特性的研究及通过微流体的高通量组合细胞共培养等,在共培养过程中仅仅可以研究不同细胞之间的信号传递及细胞的相互作用,尚无法在完全控制的前提下实现某一功能,有报道显示通过微流控的方法可以实现细胞共培养环境的搭建,但其方法是将不同细胞共同封装在微凝胶中,这种共培养方法尚不能实现生物培育肉的共培养-分调控的功能[76]。
4.4 生物培育肉支架材料的突破
水凝胶在组织工程领域无处不在,尤其在生物培育肉的制造过程中是必不可少的技术之一,因为它们可以模仿成肌细胞肌肉组织的3D 环境[77]。因此,在设计时要考虑到它们的机械性能、细胞相容性、质量转运和降解动力学。水凝胶可以用作软支架,大孔支架的原料或填充大孔支架空隙的细胞生物材料[78]。对于后者,必须在细胞接种后使用细胞相容性溶液和方案进行水凝胶聚合。凝胶动力学和技术必须具有可扩展性,并允许在整个构建体中进行均匀凝胶化。这对于目前的生物培育肉研究来说很难快速实现,尤其是细胞生物相容性方面,因此在未来的发展趋势中,水凝胶系统也将成为一个重要的突破难点。
胶原蛋白和透明质酸天然存在于肌肉细胞外基质中,因此,它们可用于模拟天然基质的某些生化和生物物理特性,并且还易于被细胞重塑和降解,这对于细胞迁移和成肌细胞的成熟至关重要[79]。胶原蛋白经常用于组织工程。肌肉细胞中的纤维状胶原I 和III丰富。它们在组织中起结构作用,作为细胞粘附的锚点,并促进细胞迁移和组织发育。但是,胶原蛋白会在细胞中产生平面结构,并且由于其较高的拉伸强度,胶原蛋白水凝胶主要用于产生机械稳定的细胞粘附大孔支架。胶原蛋白-纤维蛋白混合物可以用作肌肉再生的水凝胶,已被证明可促进细胞增殖和肌管分化。但是胶原蛋白和透明质酸的成本较高,一种低价的获取方式是解决这一方案的重要挑战。比如通过细胞生产胶原蛋白和透明质酸,然后应用于生物培育肉中。
透明质酸是在身体和肌肉细胞外基质中普遍存在的简单糖胺聚糖。它参与伤口愈合并且可以调节细胞行为如脂肪生成。透明质酸水凝胶具有良好的粘弹性和高保水性,并且可以通过无动物的平台上合成。透明质酸-胶原蛋白复合材料显示出改善的机械和生物学特性,可用于肌肉和脂肪形成支架。
海藻酸盐是一种廉价的基于海藻的多糖,在Ca2+存在下会形成水凝胶。它由两种单体组成,其中古罗糖醛酸与Ca2+相互作用,可以形成高度可调的胶连结构。但海藻酸盐与细胞相容性较差,需要通过RGD肽(精氨酰-甘氨酰-天冬氨酸短肽)功能化,才可以为细胞附着提供位点。壳聚糖是一种可食用的葡萄糖胺聚合物,可以用于骨骼肌组织工程。但受其特性影响,同样需要化学修饰以促进细胞粘附。上述的所有支架材料在单一特点方面均有各自的利弊,但如此多的支架材料,如何科学的利用其优势,规避其劣势并将不同材料进行高效的组合搭配从而促进生物培育肉的发展是一个非常大的工程学研究,在生物培育肉未来的研究中,如何合理的搭配这些支架材料从而实现低成本,高效率的培育肉制造技术亦将成为未来技术的突破难点及发展趋势。
5 展望
传统养殖业已经趋于饱和状态,急需寻求新的肉类供应突破口,而生物培育肉技术的发展通过组织工程学过程在受控,无动物环境中生产肉类的一个技术平台,可以补充传统养殖业肉类供应的缺口,但在市场化供应的前提下,仍需要攻克一下关键技术:生物培育肉需要解决血清替代问题,实现成本的极大幅度降低;需要活力高、传代次世多的包括成肌细胞、脂肪细胞、成纤维细胞等多种类细胞共培养,其过程需要培养最优化参数,注重高效廉价的无动物源的生物载体材料进行动物细胞的有效扩增,需要可控的调节细胞分裂分化的因子,有效的调节细胞分化产生肌纤维。而肌内脂肪的组织工程以及侧重于营养价值和感官特性的分析方法,需要来自食品工程和肉类科学领域及生物科学领域综合的工具和知识来实施以促进开发新的研究机会,比如肌内脂肪的组织工程或新型具有肉香支架的产生以及生物培育肉支架在可食用,模仿结缔组织膜等方面的突破。总之,生物培育肉的研究目前尚处于初期阶段,研究任重而道远,需要投入更多的人力物力促进其发展,最终成为一门跨学科、多门类的综合技术知识平台,从而为传统养殖业的肉类供应提供有效补充甚至是部分替代。
