基于PI3K/Akt 信号通路研究积雪草中微量皂苷(CA-1)的神经保护作用
2022-11-08谢元胡烨烨李甫胡卫成张迹杨晓君杨猛
谢元,胡烨烨,李甫,胡卫成,张迹,杨晓君,杨猛
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)(2.淮阴师范学院生命科学学院,江苏淮安223300)(3.中国科学院成都生物研究所天然产物研究中心,四川成都 610041)(4.江苏食品药品职业技术学院,江苏淮安 223300)
帕金森病(Parkinsons Disease,PD)是一种常见于老年人的神经退行性疾病,主要病理特征是中脑黑质区多巴胺能(Dopaminergic,DA)神经元的退化及病变性死亡[1,2]。迄今为止,帕金森病仍然是世界上第二大的神经退行性疾病,其发病率在60 岁以上的人群中呈上升趋势,随着世界人口老龄化状况日趋严重,PD 发病率的增加,已严重威胁人类健康与生活质量[3]。目前对于PD 的治疗多集中于药物治疗上,如:左旋多巴、多巴胺受体激动剂和单胺氧化酶B(MAO-B)抑制剂等,但这类药物的毒副作用尚未得到解决[4]。天然植物有效成分具有结构和生物活性多样性等优点,为设计理想的新药或功能因子提供了独特的化学结构和药理活性。
积雪草(Centella asiatica(L.) Urban)为伞形科(Apiaceae)多年生匍匐植物,广泛分布于全球热带和亚热带的沼泽地区,在我国则主要分布于华东、华南、中南及西南等地[5]。积雪草具有清热利湿、解毒消肿的功效,临床上多用于治疗跌打损伤、皮肤病等[6]。这种药用植物的制剂传统上用于治疗各种皮肤疾病或加速皮肤伤口愈合。因其安全性和有效性,积雪草被广泛用于制作蔬菜沙拉、香料和饮料[7]。在一些国家,积雪草经常被用作一种商业膳食补充剂[8]。除了其传统作用之外,近些年的研究发现积雪草具有抗抑郁、神经保护、促进神经元的生长、抗肿瘤、抗菌、抗炎等多种作用。研究表明积雪草的主要活性成分为三萜皂苷类,目前在积雪草的众多药理活性中,其神经保护作用颇为引人注目[9]。如:Xu[10]发现积雪草苷可以维持多巴胺代谢平衡、提高Bcl-2/Bax 比值起到神经保护作用,可有效逆转MPTP 诱导小鼠的帕金森病;羟基积雪草苷对脂多糖(Lipopolysaccharide,LPS)刺激的小胶质细胞的增殖和炎症因子的生成具有抑制作用,其作用机制与抑制TLR-4 和NF-κB 表达、改变细胞周期并诱导细胞凋亡有关[11];并有学者进一步证实了积雪草苷的高跨血脑屏障能力[12],揭示了积雪草有一定的神经保护作用。但大多研究局限于积雪草苷、羟基积雪草苷、积雪草酸、羟基积雪草酸和积雪草提取物等,积雪草中其它微量成分的神经保护作用鲜见报道[13]。本研究从积雪草中发现一种含量很低的积雪草三萜皂苷(CA-1),并对其化学结构和神经保护作用进行了初步研究,丰富了积雪草的活性化合物资源库,可为全面理解积雪草生物活性和相关药物的开发提供有效的理论和数据支撑。
1 材料与方法
1.1 材料与试剂
CA-1 为本课题组从积雪草中分离获得,积雪草苷和羟基积雪草苷为成都至纯本草生物科技有限公司提供;神经元分化型大鼠嗜铬细胞瘤(PC12)细胞PC12,美国菌种保藏中心ATCC;DMEM 培养基、青-链霉素,赛默飞世尔科技(中国)有限公司;0.25%胰酶-EDTA、二甲亚砜(Dimethyl sulfoxide,DMSO),美国Gibco 公司;p-Akt、Akt、PDK1、p-PDK1、GSK-3β、p-GSK-3β等相关蛋白抗体,美国Cell Slignaling Technolog 公司;脱脂奶粉,美国BD 公司;细胞全蛋白提取试剂盒、微量蛋白BCA 定量试剂盒、ECL 化学发光检测试剂盒,康为世纪生物科技有限公司;SYBR Green(ROX),瑞士Roche 公司;6-羟基多巴胺(6-Hydroxydopamine Hydrobromide,6-OHDA)、台盼蓝、反转录试剂盒、甲氮甲唑蓝(3-(4,5-Dimethyl-2-Thiazolyl)-2,5-diphenyl Tetrazolium Bromide,MTT)、Trizol Reagent,美国Sigma-Aldrich 公司;甲醇、乙醇、甲醛、十二烷基硫酸钠、三羟甲基氨基甲烷、氯化钠、三氯甲烷、异丙醇等,国药集团化学试剂有限公司。
1.2 仪器与设备
HERACELL I50i CO2培养箱,美国Thermo Fisher公司;M200 Pro 酶标仪,瑞士Tecan 公司;IX71 倒置显微镜,日本Olympus 公司;T100 Thermal Cycle PCR 仪、CPX connect 实时荧光定量PCR 仪、PowerPacTMHC 电泳槽,美国Bio-Rad 公司;5200multi化学发光凝胶成像系统,上海天能科技公司;5414R低温高速离心机,德国Eppendorf 公司;Vion IMS Qtof高分辨质谱仪,英国Waters 公司;LC6000N 型制备液相色谱仪,北京创新通恒科技有限公司。
1.3 实验方法
1.3.1 积雪草次生代谢产物CA-1 的分离
干燥的积雪草(5.0 kg)粉碎后置于50 L 圆底烧瓶中,加入20 Lφ=80%乙醇水溶液(m/V,1:4)在60 ℃水浴锅中提取3 次,每次提取24 h,合并提取液,在60 ℃下减压浓缩至浓缩液无醇味,浓缩液中添加 5 L纯水,充分混合搅拌得悬浮液。该悬浮液以二氯甲烷萃取3 次,每次5 L,除去脂溶性成分;再以正丁醇萃取3 次,每次5 L,合并正丁醇萃取液,在60 ℃下减压浓缩至干得正丁醇萃取物(172.6 g)。将正丁醇萃取物进行硅胶柱层析,以甲醇-二氯甲烷(1:8→1:3,V/V)的水饱和溶液进行梯度洗脱,通过薄层色谱合并得8 个组分。组分7 先以φ=55%甲醇水溶液反相制备得组分7-1,7-2 和7-3,其中组分7-2 继续以φ=25%乙腈水溶液制备得CA-1(2.3 mg)[14]。
1.3.2 CA-1 的高分辨质谱分析条件
电喷雾离子源(ESI),四级杆飞行时间质量分析器(Qtof),毛细管电压3 000 V(正、负离子模式),锥孔电压80 V,脱溶剂气体温度500 ℃,脱溶剂气体流速800 L/h,数据采集范围m/z200~2 000。
1.3.3 分化型PC12 细胞培养和细胞存活率测定
分化型PC12 细胞[15]用高糖DMEM 培养基(含10%胎牛血清、1%青-链霉素),无菌条件下,于37 ℃、5% CO2饱和湿度培养箱中培养,待细胞生长至对数期时,以每孔3×104个细胞的密度接种于96 孔板,待细胞生长16~24 h,约贴壁80%时,不同样品以不同浓度预处理细胞30 min,然后暴露于250 μmol/L 6-OHDA中24 h后用传统MTT法[16]测定细胞存活率:吸走细胞培养基后,加入终浓度为0.5 mg/mL 的MTT工作液100 μL,放入培养箱中孵育4 h 后,加入等体积的MTT 终止液过夜后在550 nm 处测定吸光值,按下式计算。

式中:
C——细胞存活率,%;
A实验组——实验组吸光值;
A空白组——空白组吸光值;
A对照组——对照组吸光值。
1.3.4 CA-1、积雪草苷和羟基积雪草苷对6-OHDA 损伤PC12 细胞的保护作用
细胞以每孔3×104个接种于96 孔板,培养16~24 h,分别用终浓度为6.25、12.5、25、50、100 μmol/L 的CA-1 和100 μmol/L 积雪草苷、羟基积雪草苷先预处理30 min后加入250 μmol/L的6-OHDA共同处理 24 h,MTT 法测定其细胞存活率[17]。
1.3.5 细胞形态观察
细胞以每孔6×105个接种于6 孔板,CO2培养箱中培养16~24 h 后加入终浓度50、100 μmol/L 的CA-1预处理30 min 后,加入250 μmol/L 的6-OHDA 继续培养24 h,PBS 漂洗后加入4%的多聚甲醛固定细胞,IX71 倒置显微镜[18]观察细胞形态及数量变化。
1.3.6 细胞内活性氧(ROS)检测
采用DCFH-DA 荧光染色法[19]检测细胞内活性氧。经不同药物处理和4%多聚甲醛的细胞用PBS 洗两遍后,加入最终浓度为10 μmol/L 的DCFH 的染料避光染色20 min,用无血清培养基洗3 次后在荧光显微镜下观察分析。
1.3.7 半定量PCR 和RT-qPCR
细胞以每孔6×105个接种于6 孔板,培养16~24 h后,用终浓度为50、100 μmol/L的CA-1预处理30 min,然后加入250 μmol/L 的6-OHDA,6 h 后,加入PBS清洗,然后加入1 mL Trizol 试剂将细胞从培养皿中吹下,移入离心管中进行总RNA 的提取[20]。反转录PCR合成cDNA,以GAPDH 内参基因,实时荧光定量PCR检测各个目的基因的mRNA 表达量。半定量PCR 使用2×Taq Master Mix 通过PCR 扩增后在2%的琼脂糖胶电泳检测基因表达水平。本文所用引物均由生工生物工程(上海)有限公司合成,相关序列见表1。

表1 引物序列Table 1 Primer sequence
1.3.8 细胞全蛋白提取与蛋白印迹
按上述方法[20]处理细胞,经PBS 清洗后,用细胞刮刮下细胞,根据细胞全蛋白提取试剂盒说明书,提取PC12 细胞全蛋白,用于蛋白印迹分析。采用BCA定量试剂盒进行蛋白定量后,取蛋白样品30 μg,进行SDS-PAGE 电泳分离,随后转到PVDF 膜上,加w=5%的BSA 室温封闭2 h,清洗三遍后加入1:1 000稀释的一抗4 ℃孵育过夜,清洗三遍,加入1:2 000稀释的二抗孵育后通过Tannon 5200 凝胶成像系统进行曝光和拍照分析。
1.4 数据处理
数据用至少3 次独立实验的平均值±标准差表示,采用SPSS 20.0 软件进行t检验、单因素方差分析,p<0.05 表示存在显著性差异。其中#表示模型组与对照组存在显著性差异,*表示模型组与药物处理组存在显著性差异。
2 结果与讨论
2.1 CA-1 的结构鉴定
采用高分辨质谱对CA-1的结构进行了分析鉴定。CA-1 的高分辨质谱图如图1 所示,其中图1a 和图1b分别为CA-1 在负离子和正离子模式下的高分辨质谱图,综合分析可知该化合物在负离子模式下显示了[M-H]-准分子离子峰m/z=1 119.556 0,在正离子模式下显示了[M+Na]+准分子离子峰m/z=1 143.555 8,推测其分子式为C54H88O24。CA-1 的分子量比积雪草中2 个主要成分积雪草苷和羟基积雪草苷的分子量分别大162 和146,提示CA-1 的结构可能是在积雪草苷结构的基础上多了一个葡萄糖残基,或是在羟基积雪草苷结构的基础上多了一个鼠李糖残基。积雪草中皂苷的一个结构特点是苷元的28 位碳原子普遍通过酯苷键连接一个“葡萄糖-葡糖糖-鼠李糖”结构单元,而以前的研究发现该类皂苷在二级质谱中极易发生特征性的酯苷键裂解,生成一对互补离子,有助于通过多级质谱技术解析其化学结构[14]。图1c 为CA-1 在负离子模式下的二级质谱图,其中碎片离子峰m/z=649.394 9和碎片离子峰m/z=469.155 9 为互补离子。碎片离子峰m/z=469.155 9的出现说明CA-1的28位也是通过酯苷键链接了一个“葡萄糖-葡糖糖-鼠李糖”结构单元;碎片离子峰m/z=487.341 8 对应皂苷元碎片离子,其与碎片离子峰m/z=649.394 9 数值相差162,提示皂苷元的某个羟基可能连接了一个葡萄糖分子。积雪草中皂苷的另一个结构特点是2、3 和23 位碳原子分别连接羟基,区别在于6 位碳原子是否连接羟基,考虑CA-1苷元的分子量为488,提示其6 位碳原子未连接羟基。到目前为止,仅报道了 2 个积雪草皂苷(Centellasaponin G 和Centellasaponin H)含有4 个糖基,均有一个葡萄糖残基连接于苷元的23 位碳原子[21]。因此,推测CA-1 中一个葡萄糖残基可能也是连接于苷元的23 位碳原子。考虑到积雪草中普遍存在乌苏烷型和齐墩果烷型皂苷同分异构体,而电喷雾质谱暂时不能有效地区分这2 种异构体,CA-1 的结构就存在2 种可能性。CA-1 的结构和质谱裂解途径如图2所示。

图1 CA-1 的一级和二级高分辨质谱图Fig.1 The HR-ESI-MS and MS/MS spectra of CA-1

图2 CA-1 的结构及其质谱裂解途径Fig.2 The chemical structure of CA-1 and its proposed fragmentation pathway
2.2 CA-1 对PC12 细胞活力的影响和神经保护作用
积雪草苷和羟基积雪草苷是积雪草中有神经保护作用的皂苷,也是积雪草中大多数学者研究的主要化合物。已有明确证据表明积雪草中三萜皂苷类化合物可用于多种神经系统疾病,目前研究最多的是改善阿尔兹海默症[22](AD)和帕金森病[23](PD)。为研究CA-1 的神经保护作用,本文首先评价了CA-1 对PC12细胞的毒性,结果如图3 所示,浓度在6.25 μmol/L~100 μmol/L 之间时,CA-1 对PC12 细胞没有毒性,也没有明显的促进细胞增殖的作用。本文对比了AS、MS 和CA-1 抵御6-OHDA 损伤,保护PC12 细胞的作用,结果如图4 所示,250 μmol/L 6-OHDA 诱导PC12细胞的存活率为56.83%,加入AS、MS 和CA-1 处理后存活率显著提升(p<0.05),分别为74.37%、73.52%和85.46%,且CA-1 组存活率与AS、MS 也有显著性差异(p<0.05)。表明在此模型中CA-1 的神经保护作用强于AS、MS。为进一步研究CA-1 神经保护作用的剂量效应,本文也考察了一系列浓度CA-1 预处理对PC12 细胞的保护作用,如图4 所示,随着浓度的提高,CA-1 的神经保护作用呈现显著的上升趋势,表明CA-1 的神经保护作用具有剂量依赖性,在预处理浓度超过25 μmol/L 时,CA-1 即具有显著的神经保护效果(p<0.05)。
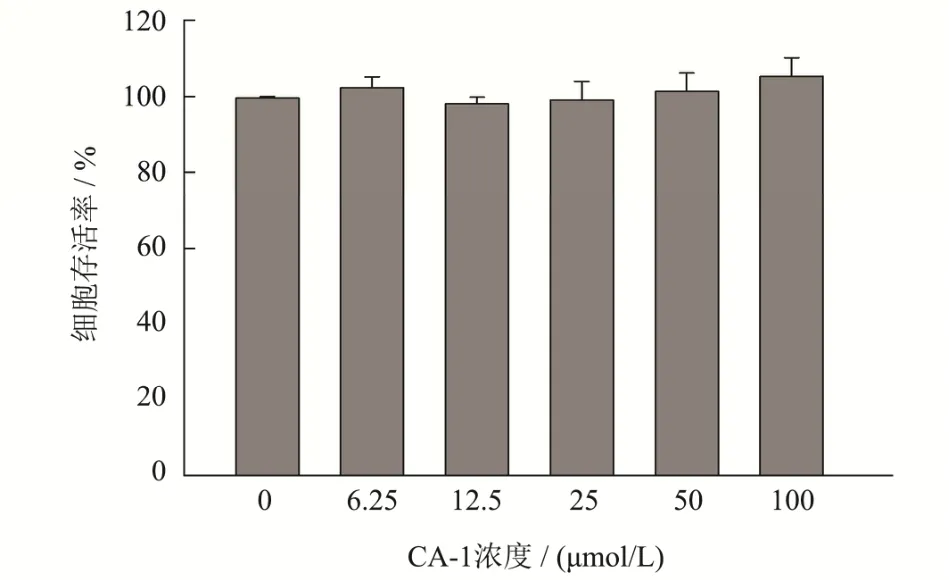
图3 CA-1 的对PC12 细胞存活率的影响Fig.3 Effect of CA-1 on cell viability PC12

图4 CA-1、AS、MS 对6-OHDA 诱导的PC12 细胞存活率的影响Fig.4 Effect of CA-1 on 6-OHDA-induced PC12 cell viablilty
2.3 CA-1 对6-OHDA 损伤PC12 细胞形态的保护作用
为从细胞形态学上研究CA-1 对6-OHDA 损伤PC12 细胞的保护作用,本文在显微镜下观察分析经不同浓度CA-1 预处理的6-OHDA 损伤PC12 细胞的形态。结果显示对照组可以明显看到细胞数量多,分化型PC12 细胞突触相互交集,连接紧密(图5a);模型组细胞数目少,细胞突触并无交集,不连接(图5b);使用50 μmol/L 的CA-1 预处理30 min 后细胞数目明显变多,细胞突触之间有一定交集(图5c);使用100 μmol/L 的CA-1 预处理30 min 后恢复效果明显,细胞形态几乎接近于正常细胞(图5d)。该细胞形态学观察结果表明CA-1 处理对6-OHDA 损伤PC12 细胞具有显著的保护作用,能保护细胞维持正常形态和突触交联。印度学者Margabandhu 等[24]报道10 μmol/L AS 能够显著抵御鱼藤酮诱导的经过药物分化的PC12细胞的损伤,提高细胞存活率和改善细胞形态,其结果与本研究不谋而合。更加充分的说明了积雪草的药用价值,揭示了积雪草皂苷对不同药物损伤细胞都有一定保护作用。

图5 CA-1 对6-OHDA 诱导的PC12 细胞形态的影响(×200)Fig.5 Effects of CA-1 on the morphology of 6-OHDA-induced PC12 cells (×200)
2.4 CA-1 缓解ROS 的产生
6-OHDA 能够引起PC12 细胞体内产生大量ROS即氧化应激使细胞损伤甚至凋亡[14],在CA-1 没有细胞增殖的作用情况下,CA-1 可能通过减轻细胞体内的ROS,从而减轻6-OHDA 对PC12 细胞的损伤和凋亡。DCFH-DA 探针能被细胞内的酯酶水解为DCFH,而没有荧光的DCFH 能被活性氧氧化成含有与FITC 类似荧光的DCF,因而能通过检测荧光强度反映细胞内ROS 的含量。为验证上述猜测,本文使用该荧光探针进行了活性氧检测。如图6 所示,在模型组(图6b)中检测到较强的荧光信号,说明细胞内有大量的活性氧产生;在CA-1 终浓度为50 μmol/L(图6c)和100 μmol/L(图6d)的预处理中,荧光信号明显减少,表明细胞内活性氧减少,Image J 分析相对荧光强度可知,根据对照组归一后,细胞内ROS 水平显著增加至对照组的12.4 倍,50 μmol/L 处理后降低至4.5 倍,100 μmol/L 处理后接近对照组。揭示了CA-1 能够显著减少受损细胞内活性氧的产生,起到神经保护的作用。一定程度上说明CA-1 通过降低细胞内ROS 表达水平,起到抑制6-OHDA 损伤的作用。

图6 DCFH-DA 荧光探针检测PC12 细胞内ROS 水平(×200)Fig.6 ROS levels in PC12 cells were detected by DCFH-DA fluorescent probe (×200)
2.5 CA-1 对氧化应激相关基因及凋亡因子表达水平的影响
本文分别采用半定量PCR(图7)和实时荧光定量PCR(图8)法检测了PC12 细胞中Cat、Sod1和Bcl2的mRNA 表达水平。6-OHDA 使细胞产生大量ROS,致使细胞损伤甚至死亡。使得转录水平中抗氧化相关酶系和凋亡相关酶系异常表达[25]。在用CA-1处理后显著提高了受损PC12 细胞抗氧化酶及抗凋亡相关因子的相对表达水平,在CA-1 浓度为100 μmol/L时Sod1、Cat、Bcl2均提高到与正常组一致。Cat和Sod1的上调说明了PC12细胞内ROS的减少是通过抗氧化酶的表达增多从而减少氧化应激来实现的,Bcl2上调说明可能通过促进抗凋亡因子的表达使得细胞凋亡减少。结果与其它有抗PD 活性的天然化合物类似,如黄芩素、莨菪碱、人参皂苷Rg1、姜黄素等[1,26,27]。

图7 半定量PCR 测定CA-1 对Sod1、Sod2、Cat、Bcl2 基因相对表达量的影响Fig.7 Effects of CA-1 on the relative expression levels of Sod1,Sod2, Cat, Bcl2 genes by Semi-Quantitative RT-PCR

图8 QPCR 测定CA-1 对Sod1、Cat、Bcl2 基因相对表达量的影响Fig.8 Effects of CA-1 on the relative expression levels of Sod1,Cat and Bcl2 genes were determined by qPCR
2.6 CA-1 的对PI3K、PDK1、Akt 和GSK3-β等蛋白表达及活化的影响
既往研究表明细胞的增殖、生长、凋亡与PI3K/Akt 通路相关[28]。PI3K/Akt 通路能够调控凋亡基因Bax、NF-κB 等下游基因,调控细胞凋亡从而达到神经保护作用[29]。PI3K 是一种胞内磷脂酰肌醇激酶能够催化脂质第二信使的生成[30]。磷脂酰肌醇二磷酸(Phospyl-diphosphate Inositol,PIP2)是一种多肽激素和膜受体的第二信使,活化后可磷酸化为肌醇三磷酸(Inositol Triphosphate,PIP3),PIP3 与细胞内含有PH 结构域(Pleckstrin Homolgy Domain)的信号蛋白Akt 和PDK1 结合[31]。一旦Akt473 磷酸化位点被激活,会将下游基因环磷腺苷效应元件结合蛋白(cAMP-response Element Binding Protein,CREB)转换为磷酸化的CREB,而磷酸化的CREB 参与细胞分化、增殖、存活和凋亡[32]。越来越多的证据表明PI3K/Akt 信号通路对细胞变性的预防和治疗的主导作用[33,34]。
使用Image J 分析了蛋白印迹调条带磷酸化/非零酸化比值结果显示6-OHDA处理12 h后模型组相比于对照组P85、Akt 表达明显减少、PDK1 表达增多,CA-1预处理30 min 后增加了磷酸化的P85 和磷酸化的Akt的表达,磷酸化的PDK1 略有增加但PDK1 表达减少。表明CA-1 的神经保护作用可能是基于PI3K/Akt 通路。PI3K/PDK1/Akt 通路可以调控下游Bcl-2 的表达,因此Bcl-2 在转录水平的变化可能是由该通路引起。
综上所述,CA-1 相比其他积雪草皂苷具有更好的神经保护作用,在功能性食品或药品开发中有重要潜力。然而,CA-1 在川产积雪草中含量太低,限制了对其进一步开发利用。可以通过以下两种途径解决CA-1的来源问题:1)以CA-1 为标准物质,对全国不同产地的积雪草进行皂苷含量分析,筛选CA-1 含量较高的积雪草资源;2)采用生物合成的方法选择性对积雪草中主要成分积雪草苷的23 位羟基葡萄糖基化,实现CA-1 的量产。

图9 CA-1 对6-OHDA 诱导的PC12 细胞PI3K/PDK1/Akt/GSK-3β通路的影响Fig.9 Effects of CA-1 on PI3K/PDK1/Akt/GSK-3β pathway in 6-OHDA-induced PC12 cells
3 结论
本文的研究对四川产积雪草的总皂苷进行了硅胶柱层析分离和反相制备色谱分离,并采用高分辨质谱鉴定出了一个微量稀有皂苷 C A-1(收率为0.001 15‰)。25 μmol/L 的CA-1 能对细胞起到显著性的保护作用。相对于同浓度的积雪草苷和羟基积雪草苷,CA-1 对6-OHDA 损伤的分化型PC12 细胞有更强的保护作用,100 μmol/L 时CA-1 能提高28.63%的细胞存活率,而积雪草苷和羟基积雪草苷分别只能提高16.69%、17.54%。100 μmol/L 的CA-1 预处理后细胞ROS 水平能恢复到与对照组相同并且Sod1、Cat、Bcl2基因的表达也能恢复到正常组水平,50 μmol/L 的CA-1 预处理后,仍能够有效改善6-OHDA 对细胞的损伤。CA-1 的神经保护作用可能是基于PI3K/Akt 通路。未来将进一步验证一系列凋亡有关蛋白的表达如Caspase 家族等;还将进一步验证细胞核内氧化应激相关蛋白如NRF2/OH-1 和p65 的表达以及体内动物实验验证。
