大肠埃希菌异质性耐药的研究进展
2022-11-05赵艳坤刘慧敏孟璐王成王加启郑楠
赵艳坤 刘慧敏 孟璐 王成 王加启 郑楠
(1. 新疆农业科学院农业质量标准与检测技术研究所 农业农村部农产品质量安全风险评估实验室(乌鲁木齐)新疆农产品质量安全实验室,乌鲁木齐 830091;2. 中国农业科学院北京畜牧兽医研究所,北京 100193)
大肠埃希菌(Escherichia coli)是一种在微生物界具有特殊地位的致病菌,可以引起人类和动物的严重感染。2020年的中国细菌耐药监测网分析报告显示,革兰氏阴性菌是最常见的医源性细菌,其检出率高达71%[1],其中E.coli位居首位,给临床治疗带来了巨大的挑战。近年来,随着抗菌药物在临床和畜牧业的大量及不合理使用,E.coli耐药性问题日趋严重,对现有可用抗菌药物均存在耐药性,尤其是多重耐药(multi-drug resistance,MDR)及泛耐药(pan-drug resistance,PDR)的出现,同时,E.coli也是耐药基因的主要储存库,既是耐药基因的供体,又是耐药基因的受体,可导致动物-人类-环境之间耐药的传播,已经成为全球性医学与社会问题,严重威胁当下的公共健康安全。
研究发现,E.coli还存在另一种耐药情况,即细菌异质性耐药(heteroresistance,HR)[2]。通过特殊的检测方法,从一些常规药敏实验中表现敏感而抗菌药物治疗不佳的临床患者分离培养的细菌中检测到耐药甚至更高水平耐药的亚群,正是这些耐药亚群的存在将很可能导致患者反复感染和治疗失败[3]。这一现象在包括E.coli在内的多种细菌中已有较多报道。早在1994年已有E.coli对甲硝唑产生异质性耐药而导致治疗失败的报道[4],近年来,E.coli对碳青霉烯类、多黏菌素、磷霉素、替加环素、头孢噻呋、哌拉西林/他唑巴坦等抗菌药物也出现了异质性耐药现象,但其异质性耐药机制尚未明晰。本文简要综述E.coli的异质性耐药流行状况以及异质性耐药现象的机制,旨在积极响应人-动物-环境“One Health”理念,为进一步加深对E.coli异质性耐药的认识和重视,为其评估治疗方案和指导临床抗菌药物的合理使用提供参考。
1 异质性耐药的发现及特征
异质性耐药的定义是指某个单一分离菌株,在其培养的群体中存在着对某种药物敏感性不同的亚群,即有些亚群对该药物敏感,而另一些亚群则存在对该药物耐药的情况[2]。异质性现象最早于1947年被描述[5],在链霉素治疗嗜血杆菌感染的流感病人期间,14人中3人治疗失败并且被证明是由于病人机体内嗜血杆菌对链霉素的敏感性发生了变化,但一直未得到重视。直到1999年日本报告1例男性肺癌术后的痰标本中分离到1株耐甲氧西林的葡萄球菌,其万古霉素最小抑制浓度(minimum inhibitory concentration,MIC)为3 mg/L,按照国际临床实验室的标准化委员会(NCCLS)规定属于敏感菌,但用万古霉素治疗12 d无效,后用特殊的检测方法确定为异质性耐药万古霉素菌株[6]。逐步引起部分专家的关注,但研究大多致力于医院金黄色葡萄球菌、肺炎克雷伯菌、铜绿假单胞菌、阴沟肠杆菌等表型异质性耐药研究,几乎不涉及动物源病原菌异质性耐药。直到2015年,El-Halfawy和Valvano发表了题为“抗菌药物异质性:一个需要明确的新兴领域”的重要评述[7],引起全球各领域关注,开启关于细菌异质性耐药的广泛研究。
异质性耐药主要有3种形式[8]。(1)整个细菌群体对抗菌药物完全敏感,而亚群的MIC则不同,这种形式在临床最不重要(除非反应最差的亚群对抗菌药物产生耐药);(2)细菌最经典的异质性耐药,即大多数细菌种群对抗菌药物敏感,有少数高度耐药,以传统药物敏感性折点为指导的抗菌药物治疗会导致失败;(3)整个细菌种群(包括抵抗力最低的亚群)都具有耐药性或中等耐药性,其中一组亚群显示出对抗菌药物耐药性增加。
异质性耐药是一种现象,其主要特征包括:(1)异质性耐药的细菌仍能在抗菌药物暴露下存活,部分细菌亚群的MIC值显著增加(至少8倍)[2];(2)异质性耐药的耐药表型不稳定,当抗菌药物压力下降时,细菌会恢复到抗菌药物敏感状态[9];(3)异质性耐药分离株中耐药细菌的频率非常低(<1/10 000),耐药细菌亚群在总群体中占少数[10]。目前,公认的MIC是细菌敏感或者耐药的判断标准,然而,由于异质性耐药典型的特征,为评估抗菌药物对致病菌的治疗效果带来了极大困难,使MIC数据的可靠性降低,且异质性耐药常被错误分类为抗菌药物敏感,从而导致抗菌药物治疗时不仅不能治疗感染,反而将逐渐进化为耐药,促进了耐药突变株的产生,造成反复感染,病程延长,导致治疗失败。因此,及时检测表型异质性耐药,精准选择抗菌药物,才能达到成功的治疗结果。
2 异质性耐药的检测方法
迄今为止,尚无检测异质性耐药的“金标准”,不同实验室、不同菌株使用的检测方法各不相同。目前,用于检测异质性耐药的主要方法包括:E-test法、K-B纸片扩散法和群体谱分析法(population analysis profiling,PAP)。E-test法、K-B法 均 为 异质性耐药检测的初筛方法,当抑菌圈内有散在菌落出现时即为疑似异质性耐药菌株,方法简便、直观,但假阴性、假阳性检出率较高,并且无法对各亚群的耐药程度及耐药亚群数量进行定量。PAP法被认为是检测异质性耐药菌株最可靠的方法,PAP通常使用标准MIC测定的格式,以2倍抗菌药物增量,并通过使用扩散板技术进行CFU计数,当异质性耐药亚群比主要群体的MIC高8倍,且异质性耐药的发生频率≥1×10-7,则被判定为异质性耐药菌株[11],但其成本高,耗时长,不能快速有效地对样本进行检测。随后,对PAP进行了改良,出现了微量稀释PAP法(microtitration population analysis profiling,MPAP),研究表明,MPAP比常规PAP检测更快、成本更低,且能够明确异质性亚群的频率和MIC,但细菌密度较高可能会增加假阳性的风险[12]。此外,改良的群体谱分析曲线法(PAP assay comparing the area under the curve,PAPAUC)是检测异质性万古霉素中介金黄色葡萄球菌(Heterogeneous vancomycin-intermediate Staphylococcus aureus,hVISA)的“金标准”[13],但该方法操作更为繁琐且昂贵,且可能会错误分类具有高度不同抗菌药物浓度依赖性亚群大小的分离株,不适宜作为其他异质性耐药菌株的检测。不同异质性耐药的检测方法优缺点见表1。

表1 异质性耐药的检测方法对比Table 1 Comparison of detection methods for heteroresistance
近年来,随着分子生物技术的发展,开发了一些异质性耐药检测的新型方法,通过比较多种抗菌药物浓度下的单个细菌生长情况,准确识别与耐药相关的异质性。数字PCR(Droplet Digital PCR,dd PCR)可以检测与耐药性相关的基因或点突变,即使它们只存在于细菌的一个亚群中[20]。越来越多的临床试验采用全基因组测序法(whole genome sequencing,WGS)检测分离菌株中耐药亚群,通过菌株中耐药亚群基因型的变化,确定异质性耐药[21],WGS的准确度远高于传统的表型检测,但该方法对于检测频率<1%的亚群仍有局限性。此外,虽然表型耐药和基因型之间有较好的相关性,但仍存在一些差异,可能导致基因分型结果分析复杂化,这些方法作为临床异质性耐药检测仍面临很大困难。因此,未来急需开发较低成本、较高准确率以及识别较低频率的耐药亚群(远低于1%)的临床实用性异质性耐药检测技术。
3 大肠埃希菌异质性耐药的研究现状
3.1 大肠埃希菌对碳青霉烯类抗菌药物异质性耐药的研究现状
E.coli的异质性耐药相关研究常见于碳青霉烯类抗菌药物,E.coli对碳青霉烯类异质性耐药(carbapenem-heteroresistant E.coli,CHEC)表型已在全球多项研究中进行了报道,几乎都在人类医学方面,E.coli对于不同研究之间表现出异质性耐药分离株流行率存在很大差异,从0%-100%(表2)。
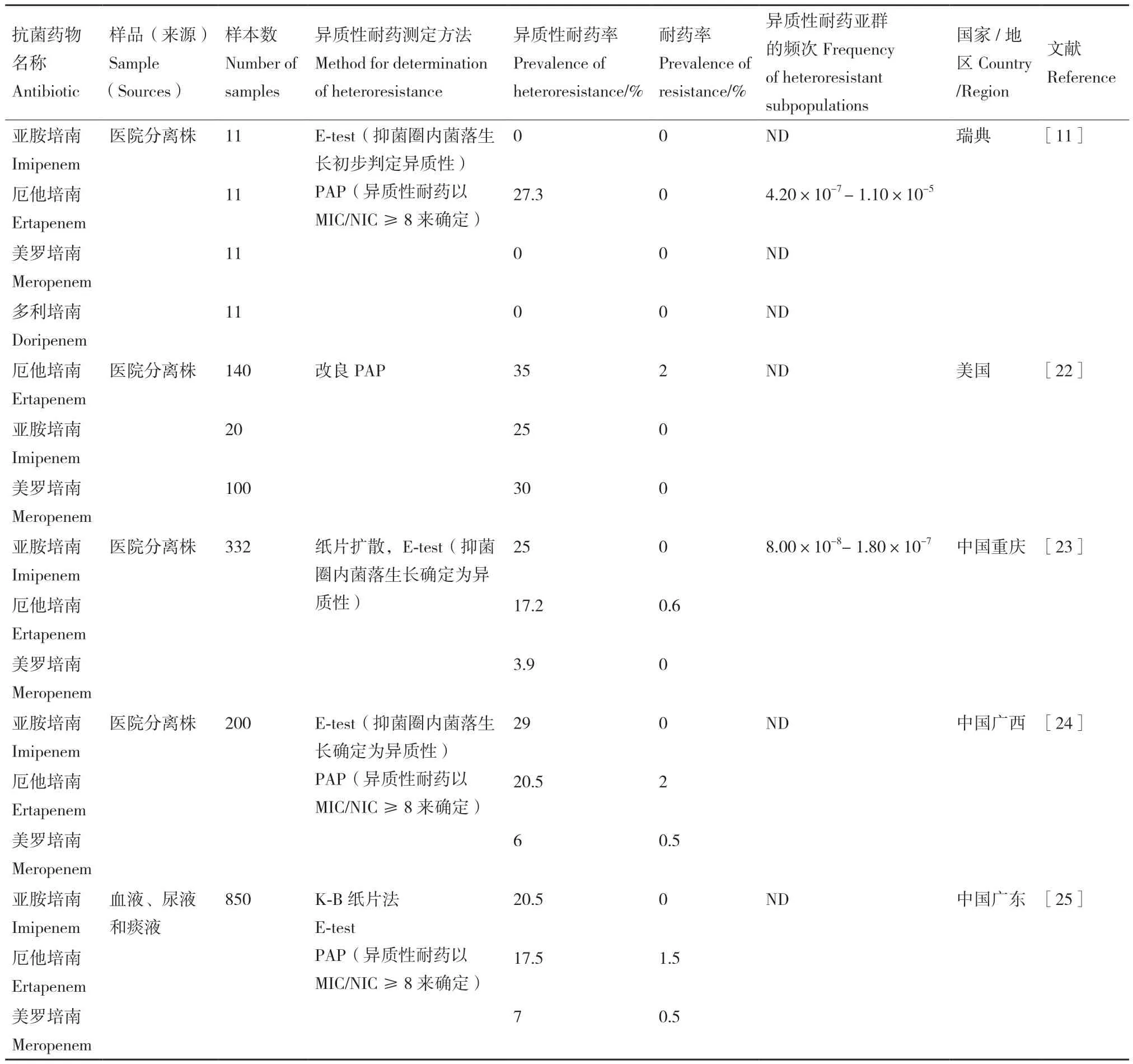
表2 大肠埃希菌对碳青霉烯类抗菌药物异质性耐药的流行情况Table 2 Prevalence of heteroresistance of E. coli to carbapenems
Nicoloff等[11]通过 E-test初步判定和 PAP 法对来自瑞典的11株医院临床分离的E.coli进行了异质性耐药性筛查,以最小抑菌浓度(MIC)/非抑菌浓度(NIC)(MIC/NIC)≥8来确定,其中厄他培南(ertapenem,ETP)显示出最高的异质性耐药率(27.3%),而未发现E.coli对亚胺培南(imipenem,IPM)和美罗培南(meropenem,MEM)的异质性耐药现象。另一个来自美国的试验通过纸片扩散初筛和改良的PAP方法测定E.coli的异质性耐药,MIC/NIC≥8判定其异质性耐药,发现E.coli对ETP、IPM和MEM均表现出很高的异质性耐药率,分别为35%,25%和30%。不难发现,CHEC在不同研究之间差异很大,表明碳青霉烯类抗菌药物的用药背景决定E.coli对异质性耐药的流行率,在国外,E.coli对ETP表现异质性耐药比对IPM和MEM和具有异质性耐药更常见。
2015年,Sun等[20]首次报道了中国侵袭性E.coli感染中的碳青霉烯类抗菌药物异质性耐药的情况,该实验通过纸片扩散或E-test筛选了332株临床E.coli分离株的异质性耐药,结果显示,114株E.coli对碳青霉烯类药物具有异质性耐药性,CHEC的流行率为34.3%,PAP结果显示,在ETP浓度高达10%的情况下,耐药亚群的增长分别为≥4 mg/L和128 mg/L,能够在最高药物浓度下生长的耐药亚群比例为8.00×10-8。E.coli异质性耐药率最高的为IPM(25%),其次是ETP(17.2%),对MEM的异质性耐药性率相对较低,为3.9%。另外,还发现了对碳青霉烯类药物的共异质性耐药(Co-heteroresistance,CHR)的现象,达17.54%。此外,超广谱 β-内酰胺酶(extended-spectrum β-lactamase,
ESBL)的产生与E.coli分离株CHEC表型显著相关。研究表明,ESBL产生是导致E.coli对ETP和IPM产生异质性耐药的一个关键因素,并被认为可能参与了对两种抗菌药物的CHR,产ESBL的细菌更多地具有CHR特征[26]。研究显示,在对碳青霉烯类不敏感的E.coli中ESBL的流行率很高(96.7%),尤其是 CTX-M 型 ESBL[27]。汤丽霞等[24]采用 E-test初筛和PAP(MIC/NIC≥8)确定的检测方法,在200株E.coli中共检出83株碳青霉烯异质性耐药,CHEC的流行率为41.5%,对ETP、IPM和MEM的异质性耐药率分别为10%、19%和0.5%,同样发现存在CHR现象,其中对IPM、ETP和MEM均表现为异质性耐药的E.coli比例为7.23%,与Sun等研究结果一致。另外,张文萍等[25]采用K-B纸片法联合E-test和PAP的方法研究CHEC的流行情况,得到了趋势一致的结果。这与国外的研究结果不尽一致,除地域差异,很大程度上取决于异质性耐药的定义方式和检测方法及判定不统一。可能的原因一是IPM的抗菌选择压力要强于ETP和MEM,二是IPM的优先使用在碳青霉烯类异质性耐药的高流行中起了关键作用。此外,不合理使用碳青霉烯类抗菌药物和无视管理举措都促进了E.coli对碳青霉烯类抗菌药物耐药性的演变。总之,适当使用MEM并谨慎使用IPM和ETP是全球碳青霉烯类治疗E.coli的明智之举。
3.2 大肠埃希菌对黏菌素类抗菌药物异质性耐药的研究现状
目前,E.coli对黏菌素的异质性耐药的研究相对较少(表3),Juhász等[28]使用含有4 mg/L黏菌素的琼脂平板法和MIC法评估耐碳青霉烯类的E.coli对黏菌素的异质性耐药情况发现,异质性耐药性率仅为3.4%,远低于碳青霉烯类,对黏菌素异质性耐药亚群的发生频率在1.25×10-8-1.10×10-5。Liao等[29]研究发现291株E.coli中对黏菌素的耐药率为0.69%,对黏菌素敏感的E.coli菌株中1.37%具有异质性耐药,其耐药亚群的MIC值比亲本菌株高16-64倍,耐药亚群的发生频率为4.00×10-7-4.00×10-6,在无抗培养基中传代1周后,黏菌素对耐药亚群的MIC值没有变化,表明耐药亚群的稳定性良好。异质性耐药可以是稳定的,即亚群在没有抗菌药物压力下不恢复耐药性,然而,异质性耐药多表现为不稳定,即亚群在无抗菌药物暴露下耐药性降低或恢复为敏感[9]。邝启红等[30]首次在中国猪源分离的E.coli中发现对黏菌素异质性耐药,采用PAP(MIC/NIC≥4)确认了12株MDR的E.coli中有11株显示出异质性耐药(91.67%),说明MDR E.coli也倾向于表现异质性耐药,每个异质性耐药菌株均包含1个以上耐药亚群,共获得 17个耐药亚群,且多个亚群对黏菌素的敏感性存在明显差异,耐药亚群的发生频率为6.61×10-7-2.57×10-6。耐药亚群在无抗培养50代后,大部分可以完全恢复到亲本分离株的易感水平,说明大多数亚群是不稳定和短暂的,只有一个亚群保持对黏菌素的耐药性(MIC为4 mg/L),这也揭示了黏菌素治疗失败的原因。考虑到实验室中的常规抗菌药物敏感性试验往往会错误地将异质性耐药分离株识别为“易感”,实际却存在不同程度的异质性耐药亚群,因此应高度关注耐药亚群的存在,El-Halfawy等[31]认为耐药亚群的频率随抗菌药物浓度而变化,为了便于未来不同研究之间的比较,建议应尽可能报告抗菌药物浓度高于原耐药水平8倍的亚群频率(图1)。
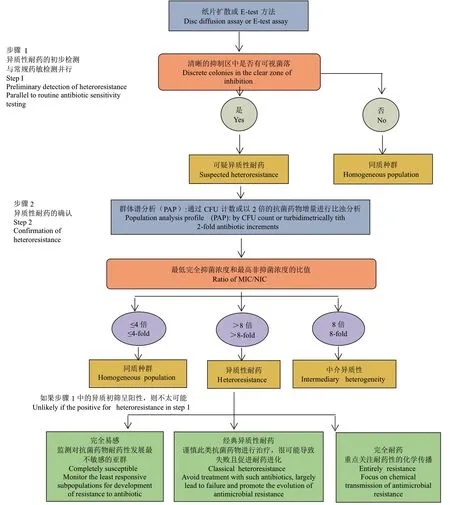
图1 异质性耐药判定标准的推荐方案(改自文献[31])Fig. 1 Recommended scheme for determination of heteroresistance(Modified from reference[31])

表3 大肠埃希菌对粘菌素类抗菌药物异质性耐药的流行情况Table 3 Prevalence of heteroresistance of E. coli to colistin antibiotics
近年来,E.coli的异质性耐药研究逐渐增多,相继有报道表明E.coli对磷霉素、头孢噻呋、替加环素等抗菌药物存在异质性耐药。目前,关于E.coli异质性耐药几乎均在人类分离株中进行,动物源相关的研究少之甚少,E.coli异质性耐药的流行来自不同的医院或养殖场,属于不同的克隆组,表明E.coli异质性耐药或许与特定的克隆或医院无关,可能是自发进化的。鉴于人类中大部分食源性E.coli感染可以追溯到动物,所以对动物中E.coli异质性耐药研究可以为将来人类感染的耐药机制提供思路,同时对动物临床合理用药以达到理想的治疗效果具有重大意义。
4 大肠埃希菌的异质性耐药机制
4.1 碳青霉烯类抗菌药物的异质性耐药机制
尽管对E.coli异质性耐药的研究已在逐渐深入,但目前E.coli异质性耐药的机制仍未十分明确,主要异质性耐药机制如图2。E.coli对碳青霉烯类抗菌药物异质性耐药的分子机制主要是产碳青霉烯酶、突变引起细菌外膜通透性下降[24]、膜孔蛋白缺失及外排泵高表达等。ESBL产生、孔蛋白缺乏和β-内酰胺酶表达升高会降低E.coli对ETP的敏感性[32]。张文萍等[25]研究结果表明,E.coli产ESBLs酶与碳青霉烯异质性耐药有关。由于异质性耐药是耐药性进化的过渡阶段,ESBL的产生也参与对头孢吡肟的异耐药机制。研究证实ESBL的产生与头孢吡肟表型异质性耐药的E.coli分离株增加显著相关[26],原因是ESBL可以水解头孢吡肟,水解酶基因的异质性表达可导致对头孢吡肟的表型异质性耐药[33]。此外,由于孔蛋白编码基因oprD的表达减少[34],稳定的耐药亚群显示出外排相关基因的上调和碳青霉烯类药物的膜通透性降低。blaTEM-1表达上调联合膜孔蛋白表达下调与E.coli亚胺培南的异质性耐药有关[35]。代佳伶[36]研究报道IPM-HR耐药菌株不表达blakpc、blaNDM-1、blaIMP、blaVIM等产碳青霉烯酶基因,检出ESBLs基因blaCTM-M-3,并且膜孔蛋白OmpF缺失,因此膜孔蛋白OmpF缺失可能是E.coli IPM-HR现象产生的机制之一。
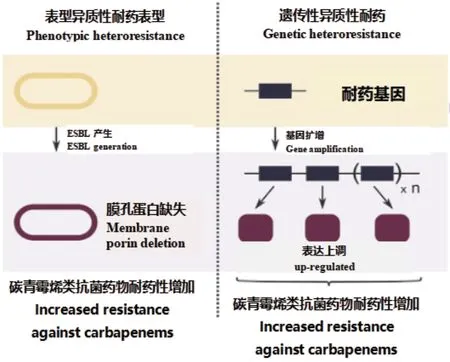
图2 大肠埃希菌对碳青霉烯类抗菌药物的异质性耐药机制(改自文献[9])Fig. 2 Heteroresistance mechanism of E.coli to carbapenems(Modified from reference[9])
由耐药基因的自发不稳定基因扩增引起的不稳定耐药是革兰氏阴性菌异质性耐药的最常见机制[8]。在存在甲氧西林的情况下,E.coli中自发突变的频率很高(约为10-5/代),并导致高频率的耐甲氧西林菌株,因此产生异质性耐药,突变率高的原因是100多个基因的突变可以产生对甲氧西林的耐药性,其中一些基因的耐药性表型是由功能缺失突变引起的(例如,参与半胱氨酸生物合成的半胱氨酸激酶失活)[37]。E.coli中的哌拉西林-他唑巴坦异质性耐药也有类似的基因扩增机制[38],其耐药性的产生包括aadB基因在内的一个区域的20-40倍扩增。在不稳定的异质性耐药表型中,61%与串联扩增有关,这些扩增通常是位于质粒或染色体上的已知耐药基因。报道显示,所有革兰氏阴性细菌-抗菌药物组合中,约14.7%将表现出由不稳定基因扩增引起的异质性耐药表型。扩增突变体的种群频率(在不影响优势种群生长的最高浓度的8倍以上)为2.90×10-7-4.90×10-5[8]。
4.2 黏菌素类抗菌药物的异质性耐药机制
现今己报道的黏菌素的异质性耐药机制主要包括PmrAB 和 PhoPQ 双组份系统的激活[3,39](图 3)、MgrB 失活[40]、AcrAB-TolC 外排泵[41]和抗性基因串联扩增[9]。双组分信号转导系统PhoPQ和PmrAB与E.coli黏菌素耐药性的形成密切相关[29]。PmrB和PhoQ是组氨酸激酶,而PmrA和PhoP是下游反应调节剂,而MgrB负调节PhoPQ系统[42]。邝启红[30]在猪源E.coli黏菌素异质性耐药菌中发现,PmrB和PhoQ的氨基酸突变是黏菌素异质性耐药菌形成的主要原因,Kuang等[43]研究结果表明,CHR的E.coli分离株的形成主要与PmrB和/或PhoQ突变相关,而与PmrA、PhoP和MgrB无关,首次证明猪源E.coli中PmrB第93位的氨基酸变异(R93P)会导致HAMP结构域β螺旋间构象变化,加剧PmrAB、PmrC的表达量升高,是导致其对黏菌素产生异质性耐药的主要机制。Huang等[41]报道,由ecr编码的小跨膜蛋白能够通过PhoPQ介导异质性耐药。在PmrAB和PhoPQ的突变率方面,Sato等[44]证实在对黏菌素产生耐药性或异质性耐药方面,PmrB比PmrA更容易发生突变。
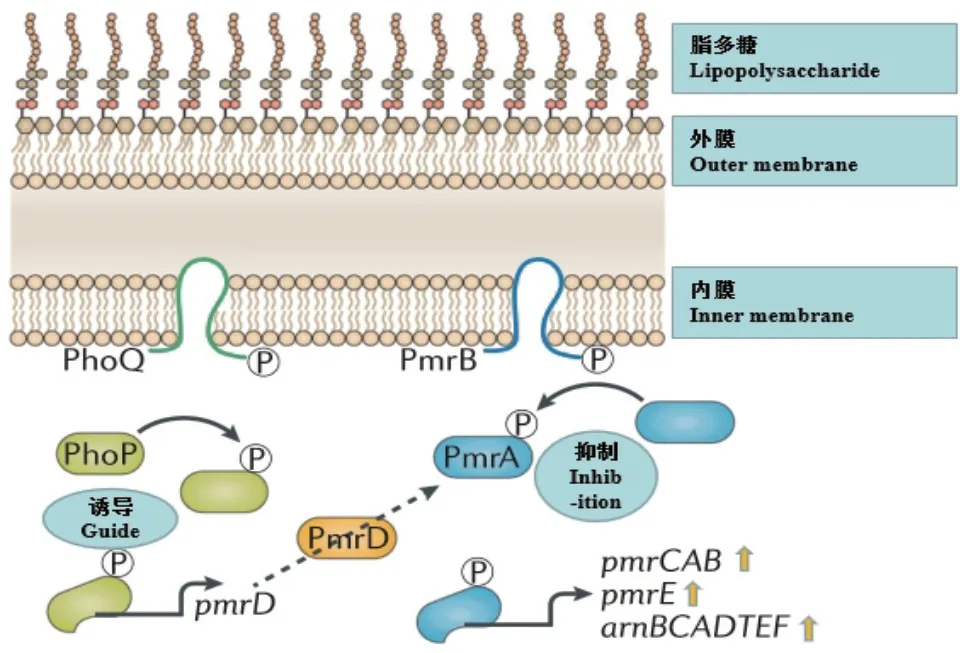
图3 革兰氏阴性菌中PmrAB和PhoPQ双组分系统调节的黏菌素异质性耐药性(改自文献[2])Fig. 3 Heteroresistance of colistin regulated by PmrAB and PhoPQ in Gram negative bacteria(Modified from reference[2])
E.coli最常见的多黏菌素耐药机制涉及质粒携带的移动多黏菌素耐药(mcr)基因,该基因于2016年新发现并命名为mcr-1[45]。随后,报道了几种氨基酸变体,例如 mcr-2[46]和 mcr-3[47],这种可转移的黏菌素质粒产生的耐药机制可能会加剧并促进耐药性的传播。Liao等[29]在两株E.coli黏菌素耐药菌株中均检测到mcr-1基因,且在两个异质性耐药菌株中检测到PmrB中的突变。
在当前研究中,黏菌素异质性耐药机制多在肺炎克雷伯氏菌、鲍曼不动杆菌、阴沟肠杆菌、铜绿假单胞菌和沙门菌等革兰氏阴性细菌的相关研究,仅有极少数文献涉及E.coli,且多数为医院感染分离菌,而导致E.coli对黏菌素异质性耐药的潜在机制仍未完全阐明,较为明确的是与PhoPQ双组分系统的表达和活性有关,该系统调节编码脂质A修饰酶的基因的表达,以减少脂质A的负电荷,从而增加黏菌素耐药性增加[48]。主要是因为PmrD 作为一个辅助蛋白,将PhoQ-PhoP和PmrB-PmrA连接起来,磷酸化的PhoP诱导的PmrD 转录,PmrD结合到磷酸化的PmrA上,通过组氨酸激酶PmrB抑制去磷酸化,增加pmrCAB、pmrE和arnBCADTEF的转录,从而调节黏菌素获得异质性耐药。。
4.3 其他抗菌药物的异质性耐药机制
近年来,研究人员相继发现了哌拉西林-他唑巴坦、头孢噻呋、头孢吡肟等β-内酰胺类抗菌药物异质性耐药的E.coli[49],其形成原因与敏感菌具有明显的竞争优势相关,而多重耐药区的插入是导致稳定耐药亚群获得耐药的主要原因。研究表明,E.coli替加环素耐药机制与RND家族AcrAB-TolC有关,AcrAB同时受外排泵调节网络中MarAB的调节;marA位点直接或间接增加了micF的表达,导致ompF的表达减少[50]。刘宇阳等[51]研究证实与原始菌株相比,耐碳青霉烯类E.coli对替加环素异质性耐药亚群的外排泵基因acrA、acrB表达上调1.79倍、5.01倍;其相关调控基因marA、marB分别表达上调5.38和2.18倍;膜孔蛋白基因ompC下调2.35倍,差异均有统计学意义,证实了RND外排泵上调与替加环素异质性耐药显著相关。
在一组磷霉素异质性耐药菌株中,观察到uhpT基因缺失,该基因编码诱导磷霉素转运蛋白介导磷霉素转运入细菌体,导致对磷霉素耐药的E.coli产生不易察觉的内集落突变体,这些突变体具有很高的生物学成本(如SNP、插入和删除),当这种耐药突变体在没有抗菌药物的情况下生长时,选择了补偿性突变(分别参与调节有氧呼吸、碳分解代谢和包膜应激反应的调节基因arcA、crp和cpxR中)[52],以提高适应性和敏感性,在这些代偿突变体中,一些突变体失去了其异质性耐药表型,其特征是失去了敏感性降低的细胞亚群,而另一些突变体仍表现出异质性耐药表型。Campos等[53]对巴西E.coli磷霉素进行异质性耐药研究,murA基因的过度表达及由转运体和调节基因突变引起的磷霉素摄取系统存在缺陷是引起磷霉素异质性耐药机制的原因。E.coli对其他抗菌药物的异质性耐药机制如表4。
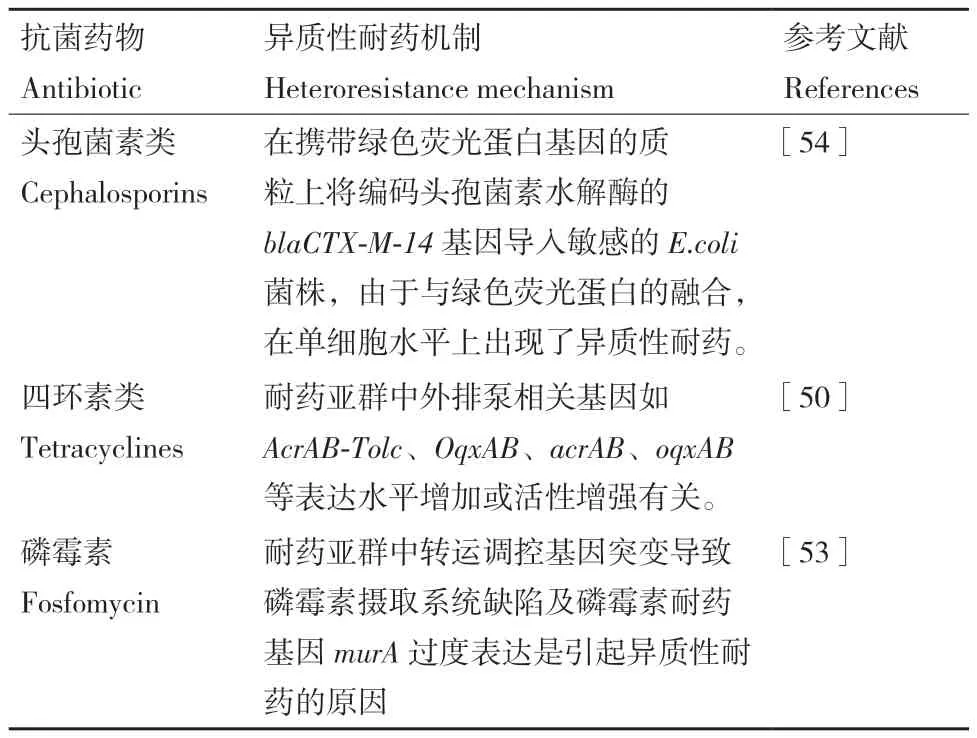
表4 大肠埃希菌对其他抗菌药物的异质性耐药机制Table 4 Heteroresistance mechanism of E.coli to other antibiotics
值得思考的是,生物被膜(biofilm)高度复杂的相互作用,如自发突变、外部刺激因素(如宿主免疫系统、抗菌治疗)、内部微环境(氧气、营养和pH梯度)和种间相互作用[55-56]等过程能够导致生物被膜层内形成广泛不同的亚群,生物被膜生物量越高,这种相互作用越明显,新兴亚种群的数量将越大。生物量的增加不一定意味着耐药性的增加,而是异质性耐药的增加[57]。在E.coli菌落中,活性生长细胞位于下层,而非生长饥饿细菌则栖息在上层,以应对基于扩散的营养供应[58],由此推断,生物被膜的形成也可能与E.coli的异质性耐药有关,但相关研究尚未见报道。到目前为止,只有一份肺炎克雷伯菌的异质性耐药研究涉及生物被膜[59],其在肺炎克雷伯菌生物被膜中,发现了能够在黏菌素浓度高达MIC四倍的情况下生长的异质性耐药亚群。耐药亚群以稳定的小菌落变体的形式表现出与剩余生物被膜群不同的菌落形态。这些最新发现是预测生物被膜内异质性耐药发生的合理依据,生物被膜中通常存在的巨大异质性生理学预测了此类疾病的发生表型。因此,生物被膜亚群及其内在变异性对E.coli异质性耐药性出现的贡献需要积极探索。
5 问题与展望
异质性耐药被认为是细菌逐渐进化为耐药的一个阶段,在长期抗菌药物压力环境下,能适应较高抗菌药物浓度的亚群不断增加,如果不及时进行干预,这类菌株将对抗菌药物完全耐药,影响临床用药选择及治疗效果。因此,及时有效的对异质性耐药菌株进行检测并防控尤为重要,统一异质性耐药的检测和判定标准是先决条件,如简化PAP测试,可通过在单个平板上生成由特定抗菌药物浓度组成的梯度,每种浓度下生长菌落的自动计数将确定耐药亚群的比例及其耐药水平,然而,实际上检测异质性耐药需要在数小时内而不是数天内提供临床治疗指导,未来对开发基于表型读数的诊断工具提出了一个重要挑战。
目前,揭示的E.coli异质性耐药机制较少,异质性耐药的相关耐药机制的研究任重而道远。一方面,ESBLs参与了E.coli从异质性耐药到碳青霉烯耐药的演变,未来,呼吁对ESBLs进行常规检测,并阐明其潜在机制将促进新型抗菌药物的开发,减缓或阻止“不可避免”的进化;另一方面,生物被膜是一种重要的耐药形式,但对生物被膜的异质性耐药研究十分有限,生物被膜对于E.coli异质性耐药的影响尚不清楚,异质性耐药在生物被膜中的发生率不容忽视,仍需开展更深入的研究。
此外,尽管诸多有关异质性耐药的报道表明了异质性耐药性确实是一个临床问题,但仍然缺乏广泛的研究(特别是前瞻性研究)来评估异质性耐药性对临床上死亡率和发病率的临床影响。且大多数关于异质性耐药的研究均采用体外试验或动物模型,因此不能完全符合宿主生物体的复杂机制,例如病原体和宿主免疫反应之间相互作用、不同异质性耐药亚群共存反应等,包括难以检测的持久细菌,活的但不可培养(VBNC)细菌。因此,后续进行临床研究将是一个重要的目标,通过使用相关的临床结果参数来检查异质性耐药性的影响,并适当分析异质性耐药性表型,以揭示可能导致治疗失败的异质性耐药性的特征。
现阶段,全球COIVD-19流行期间,E.coli等病原体的传播受到一定限制。然而,消毒剂的广泛使用和抗菌药物的使用增加可能促进其耐药性的产生和传播,更应重视异质性耐药的流行情况,以防止其多重耐药性的传播至关重要。
