复合诱变选育耐高温产乙醇酵母菌的研究
2022-11-05刘延波宋艳洁李海登沈祥坤张立新孙西玉韩素娜潘春梅
刘延波,宋艳洁,李海登,沈祥坤,张立新,孙西玉,韩素娜,潘春梅*
(1.河南牧业经济学院 食品与生物工程学院(酒业学院),河南 郑州 450046;2.河南仰韶酒业有限公司 博士后科研工作站,河南 三门峡 472400;3.河南大学 生命科学学院,河南 开封 475004;4.河南牧业经济学院 河南省白酒风格工程技术研究中心,河南 郑州 450046;5.河南牧业经济学院郑州市白酒酿造微生物技术重点实验室,河南 郑州 450046;6.河南工业大学 生物工程学院,河南 郑州 450001;7.河南省食品工业科学研究所有限公司,河南 郑州 450003)
酵母菌是双性厌氧性微生物[1],在白酒生产过程中,酵母菌以谷物等作为营养基[2],生长到一定时期,会通过异化作用使发酵液中的糖类转化为乙醇和其他代谢产物[3],因此酵母菌对白酒的发酵起着至关重要的作用[4]。传统的酵母最适的发酵温度为28~33 ℃,一般不超过36 ℃[5],由于呼吸作用会产出大量热量,特别是炎热的夏季,热量积聚在发酵液中难以散去,常使得存在于酵母细胞内的理化成分,如脂肪酸,麦角固醇等遭到破坏,影响细胞生命活动的正常进行[6],造成酵母早衰,白酒企业每年出现“夏季掉排”现象。导致只能选择压排度夏,给生产造成极大的不便并大大降低了设备和厂房等的利用率,增加了酿酒成本[7]。
ABDEL B M等[8]研究指出,一个产能为3×107L的乙醇发酵企业,若将发酵温度提升5 ℃,仅冷却成本即可节约3万美元;关于在乙醇工业中选育耐高温酵母有较多研究[9-12]。DHALIWAL S S等[13]筛选到一株在40 ℃条件下耐高温的东方伊萨酵母,乙醇产量达到71.9 g/L;徐大鹏等[14]筛选到1株在41 ℃可以良好生长的耐高温酵母菌,乙醇产量为44.0 g/L。同样筛选获取在高温条件下具有良好的乙醇发酵性能的酵母菌株,对白酒生产具有重要意义。
紫外(ultra violet,UV)线作为物理诱变因子常应用于工业微生物,使脱氧核糖核酸(deoxyribonucleic acid,DNA)分子形成嘧啶二聚体,阻碍碱基的配对,影响正常的复制和转录,从而引起菌株的突变或死亡[15-16],此外还具有便捷、经济等优点,是微生物菌株诱变选育的首选诱变因子[17]。硫酸二乙酯(diethyl sulfate,DES)是一种烷化剂,可使活跃的烷基转移到电子密度较高的分子中,置换氢原子从而导致碱基改变,能够在较短的时间内提高突变率并获得较优异的突变类型[18]。复合诱变是将两种或两种以上诱变剂先后使用,具有协同效应,相比于单一因子诱变有较大优势[19-20]。赵宇等[21]通过常压室温等离子体诱变和基因重组重排方式筛选出能在37 ℃较好生长的突变株,其乙醇发酵性能为16.2%(V/V);RAJNI K等[22]通过甲烷磺酸乙酯、亚硝基胍、近紫外辐射和远紫外辐射对葡聚糖杂交种进行连续诱变,突变株可在40 ℃条件下良好生长,乙醇产量为0.379 g/L,有效的提高了酵母的抗逆性。以上研究均表明,通过复合诱变可使出发菌种的优异性状得到较大提升。
本研究在前期筛选菌株的基础上,通过选择紫外-硫酸二乙酯复合诱变法,并在深入研究菌株的最适诱变条件后,在单因素试验基础上,结合Box-Behnken中心组合试验优化菌株的发酵条件,以期更有效改善出发菌株的耐受温度及乙醇产率,为开发利用白酒酵母资源提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
酵母菌(Saccharomyces)JZ:筛选于河南某白酒企业[23],河南牧业经济学院河南省白酒风格技术研究中心保藏。
1.1.2 试剂
葡萄糖、琼脂:北京索莱宝科技有限公司;蛋白胨:厦门生物科技有限责任公司;酵母浸粉:深圳乐芙生物科技有限公司;硫酸二乙酯(DES):济南世纪通达化工有限公司;硫代硫酸钠:无锡市正昌源化工有限公司;氯化钠:天津市祥瑞鑫化工有限公司;Ezup柱式试剂盒:深圳子科生物科技有限公司;双蒸水:上海生工生物工程股份有限公司。试验所用试剂均为分析纯及生化试剂。
1.1.3 培养基
菌种的增菌培育采用酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)液体培养基:1%酵母浸粉,2%蛋白胨,2%葡萄糖。121 ℃灭菌15 min。
菌种的活化、分离纯培养和菌种保存采用酵母浸出粉胨葡萄糖琼脂培养基:1%酵母浸粉,2%蛋白胨,2%葡萄糖,2%琼脂粉。121 ℃灭菌15 min。
2,3,5-氯化三苯四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)培养基:乳酸5 g/L,琼脂15 g/L,pH6.0。121 ℃灭菌15 min后,待其冷却至50 ℃后加入TTC 0.1 g/L(现配现用)。
乳酸培养基:乳酸40 g/L,硫酸铵5 g/L,磷酸二氢钾1 g/L,氯化钠0.1 g/L,硫酸镁0.5 g/L,氯化钙0.1 g/L,酵母膏0.2 g/L,琼脂15 g/L,pH6.0。121 ℃灭菌15 min。
目标菌种发酵培养采用高粱发酵培养基∶高粱水=1∶4,90 ℃糊化90 min,先降温冷却至60 ℃,然后加入5%糖化酶糖化2~3 h,将糖度调至12°Bx。121 ℃灭菌15 min。
1.2 仪器与设备
DRP-9052恒温振荡培养箱:上海谱振生物科技有限公司;SW-CJ-2FD双人单面净化工作台:上海笃特科学仪器有限公司;LDZX-50FBS高压蒸汽灭菌锅:绍兴上虞艾科仪器设备公司;TGL-16LM高速冷冻离心机:北京华仪通泰环保科技有限公司;PICO-21式离心机:湖南恒诺仪器设备有限公司;DYCP-31DN琼脂糖凝胶电泳仪:北京市六一仪器厂;JY04S-3C凝胶成像系统:济南童鑫生物科技有限公司;V-T3紫外分光光度计:上海美谱达仪器有限公司;CX31生物显微镜:上海博湖生物科技有限公司;ABI VeritiPro聚合酶链式反应(polymerase chain reaction,PCR)仪:北京宏达恒业科技有限公司。
1.3 实验方法
1.3.1 酵母菌的分子生物学鉴定
采用Ezup柱式酵母基因组试剂盒提取分离,以基因组DNA为模板,采用通用引物(NL-1:5'-GCATATCAATAAGCGGAGGAAAAG-3')和(NL-4:5'-GGTCCGTGTTTCAAGACGG-3')进行扩增,PCR扩增体系(50 μL):SanTaqPCR Mix预混液25μL,引物各2μL,DNA模板2μL,双蒸水(ddH2O)19 μL。PCR扩增条件:94 ℃、5 min,94 ℃、40 s,55 ℃、40 s,72 ℃、90 s,35个循环;最后72 ℃延伸10 min[24]。取3 μL PCR产物经1%琼脂糖凝胶电泳检测分离,出现清晰条带,将PCR产物送生工生物工程(上海)有限公司进行测序,将获得的基因序列在美国国家生物技术信息中心(national center of biotechnology information,NCBI)上通过基本局部比对搜索工具(basic local alignment search tool,BLAST)程序进行同源性比较与分析,并利用MEGAX 10.0.2软件中的邻接(neighbor joining,NJ)法构建系统发育树[25]。
1.3.2 酵母JZ生长曲线的测定
吸取2%活化后的甘油冻悬液接种至YEPD液体培养基,置于摇床培养箱每2 h取一次样,测其波长600 nm处的吸光度值(D600nm值),以空白培养基为对照组,绘制菌株JZ生长曲线。
1.3.3 菌悬液的制备
用接种环在斜面上挑取一环菌体,放入装有无菌生理盐水的试管中,10 000 r/min离心振荡弃去上清液,加入无菌生理盐水再次振荡,使下层菌体悬浮形成均一的悬浊液[26]。
1.3.4 诱变方法
紫外诱变:将菌悬液放置已灭菌的,装有玻璃珠的三角瓶中,振荡5 min,以打散菌体。用无菌生理盐水稀释至1×108CFU/mL,备用[13]。紫外灯预热30 min 后,取10 mL制备的菌悬液加到直径9 cm平皿中,放入无菌磁力搅拌子,然后置于磁力搅拌器上、30 W的紫外线灯30 cm处,避免接触白炽光,依次照射0、20 s、40 s、60 s、80 s、100 s和120 s[27]。
硫酸二乙酯(DES)诱变:取培养至对数生长期的菌悬液10 mL于三角瓶中,加入含量分别为0、5.0%、7.5%、10.0%、12.5%、15.0%的硫酸二乙酯各10 mL,于28 ℃、200 r/min条件下振荡处理30 min后,立即加入1 mL 25%的硫代硫酸钠溶液终止反应。
将出发菌株酵母菌悬液经紫外照射后立即加入硫酸二乙酯进行复合诱变处理,取未照射的制备菌液和照射菌液各1 mL进行稀释分离,计数活菌细胞数[28]。致死率计算公式如下:

1.3.5 耐高温酵母菌的筛选及形态学鉴定
挑取长势良好的诱变菌种进行划线接种,分别在33 ℃、35 ℃、37 ℃、40 ℃、42 ℃、45 ℃、47 ℃、50 ℃的条件下静置培养24 h,通过OD600nm值反映生长情况,并通过美蓝染色记录其基本形态特征。
1.3.6 遗传稳定性试验
将突变株的种子液按2.0%的接种量接种至发酵培养基,静置于40 ℃条件下进行厌氧发酵6 d后,按照国标GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》蒸出馏出液,用酒精度计测馏出液的乙醇产量,进行连续5次传代培养,以确定突变株的遗传稳定性。
1.3.7 发酵条件优化
(1)单因素试验
发酵温度:按5%接种量接种于发酵培养基,分别在发酵温度为28 ℃、31 ℃、35 ℃、37 ℃、40 ℃、43 ℃条件下静置培养6 d,通过监测CO2质量损失反映发酵情况。
初始pH值:按5%的接种量分别接种于初始pH值为2.0、3.0、4.0、5.0、6.0、7.0的发酵培养基中,静置培养6 d,通过监测CO2质量损失反映发酵情况。
初始糖度:按5%的接种量分别接种于初始糖度为8.0°Bx、10.0°Bx、12.0°Bx、14.0°Bx、16.0°Bx、18.0°Bx的发酵培养基中,静置培养6 d,通过监测CO2质量损失反映发酵情况。
接种量:分别吸取6.0%、8.0%、10.0%、12.0%、14.0%、16.0%的菌液接种于发酵培养基中,静置培养6 d,通过监测CO2质量损失反映发酵情况[29]。
(2)响应面试验
在单因素试验基础上,选取对CO2质量损失影响较大的发酵温度(A)、初始pH值(B)、初始糖度(C)三个因素作为自变量,以发酵结束后的CO2质量损失(Y)为响应值,采用Design Expert 8.0.6软件设计3因素3水平Box-Behnken试验,优化发酵条件并进行验证,Box-Behnken 试验设计因素与水平见表1。

表1 发酵条件优化Box-Behnken试验设计因素与水平Table 1 Factors and levels of Box-Behnken experiments design for fermentation conditions optimization
1.3.8 CO2质量损失测定
挑取菌液接入锥形瓶中,并在发酵栓中注入约5 mL硫酸,封口,置感量为0.01 g的分析天平上称取,记下质量m1。置于所需温度的培养箱进行培养,发酵时间结束之后,取出发酵栓,轻轻摇动,使CO2逸出,称量后记下质量m2,计算两者之间的质量差。
2 结果与分析
2.1 酵母菌JZ的鉴定
采用NL-1基因和NL-4基因特异性引物对菌种JZ的基因组DNA进行PCR扩增,扩增产物电泳图见图1。由图1可知,引物浓度适中,扩散效率较好;菌株JZ扩增产物带大小介于750 bp和500 bp,产物长度约为600 bp。
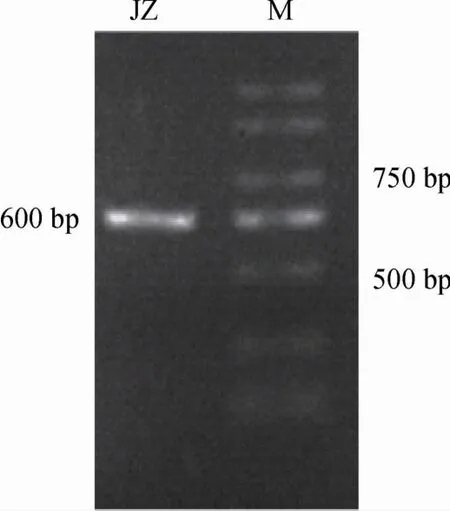
图1 酵母JZ 28S rDNA PCR扩增产物琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoretogram of 28S rDNA PCR amplification product of yeast JZ
将获得的基因序列在NCBI上通过BLAST程序进行同源性比较与分析,并利用MEGAX 10.0.2软件中的邻接(NJ)法构建系统进化树,结果见图2。由图2可知,酵母JZ位于独立进化分支内,其遗传进化关系与库德里阿兹威毕赤酵母(Pichia kudriavzevii)的相似性为98%,因此,菌株JZ被鉴定为库德里阿兹威毕赤酵母(Pichia kudriavzevii)。
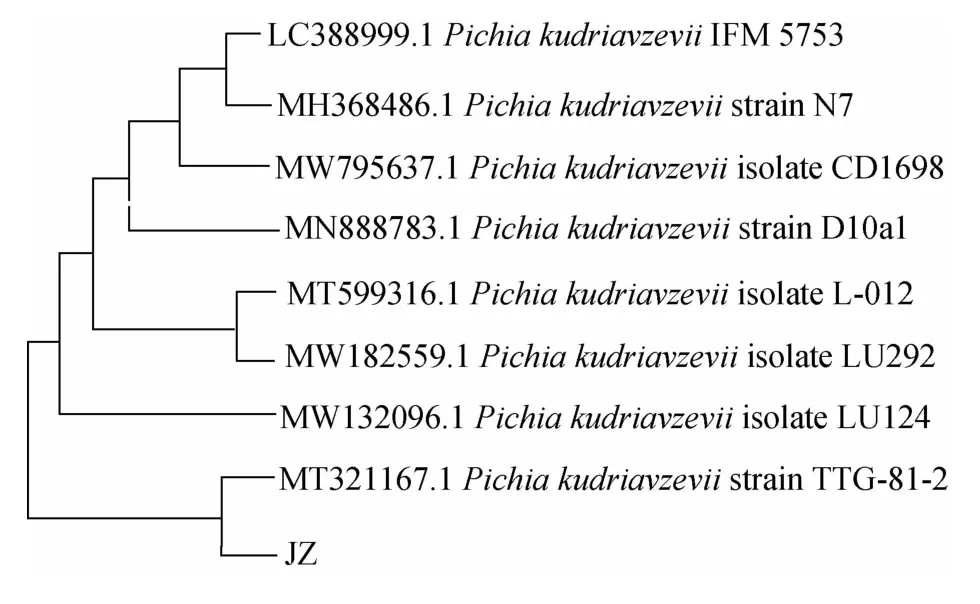
图2 基于28S rDNA基因序列菌株JZ的系统发育树Fig.2 Phylogenetic tree of strain JZ based on 28S rDNA gene sequence
2.2 菌株JZ生长曲线的测定
由图3可知,0~4 h为延迟期,细胞经过初步适应后,代谢活动逐渐旺盛,但生长仍较缓慢,细胞数基本不增加;从第6小时开始细胞的生长进入对数生长期,对理化因素较为敏感,该时期的细胞生长平衡,细胞形态、大小、生理特征比较一致,生长最为旺盛,菌体活力最好,初级代谢产物大量产生;在22~30 h之间,该时期的生长菌群总数处于平稳阶段,且细胞繁殖速度渐趋下降。为达到较高的菌体密度以及较好的繁殖速度,故本试验以对数生长后期16 h作为诱变时间。
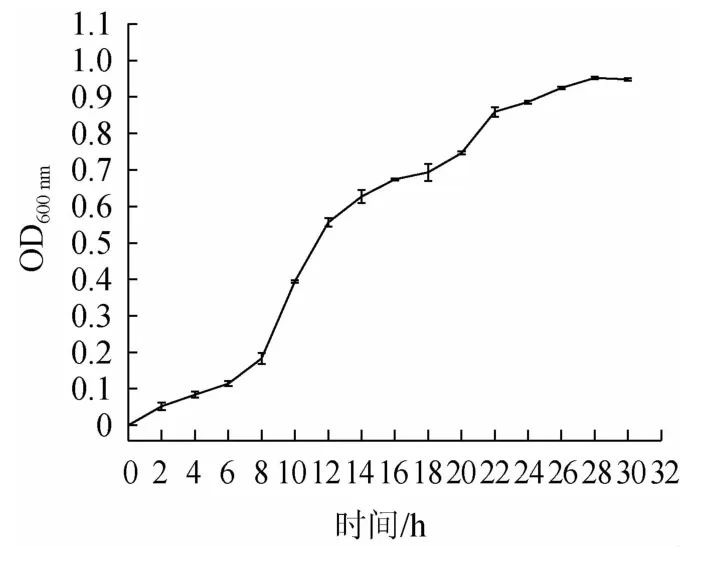
图3 菌株JZ的生长曲线Fig.3 Growth curve of strain JZ
2.3 菌株JZ的诱变
2.3.1 紫外诱变
由图4可知,菌种的致死率与紫外照射时间呈正相关。在20 s以内时,致死率较低,说明对菌种生长无较大影响。当持续照射20 s后,菌种致死率快速上升,并在80 s时,菌种致死率快速增加到82.46%,符合最佳诱变的致死率范围80%~90%。因此,选择菌种的最佳诱变时间为80 s。
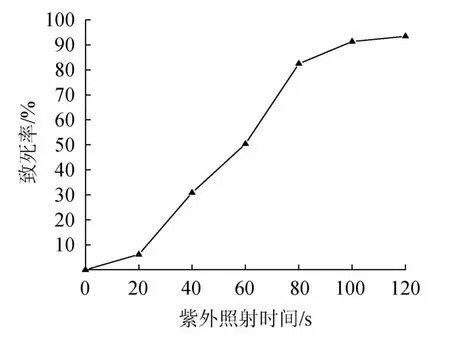
图4 紫外照射时间对菌体致死率的影响Fig.4 Effect of UV irradiation time on the lethality of bacteria
2.3.2 硫酸二乙酯诱变
由图5可知,硫酸二乙酯的添加量与菌种致死率呈正相关。当诱变剂添加量为5.0%时,致死率达到81.75%,随着诱变剂浓度的提高,曲线趋于平缓。因此,选择诱变剂硫酸二乙酯添加量为5.0%。

图5 硫酸二乙酯添加量对菌体致死率的影响Fig.5 Effect of diethyl sulfate addition on the lethality of bacteria
2.3.3 诱变菌株JZ-2的形态学鉴定
通过平板分离培养基分离纯化,从诱变菌株中筛选出10株酵母菌;用TTC培养基和乳酸培养基进行初筛,筛选出3株能耐45 ℃以上的酵母菌,编号为JZ-1~JZ-3。其中JZ-2菌株在TTC培养基下颜色最深,JZ-1和JZ-3次之。通过YPD固体培养基划线分离,以及47 ℃高温培养,最终筛选出一株菌落形态较好的耐高温酵母菌,编号为JZ-2,菌株JZ-2菌落及细胞形态观察结果见图6。由图6a可知,在28 ℃培养条件下,菌株JZ-2菌落形态为圆形,较大较厚,呈乳白色,表层湿润,粘稠,表面平坦,不反光。由图6b可知,在47 ℃培养条件下,菌落形态为圆形,乳白色,菌落较小,直径范围约0.5~1.0 mm。28 ℃是常温下培菌的温度且比较适合菌株的生长,47 ℃是酵母菌的最高耐受温度,两者的菌落和镜检图可做对比,由图6c可知,在28 ℃下镜检,发现细胞多为椭圆状且细胞形态较大。由图6d可知,47 ℃条件下,细胞多数呈圆柱形、柠檬形。

图6 菌株JZ-2的菌落(a,b)及细胞(c,d)形态Fig.6 Colony (a,b) and cell (c,d) morphologies of strain JZ-2
2.3.4 诱变菌株JZ-2产乙醇测定
在40 ℃下用糖度为12°Bx的发酵培养基培养菌种JZ-2,静置培养6 d,测得CO2质量损失为5.81 g,产乙醇为4.8%vol。
2.4 诱变菌株JZ-2遗传稳定性测定
在对突变菌种JZ-2经过5次传代,在47 ℃条件下仍能稳定生长,且产乙醇能力趋于稳定,为4.6%vol,表明诱变菌株JZ-2具有较好的遗传稳定性。
2.5 诱变菌株JZ-2的温度耐受性
在不同温度下对突变株JZ-2分别培养24 h,OD600nm值测定结果见图7。由图7可知,当培养温度为33~37 ℃时,菌种的OD600nm值呈上升态势;温度在37~50 ℃时,OD600nm值不断减少;当达到50 ℃时,OD600nm值达到最小值,生长趋近停止;在47 ℃时,菌株缓慢生长,生长受到抑制;表明该酵母菌的最适生长温度为37 ℃,最高温度耐受性为47 ℃。
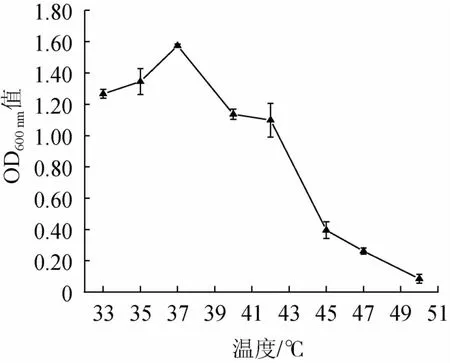
图7 温度对菌株JZ-2生长的影响Fig.7 Effect of temperature on strain JZ-2 growth
2.6 诱变菌株JZ-2发酵条件优化
2.6.1 单因素试验结果
由图8a可知,在28~40 ℃条件下,CO2质量损失呈上升态势,在40~43 ℃下,CO2质量损失不断减少,表明发酵温度为40 ℃时,突变株JZ-2的发酵性能最好。过高或过低pH环境中生长的酵母细胞,其细胞膜的带电荷状态以及酶促反应均会受到影响。由图8b可知,CO2质量损失在发酵pH为4.0时达到最高为5.66 g,说明该pH状态下,既保证了细胞膜的稳定电荷,又使得酶促反应正常进行。由图8c可知,当发酵培养基的糖度在8~16°Bx范围内,CO2质量损失不断增加,16~18°Bx之间CO2质量损失减少,表明菌株JZ-2的最适发酵糖度为16°Bx。由图8d可知,当接种量为12%时,CO2质量损失达到最高为6.43 g,表明菌种JZ-2的最适接种量为12%。
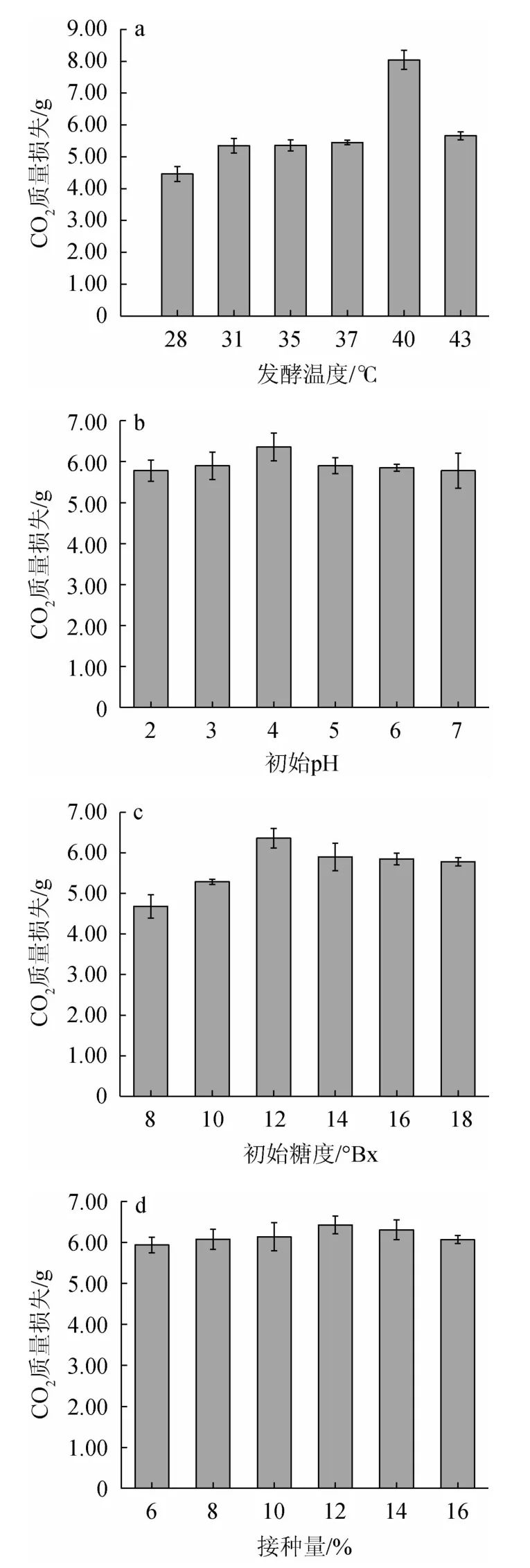
图8 不同发酵温度(a)、初始pH(b)、初始糖度(c)和接种量(d)对CO2质量损失的影响Fig.8 Effects of different fermentation temperature (a),initial pH (b),initial sugar contents (c) and inoculum (d) on CO2 mass loss
2.6.2 响应面试验结果与分析
在单因素试验基础上,根据Box-Behnken试验设计原理,设计了17个试验的响应面分析试验,Box-Behnken试验设计与结果见表2,方差分析结果见表3。采用Design Expert 8.0.6软件对表4数据进行多元二次回归拟合,得到CO2质量损失(Y)对发酵温度(A)、初始pH值(B)、初始糖度(C)的多元回归方程为:Y=7.51-0.24A+0.096B+0.42C+0.21AB+0.16BC-1.48A2-0.35B2-0.33C2。

表2 发酵条件优化Box-Behnken试验设计及结果Table 2 Design and results of Box-Behnken experiments for fermentation conditions optimization

表3 回归模型方差分析Table 3 Variance analysis of regression model
由表3可知,该模型的F=90.31,P<0.000 1,表明该模型极显著;失拟项F值=4.83,P>0.05,表明失拟项不显著,模型的决定系数R2=0.998 1,调整决定系数R2Adj=0.995 7,说明该模型合理可行。由P值可知,一次项A、C、二次项A2、B2、C2对Y值影响极显著(P<0.01),交互项AB、BC对Y值影响显著(P<0.05),其余项则不显著。由F值可知,各因素对CO2质量损失的影响显著性大小顺序依次为初始糖度(C)>发酵温度(A)>初始pH值(B)。
2.6.3 各因素交互作用响应曲面分析
三个显著因素的响应面曲线都呈现抛物线形态,且开口向下,表明存在有峰值。响应面坡度越陡,各种因素间的交互作用就越显著。各因素交互作用响应面及等高线见图9。由图9可知,A和B、B和C交互作用显著(P<0.05),A和C交互作用不显著(P>0.05)。
2.6.4 验证试验
由Design Expert8.0.6软件优化发酵培养条件,结果表明:当优化条件分别为发酵温度39.82 ℃,初始pH值4.28,初始糖度15.43°Bx时,CO2的质量损失预测值为7.685 g。根据实际操作可行性,将发酵条件修正为发酵温度40 ℃,初始pH值4,初始糖度16°Bx。在此最佳条件下进行3次平行验证试验,可得CO2质量损失实际值为(7.63±0.17)g,与预测值基本吻合,说明所建模型拟合效果真实良好。并通过利用蒸馏-酒精计法测得优化后的菌种JZ-2的产乙醇能力为5.6%vol。
3 结论
本研究对实验室保藏菌种JZ进行UV-DES复合诱变,获得了温度耐受性以及乙醇产量显著提高且遗传性能稳定的突变株JZ-2,并利用单因素试验及响应面分析法对其发酵培养条件进行优化。经筛选得到的突变菌株JZ-2,在40 ℃下发酵6 d,产乙醇可达4.8%vol。在单因素试验的基础上,响应面优化结果显示,突变菌种JZ-2的最佳发酵条件为培养温度40 ℃、初始pH4、糖度为16°Bx、接种量12%,在此条件下,突变菌株JZ-2的产乙醇能力最高可达5.6%vol。发酵酒分仍偏低,可能原因为首先该菌株是毕赤酵母,产乙醇能力在一定程度上没有酿酒酵母的产酒率高;其次温度的影响,40 ℃的条件下虽不能完全抑酵母的生长,但对其存在一定的抑制。但相比于初始菌株产乙醇能力提高了17%,显示其在高温下发酵生产乙醇的潜力巨大,为开发利用白酒酿造微生物资源和解决企业“夏季掉排”现象提供理论依据和应用参考。
