MAL 蛋白调控肺动脉平滑肌细胞增殖与凋亡对肺动脉高压的作用和机制
2022-11-03刘进军李晴晴曾超超王月祥胡擎天王洪巨吴士礼
刘进军,李晴晴,曾超超,,王月祥,,胡擎天,,王洪巨,吴士礼
1蚌埠医学院第一附属医院心血管科,安徽 蚌埠 233000;2蚌埠医学院,安徽 蚌埠233030
肺动脉高血压(PAH)由多种病因所致,表现为肺循环阻力和肺动脉压力进行性升高,导致右心衰竭死亡[1,2]。PAH病理改变包括肺血管收缩、血栓形成、肺动脉平滑肌细胞(PASMCs)异常增殖所致血管重塑及肺内皮细胞功能障碍或损伤[3,4]。PAH早期缺乏典型的临床表现[5],早期诊断和干预是降低患者死亡率及改善预后的关键。
尽管PAH的机制仍不完全清楚,但缺氧是PAH明确的触发因素之一[6,7]。研究表明,缺氧可诱导肺动脉收缩造成通气不良区域中的肺血管持续性收缩从而降低血液供应使通气血流得以匹配,同时缺氧具有抗凋亡效应,促进肺血管的重塑[8]。PASMCs作为血管的重要组成部分,其正常的分化和增殖是维持血管正常功能的必须条件[9-11]。PAH早期常出现PASMCs异常增殖和分化异常,导致血管平滑肌细胞肥大、血管壁增厚、血管内直径变窄和血流灌注阻力增加,最终导致肺动脉结构重塑[12]。因此肺动脉平滑肌细胞的增殖和凋亡失衡在肺血管重塑的发生、发展过程中起关键性作用,通过抑制PASMCs增殖和诱导细胞凋亡可能是逆转肺血管的重塑和治疗肺动脉高压的一个新的治疗策略。
髓磷脂和淋巴细胞蛋白(MAL)是脂筏中不可或缺的膜蛋白成分,与极化上皮细胞中蛋白的顶端转运有关[13,14]。最新研究表明,MAL除参与稳定脂筏外,其还参与调控细胞增殖过程[15,16]。目前,MAL在PAH中的作用尚未见报道。本研究采用PAH患者血液标本、缺氧诱导PASMCs增殖模型及饥饿诱导的凋亡模型,并通过体外干预mal基因表达,探讨MAL在PAH中的作用及可能机制。
1 资料和方法
1.1 基本资料
收集2020年1月~2021年1月就诊于蚌埠医学院第一附属医院心血管科诊断为肺动脉高压患者50例,其中男性29例,女性21例,诊断标准符合《中国肺动脉高压诊断与治疗指南(2021版)》;另选本院同期健康体检者50例,其中男性25例,女性25例。入组时排除肝肾功能不全、感染性疾病和既往冠脉介入治疗史等。本实验征得蚌埠医学院第一附属医院伦理委员会同意(批准号:伦科批字[2021]第220号),所有受试者知晓此研究。
PAMSCs(北京协和细胞资源中心),MAL 蛋白ELISA试剂盒(Abbexa,英国),CCK-8试剂(北京索莱宝公司),mal慢病毒(control siRNA:TTCTCCGAAC GTGTCACGTAA;malsiRNA:GACTTGCTCTTCAT CTTTGAG TTTA,上海吉凯基因),细胞凋亡检测试剂盒(北京碧云天公司),PCR 检测试剂盒(TaKaRa),MAL 抗体(santa cruz biotechnology),p65及p-p65抗体(CST)。
1.2 血浆MAL水平ELISA检测
PAH患者入院后次日清晨,空腹抽取肘静脉血,采用含肝素钠抗凝管收集血液并立即离心10min(3000r/min),收集血浆;收集体检为健康者外周血,血浆收集方法同PAH患者。所有血浆冻存于-80 ℃冰箱,避免反复冻融。MAL蛋白水平检测按照ELISA试剂盒说明书进行操作。
1.3 细胞培养
将PAMSCs接种于含10%FBS的DMEM培养中,根据慢病毒转染的步骤将mal-siRNA和mal-LV转染PAMSCs细胞中,将细胞分别置于含有5%CO2的常氧环境与缺氧环境(5%CO2、5%O2、90%N2)中分别培养。
1.4 细胞增殖检测
将4×103PAMSCs接种于96孔板,培养24 h后,加入CCK-8试剂,分别在常氧和缺氧环境下培养2 h,测定A450nm。
1.5 细胞凋亡模型建立与检测
饥饿诱导细胞凋亡模型建立,缺氧环境培养的PAMSCs细胞更换为无血清培养基后,继续培养12 h,根据凋亡检测试剂盒的操作步骤对凋亡诱导的PAMSCs细胞进行染色,采用流式细胞仪检测凋亡细胞比例。
1.6 荧光定量PCR检测
提取细胞总RNA并根据反转试剂盒操作说明书合成cDNA,采用荧光定量PCR分析PAMSCs细胞中mal基因的表达水平,以β-actin为内参。mal引物序列如下:上游引物:5'-ACCGCTGCCCTCTTTTACC-3',下游引物:5'-GAAGCCGTCTTGCATCGTGAT-3';β-actin引物序列如下:上游引物:5'-CATGTACGTTGCTATCCAGG C-3',下游引物:5'-CTCCTTAATGTCACGCAC GAT-3'。
1.7 免疫印迹检测
提取细胞总蛋白,经SDS-PAGE电泳、转膜和封闭后,孵育一抗(MAL、p65、p-p65、β-actin抗体,稀释比例均为1∶1000),TBST洗涤后,孵育二抗,滴加ECL发光液置于曝光仪(Bio-Rad)中曝光。
1.8 统计学分析
数据分析采用SPSS Statistics 26.0软件,计量资料采用均数±标准差表示,组间差异采用t检验分析;计数资料的组间比较采用χ2检验,样本量小于5采用Fisher精确概率检验法,检验水准为α=0.05,以P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料及实验室指标
PAH组与HC组的一般资料包括年龄、性别、吸烟史及BMI比较,差异均无统计学意义(P>0.05);实验室检查指标中,PAH组HDL、LDL、SBP及DBP水平显著高于HC组(P<0.05),而总胆固醇水平差异无统计学意义(表1)。
2.2 PAH患者血浆中MAL蛋白表达升高
PAH患者血浆中MAL蛋白的表达水平(60.040±10.445 pg/mL)显著高于对照组(HC)(20.065±9.203 pg/mL),差异具有统计学意义(P<0.01,图1)。
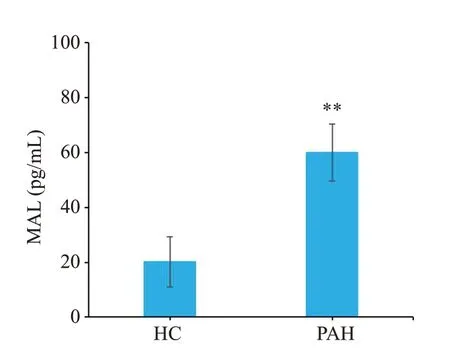
图1 PAH患者血浆中MAL表达升高Fig.1 Plasma MAL level is elevated in PAH patients.**P<0.01 vs HC.
2.3 PAH患者分级一般资料及实验室指标比较
对50例PAH患者进行超声心动图检测,根据伯努利方程计算肺动脉压并根据肺动脉压进行分级,其中轻度组(35~45 mmHg),32例;中重度组(>45 mmHg),18例。两组PAH患者一般资料,包括年龄、性别、吸烟史、BMI,差异均无统计学意义(P>0.05);实验室检查指标中,中重度组LDL、总胆固醇、SBP及DBP均值均高于轻度组(P<0.05,表2),而HDL水平差异无统计学意义(表1)。
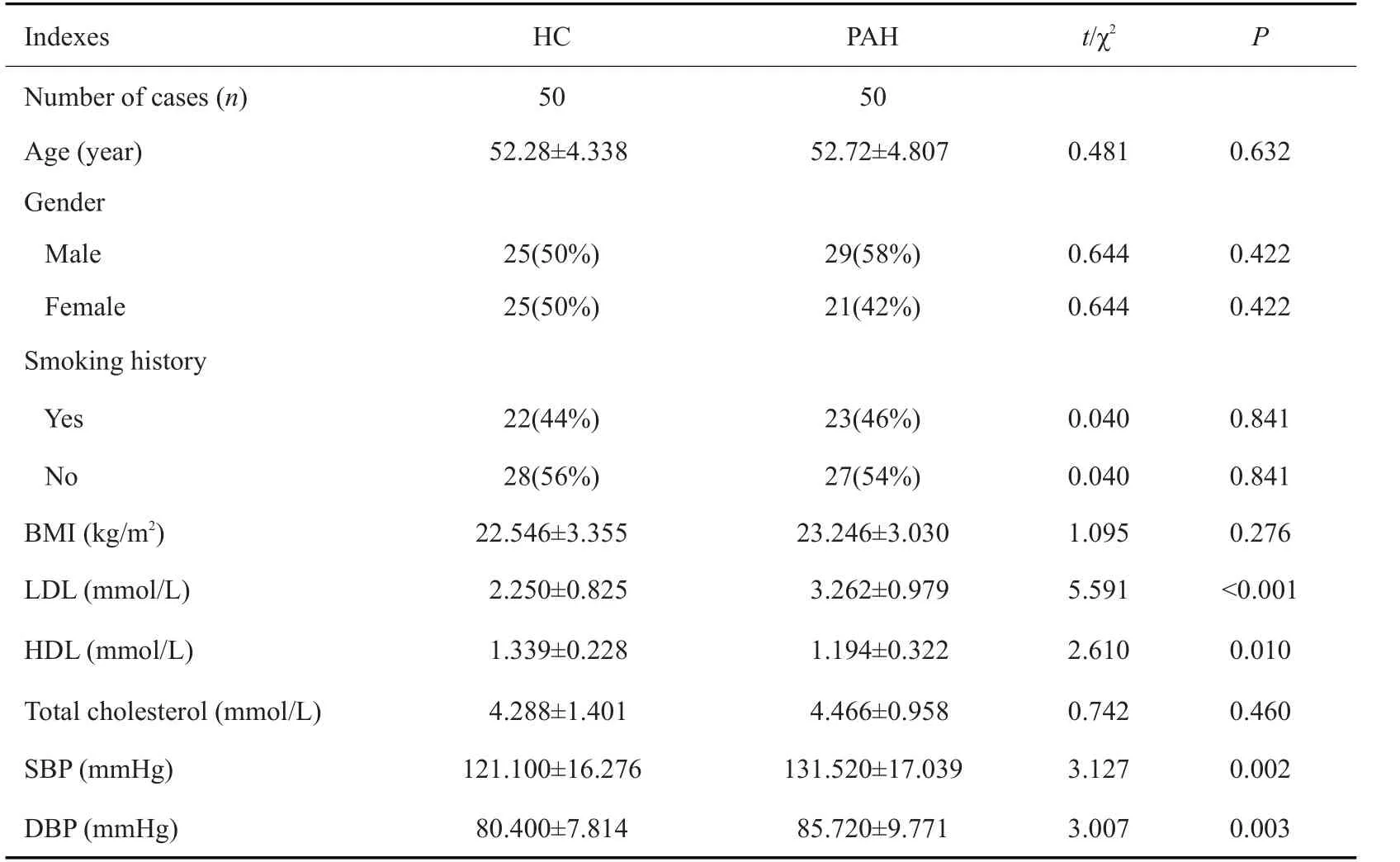
表1 两组一般资料及实验室指标比较Tab.1 Comparison of demographic data and laboratory test results between PAH patients and healthy individuals
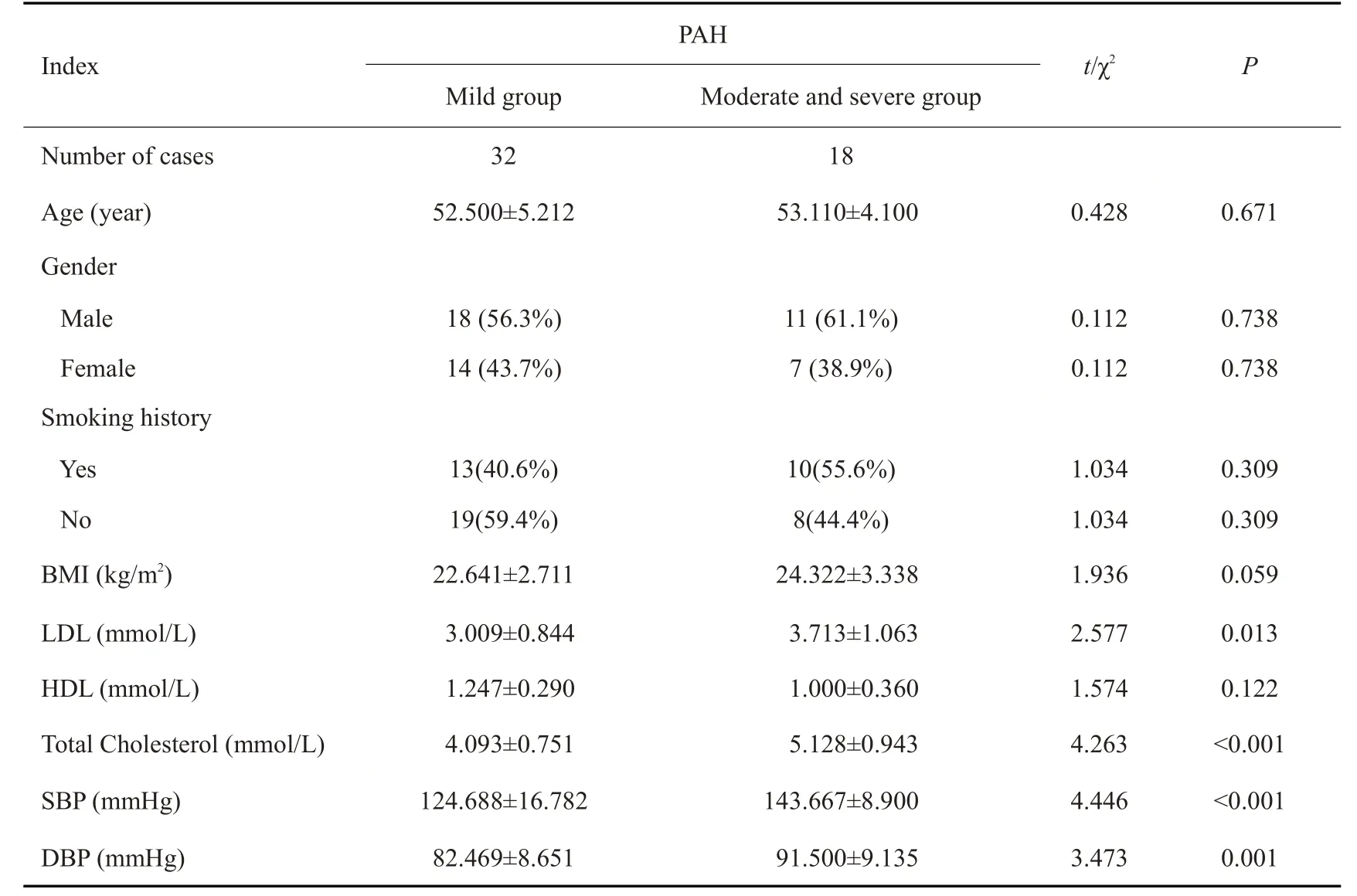
表2 两组患者一般资料及实验室指标比较Tab.2 Comparison of demographic and laboratory test results between moderate to severe PAH and mild PAH groups
2.4 血浆MAL水平与PAH患者分级关系
50例PAH患者中,轻度组PAH患者(n=32),血浆MAL 水平(55.806±9.778 pg/mL)显著高于中重度组PAH患者(n=18,67.567±6.812 pg/mL),两组患者血浆MAL水平比较差异具有统计学意义(t=4.515,P<0.001)。
2.5 缺氧诱导PASMCs高表达MAL蛋白
体外采用缺氧诱导PASMCs增殖模型,结果显示缺氧组PASMCs中MAL的mRNA及蛋白表达水平显著高于常氧组(P<0.05,图2A~C)。
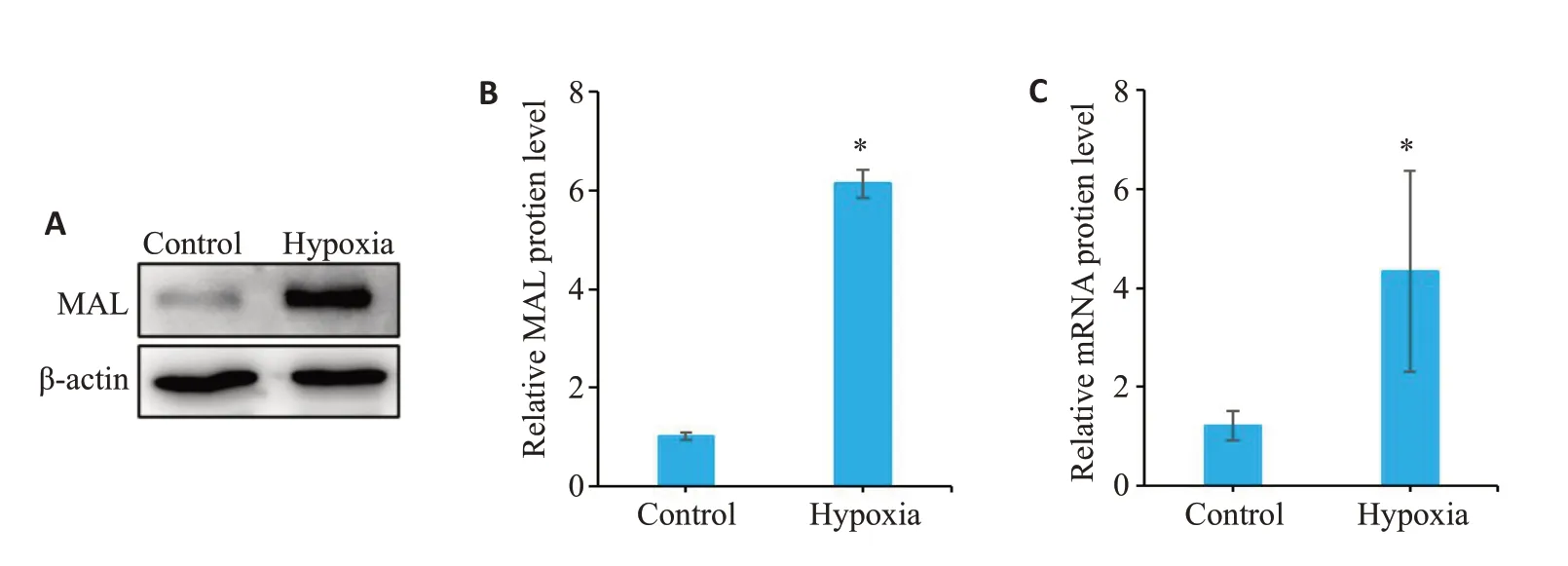
图2 缺氧环境诱导PAMSCs高表达MALFig.2 Hypoxia induces increased expression of MAL in PAMSCs.A: Western blotting of MAL expression.B: Quantitative analysis of MAL protein expression.C: Analysis of MAL mRNA expression.*P<0.05 vs control.
2.6 干扰mal基因的表达改变PAMSCs形态并抑制细胞增殖
缺氧可促进PAMSCs增殖,细胞状态良好;而干扰mal后,细胞形态发生改变,表现为细胞悬浮,胞内出现空泡(图3A);CCK-8结果显示,干扰mal可显著抑制PAMSCs增殖(图3B)。
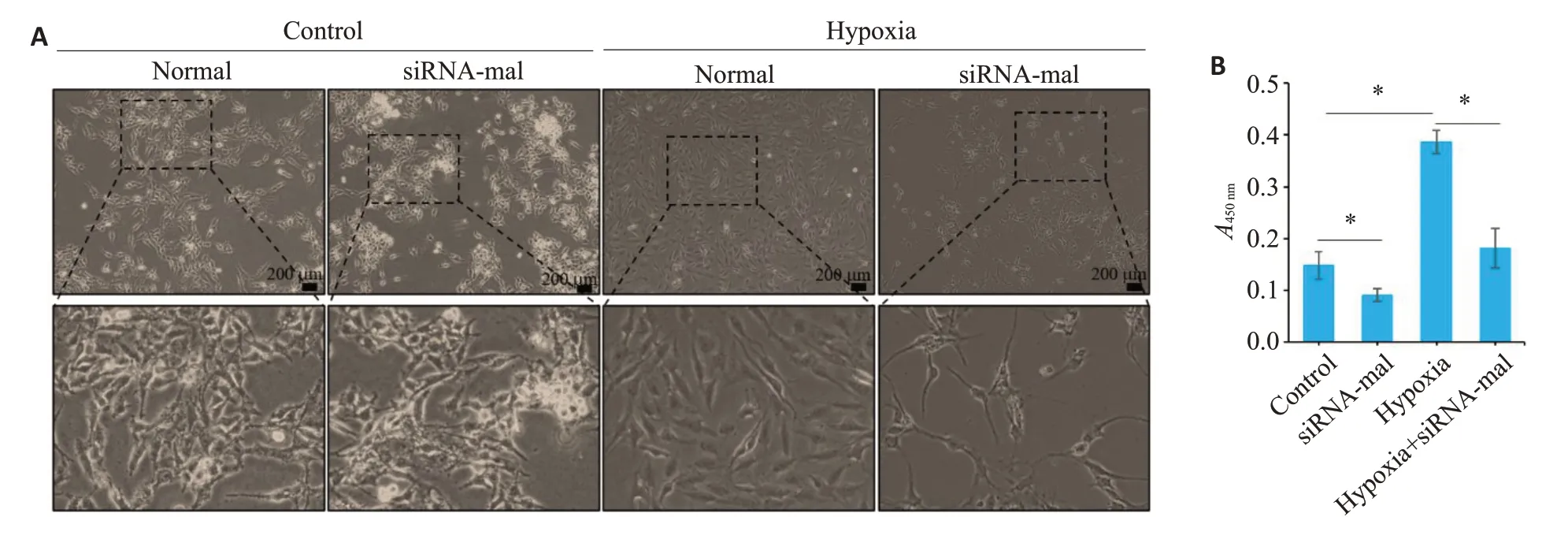
图3 干扰mal对PAMSCs形态及增殖的影响Fig.3 Effects of transfection with siRNA-mal on morphology and proliferation of PAMSCs.A: Observation of PAMSCs growth.B:A450 nm values in CCK-8 assay.*P<0.05.
2.7 干扰MAL的表达促进缺氧环境下PASMCs的凋亡
采用无血清处理缺氧环境下培养的PASMCs诱导细胞凋亡模型,结果显示干扰mal的表达可显著促进饥饿诱导的PASMCs细胞凋亡(图4)。
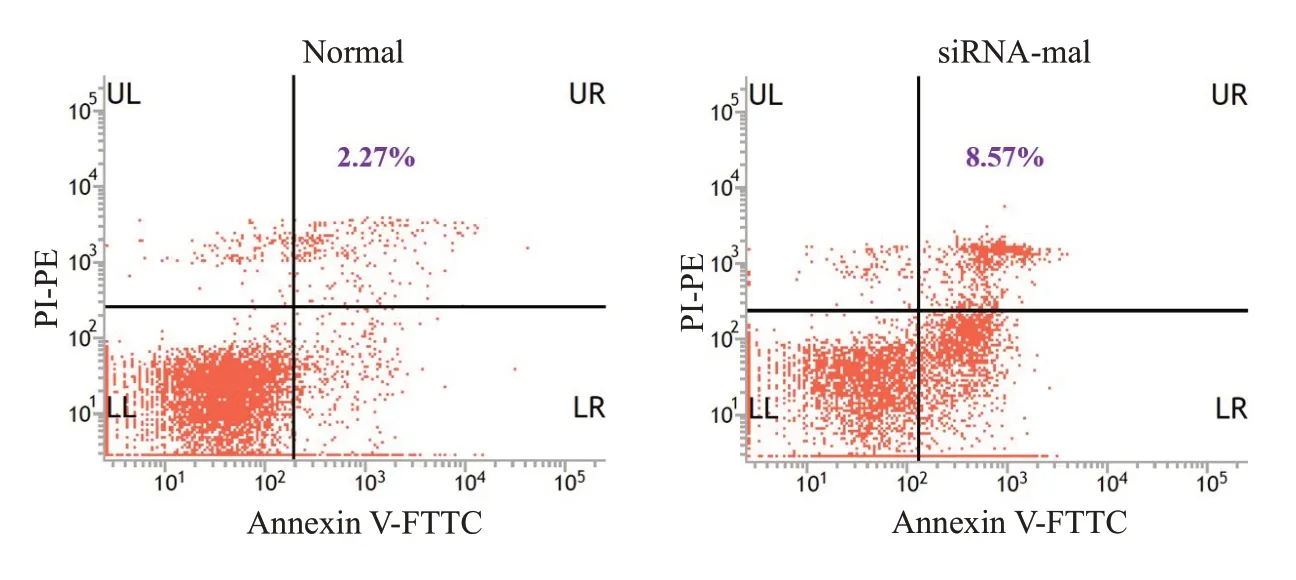
图4 干扰mal对PAMSCs凋亡的影响Fig.4 Effects of transfection with siRNA-mal on apoptosis of PAMSCs.
2.8 NF-κB/P65信号通路参与MAL蛋白调控PASMCs增殖
在缺氧环境培养下,PAMSCs中p-p65表达水平增高,而敲低mal可显著抑制p-p65表达,与常氧对照组相比差异具有统计学意义(P<0.05,图5A、B)。另外,我们发现PAMSCs过表达mal基因同时添加NF-κB特异性抑制剂(SN50)可显著抑制细胞增殖能力(图5C)。
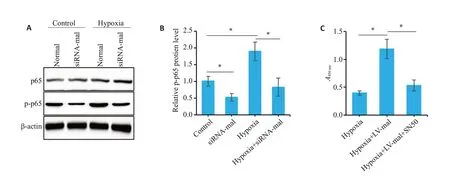
图5 NF-κB信号通路参与MAL调控PAMSCs细胞的增殖Fig.5 NF-κB pathway is involved in MAL-mediated regulation of PAMSC proliferation.A:Western blotting of NF-κB pathway activation.B:Analysis of relative p-p65 level.C:A450 nm values of CCK-8 assay.*P<0.05.
3 讨论
PAH的关键病理学特征为远端肺动脉重构,包括肺内皮细胞凋亡和平滑肌细胞异常增殖[17]。然而,PAH的发病机制尚不完全明确,因此目前尚无有效的预防措施[18,19]。本研究中,我们发现,PAH患者血浆中MAL水平升高与疾病程度有关。体外干预MAL的表达可以抑制缺氧诱导的PAMSCs增殖能力并促进饥饿诱导的细胞凋亡。此外,我们证明NF-κB信号通路可能参与了MAL调控PAMSCs细胞增殖与凋亡的过程。
研究发现MAL蛋白除具有维持脂筏稳定的功能外,其在调控细胞生物学功能方面具有重要作用,与极化上皮细胞中蛋白的顶端转运有关且参与细胞周期及增殖/凋亡相关性信号通路调控[15,20]。新近研究发现,MAL参与调控淋巴细胞及多种肿瘤细胞的增殖和凋亡,在多种疾病的发生发展过程中发挥重要作用[21,22]。过表达MAL的转基因小鼠会导致特定组织中相关细胞异常增殖,进一步会导致其结构改变。在大鼠脊髓损伤模型中脊髓灰质中的MAL表达增高,并参与脊髓损伤后修复及多种炎性细胞的增殖[23]。因此,调控机体组织中MAL的表达水平可能对疾病进程具有调控作用。最近研究表明,MAL在小鼠肺内皮细胞(1G11)和小鼠肺血管内皮中均有表达[24]。这些研究均提示MAL促进细胞增殖的能力在多种疾病尤其是肺部疾病中可能发挥重要的作用。但是该蛋白在PAH中的作用尚未见报道,本研究通过分析PAH患者和健康人外周血中MAL的水平,发现PAH血浆中MAL蛋白表达异常升高,进一步分析发现,疾病症状较重的PAH患者血浆中MAL水平显著高于轻症患者,提示MAL可能参与PAH的疾病进程。
鉴于MAL的生物学功能,我们推测MAL能否参与调控PAH患者肺动脉平滑肌细胞的异常增殖。研究报道,在常氧环境培养下,PAMSCs细胞生长缓慢,细胞内有空泡,缺氧可显著提高PAMSCs增殖能力,且细胞体积变小,细胞中VEGF等的表达升高,这些改变均参与了PAH 中血管重塑过程[25]。我们采用缺氧诱导PASMCs体外增殖模型,通过细胞形态和增殖能力证实该模型可模拟PAH下肺动脉平滑肌细胞的病理改变,与报道一致[26]。更重要的是,我们发现,缺氧环境下,PASMCs中MAL的表达显著升高,进一步证实了,高水平MAL可能与PASMCs异常增殖有关,并参与PAH血管重塑。为了证实MAL对PASMCs的调控作用,我们采用小干扰和过表达慢病毒调控细胞中mal基因的表达,结果显示,干扰MAL可显著抑制细胞的增殖能力,同时可显著促进饥饿诱导的细胞凋亡比例。
NF-κB是细胞内主要的转录调控信号通路,在细胞行为中发挥重要作用,该通路的激活可导致细胞增殖失控,抑制细胞凋亡相关基因的转录,最终导致细胞过度增殖[27]。多项研究证实PAH中存在NF-κB信号通路激活,且与肺动脉平滑肌细胞的病理改变相关[28]。我们的研究显示,干扰mal基因的表达会抑制PAMSCs中NF-κB通路的激活,表现为p65磷酸化水平显著降低,NF-κB的抑制剂(SN50)处理进一步证实了NF-κB的调控作用。另外,抑制NF-κB可逆转过表达mal对PAMSCs细胞增殖的促进作用。我们的研究结果表明,缺氧环境诱导的MAL上调可能激活了NF-κB通路,该信号通路在维持PAMSCs过度增殖及抗凋亡中起重要作用。
我们的研究表明,PAH患者外周血中高水平MAL与疾病程度相关,可能通过促进肺动脉平滑肌细胞增殖,抑制其凋亡参与疾病进程。若干预MAL表达,有望通过调控肺动脉平滑肌细胞增殖与凋亡过程缓解疾病症状,为PAH的治疗提供新的分子靶点。
