多肽金纳米粒P12在小鼠体内的生物安全性研究
2022-11-02刘夏荔马惠强黄凯峰姬宇婷
刘夏荔,马惠强,黄凯峰,姬宇婷,杨 红,*
(1.上海交通大学医学院附属第一人民医院呼吸与危重症医学科,上海 200080;2.天津医科大学基础医学院生物医学工程与技术学院,天津 300020;3.上海交通大学医学院附属第一人民医院检验科,上海 200080;4.天津医科大学基础医学院药理系,天津 300020)
0 引言
纳米医学是化学、物理、生命科学、材料科学等传统学科相融合的研究领域,其作为一个相对新的跨多学科研究方向备受关注[1]。纳米医学在药物靶向输送、高效疫苗、超灵敏分子诊断器件等应用方向具有广阔前景,有望促进医学的发展,改变目前行医的方式。肺部疾病是导致人类死亡的主要疾病之一,每年因肺病死亡的人数占全球总死亡人数的1/6,预计到2030年,此比例将增加至1/5[2]。现已有许多研究表明纳米医学应用在肺癌[3]、肺纤维化[4]、急性肺损伤[5]、哮喘[6]和其他肺部疾病的治疗方面具有优势,其为肺部疾病的治疗提供了新的干预手段。
本课题组前期合成了一种具有生物活性的新型多肽金纳米粒P12[7],由序列为CLPFFD的多肽包裹在金纳米粒表面组成。课题组已证实P12可通过抑制Toll样受体4(Toll-like receptor 4,TLR4)信号通路发挥抑炎效用,并且在脂多糖(lipopolysaccharide,LPS)诱导的急性肺损伤小鼠模型中证实P12可通过诱导肺巨噬细胞向抑炎促修复的M2型分化进而发挥治疗作用[5]。此外,还发现与其他给药方式(腹腔给药和尾静脉给药)相比,气道给药途径可使P12靶向肺巨噬细胞,提高其在靶细胞中的生物利用率[8],在低浓度时就可达到较好的治疗效果。
本课题组前期的研究表明P12在细胞水平具有良好的安全性,不影响人外周血单核细胞、人单核细胞白血病来源巨噬细胞和小鼠骨髓分化巨噬细胞的活力[5,9-10]。为了促进P12的临床转化,本研究参考《药物非临床研究质量管理规范》(GLP)和已发表的系统评价金纳米粒子/化疗药物在小动物(小鼠、大鼠等)上的生物安全性文章[11-12],探究经气道给药时小鼠对P12的最大耐受剂量,并明确P12的急性毒性,以期评价P12的体内安全性。
1 材料与方法
1.1 试验动物
SPF级试验用野生型C57BL/6J雌性小鼠18只,7~8周龄,体质量20~24 g,购自上海斯莱克实验动物有限公司。所有动物试验操作均由上海交通大学附属第一人民医院实验动物管理与伦理委员会批准后进行。
1.2 裸金纳米粒子与P12的制备
裸金纳米粒子制备:将柠檬酸钠(2mL,38.8mmol/L)加入到沸腾的氯金酸溶液(20 mL,1 mmol/L)中,持续搅拌并加热15 min,冷却后即得到粒径约13 nm的裸金纳米粒子。
P12合成:将体积比为1∶10的多肽溶液(1mmol/L)和裸金纳米粒子混匀,避光静置12 h,即可得到浓度为10 nmol/L的P12(如图1所示)。
图1 P12的制备示意图
1.3 裸金纳米粒子与P12的表征
利用透射电子显微镜(HITACHI,HT7700,日本)分别对合成的裸金纳米粒子及P12的形貌及粒径大小进行表征:首先吸取5μL样品滴加于铜网上,然后常温静置1 h,待样品干燥后使用透射电子显微镜观察成像结果并记录保存(加速电压80 kV)。此外,利用纳米粒度仪(Malvern,Zetasizer NanoZS,英国)对裸金纳米粒子及P12的粒度分布和分散特性进一步验证:取1 mL样品置于聚苯乙烯测试皿中,然后插入纳米粒度仪样品槽,选择粒径测量模式进行粒径大小检测(温度25℃,金折射率为0.2)。
1.4 气道给药方法
于腹腔注射1%的戊巴比妥钠(45 mg/kg)麻醉18只小鼠,之后将小鼠呈仰卧位固定于泡沫板上,脱除颈前毛发,使用75%酒精浸润的棉球消毒完成备皮。在小鼠颈前正中剪一道约3 mm的纵向切口,钝性分离皮肤下的肌肉等组织,暴露气管。用1 mL胰岛素注射器抽取50μL的P12(125 nmol/L~2μmol/L)或磷酸盐缓冲液(phosphate buffered saline,PBS)后,经环甲膜刺入气管内,推动注射器,见到紫红色液体进入气道且小鼠呼吸变得急促,肺部闻及湿啰音,则可确认药物进入肺部。
1.5 剂量递增试验
将125 nmol/L作为P12的初始浓度经小鼠气道给药(50μL),观察并记录一周内小鼠每日的体质量变化和临床症状[11]。剂量递增试验观察设置2个终点指标:体质量下降>15%或临床症状评分>2分。若一周内没有观察到2种终点指标,则在7 d观察结束后,取新的一只小鼠经气道给予加倍浓度的P12,重复以上观察,直至出现任一观察终点指标,或者给予的P12剂量达到2μmol/L(50μL)。当满足这2个终点指标中的任何一个时,剂量递增停止,并将此浓度的上一个浓度作为P12气道给药的最大耐受剂量。
1.6 急性毒性试验
随机将12只小鼠分为3组(每组4只):气道给予50μL PBS的对照组、气道给予50μL P12(500 nmol/L)的治疗剂量组以及气道给予50μL P12(2μmol/L)的大剂量组。在气道给予PBS或P12 24 h后,取小鼠的主要脏器及血液,测量小鼠的脏器系数,检测血常规、血生化,并确认组织病理变化,以判断P12是否有急性毒性。
1.6.1 血常规、血生化检测
3组小鼠经气道给予P12 24 h后,经心脏采血。将所得血液取0.l mL装于含乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝剂的微量离心管中用于血常规检测,余下约0.8 mL收集于不含抗凝剂的微量离心管中用于血生化检测。通过自动动物血液细胞分析仪(BC-2800Vet)检测含有EDTA抗凝剂的血液的全血细胞计数、分类计数信息。将不含抗凝剂的血液在3 500 r/min、4℃条件下离心10 min得到血清,并通过自动生化分析仪(西门子ADVIA240)检测血生化指标,包括血清中的谷丙转氨酶、谷草转氨酶、碱性磷酸酶、尿素、血肌酐、总蛋白、白蛋白、球蛋白、钠、钙、磷、钾的水平等。
1.6.2 肺组织病理切片制备和图像评价
3组小鼠经气道给予P12 24 h后进行安乐死,取小鼠的给药部位(气管)及胸腺、肺、心脏、肝、脾、肾、肾上腺等组织,置于4%多聚甲醛中浸泡固定,经组织脱水、透明和浸蜡后取出于包埋框内进行包埋,制备石蜡切片。再经过烤片、脱蜡、水化、苏木精-伊红染色、脱水、透明和封片后制备成病理切片。采用正置光学显微镜进行图像采集,由病理科医生对图像进行评价分析。
1.6.3 脏器系数测定
3组小鼠经气道给予P12 24 h后进行安乐死,取出肺、心脏、肝、脾和肾组织,在PBS中洗去表面血污,并在吸水纸上吸去表面水分后称量质量。用器官质量除以小鼠体质量即得到脏器系数。
1.7 统计学分析
采用GraphPad Prism 7统计学软件对试验数据进行分析,2组间比较采用t检验,2组以上组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 P12的理化特性表征
P12由一个直径为13 nm的裸金纳米粒子和覆盖在表面的短肽(序列为CLPFFD)涂层组成。与传统的纳米给药系统不同,P12是一种不携带任何治疗药物但具有生物活性的纳米粒子[7]。裸金纳米粒子和P12的透射电子显微镜图像显示二者具有相似的均匀球形结构,平均直径为(13.0±0.4)nm[如图2(a)所示]。采用动态光散射技术测定裸金纳米粒子和P12的水化粒径,结果显示,P12的水化粒径比裸金纳米粒子大3.4 nm,表明P12表面存在多肽偶联[如图2(b)所示]。
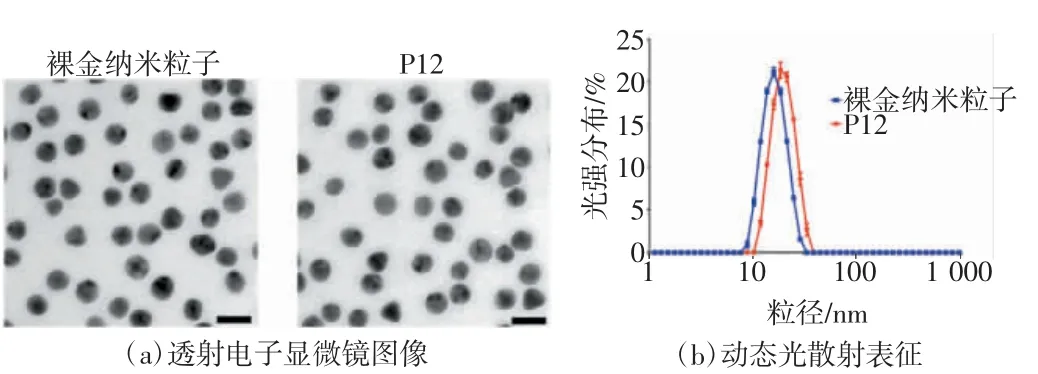
图2 P12的表征
2.2 小鼠气道给予P12后7 d的毒性试验
将125 nmol/L(50μL)作为气道给药的初始剂量,直至给药剂量(2μmol/L,50μL)到达治疗剂量(500 nmol/L,50μL)的4倍,也没有观察到小鼠体质量下降>15%,并且临床症状表现正常,包括自主活动、精神状态、毛色情况及给药部位的局部状态。由此可见,气道给予P12的最大耐受剂量高于治疗剂量。并且小鼠气道给药后7 d的体质量变化与给予P12的剂量无明显关系(如图3所示),表明P12在治疗剂量范围内没有明显毒副作用。
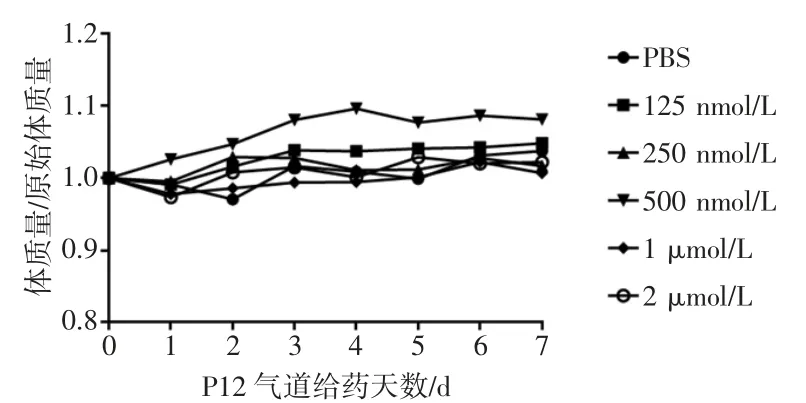
图3 剂量递增试验对小鼠体质量的影响结果
2.2.1 P12对小鼠的脏器系数及血常规的影响
3组小鼠经气道给药后的脏器系数及血常规分析结果见表1。与对照组小鼠相比,治疗剂量组和大剂量组小鼠在给药后24 h的主要器官(包括肺、心、肝、脾和肾)脏器系数均无显著变化。血常规分析结果表明,P12经气道给药后对小鼠红细胞数量、血红蛋白浓度、红细胞压积、白细胞数量、中性粒细胞百分比及单核细胞百分比等参数不产生影响。此外,治疗剂量组和大剂量组的淋巴细胞百分比[(74.88±1.79)%、(76.10±1.77)%]与对照组[(78.40±1.05)%]相比,虽有所下降,但3组的淋巴细胞百分比均在正常范围[(74.00±6.00)%]内[12]。
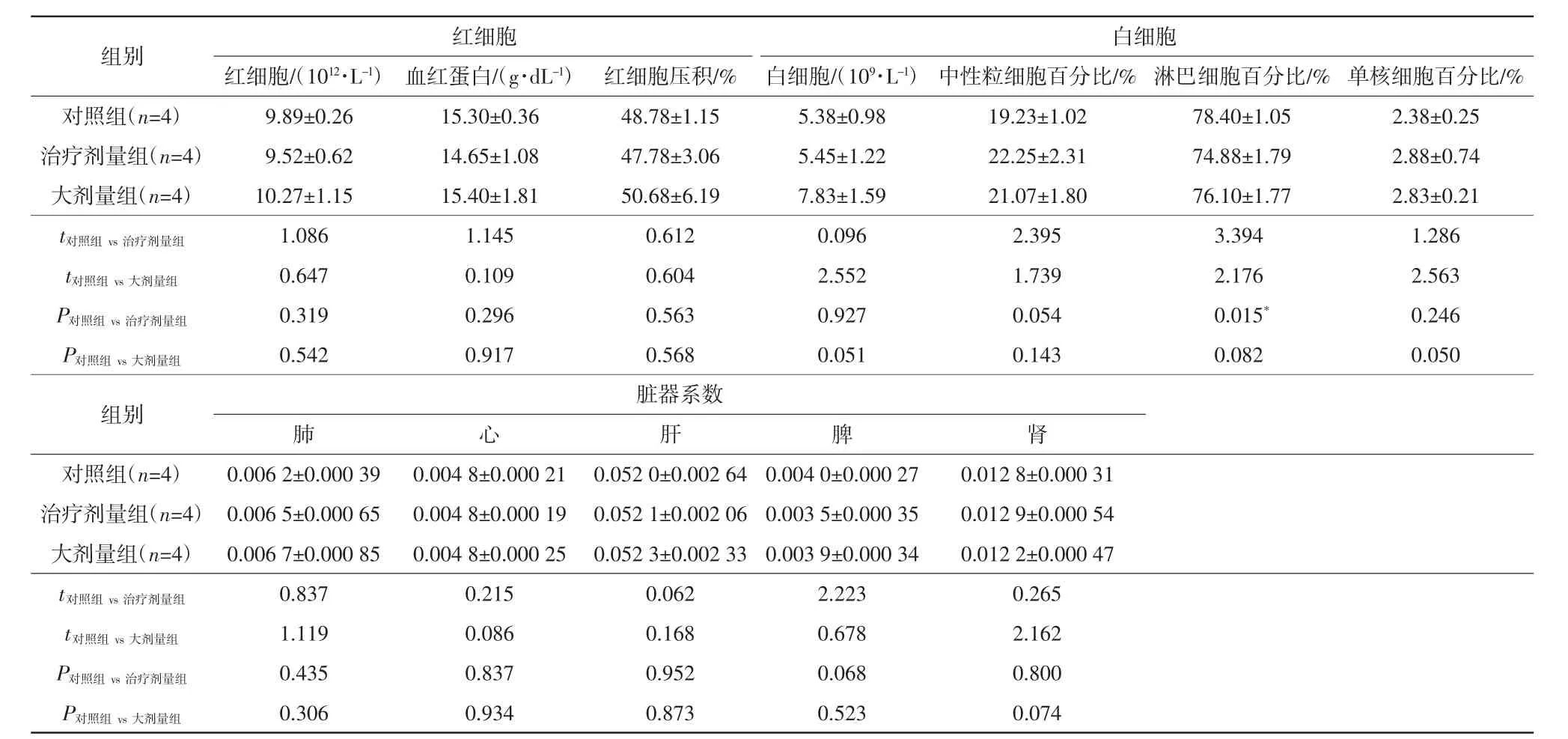
表1 3组经气道给药后的脏器系数及血常规分析结果
2.2.2 P12对小鼠血生化及组织病理的影响
血生化检验结果显示,治疗剂量组以及大剂量组的小鼠经气道给予P12后,血清蛋白、肝酶、血清无机离子和肾功能指标没有显著变化(见表2)。其中,总蛋白和球蛋白水平没有显著变化,谷丙转氨酶、谷草转氨酶、碱性磷酸酶水平也无显著改变,钠、钙、磷、钾浓度也无显著变化,尿素、血肌酐水平也没有显著变化。然而,大剂量组小鼠经气道给予P12后,白蛋白水平[(29.33±0.59)g/L)]与对照组[(31.25±1.01)g/L]相比有所下降,但是其值仍然在正常参考范围内[(28.90±2.47)g/L][13]。

表2 3组经气道给药后的血生化分析结果
另外,取小鼠的给药部位(气管)及胸腺、肺、心、肝、脾、肾、肾上腺等脏器组织进行病理学观察,发现3组小鼠经气道给药后并没有造成各个器官及给药部位的组织病理改变(如图4所示)。这些结果表明气道给予小鼠治疗剂量和大剂量的P12不会产生急性毒性。
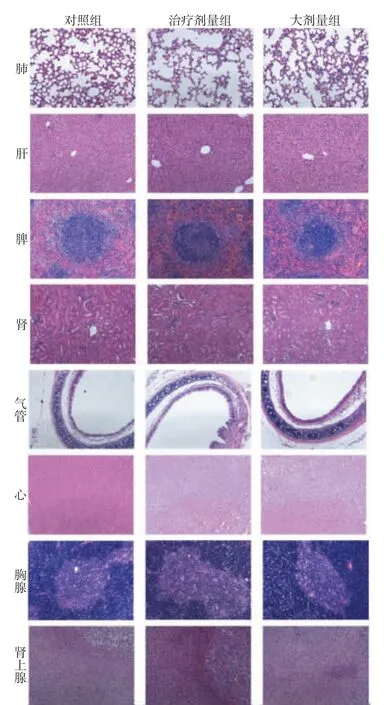
图4 3组小鼠经气道给药后的组织病理变化
3 讨论
纳米医学作为一个相对新的跨多学科研究领域发展迅猛[14-15]。金纳米粒子在疾病的治疗及诊断中具有强大的优势,其不但可作为药物递送的载体,用于递送小分子药物、DNA、RNA、小干扰RNA(small interfering RNA,siRNA)、蛋白质、多肽和抗体等[16],还可通过多肽修饰技术赋予其新的抗炎活性。近年来,金纳米粒子在治疗肺部疾病(肺癌、肺纤维化和急性肺损伤等)中展示出广阔的应用前景[14],其作为新型纳米药物主要包括以下3个方面的优势:一是毒性低,易于合成且具有高比表面积,可用于装载药物和活性分子;二是可通过调整粒径大小、形状、表面电荷和表面涂层等途径,使其具有新的生物活性;三是在组织中的浓度易被定量分析,便于对其进行定位,以获取其对组织和细胞的靶向性信息。
相较于金纳米粒子的合成表征与医学应用拓展方面的研究,在体内安全性及毒理学方面的研究目前相对较少[12]。随着金纳米粒子在医学领域中的广泛应用,该信息变得非常重要。在安全性方面,以往的研究结果好坏参半,这可能是由于功能化的金纳米粒子表面连接或装载不同的活性分子,使其具有高度多样性与异质性,进而表现出不同的安全性[16]。这些研究结果提示不同的金纳米粒子制剂可能具有其独特的生物活性、体内分布和被清除能力。因此,在临床研究前期,应采用小动物甚至大动物对其安全性进行测试[17]。
本研究对P12的表面电荷和粒径大小等理化性质进行表征,证实了P12的表面有多肽的偶联。目前,已有研究者开发出不同的多肽金纳米体系,赋予金纳米粒子抑制蛋白激酶C激活等不同的活性功能[16],本研究中合成的P12为多肽修饰金纳米粒子的应用提供了新的证据。在小鼠经气道给予P12的一周内,发现即使给药剂量高达治疗剂量的4倍也没有观察到小鼠体质量和临床症状(自主活动、精神状态、毛色变化及给药部位的局部状态等)的异常。一项通过大鼠尾静脉给予GNP-50PKCi[由裸金纳米粒子与蛋白激酶C抑制剂(PKCi)杂交合成]的安全性评估研究表明,GNP-50PKCi未对大鼠体质量变化和临床症状产生影响[16],与本研究结果相符。此外,本研究中在气道给予治疗剂量或大剂量P12 24 h后,发现小鼠的脏器系数(肺、心、肝、脾和肾)、血常规(红细胞/白细胞数量、血红蛋白浓度、红细胞压积等指标)、血生化(血清蛋白、血清无机离子、肝酶和肾功能指标)及组织病理(气管、胸腺、肺、心、肝、脾、肾和肾上腺)特征均表现正常,表明气道给予该剂量的P12不会产生急性毒性,具有较好的生物安全性。一项评估携带阳离子表面活性剂的金纳米粒子GNRs在小鼠体内外毒性的研究也与本研究的结果一致,该研究发现GNRs不会造成小鼠组织的病理变化,没有急性毒性作用,表现出良好的安全性[18]。而最近的一篇综述对过去12 a金纳米粒子在疾病动物模型的治疗及毒性作用进行了总结,发现其并没有经常出现严重的毒性或不良反应,仅有2项研究报道了其副作用[17]。
本研究与先前的研究相符,证明了多肽金纳米粒P12具有较好的体内安全性,为P12气道给药提供了系统的体内安全性信息,对未来抗炎纳米颗粒应用于急性肺损伤等肺部疾病的治疗具有重要的指导意义。但本研究也存在一些局限性以待完善:(1)采用小动物开展试验,小动物和人之间的差异可能会影响药物安全性的真实评估效果;(2)缺乏采用具有明确毒性的药物作为阳性对照。
