顺磁离子介导磁弛豫生物传感器评定鱼肉新鲜度
2022-10-31曹子岳董永贞彭雪雯范志勇俞晓平陈翊平
曹子岳,董永贞,彭雪雯,陈 瑞,江 丰,范志勇,俞晓平,陈翊平,
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.湖北省食品质量安全监督检验研究院,湖北 武汉 430074;3.中国计量大学生命科学学院,浙江 杭州 310018)
鱼肉含有丰富的蛋白质、不饱和脂肪酸、微量元素等营养物质,受到消费者的普遍喜爱。但鱼肉在加工贮存过程中,会发生一系列的化学、物理和生物变化(例如糖酵解、蛋白质水解和脂肪降解),导致其腐败变质,营养价值降低,甚至产生有毒物质,威胁人体健康。其中,鱼肌肉中三磷酸腺苷的降解为主要的反应之一,其发生顺序如下:三磷酸腺苷→二磷酸腺苷→单磷酸腺苷→单磷酸肌苷→肌苷→次黄嘌呤→黄嘌呤→尿酸。在此反应中,次黄嘌呤是主要的分解产物,在鱼被宰杀后会立即积累,并被黄嘌呤氧化酶(xanthine oxidase,XOD)催化分解生成黄嘌呤和尿酸。研究表明,当鱼肉中的次黄嘌呤含量超过102 mg/kg时,鱼肉初步腐败;当鱼肉中的次黄嘌呤含量超过144 mg/kg时,鱼肉完全腐败。此外,在鱼类及其产品生产、运输和贮存过程中,组胺通常也是质量监控的生物标志物之一,若人体摄入过量的组胺将引发特定的生理毒害作用,如运动神经元损伤、心脏损害等。欧盟颁布的标准法规中规定鱼和鱼产品中组胺的限量为100 mg/kg。因此,针对次黄嘌呤和组胺进行快速分析,对评定鱼肉新鲜度和鱼产品品质以及保障人体健康具有重要意义。
目前,次黄嘌呤和组胺的检测方法主要包括传统方法和生物传感器法。传统方法例如薄层色谱法、毛细管电泳法和高效液相色谱法。其中薄层色谱法操作方便、设备简单,但灵敏度较低;毛细管电泳法灵敏度高、成本低,但稳定性和重现性较差;高效液相色谱法灵敏度高、准确性好,但需要复杂的前处理步骤和昂贵的仪器设备,限制了它们的进一步应用。生物传感器法是一种较为新颖的检测方法。研究人员已经开发了一系列生物传感器检测次黄嘌呤和组胺,例如比色生物传感器、电化学生物传感器等。但这些生物传感器大多仍受限于灵敏度低、成本高、操作流程复杂等因素,难以应用到次黄嘌呤和组胺的快速检测中。
磁弛豫生物传感器是一种新型的生物传感器,通过纳米磁颗粒或顺磁离子改变水分子的弛豫行为,以弛豫时间作为信号对目标物质进行定量分析。如图1A所示,Mn(II)具有多个不成对轨道电子(1s2s2p3s3p3d,5 个未成对轨道电子),由于电子偶极子与质子偶极子的相互作用,改变水分子的弛豫行为,具有较长的电子自旋共振(electron spin resonance,ESR)信号,磁信号更强,横向弛豫时间(transverse relaxation time,)更短,而Mn(VII)无未成对轨道电子(1s2s2p3s3p3d),因此具有较短的ESR信号,磁信号可忽略,更长;与之类似,Fe(II)具有较少的未成对轨道电子(1s2s2p3s3p3d,4 个未成对轨道电子),具有较短的ESR信号,磁信号弱,值高,而Fe(III)具有较多的未成对轨道电子(1s2s2p3s3p3d,5 个未成对轨道电子),具有较长的ESR信号,磁信号强,值低。因此,可通过Mn(VII)/Mn(II)和Fe(III)/Fe(II)的价态转换,实现生物传感信号的读出。
次黄嘌呤和组胺分别能被XOD 和二胺氧化酶(diamine oxidase,DAO)催化分解产生过氧化氢(如式(1)~(3))。本研究通过利用HO的还原性和氧化性,诱导不同价态顺磁离子(Mn(VII)/Mn(II)和Fe(II)/Fe(III))的转化(式(4)、(5)),使磁信号发生变化,进而改变周围水分子的值,以实现次黄嘌呤和组胺的定量分析。建立的磁弛豫生物传感器的测定原理如式(1)~(5)和图1所示。

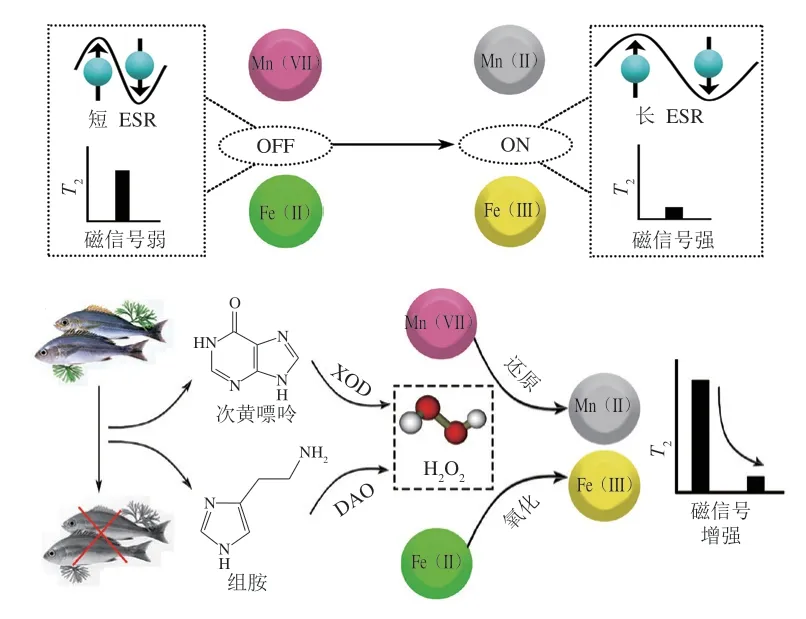
图1 顺磁离子介导的磁弛豫生物传感器的构建原理图Fig.1 Schematic diagram of the construction of paramagnetic ionsmediated magnetic relaxation switching biosensor
1 材料与方法
1.1 材料与试剂
从当地市场购买鲫鱼作为实际样品,收集鱼肉并用绞肉机绞碎后保存于-20 ℃备用。
次黄嘌呤、XOD 上海源叶生物科技有限公司;组胺上海麦克林生化科技有限公司;DAO 上海鼓臣生物技术有限公司;HO溶液(质量分数30%)、高锰酸钾、四水合二氯化锰、七水合硫酸亚铁、六水合氯化铁、NaOH、三氯乙酸、HSO溶液(质量分数98%)、HCl溶液(质量分数36.0%~38.0%)(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
0.47 T低场核磁共振(low field-nuclear magnetic resonance,LF-NMR)仪 上海纽迈电子科技有限公司;D-37520离心机 美国贝克曼公司;ME104E电子分析天平 梅特勒-托利多国际贸易(上海)有限公司。
1.3 方法
1.3.1 顺磁离子溶液的值测定
用去离子水制备梯度浓度的M n(VII)、Mn(II)溶液(1.95、3.9、7.81、15.63、31.25、62.5、125、250、500、1 000 µmol/L)和Fe(III)、Fe(II)溶液(156.3、312.5、625、1 250、2 500、5 000、10 000 µmol/L),去离子水作为空白对照。用LF-NMR仪对制备好的顺磁离子溶液进行的测定,用CPMG脉冲序列进行的测定,参数如下:NMR频率19.00 MHz;重复采样等待时间5 000 ms;回波时间1 ms;前置放大增益3;回波个数18 000;采样频率100 kHz。计算值的变化值:Δ=去离子水-顺磁离子溶液。
1.3.2 顺磁离子溶液浓度的优化
将200 μL不同浓度的KMnO溶液(0.2、0.5、1.0 mmol/L)分别加入到200 µL梯度浓度的HO溶液(0、20、50、100、200、500、1 000 µmol/L)和100 µL 0.1 mol/L HSO溶液的混合溶液中,室温下静置反应5 min,对反应后溶液进行的测定。
将200 µL不同浓度FeSO溶液(1、2、5 mmol/L)分别加入到200 µL梯度浓度的HO溶液(0、0.1、0.2、0.5、1 mmol/L)和100 µL 0.2 mol/L HCl溶液的混合溶液中,室温下静置反应5 min,进行氧化还原反应,对反应后溶液进行的测定。
1.3.3 顺磁离子介导系统对HO的响应测定
将200 μL梯度浓度的HO溶液(0、1.95、3.9、7.81、15.63、31.25、62.5、125、250、500、1 000、2 500 µmol/L)分别加入到200 µL 0.5 mmol/L KMnO溶液和100 µL 0.1 mol/L HSO溶液的混合溶液中,室温下静置反应5 min,对反应后溶液进行的测定。
将200 µL梯度浓度的HO溶液(0、10、20、50、100、200、500、1 000 µmol/L)分别加入到200 µL 2 mmol/L FeSO溶液和100 µL 0.2 mol/L HCl溶液的混合溶液中,在室温下静置反应5 min,进行氧化还原反应,对反应后溶液进行的测定。
1.3.4 顺磁离子介导磁弛豫生物传感器检测次黄嘌呤和组胺的可性行测定
将100 µL 0.5 mg/mL DAO加入到200 µL 0.5 mmol/L KMnO溶液和100 µL 0.1 mol/L HSO溶液的混合溶液中进行氧化还原反应。
将100 µL 1.05 mmol/L次黄嘌呤溶液与100 µL 1 mg/mL XOD混合均匀,在37 ℃下酶催化反应30 min。反应后,在上述反应溶液中加入200 µL 0.5 mmol/L KMnO溶液和100 µL 0.1 mol/L HSO溶液的混合液中,室温下反应5 min,反应后测定其值。
将100 µL 1 mmol/L组胺溶液与100 µL 2 mg/mL DAO混合均匀,在37 ℃下酶催化反应60 min。反应后,在上述反应溶液中加入200 µL 2 mmol/L FeSO溶液和100 µL 0.2 mol/L HCl溶液的混合液中,室温下反应5 min,反应后测定其值。
1.3.5 最优XOD与DAO质量浓度的测定
将100 µL不同质量浓度的XOD(0.1、1、2、5 mg/mL)与100 µL 1.05 mmol/L次黄嘌呤溶液混合均匀,在37 ℃下酶催化反应30 min。反应后,在上述反应溶液中加入200 µL 0.5 mmol/L KMnO溶液和100 µL 0.1 mol/L HSO溶液的混合液,室温下反应5 min,反应后测定其值。
将100 µL不同质量浓度的DAO(1、2、5、10 mg/mL)与100 µL 1 mmol/L组胺溶液混合均匀,并在37 ℃下酶催化反应60 min。反应后,在上述反应溶液中加入200 µL 2 mmol/L FeSO溶液和100 µL 0.2 mol/L HCl溶液的混合液,室温下反应5 min,反应后测定其值。
1.3.6 Mn(VII)/Mn(II)介导磁弛豫生物传感器检测次黄嘌呤
将100 µL梯度浓度的次黄嘌呤溶液(0、0.105、0.525、1.05、5.25、10.5、26.3、52.5、105、263、394、525、630、1 050 µmol/L)与100 µL最优质量浓度的XOD混合均匀,在37 ℃下酶催化反应30 min。反应后,在上述反应溶液中加入200 µL最优浓度的KMnO溶液和100 µL 0.1 mol/L HSO溶液的混合液,室温下反应5 min,反应后测定其值。0 µmol/L次黄嘌呤溶液为空白样品。
1.3.7 Fe(III)/Fe(II)介导磁弛豫生物传感器检测组胺
将100 µL梯度浓度的组胺溶液(0、1、2、5、10、20、50、100、200、500、1 000 µmol/L)与100 µL 最优质量浓度的DAO混合均匀,在37 ℃下酶催化反应60 min。反应后,在上述反应溶液中加入200 µL最优浓度的FeSO溶液和100 µL 0.2 mol/L HCl溶液的混合液,室温下反应5 min,反应后测定其值。0 µmol/L组胺溶液为空白样品。
1.3.8 顺磁离子介导磁弛豫生物传感器的特异性测试
在最优条件下,对Mn(VII)/Mn(II)介导磁弛豫生物传感器检测次黄嘌呤的特异性进行测试,使用263 µmol/L次黄嘌呤、500 µmol/L葡萄糖、150 µmol/L尿酸、25 µmol/L乳酸、25 µmol/L抗坏血酸混合溶液作为测试溶液。测试步骤和反应条件与1.3.6节一致。
在最优条件下,对Fe(III)/Fe(II)介导磁弛豫生物传感器检测组胺的特异性进行测试,使用100 µmol/L组胺、500 µmol/L葡萄糖、263 µmol/L次黄嘌呤、25 µmol/L乳酸、25 µmol/L抗坏血酸混合溶液作为测试溶液。测试步骤和反应条件与1.3.7节一致。
1.3.9 顺磁离子介导磁弛豫生物传感器的实际样品测试
1.3.9.1 加标回收率测试
向鲫鱼样品中分别加入不同浓度次黄嘌呤标准品(80、250、750 µmol/L)和10 mL 1 mol/L三氯乙酸溶液,超声15 min,在10 000 r/min下离心10 min,收集上清液。用1 mol/L NaOH溶液调节上清液至pH 6.5得到待测液,取100 µL待测液用Mn(VII)/Mn(II)介导磁弛豫生物传感器在最优条件下进行检测,测试步骤和反应条件与1.3.6节一致。
向鲫鱼样品中加入不同浓度组胺标准品(10、200、1 000 µmol/L),加入45 mL去离子水,超声15 min,在10 000 r/min下离心10 min,收集上清液为待测液。取100 µL待测液用Fe(III)/Fe(II)介导磁弛豫生物传感器最优条件下进行检测,测试步骤和反应条件与1.3.7节一致。
1.3.9.2 鲫鱼样品中次黄嘌呤的测定
将鲫鱼样品在25 ℃下分别贮藏0、1、3、6、10、20 h。分别取5 g不同贮藏时间的鱼肉样品于离心管中,加入10 mL 1 mol/L三氯乙酸,超声15 min,在10 000 r/min下离心10 min,收集上清液。用1 mol/L NaOH溶液调节上清液至pH 6.5得到待测液,取100 µL待测液用Mn(VII)/Mn(II)介导磁弛豫生物传感器在最优条件下进行检测,测试步骤和反应条件与1.3.6节一致。为保证磁弛豫生物传感器的准确性,使用葛倩倩报道的高效液相色谱(high performance liquid chromatography,HPLC)法确定鲫鱼样品中的次黄嘌呤含量。
1.3.9.3 鲫鱼样品中组胺的测定
取5 g 1.3.9.2节中不同贮藏时间的鲫鱼样品于离心管中,加入45 mL去离子水,超声15 min,在10 000 r/min下离心10 min,收集上清液为待测液。取100 µL待测液用Fe(III)/Fe(II)介导磁弛豫生物传感器在最优条件下进行检测,测试步骤和反应条件与1.3.7节一致。为保证磁弛豫生物传感器的准确性,使用郭慧等报道的HPLC法确定鲫鱼样品中的组胺含量。
1.3.9.4 顺磁离子介导的磁弛豫生物传感器用于指导鱼肉贮藏方式
采用常规包装4 ℃贮藏、真空包装25 ℃贮藏、真空包装4 ℃贮藏3 种方式对鱼肉样品进行处理并贮藏20 h,贮藏完成后使用1.3.9.2节和1.3.9.3节步骤分别对不同贮藏方式鱼肉样品中的次黄嘌呤和组胺进行检测。
1.4 数据处理
实验均重复3 次,数据由Origin 2018软件处理并绘图。
2 结果与分析
2.1 顺磁离子磁信号的分析
为验证磁弛豫信号读出系统的可用性,首先对Mn(VII)、Mn(II)、Fe(III)和Fe(II)溶液的值进行比较。如图2A所示,Mn(VII)的Δ值可以忽略不计,磁信号接近于水,而Mn(II)具有很强的磁信号,两者转换产生的传感信号是一种从无到有的过程。如图2B所示,相同浓度下,Fe(III)具有更强的磁信号,且两者磁信号差异明显,两者转换产生的传感信号是一种从弱到强的过程。因此,Mn(VII)/Mn(II)和Fe(III)/Fe(II)的价态转换可用于开发磁弛豫生物传感器的读出系统,用于氧化还原底物如HO的定量分析。
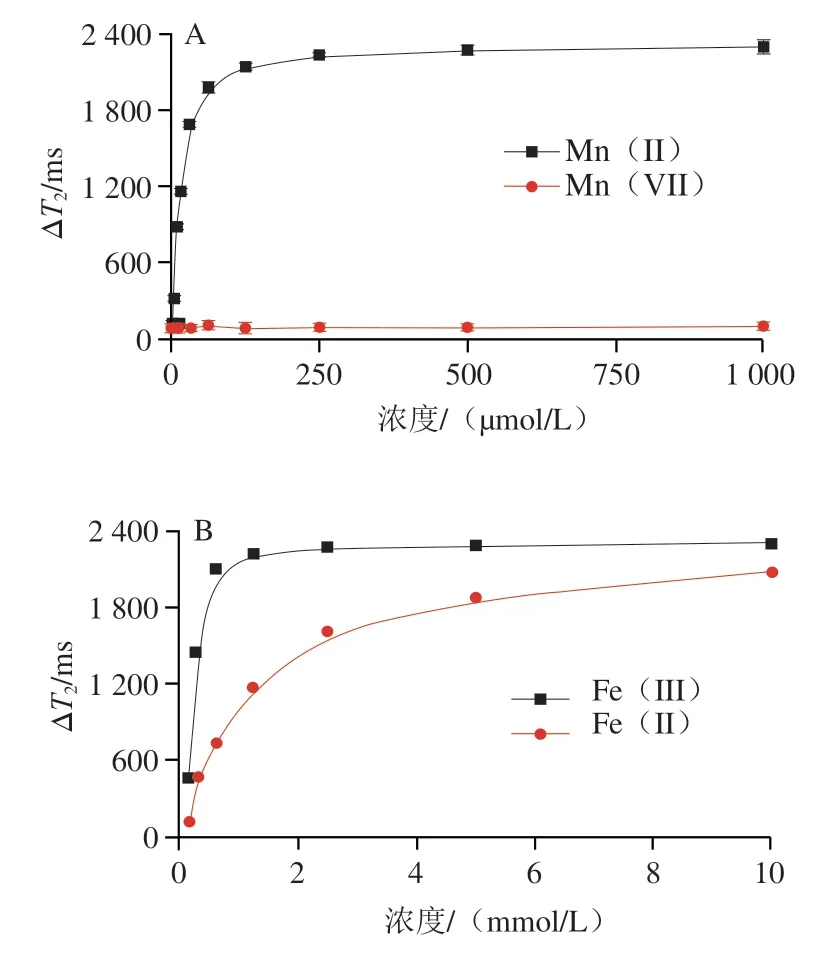
图2 Mn(VII)/Mn(II)(A)和Fe(II)/Fe(III)(B)的T2信号测定值Fig.2 T2 signals of Mn (VII)/Mn (II) (A) and Fe (II)/Fe (III) (B)
2.2 顺磁离子介导磁弛豫生物传感信号读出系统的构建
2.2.1 顺磁离子溶液浓度的优化
以HO诱导的顺磁离子价态转化作为磁弛豫生物传感器的信号读出系统,研究不同的Mn(VII)和Fe(II)浓度下,顺磁离子系统对HO的响应性能。如图3A所示,在HO浓度较低时,0.2 mmol/L Mn(VII)溶液与0.5 mmol/L Mn(VII)溶液具有相近的Δ值;在HO浓度较高时,0.2 mmol/L Mn(VII)溶液的响应趋于平缓;当Mn(VII)浓度为1.0 mmol/L时,对HO的响应强度低。当Mn(VII)浓度为0.5 mmol/L时,具有更好的响应性能和趋势。因此,选择0.5 mmol/L的Mn(VII)浓度用于后续实验。如图3B所示,当Fe(II)浓度为1 mmol/L时,在HO浓度大于0.5 mmol/L后,Δ值不再改变;当Fe(II)浓度为5 mmol/L时,对HO响应强度变化较小。因此,选择2 mmol/L的Fe(II)浓度用于后续实验。
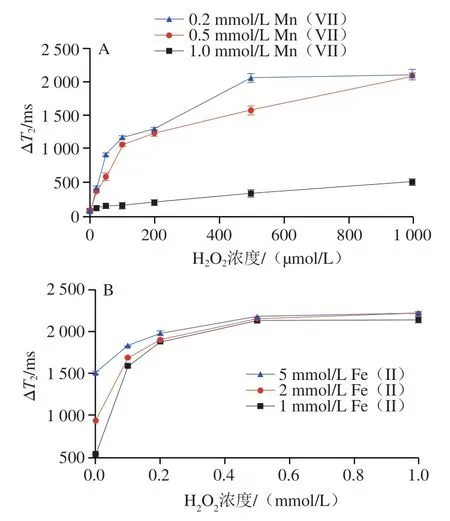
图3 不同浓度Mn(VII)(A)和Fe(II)(B)对H2O2的响应性能Fig.3 Response performance to H2O2 of different concentrations of Mn (VII) (A) and Fe (II) (B)
2.2.2 Mn(VII)/Mn(II)和Fe(III)/Fe(II)介导的系统对HO的响应分析
在最优Mn(VII)和Fe(II)浓度下,构建顺磁离子介导的磁弛豫生物传感信号读出系统。如图4A、C所示,随着HO浓度的增加,Mn(VII)/Mn(II)和Fe(II)/Fe(III)系统的Δ值均逐渐增强,表明有更多的Mn(VII)被还原为Mn(II),更多的Fe(II)被氧化为Fe(III)。以HO浓度的对数为横坐标(lg),建立标准曲线,分析其线性关系和方法的检出限(limit of detection,LOD)(LOD由空白样品标准偏差(standard deviation,SD)的3 倍与标准曲线在低浓度范围斜率()的比得到)。如图4B所示,Mn(VII)/Mn(II)系统的线性范围为7.81~1 000 µmol/L(=841.22-466.08),线性相关系数()为0.99,LOD为0.8 µmol/L(SD为6.97,为26.2)。如图4D所示,Fe(II)/Fe(III)系统的线性范围为10~1 000 µmol/L(=615.4+434.16),为0.994,LOD为1.42 µmol/L(SD为5.2,为10.98)。这些结果表明Mn(VII)/Mn(II)和Fe(II)/Fe(III)系统均对HO具有良好的响应,证明顺磁离子价态转化介导的磁弛豫信号读出系统具有可行性。

图4 Mn(VII)/Mn(II)(A、B)和Fe(II)/Fe(III)(C、D)介导磁弛豫信号读出系统H2O2响应性能Fig.4 Response performance to H2O2 of Mn (VII)/Mn (II) (A and B)and Fe (II)/Fe (III) (C and D)-mediated readout systems for magnetic relaxation signals
2.3 顺磁离子介导磁弛豫生物传感器的构建
2.3.1 顺磁离子介导磁弛豫生物传感器检测次黄嘌呤和组胺的可性行分析
如图5A所示,DAO能够直接将Mn(VII)还原为Mn(II),磁信号变化明显,因此选用Fe(II)/Fe(III)系统对组胺进行检测。如图5B、C所示,反应液的磁信号发生明显变化,说明在此酶催化条件下(100 µL 1.05 mmol/L次黄嘌呤溶液中加入100 µL 1 mg/mL XOD;100 µL 1 mmol/L组胺溶液中加入100 µL 2 mg/mL DAO),反应体系能够产生HO并使顺磁离子价态发生转化,证明顺磁离子介导磁弛豫生物传感器用于检测次黄嘌呤和组胺具有可行性。

图5 DAO对Mn(VII)/Mn(II)系统的影响(A)与Mn(VII)/Mn(II)(B)和Fe(II)/Fe(III)(C)介导磁弛豫生物传感器检测次黄嘌呤和组胺的可行性验证Fig.5 Effect of DAO on the Mn (VII)/Mn (II) system (A) and feasibility of Mn (VII)/Mn (II) (B) and Fe (II)/Fe (III) (C)-mediated magnetic relaxation switching biosensor for the detection of hypoxanthine and histamine
2.3.2 酶质量浓度的优化
为了提高顺磁离子介导磁弛豫生物传感器的分析性能,对XOD和DAO的用量进行优化。由图6A可知,当XOD的质量浓度高于1 mg/mL时,Δ值相近,表明1 mg/mL XOD可以完全催化100 µL 1.05 mmol/L次黄嘌呤。因此,选择1 mg/mL XOD用于后续实验。由图6B可知,当DAO的质量浓度高于2 mg/mL时,Δ值相近,表明2 mg/mL DAO可以完全催化100 µL 1 mmol/L组胺。因此,选择2 mg/mL的DAO用于后续实验。

图6 XOD(A)和DAO(B)质量浓度的优化Fig.6 Optimization of XOD (A) and DAO (B) concentrations
2.3.3 Mn(VII)/Mn(II)和Fe(III)/Fe(II)介导磁弛豫生物传感器检测次黄嘌呤和组胺分析
在最优条件下,对梯度浓度的次黄嘌呤和组胺进行测定。如图7A、C所示,随着目标物质(次黄嘌呤和组胺)浓度的增大,Δ值均逐渐增强。以次黄嘌呤或组胺浓度的对数为横坐标,建立标准曲线。由图7B可知,Mn(VII)/Mn(II)介导磁弛豫传感器检测次黄嘌呤的线性范围是0.525~1 050 µmol/L,线性回归方程=473.77+762.38,为0.996,LOD为0.17 μmol/L(SD为23.36,为420.69)。由图7D可知,Fe(II)/Fe(III)介导磁弛豫传感器检测组胺的线性范围是5~1 000 µmol/L,线性回归方程=187.93+838.86,为0.992,LOD为2.34 µmol/L(SD为8.32,为10.68)。这些结果表明,顺磁离子介导磁弛豫生物传感器能够实现次黄嘌呤和组胺的定量分析,并且检测范围宽,灵敏度高,可进一步用于鱼肉新鲜度的评价。
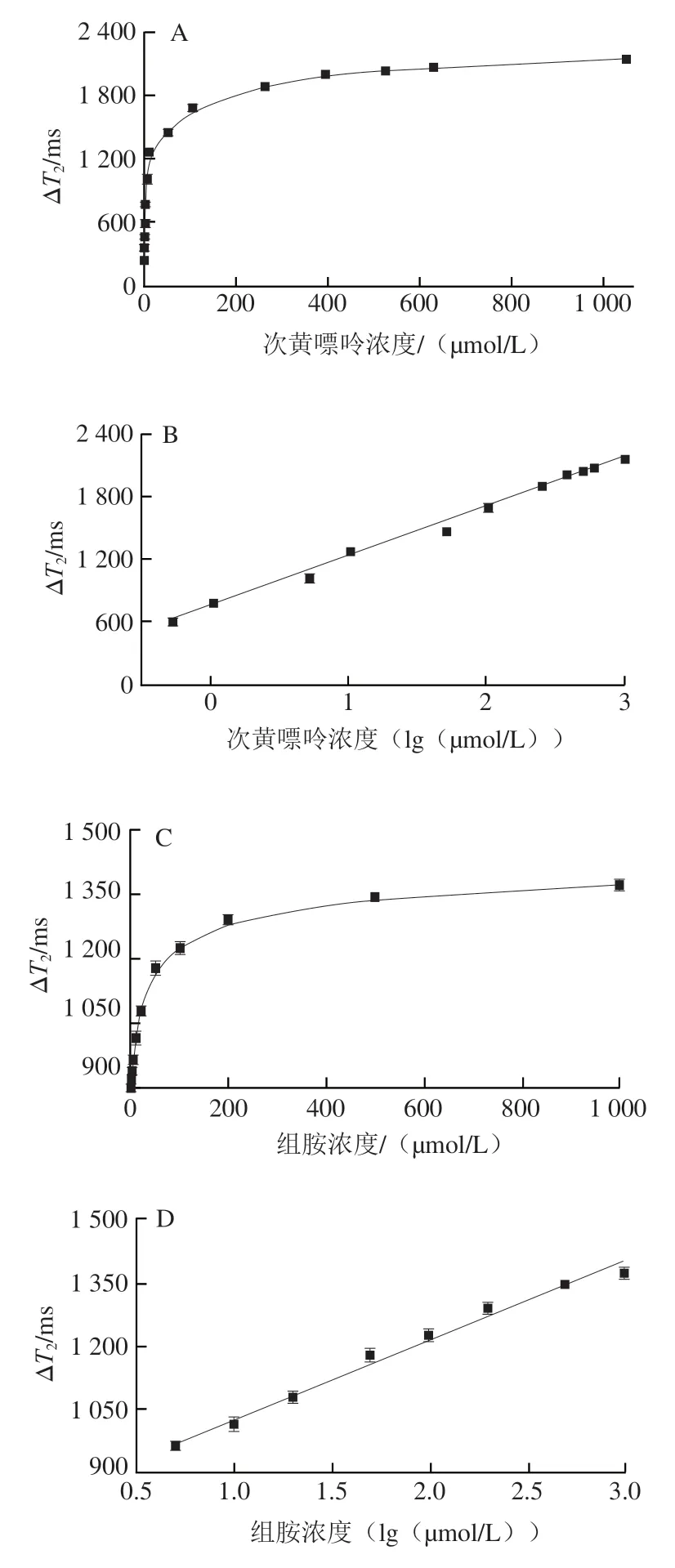
图7 Mn(VII)/Mn(II)(A、B)和Fe(II)/Fe(III)(C、D)介导磁弛豫传感器检测次黄嘌呤和组胺的性能Fig.7 Detection performance of Mn (VII)/Mn (II) (A and B) and Fe (II)/Fe (III) (C and D)-mediated magnetic relaxation sensor for hypoxanthine and histamine
2.4 顺磁离子介导的磁弛豫生物传感器的特异性和准确性
鱼肉基质复杂,能够在一定程度上影响检测方法的特异性和准确性。通过向鱼肉样品中分别添加不同浓度的干扰物质研究磁弛豫生物传感器检测次黄嘌呤和组胺的特异性。如图8A、B所示,仅次黄嘌呤或组胺存在时,反应液具有较高的Δ值且响应明显,因此该顺磁离子介导的磁弛豫生物传感器检测次黄嘌呤或组胺的特异性良好。

图8 Mn(VII)/Mn(II)(A)和Fe(II)/Fe(III)(B)介导的磁弛豫生物传感器检测次黄嘌呤和组胺的特异性Fig.8 Specificity of Mn (VII)/Mn (II) (A) and F (II)/Fe (III) (B)-mediated magnetic relaxation switching biosensor for the detection of hypoxanthine and histamine
对方法的加标回收率进行考察如表1 所示,Mn(VII)/Mn(II)介导的磁弛豫传感器对次黄嘌呤的回收率为76.26%~102.7 6%,变异系数为7.32%~10.15%;Fe(II)/Fe(III)介导的磁弛豫传感器对组胺的回收率为70.73%~90.42%,变异系数为8.01%~13.36%,证明本方法具有良好的准确性。
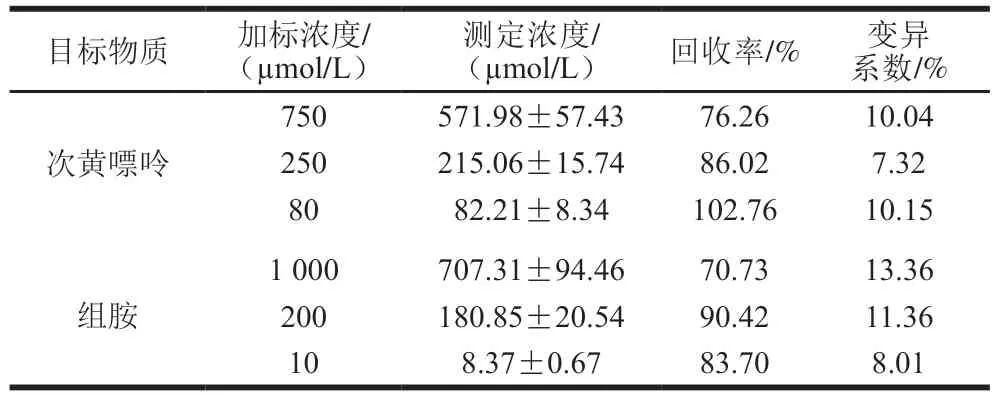
表1 Mn(VII)/Mn(II)和Fe(II)/Fe(III)介导的磁弛豫生物传感器检测鱼肉样品中次黄嘌呤和组胺的回收率(n=3)Table 1 Recoveries of Mn (VII)/Mn (II) and Fe (II)/Fe (III)-mediated magnetic relaxation switching biosensor for hypoxanthine and histamine in spiked fish samples (n=3)
如表2所示,与其他方法相比,本研究提出的方法对次黄嘌呤的检测具有最低的LOD,且线性范围宽于绝大多数方法;对组胺的检测具有较低的LOD和较宽的线性范围。虽然一些光学和电化学传感器的LOD更低,但本研究建立的生物传感器相较于光学传感器,线性范围不分段且明显宽于电化学传感器,因此在实际应用中具有更好的潜力。

表2 顺磁离子介导磁弛豫生物传感器检测次黄嘌呤和组胺与其他方法的对比Table 2 Comparison of paramagnetic ions-mediated magnetic relaxation switching biosensor with other reported methods for the detection of hypoxanthine and histamine
2.5 顺磁离子介导磁弛豫生物传感器的鲫鱼样品测试分析
将鲫鱼样品在室温条件下分别贮藏不同时间后,用所构建的传感器进行检测,并与HPLC进行比对。如图9所示,贮藏10 h后,从鱼肉样品中Mn(VII)/Mn(II)介导磁弛豫生物传感器检测到的次黄嘌呤超过375 µmol/L(102 mg/kg),组胺均超过100 µmol/L(100 mg/kg),这意味着在室温下存储,次黄嘌呤和组胺持续产生,导致鱼肉开始变质。在贮藏20 h后,Mn(VII)/Mn(II)介导的磁弛豫生物传感器检测到的次黄嘌呤超过529 µmol/L(144 mg/kg),表明鱼肉已经完全变质。此外,本研究所构建的顺磁离子介导的磁弛豫生物传感器与HPLC检测结果具有良好的一致性,表明本方法具有良好的准确性和实际应用潜力。
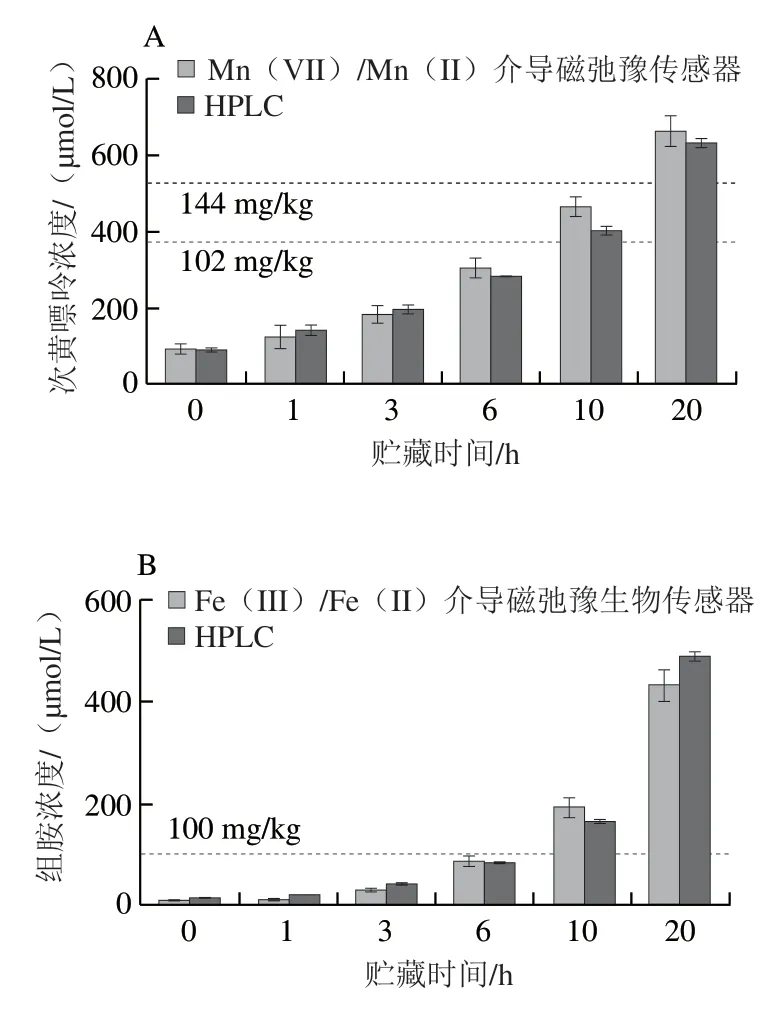
图9 顺磁离子介导的磁弛豫生物传感器和HPLC检测鱼肉样品中的次黄嘌呤(A)和组胺(B)Fig.9 Results of paramagnetic ions-mediated magnetic relaxation switching biosensor and HPLC for hypoxanthine (A) and histamine (B)in fish samples
2.6 顺磁离子介导磁弛豫生物传感器检测不同贮藏方式下鱼肉品质的变化
如图10所示,在25 ℃真空包装贮藏20 h后,鱼肉中次黄嘌呤的含量超过了102 mg/kg(开始变质),组胺含量未超过100 mg/kg,这表明真空包装可以有效地控制鱼的质量,原因可能是真空包装可以降低氧气浓度,从而减弱了三磷酸腺苷的降解速度和微生物的作用。而4 ℃常规包装贮藏时,次黄嘌呤和组胺含量均未超标。进一步研究4 ℃真空包装贮藏对鱼肉的保鲜效果,发现贮藏20 h后,次黄嘌呤与组胺含量低于4 ℃常规包装贮藏。因此,4 ℃真空包装是一种有效保证鱼肉品质的方式。
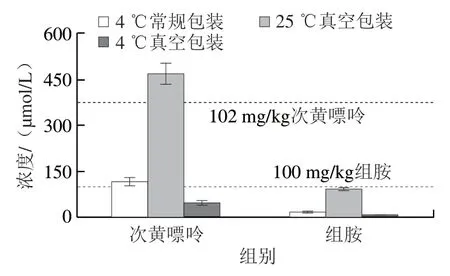
图10 顺磁离子介导磁弛豫生物传感器检测不同贮藏方式下鱼肉样品中次黄嘌呤和组胺的变化Fig.10 Changes in hypoxanthine and histamine contents in fish samples during storage under different conditions as detected by paramagnetic ions-mediated magnetic relaxation switching biosensor
3 结论
构建一种顺磁离子价态转换介导的磁弛豫生物传感器,通过酶催化反应产生HO实现生物信号的转化,进而结合氧化还原反应实现顺磁离子的价态转换,最终实现磁弛豫信号的高效读出。本方法实现了鱼肉中次黄嘌呤(LOD为0.17 µmol/L)和组胺(LOD为2.34 µmol/L)的高灵敏快速检测,线性范围分别为0.525~1 050 µmol/L和5~1 000 µmol/L,且与HPCL检测结果一致,可用于鱼肉品质的高效评价。与传统的HPLC分析相比,本研究所构建的顺磁离子介导的磁弛豫生物传感器不需要精密昂贵的仪器和专业的检测人员,所用设备简单,极大简化了次黄嘌呤和组胺的检测过程和检测费用,在鱼肉品质评定方面具有良好的应用潜力。
