超声预处理对花生分离蛋白微凝胶颗粒结构及其Pickering乳液特性的影响
2022-10-31葛艳争石爱民任广跃李嗣生职兰懿杜祖波
葛艳争,石爱民,任广跃 ,刘 哲,李嗣生,职兰懿,王 强,,杜祖波
(1.河南科技大学食品与生物工程学院,河南 洛阳 471000;2.中国农业科学院农产品加工研究所,农业农村部农产品加工综合性重点实验室,北京 100193;3.山东鲁花集团有限公司,山东 莱阳 265200)
食品级Pickering乳液是用天然食品大分子固体颗粒(蛋白质、多糖等食品级颗粒)对油水界面稳定制备的一种新型乳液。与传统乳液相比,Pickering乳液具有较高的稳定性,不易受外界环境因素的影响,且生产成本低、环境友好。因此,由食品级颗粒稳定的Pickering乳液的开发在食品和医药等研究领域有广泛应用前景。
大豆蛋白、玉米醇溶蛋白、乳清蛋白、大米蛋白、豌豆蛋白等均可有效地稳定Pickering乳液体系。近年来,由于花生蛋白来源丰富、具有优异的营养价值,且对人体健康的有益影响,已被运用在食品配方中。花生分离蛋白(peanut protein isolate,PPI)是最具有商业价值的花生蛋白产品,并且PPI具有优异的乳化性、凝胶性、持水性等多种功能特性,具有发展为Pickering乳液稳定剂的潜力。
目前,制备食品级固体颗粒的方法主要采用复合改性法,分别有加热复合离子诱导法、加热复合酶法、超声复合水解法等。Ning Fangjian等通过加热和盐离子双重诱导法制备了具有较好润湿性的PPI纳米颗粒,并用其稳定了O/W型Pickering乳液。Jiao Bo等利用加热复合酶法制备PPI纳米颗粒,并用其稳定了高内相Pickering乳液。Zhang Xinxia等采用超声预处理复合酸水解大米蛋白的方法,制备了一种球形结构的大米肽纳米颗粒,证实超声可以显著减小固体颗粒的粒径。超声处理具有效率高、操作简单、无需化学处理更绿色且更适合于食品加工等优势,且有研究表明超声预处理可以改变蛋白质的二级结构,使其三级结构变的舒展,暴露更多的疏水性残基,有利于酶交联反应的进行。
因此,本研究以PPI为原料,利用超声预处理,随后经过谷氨酰胺转氨(glutamine transaminase,TG)酶交联得到PPI凝胶进行高速剪切和高压均质制备花生分离蛋白微凝胶颗粒(peanut protein isolate microgel particles,PPIMP),构建Pickering乳液体系,并对PPIMP的相关性质及其稳定的Pickering乳液特性进行研究,以期为Pickering乳液在食品工业中的应用提供理论依据和技术支撑。
1 材料与方法
1.1 材料与试剂
花生蛋白粉(蛋白质量分数(47.22±0.06)%、油脂质量分数(5.27%±0.06)%、灰分质量分数(4.97±0.03)%) 青岛长寿食品有限责任公司;葵花籽油 佳格食品(中国)有限公司;TG 酶北京索莱宝科技有限公司;氢氧化钠 国药集团化学试剂有限公司;8-苯胺-1-萘磺酸(1-anilino-8-naphtaalenesulfonate,ANS) 北京百灵威科技有限公司;尼罗红、尼罗蓝 美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
KQ-500DE型数控超声波清洗器 昆山市超声仪器有限公司;DHR-2流变仪 美国TA仪器公司;激光共聚焦显微镜 德国Leica公司;Mastersizer3000激光粒度分析仪、Nano-ZS型激光粒度仪 英国Malvern公司;Freezee zone 6真空冷冻干燥机 美国Labconco公司;T18 digital高速剪切机 美国IKA公司;AH-100D高压均质机 上海ATS公司;J-1500圆二色谱仪日本分光株式会社;多重光散射稳定性分析仪 法国Formulaction公司。
1.3 方法
1.3.1 PPI的制备
参考本研究团队前期实验方法并略有改动。将花生蛋白粉与去离子水按1∶10(g/mL)比例混合,用1 mol/L的NaOH溶液调节pH 9.0,再将混合液在室温下搅拌2 h,4 200 r/min离心10 min取上清液。然后,用1 mol/L的HCl溶液将上清液调pH 4.5,4 200 r/min离心10 min。最后,收集沉淀,并用1 mol/L的NaOH溶液调pH 7.0,冷冻干燥获得蛋白质质量分数为91.52%的花生分离蛋白。
1.3.2 超声预处理
制备质量分数为15%的PPI溶液,室温下搅拌2 h,并调pH 7.0后放入冰箱冷藏过夜。超声时间分别设置为0、10、20、30、40 min,超声功率为500 W处理PPI溶液。
1.3.3 PPIMP的制备
参考本研究团队前期实验方法并略有改动。将TG酶(20 U/g PPI)加入到处理后的PPI溶液中并在45 ℃水浴加热4 h。加入2 倍体积的去离子水,随后使用高速剪切机12 000 r/min剪切2 min,再通过高压均质机在50 MPa的压力下均质2 min得到PPIMP分散液。
1.3.4 PPIMP粒径及Zeta电位的测定
采用Nano-ZS型激光粒度仪对PPIMP进行粒径与Zeta电位分析。使用超纯水将颗粒质量分数稀释到0.5%,取1 mL样品缓缓地加入到样品池中,防止气泡产生。
1.3.5 表面疏水性测定
参考Zhu Xuefeng等的方法并略有改动。用0.01 mol/L pH 7.0的磷酸盐缓冲液配制1 mg/mL的蛋白溶液,室温下10 000×离心20 min后取上清液,用Lowry法测定蛋白浓度。分别将上清液稀释2、4、8、10 倍后取4 mL加入20 μL的8 mmol/L的ANS荧光探针。在避光条件下,发射波长和激发波长分别为390 nm和470 nm,狭缝5 nm,用荧光分光光度计测定样品表面疏水性。
1.3.6 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析
参考Mohsin等的方法并略作修改,将处理后的样品冷冻干燥,再以1∶100比例与溴化钾混合均匀研磨,并将其压制成薄片,在波数范围400~4 000 cm,扫描64 次。
1.3.7 圆二色谱分析
参考操强等的方法并略作修改。将PPIMP配制成0.1 mg/mL的溶液,以超纯水为空白在190~250 nm扫描,样品池光程长为1 mm。
1.3.8 乳化性和乳化稳定性分析
参考Feng Haiying等的方法并略有改动。取20 mL质量分数为1%的PPIMP与5 mL葵花籽油混合,12 000 r/min高速剪切2 min制备成乳液,从底部迅速吸取50 μL加入到4 950 μL 0.1%的十二烷基硫酸钠溶液混匀,在500 nm波长处测定吸光度。静置10 min后,以相同方法再次测定吸光度。乳化性和乳化稳定性按式(1)和(2)计算。
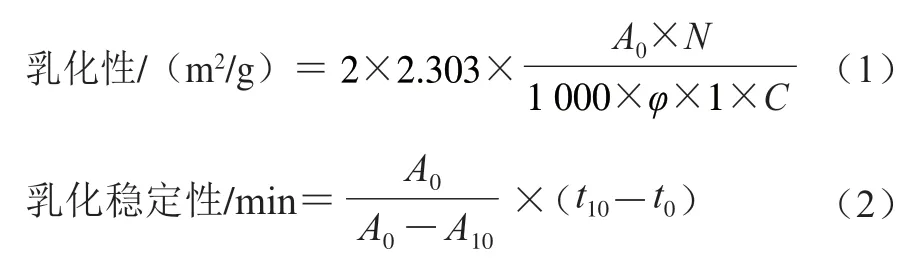
式中:为初始吸光度;为稀释因子;为乳液中的油相体积分数/%;为蛋白质的初始质量浓度/(g/mL);为10 min后的吸光度;-为两次测定时间的差值。
1.3.9 Pickering乳液的制备
将制备的PPIMP分散液稀释到蛋白质质量分数为0.5%,再向上述PPIMP分散液中加入葵花籽油使其体积分数分别达到65%、70%、75%、80%,在10 000 r/min剪切2 min得到Pickering乳液。
1.3.10 Pickering乳液粒径的测定
参考本研究团队前期实验方法并略有改动。采用Mastersizer 3000激光粒度分析仪测定Pickering乳液的粒径分布以及平均粒径,用去离子水作为分散剂(1.330),乳液的折光系数为1.471。
1.3.11 Pickering乳液的稳定性动力学指数(turbiscan stability index,TSI)分析
取约20 mL新鲜制备的Pickering乳液于Turbiscan稳定性分析仪专用圆柱形玻璃瓶中,保持样品瓶外壁洁净,内壁无样品区域无残留,液面平整。在设定温度(55 ℃)下每隔30 min对样品扫描一次,共扫描6 h。利用Turbisoft软件计算乳液随时间变化的TSI值。
1.3.12 Pickering乳液流变学特性的测定
参考本研究团队前期实验方法并略有改动。通过1 Hz的应变扫描得到样品的线性黏弹区域,所有样品的测试均在该线性黏弹区范围内测试。25 ℃条件下,以直径为40 mm的铝制平板,在剪切速率1.0~100 s内进行乳液表观黏度的测定。设置角频率为0.1~100 rad/s,频率扫描测量的应变振幅为0.5%,得到频率扫描曲线。
1.3.13 Pickering乳液激光共聚焦显微镜分析
取0.5 mL乳液置于激光共聚焦培养皿中,加入10 μL(1∶1)尼罗红和尼罗蓝混合染料(用异丙醇溶解),混合均匀后,于避光条件下染色30 min。将染色后的乳液置于载物台上,在488 nm和633 nm激发波长观察。
1.4 数据处理与分析
每个实验均重复3 次取平均值,使用Origin 8.5软件作图。采用SPSS 19.0软件进行数据处理和显著性分析,<0.05,差异显著。
2 结果与分析
2.1 超声时间对PPIMP粒径及电位的影响
超声时间对PPIMP 平均粒径与平均分散系数(polymer dispersity index,PDI)的影响如表1所示,随着超声时间的延长,PPIMP的平均粒径先减小后增大。与未超声的PPIMP平均粒径相比,超声时间为20 min的PPIMP平均粒径从372.95 nm减小至284.38 nm。与刘竞男等研究超声处理大豆分离蛋白时得到结论相似,其可能原因是超声处理产生的空化效应使蛋白由大分子物质分解成小分子颗粒。超声时间延长至40 min时,PPIMP的平均粒径又逐渐增大至356.40 nm,这可能是超声过程中蛋白质的重聚现象导致。所有样品的PDI均小于0.5,表明分散液是均匀且稳定的体系。固体颗粒的粒径大小直接影响Pickering乳液的液滴大小,粒径越小其吸附能力越强,越有利于形成稳定性更高的Pickering乳液。由此可知,经过超声预处理后的PPIMP更有利于Pickering乳液的稳定。
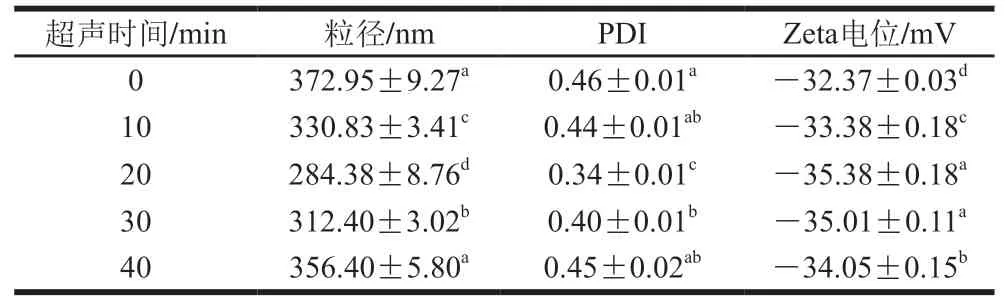
表1 超声时间对PPIMP粒径和Zeta电位的影响Table 1 Effect of ultrasonic time on the particle size and zeta potential of PPIMP
超声时间对PPIMP Zeta电位的影响见表1,超声处理前后PPIMP的Zeta电位均为负,且Zeta电位绝对值均在30~40 mV之间。在超声时间为20 min时,PPIMP的Zeta电位绝对值最大(35.38 mV),表明此时蛋白颗粒之间的静电斥力最大,最不易发生聚集,这与粒径的结果一致。而随着超声时间的增加,PPIMP的Zeta电位的绝对值先增大后减小。可能原因是超声处理使蛋白质中的极性基团暴露。
2.2 超声时间对PPIMP表面疏水性的影响
用ANS作为荧光探针检测不同超声时间处理的PPIMP的表面疏水性变化如图1所示,随着超声时间的延长,表面疏水性先增高后降低。超声时间为0 min的PPIMP表面疏水性最小为109.54,超声时间为20 min的PPIMP表面疏水性最大为138.16。本研究表面疏水性的增长效果明显高于超声-TG酶对红豆蛋白的表面疏水性的影响。表面疏水性对固体颗粒的乳化性有决定性的影响,表面疏水性的提高有利于增强PPIMP的乳化效果。Wang Yuntao等的研究表明在一定的超声时间内,鹰嘴豆分离蛋白的表面疏水性随超声时间的延长而升高。当超声时间过长时,蛋白质的表面疏水性降低,可能是过度的超声处理过程中会产生热量,冷却过程中,蛋白质的疏水相互作用将导致蛋白质聚集,从而导致其表面疏水性降低,该结果和Cui Qiang等研究结果一致。这些结果表明适宜的超声处理产生的空化效应会改变蛋白质的空间结构,导致蛋白氢键和分子间作用力裂解,蛋白内部的疏水基团暴露,使其表面疏水性增强。
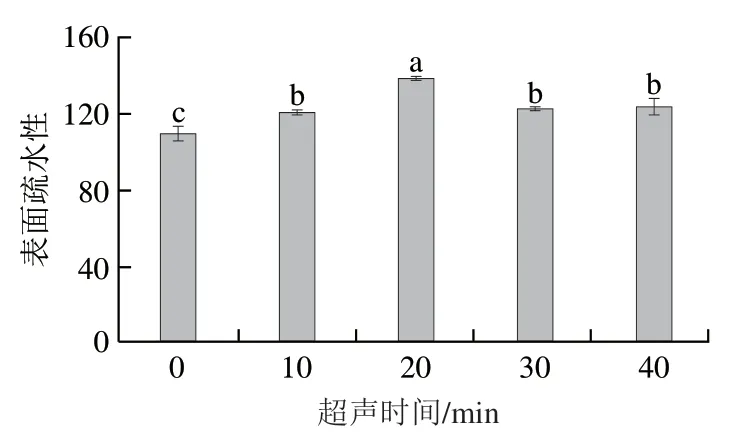
图1 超声时间对PPIMP表面疏水性的影响Fig.1 Effect of ultrasonic time on the surface hydrophobicity of PPIMP
2.3 超声时间对PPIMP二级结构的影响
如图2所示,FTIR主要峰是3 600~3 100 cm(N—H伸缩和氢键)和1 600~1 700 cm(C=O伸缩和氢键)。不同超声时间处理的PPIMP在1 605 cm均具有强吸收峰。此外,超声时间为20 min的PPIMP与未经超声处理的PPIMP相比,3 285 cm处的吸收带变得更宽,这可能是由于超声破坏了蛋白中的氢键作用,使蛋白质分子展开。圆二色谱分析进一步研究了超声时间对PPIMP二级结构影响。将图谱用CD Pro拟合软件分析,数据如表2所示。超声处理20 min的PPIMP,-螺旋相对含量增加、-折叠相对含量降低。这可能是超声的空化效应破坏了蛋白质的刚性结构,而使蛋白质的柔性结构增加。

图2 不同超声时间处理PPIMP的FTIR图Fig.2 FTIR of PPIMP treated by ultrasonic for different periods of time

表2 圆二色谱测定不同超声时间处理的PPIMP二级结构相对含量Table 2 Relative content of secondary structures in PPIMP treated by ultrasonic for different periods of time determined by circular dichroism spectroscopy %
根据粒径、Zeta电位、表面疏水性、二级结构、乳化性及乳化稳定性结果可推测,经过超声预处理改变了PPI空间结构,导致蛋白氢键和分子间作用力裂解,疏水基团暴露,有利于TG酶交联形成凝胶。再通过高速剪切与高压均质的撞击、空穴等作用力将凝胶块破碎,得到纳米级的PPIMP。
2.4 超声时间对PPIMP乳化性及乳化稳定性的影响
乳化性表示蛋白质促进乳液形成的能力,用于表征乳状液乳化特性;乳化稳定性表示赋予乳液抗应变的能力,以抵抗在一定时间内发生的不稳定性变化,如聚结、絮凝或沉淀等,用于表征乳状液稳定状态。如图3所示,随着超声时间延长,PPIMP的乳化性及乳化稳定性均呈先增加后降低的趋势。超声时间20 min时,乳化性(20.14 m/g)及乳化稳定性指数(166.42 min)均达到最大值,且具有显著差异(<0.05)。王喜波等研究的超声时间对大豆-乳清混合蛋白乳化性质的影响也得到了相似的结论,可能原因是超声20 min时暴露了更多的疏水性基团,从而导致蛋白质与油的相互作用增强。这一结果与PPIMP表面疏水性的结果一致。此外,当超声时间超过30 min时,乳化性及乳化稳定性均有所降低,可能原因是超声时间过长,蛋白质的重聚现象严重而不利于疏水基团的暴露,导致乳化性及乳化稳定性有所降低。
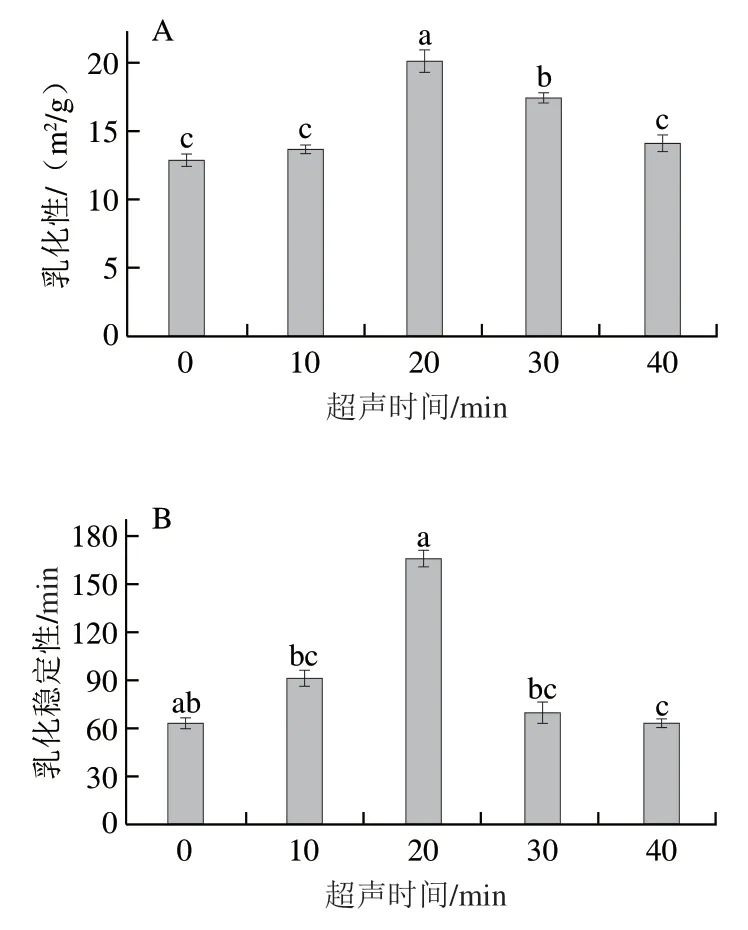
图3 超声时间对PPIMP乳化性(A)及乳化稳定性(B)的影响Fig.3 Effect of ultrasonic time on the emulsifying capacity (A) and emulsion stability (B) of PPIMP
2.5 Pickering乳液粒径分布及平均粒径分析
制备蛋白质质量分数为0.5%,油相体积分数分别为65%、70%、75%、80%的Pickering乳液。未经超声处理PPIMP制备的Pickering乳液在放置10 min后出现乳析现象,故未对其进行系统的性质表征。超声20 min PPIMP制备的Pickering乳液,放置10 min后呈现为均一的乳液体系。图4为不同油相体积分数(65%~80%)Pickering乳液的粒径分布及平均粒径图。随着油相体积分数的增加,Pickering乳液的平均粒径先减小后增加,在油相体积分数为75%时,乳液的平均粒径最小。由粒径分布图(图4A)可以观察到,随着油相体积的增加,粒径分布图中的主峰位置先逐渐向小尺寸移动(65%~75%),后又向大粒径方向移动(75%~80%)。这可能是油相体积分数为80%时,乳液属于高内相乳液,液滴之间会相互挤压,测定时搅拌分散不完全。也可能是质量分数为0.5%的PPIMP不能完全包裹住所有液滴,加剧了乳液的絮凝,从而使粒径增大,这与刘付用大豆蛋白稳定的Pickering乳液粒径结果一致。
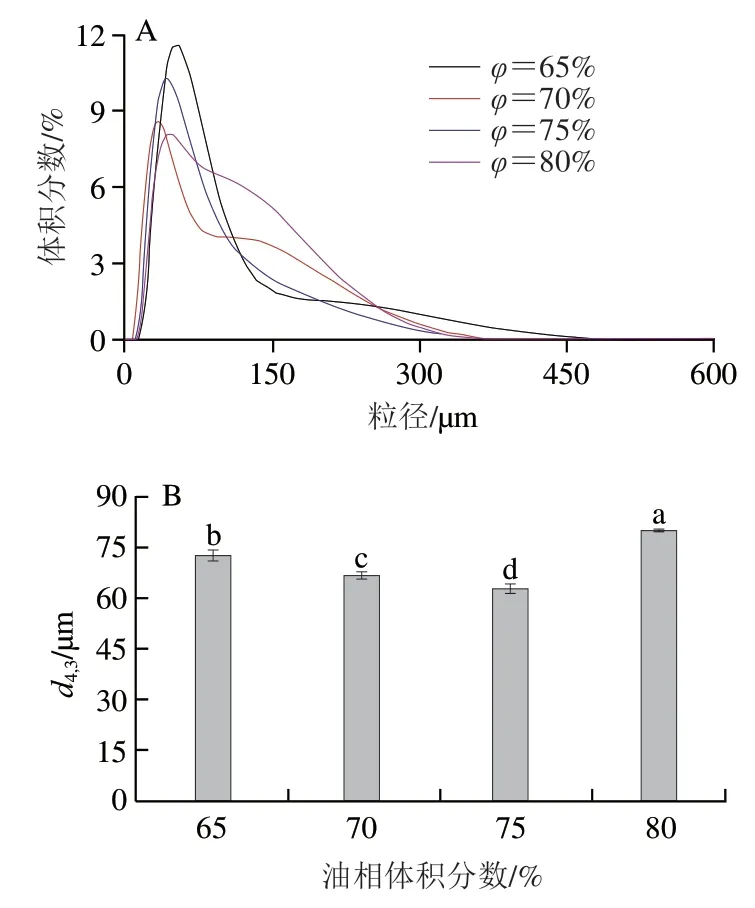
图4 不同油相体积分数制备的Pickering乳液的粒径分布(A)及平均粒径(B)Fig.4 Particle size distribution (A) and average particle size (B) of Pickering emulsions prepared with different oil phase volume fractions
2.6 Pickering乳液稳定性分析
TSI能够便捷地比较样品之间的稳定性差异,是分析乳液体系物理稳定性的重要指标。与起始线的偏差越大(TSI=0),曲线的斜率越小表示体系越稳定。图5显示了不同油相体积分数制备Pickering乳液TSI随时间的变化,TSI在0~5 000 s左右时,不同油相体积分数Pickering乳液的TSI值变化较大,之后变化较平缓。TSI数据表明乳液的稳定性顺序为:油相体积分数80%>75%>70%>65%。油相体积分数为65%的Pickering乳液TSI值最大为0.84(斜率最大),油相体积分数为80%的Pickering乳液TSI值最小为0.33(斜率最小)。当内相体积分数大于74%时,称为高内相乳液。对于高内相乳液,内相体积分数越大,乳液越稳定。当油相体积分数为80%时,乳液的TSI值最小,即乳液最稳定,这与PPIMP不能完全包裹住所有的液滴而液滴间形成桥接絮凝状网络结构有关。
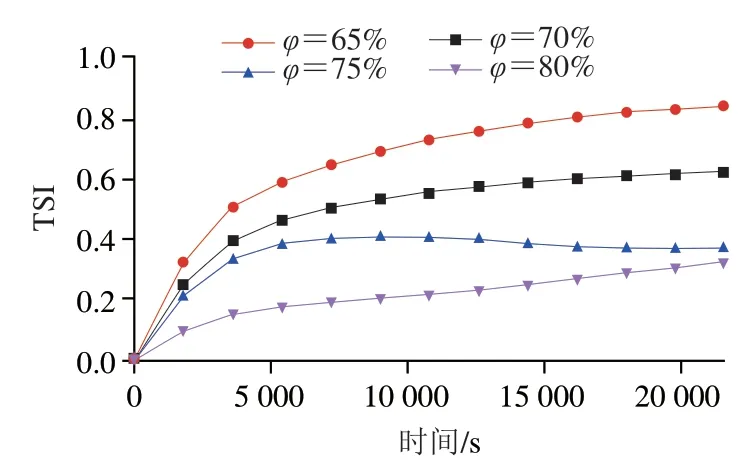
图5 不同油相体积分数制备的Pickering乳液TSI随时间的变化曲线Fig.5 Turbiscan stability index of Pickering emulsions prepared with different oil phase volume fractions as a function of time
2.7 Pickering乳液流变分析
如图6A所示,所有乳液随着剪切速率的增大黏度逐渐下降,表现出典型非牛顿假塑性行为(剪切稀化)。这种剪切稀化行为是乳液间的弱缔合相互作用。在相同的剪切速率下,随着油相体积分数的增加,Pickering乳液的表观黏度越大。该结果和江连洲等研究大豆分离蛋白凝胶颗粒稳定的Pickering高内相乳液黏度结果一致。

图6 不同油相体积分数制备的Pickering乳液的静态(A)、动态(B)流变分析图Fig.6 Rheological analysis of Pickering emulsions prepared with different oil phase volume fractions
由图6B可以观察到,油相体积分数大于等于70%时,表现出弹性凝胶行为,在频率扫描范围内,弹性模量始终大于黏性模量。另外,在同一频率下,随着油相体积分数的增加,弹性模量和黏性模量逐渐增加。研究表明PPIMP稳定的Pickering乳液的流变行为受油相体积分数影响,油相体积分数越高,越容易形成紧密的网络结构,有利于乳液的稳定。
2.8 Pickering乳液微观结构分析
PPIMP和食用油分别被尼罗蓝和尼罗红标记为绿色和红色。由图7可以观察到,绿色的蛋白颗粒包裹着红色油滴,说明乳液均为水包油型。当油相体积分数由65%增加到80%时,液滴大小呈现先减小后增大的趋势。油相体积分数为80%时,会出现液滴和液滴絮凝,液滴间排布紧密相互挤压而失去球形。这可能是由于可用固体颗粒的数量不足以稳定所有液滴,固体颗粒可以桥接液滴,界面上的颗粒与水相中颗粒形成了桥连絮凝,使乳液体系更加稳定。
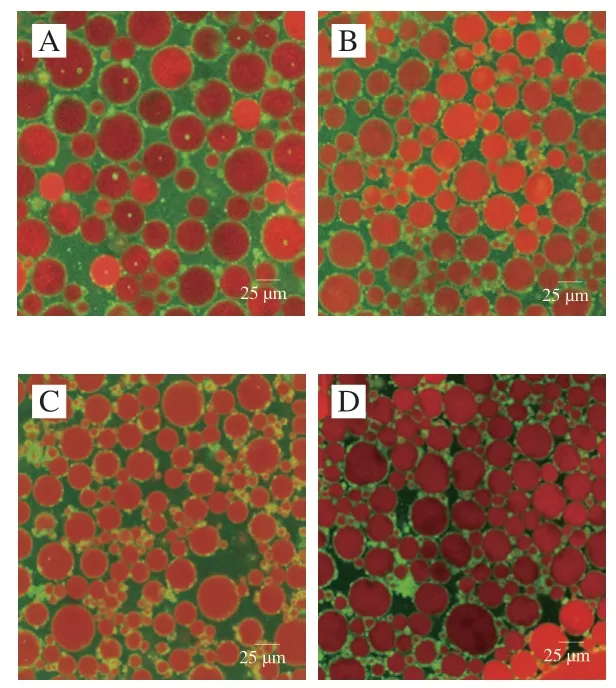
图7 不同油相体积分数制备的Pickering乳液的CLSM图Fig.7 CLSM micrographs of Pickering emulsions prepared with different oil phase volume fractions
3 结论
随着超声时间的延长,PPIMP的平均粒径先增高后降低,表面疏水性、乳化性及乳化稳定性先增大后减小。在超声时间为20 min时,平均粒径最小,且表面疏水性、乳化性及乳化稳定性指数最大。此外,采用超声时间20 min的PPIMP制备不同油相体积分数的乳液,均为水包油型Pickering乳液,非牛顿假塑性流体。乳液稳定性结果表明,当油相体积分数为80%时,制备的高内相Pickering乳液最稳定。因此,通过超声预处理制备的PPIMP可作为一种有效的Pickering稳定剂,且PPIMP的成功制备对花生蛋白产品的开发具有重要意义。
