基于运动食品的蛋白-磷脂聚集体及其乳液的液滴特性
2022-10-24管军军路新开冀旭阳
周 洋,管军军,路新开,冀旭阳
(1 河南工业大学体育学院 郑州 450001 2 河南工业大学生物工程学院 郑州450001
大豆蛋白与磷脂是大豆制油后的主要副产品[1]。大豆蛋白按其蛋白含量主要分为大豆分离蛋白(SPI,蛋白>90%干基)与大豆浓缩蛋白(SPC,蛋白>70%干基)[2]。SPI 蛋白含量高且基本接近纯蛋白,可作为研究大豆蛋白功能特性的主要原料;SPI 由2S、7S、11S、和15S 蛋白组成,其中7S(β-伴球蛋白)和11S(大豆球蛋白)为主要成分,占总蛋白的80%左右[3]。7S 蛋白由α 亚基、α′亚基和β亚基通过疏水键形成三聚体,11S 则由酸性亚基A和碱性亚基B 组成,通过双硫键和疏水作用形成六聚体结构的球蛋白[4-5]。大豆中磷脂含量高,总磷脂中主要磷脂组分为磷脂酰胆碱(卵磷脂PC)、磷脂酰乙醇胺(脑磷脂PE)、磷脂酰肌醇(PI)、磷脂酸(PA)、磷脂酰甘油(PG)等[6]。磷脂是大脑和神经系统所必需成分,也是脂蛋白的主要成分,在脂类的转运中起重要作用。
大豆蛋白是重要的植物蛋白,具有良好的水中分散性与两亲性(亲水/亲油),广泛用于食品加工中[7]。大豆蛋白包含人体全部必需氨基酸,可满足人体对蛋白质的需求,具有保健作用[8]。其酶解产品/大豆肽是一种较好的运动营养食品[9-10],为体育运动者快速提供营养补充。磷脂是细胞膜的基本成分,有很高的营养与医学价值,可改善运动性疲劳,稳定紧张情绪[11-12]。磷脂也是两性物质,可作为天然的表面活性剂,形成乳液,然而,其乳化稳定性不如蛋白。研究发现磷脂与大豆蛋白形成复合乳液,可改善蛋白的乳化活性,同时增加磷脂的乳化稳定性[13],且磷脂的结合对改善大豆蛋白功能性有重要作用[14-15]。
关于磷脂与大豆蛋白形成的复合乳液中蛋白-磷脂聚集态及其复合乳液的液滴特性鲜有报道。本研究以酶解大豆蛋白与磷脂为主要原料,构建运动营养食品体系,研究其形成聚集体及其复合乳液,以及静态消化模型中复合乳液液滴特性与蛋白亚基的变化,为扩大这种复合乳液在运动营养食品中的应用,分析其消化机理奠定基础。
1 材料与方法
1.1 材料与试剂
黄豆,郑州丹尼斯超市;大豆油,益海嘉里食品营销有限公司;粉末磷脂,丙酮不溶物含量≥98%,郑州四维科技有限公司;胃蛋白酶,10 000 NFU/mg,生工生物工程(上海)股份有限公司;化学试剂均为分析纯,天津市科密欧化学试剂有限公司等。
1.2 主要仪器
FA25 高剪切分散乳化机,德国FLUKO 公司;SHA-C 数显水浴恒温振荡器,金坛华峰仪器有限公司;722N 可见分光光度计,上海精科实业有限公司;ZS90 型纳米粒度及Zeta 电位分析仪,英国马尔文仪器有限公司;FD-1 型冷冻干燥机,北京博医康实验仪器有限公司;85-2 型恒温磁力搅拌器,河南智城科技发展有限公司;JP-100A-2 高速多功能粉碎机,永康市久品工贸有限公司;DDS-11D 雷磁电导率仪,上海净信实业发展有限公司;BH200 生物显微镜,舜宇光学科技集团有限公司。
1.3 酶解大豆蛋白(ESP)制备
大豆分离蛋白(SPI)的制备:根据参考文献[16-17]所述方法,黄豆除杂粉碎过60 目筛后石油醚脱脂,加10 倍蒸馏水,搅拌1 h,2 mol/L NaOH调pH 值至8.0,50 ℃水浴搅拌1 h,5 000 r/min 离心35 min,取上清液,2 mol/L HCl 调pH 值至4.8,冰箱4 ℃冷藏8 h,5 000 r/min 离心30 min,取沉淀冷冻干燥后即得到大豆分离蛋白。
ESP 制备:根据参考文献[18]适当改进,将SPI与蒸馏水按质量比1∶50 于锥形瓶中搅拌溶解,2 mol/L HCl 调pH 值至2,37 ℃水浴30 min,加入胃蛋白酶(酶∶SPI=1∶1 000,质量比),进行酶解反应,茚三酮比色法(570 nm)监测反应进度。60 ℃水浴30 min 结束酶解反应,冷冻干燥后即得到ESP样品。
1.4 酶解大豆蛋白-磷脂聚集体的制备
根据文献[19-20]方法加以改进,ESP∶蒸馏水=1∶50 (质量比) 于烧杯中溶解,2 mol/L NaOH调pH 值至7.0,一定质量比加入磷脂,高剪切分散乳化机(20 000 r/min)均质3 min,形成ESP-磷脂聚集体。
1.5 ESP-磷脂复合乳液及ESP 乳液的制备
ESP-磷脂复合乳液:取一定量的ESP 溶于蒸馏水中,2 mol/L NaOH 调pH 值至7.0,磷脂加热溶解于大豆油中,然后将三者混合,高剪切分散乳化机(20 000 r/min)均质3 min。
ESP 乳液: 取一定量的ESP 溶于蒸馏水中,2 mol/L NaOH 调pH 值至7.0,加入大豆油,高剪切分散乳化机(20 000 r/min)均质3 min。
1.6 胃消化模型的建立
参考文献[21-22]建立胃消化模型,取200 mL乳液、0.16 g 胃蛋白酶及400 mL 胃液母液(组成:9.2 mL KCl 89.6 g/L,6.5 mL 质量分数37%的HCl,3.0 mL NaH2PO488.8 g/L,10 mL NH4Cl 30.6 g/L,15.7 mL NaCl 175.3 g/L,18 mL CaCl222.7 g/L,10 mL 葡萄糖65 g/L,pH 1.3±0.2) 于锥形瓶中混匀,水浴(37 ℃)振荡(60 r/min)模拟胃运动4 h。不同的消化时间点取样,一部分直接进行相关测定,一部分冷冻干燥制成干粉备用,试验重复3次。
1.7 电导率的测定
用电导仪对样品进行电导率的测定,温度设定为25 ℃。
1.8 粒径与Zeta 电位的测定
参考Chanamai 等[23]的方法,稍有改动。用蒸馏水稀释样品至500 倍,取适量稀释液于样品槽中,温度25 ℃,相对折射率设置为1.095(大豆油1.456 与水相1.33 的折射率之比),取3 次测量结果的平均值。
1.9 显微观察
吸取20 μL 样品均匀涂于载玻片上,16×40倍光学显微镜观察并拍照。
1.10 SDS-PAGE 单向电泳(1-DE)
称取一定量的样品溶于200 μL 蒸馏水中,加入样品缓冲溶液 (0.25 mol/L Tris-HCl,pH=6.8、10% SDS、50% 甘油、0.5% BPB、5% β-巯基乙醇)200 μL。配制12%分离胶(pH=6.8,Tris-Hcl 溶液,30%丙烯酰胺、10%SDS、10%AP)和5%浓缩胶(pH=8.8,Tris-Hcl 溶液、30%丙烯酰胺、10%SDS、10%AP),待胶凝固后,15 μL 样品液上样。电压300 V,浓缩胶电流10 mA,分离胶电流30 mA。电泳结束后考马斯亮蓝G250 染色。
1.11 ISO-DALT 双向电泳(2-DE)
参考文献[24],[25],第1 步等电聚焦在凝胶管(120 mm×1.5 mm) 中进行。凝胶液 (尿素、10%TritonX-100、28.38%丙烯酰胺溶液、2%两性电解质(pH=3~10)、10%AP、双蒸水,10%TEMED)灌入凝胶管中,覆盖液A(8 mol/L 尿素溶液)静置1~2 h 后去除,加入20 μL 裂解液(5% β-疏基乙醇、20%曲拉通、9.5 mol/L 尿素、2%两性电解液) 和少量双蒸水静置1~2 h 后去除,再加入20 μL 裂解液和NaOH 溶液。将凝胶管放在上槽为NaOH 溶液、下槽为H3PO4缓冲溶液的电泳槽中,200 V,30 min;300 V,30 min;400 V,60 min。取出凝胶管并去除裂解液和NaOH 溶液,20 μL 样品液(同SDSPAGE 电泳制样) 上样并加覆盖液B (9 mol/L 尿素,2%两性电解液)10 μL 及NaOH 溶液;400 V,3 h;800 V,13 h;1 500 V,2 h。结束后取出胶条于平衡液中平衡2 h。
第2 步SDS-PAGE 电泳步骤同上述1.10 节。不同的是将平衡好的胶条平放在浓缩胶上,琼脂糖凝胶固定,1 500 V,浓缩胶时电流40 mA,分离胶时电流70 mA。结束后硝酸银法染色[26]。
1.12 数据分析
每组试验重复3 次,用SAS9.2 软件进行单因素和多因素方差分析,P<0.05 时差异显著。
2 结果与讨论
2.1 酶解大豆蛋白的选择及其蛋白亚基分析
大豆蛋白经胃蛋白酶水解后,其自由氨基将增加,利用氨基与茚三酮显色反应可监测酶解反应的进度,进而反映蛋白的酶解程度。图1a 为SPI酶解反应过程中茚三酮比色法吸光度的变化。图中显示酶解30 min 前蛋白水溶液的吸光度逐渐增加,30 min 之后趋于平稳,蛋白水溶液吸光度的变化反映了溶液中自由氨基含量,说明胃蛋白酶在30 min 前对蛋白作用明显,使其酶解产生的氨基酸逐渐增多,30 min 后蛋白酶作用减弱,变化不明显。
对不同酶解时间的蛋白进行SDS-PAGE 电泳显示(图1b),随着酶解时间的延长,蛋白中7S和11S 蛋白亚基条带逐渐变浅,尤其在30 min 前变化最明显,与酶解0 min 的相比,30 min 之后的酸性和碱性亚基明显减少。图1b 显示酶解4 h 之后,蛋白依然不能完全降解,可能是仅在酸性环境中,蛋白的酶切位点不能完全暴露。进一步对酶解30 min 的蛋白和SPI 单双向电泳对比分析,如图1c 显示,单向电泳图谱中酸性亚基的条带减少,其余亚基条带变浅,双向电泳图谱也显示11S 亚基部位的蛋白点消失得较多,尤其是B 亚基。而7S 的亚基中pI=4 左右的蛋白点增多[27]。因此,本研究中大豆蛋白酶解时间控制在30 min,从而制取酶解蛋白样品。


图1 大豆蛋白酶解过程中茚三酮显色反应(a)、SDS-PAGE 电泳(b)及ISO-DALT 双向电泳(c)图谱Fig.1 Ninhydrin color reaction (a),SDS-PAGE electrophoresis (b) and ISO-DALT two-dimensional electrophoresis (c)during soybean proteolysis
一般来说,胃蛋白酶的活性位点芳香族氨基酸或酸性氨基酸形成的肽键。大豆蛋白含有人体全部必须氨基酸,其肽键中有适合胃酶降解的位点,但是本研究发现随着酶解反应的进行,亚基并没有完全降解,尤其是7S 蛋白,根据酶解反应空间位阻机理,这与蛋白活性位点在溶液中的暴露程度有关。胃酶最适反应pH 2 左右,有研究表明,极端pH 值处理可诱导SPI 与11S 亚基部分解离,而对7S 亚基影响较小。在酸性环境中,大豆蛋白中11S 六聚体会解离成三聚体或单个亚基,多以7S 和3S 亚基存在[28],因此胃蛋白酶反应条件下,可促使大豆11S 蛋白解聚成7S 亚基或降解成更小的肽片断、氨基酸等,而对于7S 蛋白的降解则影响有限。
2.2 酶解大豆蛋白-磷脂聚集体的液滴特性
图2显示的是不同比例的酶解蛋白与磷脂形成的聚集体放置不同时间的液滴变化。图2a 表示的液滴电导率,即电荷流动难易程度。酶解蛋白与磷脂的比例在10∶1 以内时电导率明显较高 (P<0.05),且放置4 h 后没有明显变化,而比例在10∶1 以上的聚集体溶液的电导率较低,放置4 h 后电导率更低。结果说明高浓度的蛋白会增加溶液的导电阻力。磷脂与蛋白通过疏水作用相结合[29],酶解蛋白亲水端暴露在表面,随着蛋白量增加,理应导电性越好,但当酶解蛋白磷脂作用饱和后,其含量还持续增加,疏水基团也会增多,反而会增加导电阻力。

图2 ESP-磷脂聚集体的电导率(a)、Zeta 电位(b)、粒径(c)及显微观察(d)分析Fig.2 Analysis of conductivity (a),Zeta potential (b),particle size (c) and microscopic observation (d)of ESP-phospholipid aggregates particles
图2b 显示酶解蛋白与磷脂比例在5∶1 内的溶液电位绝对值更大,与其它比例的差异显著(P<0.05),放置时间对溶液电位值无明显作用。电位绝对值越大说明溶液越稳定[30]。对不同比例的酶解蛋白磷脂聚集体溶液进行粒径测定(图2c)发现酶解蛋白与磷脂形成的聚集体的平均粒径基本在410 nm 以内,比例在10∶1 以内的平均粒径明显要大一些(400 nm 左右,P<0.05),而且随放置时间的变化波动不大。再增加酶解蛋白与磷脂比例,测得聚集体的平均粒径反而偏小(<390 nm)。
结合图2a、2b、2c 发现,聚集体溶液的电导率、电位及粒径基本表现一致,且随着放置时间延长并没有表现出较大的波动性,如图中虚线框内(10∶1 以内)。不过,5∶1 以内有更高的电位值(绝对值)。考虑到酶解大豆蛋白亲水性较强,磷脂更偏向亲油性,且后续的工作要探讨其作为壁材形成的O/W 型复合乳液,因此选用5∶1 酶解大豆蛋白-磷脂聚集体制备复合乳液。
另外,通过显微观察(图2d)可以看出蛋白与磷脂的比例为5∶1 形成的液滴大小均一,排列较为致密。综上结果说明酶解蛋白与磷脂的添加量为5∶1 时形成的聚集体溶液较稳定。
2.3 酶解大豆蛋白-磷脂复合乳液的液滴特性
通常,油脂在乳液中暴露的越多,电导率越小。乳液中水相的添加量大于油相时,易形成O/W体系,当油相被包埋的越多,体系电导率越大。以ESP-磷脂聚集体为壁材(添加量为5∶1),与大豆油形成复合乳液,研究油/水比例对于复合乳液液滴的影响。由图3a 可知,油/水比例为1∶1 时,乳液电导率最大(P<0.05),但此体系容易反相变为W/O 型,油/水比例为1∶2 和1∶3 的乳液电导率相差不显著,并结合O/W 体系稳定性,本研究选择油/水比例为1∶3 的乳液体系较佳。

图3 ESP-磷脂复合乳液电导率(a)、复合乳液与ESP 乳液Zeta 电位(b)、粒径(c)及显微观察(d)分析Fig.3 ESP-phospholipid composite emulsion conductivity (a),composite emulsion and ESP emulsion Zeta potential (b),particle size (d) and microscopic observation (d) analysis
图3b、3c、3d 显示的是以油/水比例1∶3 形成的酶解蛋白 (ESP)-磷脂复合乳液和ESP 乳液的液滴特性。由图3b 可知复合乳液的电位绝对值整体偏小(P<0.05),说明形成的液滴带电荷量不如ESP 乳液,其静电排斥作用较弱;由于磷脂与ESP作用形成聚集体,很多带电基团参与聚集体静电力的形成,减少了液滴表面的负电荷。
图3c 可以看出复合乳液液滴平均粒径偏大(1 300 nm 左右,P<0.05),且放置一定时间内,没有发生明显变化。而ESP 乳液液滴平均粒径偏小(950 nm 左右),静置1 h 后粒径则迅速变大(接近1 200 nm)。结合乳液形成时的显微图(图d)可知,复合乳液液滴偏大,且大小不均一,ESP 乳液偏小,且排列紧密。
大豆蛋白为球蛋白有一定的刚性,所以ESP为限制性水解大豆蛋白也具有一定的刚性,ESP与磷脂形成聚集体后仍然存在刚性,从而聚集体与油脂形成复合乳液时二者之间的位阻(即空间效应) 较ESP 与油脂间的位阻大,这也决定了ESP-磷脂复合乳液的液滴粒径较大。另一方面,由于ESP-磷脂复合乳液液滴表面电荷相对ESP乳液较少,液滴之间的静电斥力也相对较小,形成复合乳液后的液滴则较ESP 乳液更易于聚集形成较大的液滴(图3d),因此,复合乳液形成后液滴可快速聚集(<10 min,图3c)形成较稳定的乳液体系。
2.4 基于胃消化模型的ESP-磷脂复合乳液的液滴特性
体外胃消化模型是研究食品在人体消化过程中组分变化及其体系稳定性的便捷方法。由图4a可知,复合乳液在胃消化过程中的电导率整体要高于ESP 乳液(P<0.05),说明复合乳液中水相对油相的包裹性更好。随着消化时间越长,乳液电导率均呈先增加后减小的趋势,30 min 前,暴露的油滴与蛋白结合不紧密,受蛋白酶进一步酶解作用,部分油滴聚集上浮,使乳液中的油相减少,电导率增加。消化后期使油滴暴露的速度大于其聚集上浮的速度,则电导率略降低。
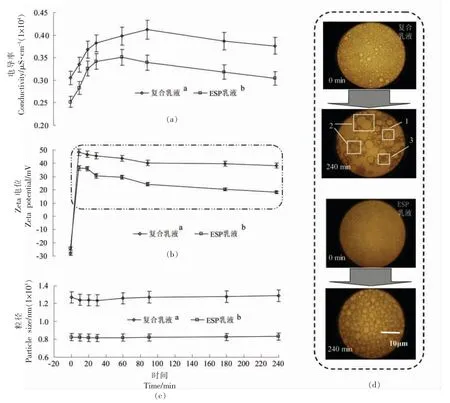
图4 体外胃消化中乳液的电导率(a)、Zeta 电位(b)、粒径(c)及显微观察(d)分析Fig.4 Analysis of conductivity (a),Zeta potential (b),particle size (c) and microscopic observation (d)of emulsion in vitro gastric digestion
图4b 显示了乳液消化4 h 内的电位变化,可知乳液电位受胃液影响严重,胃液的添加使乳液的电位从负值短时间内迅速变为正值,胃液中含有大量的H+,中和了蛋白的负电荷,前期试验表明复合乳液携带负电荷较ESP 乳液少,中和胃液中H+的量较少,导致复合乳液在消化中的电位绝对值要高于ESP 乳液(P<0.05,图中虚线框内数据)。但乳液进一步消化后,其电位值均有降低,说明胃蛋白酶对乳液中的酶解蛋白仍有一定作用。
图4c 显示乳液消化中的平均粒径变化,可知无论复合乳液还是ESP 乳液,胃消化过程对其粒径影响不大,但是复合乳液的平均粒径明显高于ESP 乳液(P<0.05)。但结合图4d 的乳液消化过程的显微观察,与ESP 乳液相比,复合乳液液滴的变化主要体现在液滴大小不均一、排列稀疏。说明胃液消化过程加速了复合乳液液滴的变化,使其聚集形成较大的液滴(如图4d、方框1、2),或者形成粒径较小的液滴(如图4d、方框3)。而对于ESP 乳液,也发现类似情况。不过,两种乳液显微观察与平均粒径的数据有不一致的情况(图4c、4d),这是由于粒径数据表现的是乳液液滴整体的状况,是平均水平,显微观察则表现的是局部细节,从而出现乳液平均粒径在体外消化过程中变化不大,而在显微观察中有变化的情况。不过,二者(粒径与显微) 结合起来则能较好地从不同层面反映乳液液滴的真实状况。
2.5 酶解大豆蛋白-磷脂复合乳液体外胃消化中蛋白亚基变化
对复合乳液和ESP 乳液在胃消化过程中蛋白质的变化进一步分析,通过SDS-PAGE 单向电泳(图5)可知乳液中的酶解蛋白在胃消化中进一步得到降解。与图1b 显示的结果对比可知单独的蛋白被胃蛋白酶作用后不能完全被降解,但形成乳液后,蛋白的部分亚基能被完全降解。说明大豆蛋白乳化后更易被蛋白酶作用,乳化能促进大豆蛋白被胃酶降解。大豆蛋白发挥其乳化性能后,改变了其空间结构,使蛋白的酶切位点暴露的更多。单向电泳显示复合乳液在胃消化30 min 时,各亚基条带明显变浅,而ESP 乳液在消化30 min 时蛋白条带变化并不明显。单向电泳图谱还可以看出,乳液消化前期蛋白的β 亚基没有降解,反而略有增加,可能是11S 亚基受胃液环境影响部分降解为7S,而β 亚基不易被蛋白酶作用,故其不降反增。从图中可知碱性亚基在胃消化过程也不能降解完全。

图5 乳液SDS-PAGE 电泳图谱Fig.5 SDS-PAGE electrophoresis pattern of emulsion
双向电泳图谱(图6)可知,复合乳液在消化30 min 后,能检测到的蛋白点明显减少,其中碱性亚基B 基本检测不到,而ESP 乳液虽然在消化30 min 后仍然能检测到较复合乳液较多的蛋白组分,但是也基本检测不到碱性亚基B 组分;而到240 min 后,两种乳液基本只能检测到β 亚基。

图6 乳液ISO-DALT 双向电泳图谱Fig.6 ISO-DALT two-dimensional electrophoresis pattern of emulsion
由单向电泳可知,胃消化过程中复合乳液中蛋白酶解主要发生在30 min 前,蛋白酶最先降解的是α、α′和酸性亚基A,然后是碱性亚基B,β 亚基基本不能降解;复合乳液中由于采用ESP-磷脂聚集体,前面的结果表明复合乳液中空间效应较ESP 乳液明显,因此复合乳液在胃消化过程中蛋白更易于暴露活性位点,从而增加聚集体中蛋白的降解速度。值得注意的是,碱性亚基B 消化30 min 后在单向电泳图谱中能检测出,但在双向电泳中未能检测到,这说明碱性亚基B 某些组分已降解,其它组分由于含量少,在双向电泳中不能被检测到。
2.6 体外胃消化中复合乳液液滴“自组装”机理探讨
大豆蛋白与磷脂,二者因具有亲水/亲油性常作为天然表面活性剂而用于食品体系中,由于其营养功能,也常用于运动营养食品中。大豆蛋白由于具有一定的刚性,且分子质量较大,常以聚集态存在于溶液中,作为表面活性剂不利于快速移动至界面处,因此乳化活性较弱,但具有较好的乳化稳定性;磷脂刚好与之相反,由于其分子质量较小,便于快速移动至界面,具有较好乳化活性[31];而且大豆蛋白两亲性中亲水性较强,磷脂则亲水性较弱;因此,大豆蛋白与磷脂作为壁材能较好的优势互补,形成较为稳定的大豆蛋白-磷脂聚集体系。
为了降低大豆蛋白的刚性,本研究中采用酶解的方法加以前处理以增加蛋白分子的柔性。之所以采用胃蛋白酶,是因为可减少乳液中大豆蛋白在胃消化中受到胃蛋白酶的作用有可能影响乳液的稳定性。而试验的结果却发现,胃蛋白酶对于大豆蛋白的前处理不能完全把蛋白中活性位点降解。不论是复合乳液还是酶解蛋白乳液,在体外胃消化中除β 亚基外,其它亚基基本被降解。但从液滴特性来看,由于复合乳液中引入了磷脂,其平均粒径较酶解蛋白乳液(未加磷脂)大,但从粒径变化分析,复合乳液的平均粒径变化较小,因此乳液在重力场中有较好的稳定性。
由于分析方法对液滴特性表现侧重点不同,体外胃消化试验中,受到胃蛋白酶降解的乳液蛋白液滴发生了一些变化,虽然在数值上平均粒径波动不大,但是显微观察发现液滴受到不同程度的影响,尤其对于复合乳液更为明显。综合电导、电位及粒径随放置时间或体外胃消化时间的变化,整体来说,体外胃消化中复合乳液液滴的稳定性要高于ESP 乳液。
对于大豆蛋白,胃蛋白酶处理大豆蛋白只能限制性降解蛋白,但酶解蛋白能与磷脂形成较为稳定的聚集体,进而形成复合乳液后有较好的稳定性。虽然蛋白在体外胃消化过程中受到了降解,但复合乳液整体稳定性有所提升(电导率增加)。由此,可以推导复合乳液在体外胃消化中存在一个液滴“自组装”过程。具体来说:复合乳液进入胃液后,由于pH 值突然降低,以至于其液滴表面电荷“由负变正”,且带有更多的正电荷(图4b),增加了液滴之间的静电斥力,减少液滴之间的聚集,从而使复合乳液的稳定性提高(图4a);随着消化的进行,液滴壁材(ESP-磷脂聚集体)中蛋白被降解,表面电荷有所减少,静电斥力相应降低,加上胃消化中对乳液一定程度的“蠕动”(本研究中以振荡代替),液滴“相互靠近”的可能性加大,当液滴之间的距离降到一定程度后,由于蛋白的降解导致壁材一定程度的破坏,液滴中油脂会“暴露”出来,根据“同性相吸”原理,液滴由于“暴露”的油脂而“吸引”在一起,其结果是壁材“自组装”形成新的聚集体将油脂重新包埋起来形成一个更大的液滴(如图4d、方框1、2),或者将液滴“一分为二”形成较小的液滴(如图4d、方框3)。在体外胃消化的后期,由于蛋白降解程度的提高,壁材的“强度”受到一定程度的影响,导致“包埋能力”下降,会有一部分油脂析出,最直接的表现就是电导率有所降低(图4a)。当然,以上只是根据试验的结果进行的推理,具体情况还需要通过相关试验加以验证。
另一方面,试验结果也表明,由于磷脂的加入,也加速了大豆蛋白类食品乳液于胃中蛋白的降解,进而有利于小肠中对于蛋白类营养物质的消化吸收。这为扩大大豆蛋白类食品乳化体系在运动营养食品中的应用并阐明消化吸收机理提供一定的理论支撑。
3 结论
本研究以酶解大豆蛋白、磷脂为主要原料,对其聚集体及其复合乳液的液滴进行系统探讨,结果如下:
1) 胃蛋白酶对大豆蛋白只能有限降解,在酶解30 min 后蛋白亚基变化不显著,酶解4 h 后蛋白各亚基仍不能被完全降解。
2) 酶解蛋白与磷脂的质量比为5∶1 时其聚集体具有较好的液滴特性(P<0.05);以该比例制备聚集体作为壁材,发现油相和水相的比例为1∶3 时可形成较为理想的水包油型乳化体系(P<0.05)。
3) 复合乳液液滴平均粒径及电位均高于酶解蛋白乳液(P<0.05),但是在消化过程中液滴特性变化程度相较于酶解蛋白乳液要小。
4) 体外胃消化过程中,复合乳液的液滴特性(电导率、电位及平均粒径)明显高于酶解蛋白乳液(P<0.05),但二者变化趋势基本相同。
5) 体外胃消化过程中,复合乳液中的蛋白降解速度要大于酶解乳液,且除β 亚基外其余亚基均能被降解。
综上所述,酶解蛋白-磷脂聚集体作为壁材形成复合乳液表现出较好的稳定性,但在体外胃消化过程中蛋白被降解,推导其在体外胃消化中存在液滴“自组装”过程,这为扩大大豆蛋白类食品乳化体系在运动营养食品中的应用如缓解运动性疲劳等,并阐明其消化吸收机理提供一定的理论支撑。
