长期氮添加对落叶松和水曲柳人工林土壤碳、氮、磷含量和胞外酶活性的影响
2022-10-19赵凯歌周正虎王传宽
赵凯歌,周正虎,金 鹰,王传宽
(东北林业大学生态研究中心,森林生态系统可持续经营教育部重点实验室,黑龙江 哈尔滨 150040)
工农业迅速发展过程中氮氧化物的大量排放导致全球氮(N)沉降速率不断提高,引发了诸如土壤酸化、生物多样性丧失等生态问题,N沉降对陆地生态系统的影响受到了广泛关注[1-2]。土壤微生物在土壤有机质分解、营养物质循环,以及土壤肥力形成过程中发挥着重要作用[3]。N沉降会通过影响森林植被组成、凋落物化学成分、细根生物量和性状、土壤酸化、N可利用性等过程影响土壤微生物群落[1];微生物群落结构和功能的改变反过来也会显著影响土壤碳(C)和养分循环[4]。有研究认为N沉降会通过降低微生物对惰性有机质的分解,进而促进土壤惰性有机碳的累积,有利于土壤碳的长期固存[5]。然而,在贡嘎山针叶林中的研究发现N添加促进了土壤惰性碳的分解,进而引起土壤呼吸速率的显著升高[6]。微生物通过产生胞外酶将环境中的有机质分解成可溶性的小分子物质之后才能被自身吸收利用,微生物胞外酶活性的大小直接影响着土壤C、N、磷(P)的循环过程[7]。例如,过氧化物酶、酚氧化酶、多酚氧化酶等氧化酶主要分解惰性有机质,而β-葡萄糖苷酶、纤维素酶等水解酶主要分解活性有机质,几丁质酶和磷酸酶控制着有机质中N、P的矿化和释放[8-9]。因此,分析微生物胞外酶活性有助于揭示森林土壤C、N、P循环对N添加的响应机制。
和针叶林相比,阔叶林的枯落物质量较高(N含量高且木质素含量低),进而更容易被微生物分解[10-11],这可能会改变N添加对微生物生长和活性的影响。此外,不同树种形成的菌根类型也会对土壤C、N、P循环过程产生显著影响。丛枝菌根(AM)占据优势的森林土壤被认为具有较高的N含量、开放的N循环,以及较低的碳氮比(含量经记为C/N,下同)和较高的C循环速率[12-13]。相反,外生菌根(ECM)占主导的森林枯落物具有较高的木质素浓度、C/N,导致ECM树种叶片凋落物的分解速率要慢于AM树种[13]。然而,相同气候和土壤条件下不同菌根类型森林土壤C、N、P循环过程对N添加的响应尚无定论。落叶松(Larixgmelinii)和水曲柳(Fraxinusmandshurica)是东北地区优势树种和主要造林树种,且落叶松和水曲柳分别属于针叶树种和阔叶树种,以及ECM树种和AM树种[14-16]。与落叶松相比,水曲柳的凋落叶质量更高,比如水曲柳叶片具有较高的N含量、较低的木质素含量[16]。因此,水曲柳凋落叶的分解速率显著高于落叶松凋落叶的分解速率,最终导致落叶松人工林中地表凋落叶的现存量显著高于水曲柳人工林的[16-17]。为此,本研究基于东北林业大学帽儿山生态站落叶松和水曲柳人工林长达16 a的N添加试验,揭示长期N添加对落叶松和水曲柳人工林土壤C、N、P组分及相关酶活性的影响,并探讨树种的调控响应。
1 材料与方法
1.1 实验设计
本研究在东北林业大学帽儿山森林生态站(127°30′ E,45°20′N)开展。长期气象数据(1980—2017年)显示该地区年平均气温为 2 ℃,1月和7月的平均气温分别为-20.7和20.5 ℃;年均降水量为702 mm,其中81%的降雨量出现在生长季节(5—9月);无霜期为130~172 d[18]。该地区的顶级群落为阔叶-红松林,现有植被是顶级植被屡遭人为干扰后形成的次生林和人工林,主要造林树种为落叶松(Larixgmelinii)、红松(Pinuskoraiensis)和水曲柳(Fraxinusmandshurica)。土壤为典型暗棕壤。
长期N添加试验在落叶松和水曲柳两种人工林中开展。两种人工林均栽种于1986年,且立地条件一致[19],株行距为1.5 m × 2.0 m。2002年5月,在每种人工林中随机设立了6个20 m × 30 m的样地、3个N添加处理样地和3个对照样地。自2003年起开始施加NH4NO3,N添加量为10 g/(m2·a),其中5、6、7、8和9月的施N量分别是总量的15%、21%、28%、21%和15%[20]。
1.2 样品采集
2018年7月,在每个样地内随机选择7个位置采集0~10 cm土壤样本,将每个样地内的7个土壤样品混合。去除土壤样品中的石块和植物根系,过孔径2 mm土壤筛。一部分样品储存在4 ℃冰箱中,用于分析有效N、有效P、微生物生物量和酶活性;另一部分样品风干粉碎后用于分析土壤总有机C、全N、全P和土壤C组分。
1.3 样品分析方法
用2 mol/L KCl提取土壤无机氮(IN);用0.5 mol/L NaHCO3提取土壤有效磷(AP)。土壤全氮(TN)采用浓硫酸+硫酸铜+硫酸钾进行土壤消煮,全磷(TP)采用高氯酸进行土壤消煮,浸提液和消煮液中的IN、AP和TN、TP含量均由连续流动分析仪(BRAN+LUEBBE-AA3, Germany)测定。土壤总有机碳(TOC)含量由Multi N/C 2100s分析仪固体模块(Analytik Jena AG,Germany)测定。采用酸水解法[21]测定有机碳组分,将总有机碳分为活性碳库Ⅰ(LPⅠ-C)、活性碳库Ⅱ(LPⅡ-C)和惰性碳(RP-C)库。首先用2.5 mol/L H2SO4在105 ℃下水解30 min提取活性碳库Ⅰ;然后在室温下用13 mol/L H2SO4水解过夜,提取活性碳库Ⅱ;总有机碳浓度与两个活性碳库浓度的差值为惰性C库的浓度。
土壤微生物生物量碳(MBC)、土壤微生物生物量氮(MBN)采用氯仿熏蒸-浸提法测定[22]。新鲜土样置于烧杯中,于25 ℃真空条件下用氯仿熏蒸处理24 h。未熏蒸组不添加氯仿同样条件下处理24 h。用0.5 mol/L K2SO4分别浸提熏蒸组和未熏蒸组的C、N元素。利用Multi N/C 2100s分析仪液体模块测定两组浸提液中的C、N浓度,其中未熏蒸组的C、N含量分别为土壤溶解性有机氮(DOC)、溶解性有机碳(DON)含量。MBC、MBN分别为熏蒸组和未熏蒸组浸提液中C、N含量的差值。
土壤酶活性的测定参考Martens等[23]的方法。β-1,4-葡萄糖苷酶或几丁质酶活性的测定方法为:精确称取鲜土1 g,加入4 mL醋酸缓冲液(pH为5.0,0.1 mol/L)和1 mL对硝基苯-β-D吡喃葡萄糖苷(BG底物, 0.025 mol/L)或β-N-乙酰氨基葡萄糖苷(NAG底物, 0.01 mol/L),漩涡震荡混匀,然后将土浆在35 ℃下培养1 h。培养结束后加入1 mL CaCl2溶液(0.5 mol/L)和4 mL NaOH溶液(0.5 mol/L),漩涡震荡后过滤,分光光度计410 nm下测量滤液吸光值。酸性磷酸酶活性的测定与BG、NAG的步骤相同,具体将缓冲液改为通用缓冲液(pH为6.0),底物为对硝基苯磷酸二钠(0.025 mol/L)。酚氧化酶的测定方法以50 mmol/L邻苯三酚(1,2,3-三羟基苯)为底物,培养2 h,在460 nm处测定吸光值。除了向反应液中加入H2O2,过氧化物酶测定步骤与酚氧化酶的测定步骤相同,加入H2O2后的总活性减去酚氧化酶活性即为过氧化物酶活性。以上所有酶活性的单位为μg/(g·h)。
1.4 数据处理
利用单因素方差分析(One-way ANOVA)检验落叶松和水曲柳人工林间土壤C、N、P组分及相关酶活性的差异显著性(α= 0.05)。自然对数转换后的响应比(RR,公式中以RRR表示)用于量化N添加对相关指标的影响程度:
式中,xt和xc分别是N添加和对照处理相应变量的平均值。若RRR大于0且95%置信区间不包含0,表明N添加导致该参数显著增加;若RRR小于0且95%置信区间不包含0,表明N添加导致该参数显著减少;若95%置信区间包含0,则表明N添加没有显著改变该参数。采用线性回归分析量化变量间的相关性,利用SPSS 19.0进行统计分析,利用SigmaPlot 14.0进行作图。
2 结果与分析
2.1 水曲柳和落叶松人工林土壤C、N、P组分和微生物活性对比
经测定发现,水曲柳和落叶松两种人工林间土壤总有机C含量没有显著差异(表1)。此外,两种人工林间土壤溶解性有机碳(表1)和微生物生物量碳(表2)大小也相当。然而,两种人工林间酸水解法划分的土壤C组分具有显著差异(表1)。落叶松人工林土壤活性碳库Ⅰ是水曲柳人工林的1.3倍,但落叶松人工林土壤惰性C库比水曲柳人工林的惰性C库低9.8%。两种人工林间土壤全氮、溶解性有机氮、微生物生物量氮以及无机氮含量均无显著差异(表1、表2)。尽管落叶松人工林的全磷和有效磷含量均高于水曲柳人工林,但两者间差异并不显著(表1)。水曲柳和落叶松两种人工林土壤β-1,4-葡萄糖苷酶活性差异显著,前者是后者的1.4倍(表2)。尽管几丁质酶、酸性磷酸酶、酚氧化酶、过氧化物酶活性均呈现水曲柳人工林大于落叶松人工林,但两者间差异并不显著(表2)。

表1 水曲柳和落叶松人工林土壤C、N、P组分对比

表2 水曲柳和落叶松人工林土壤微生物生物量及相关酶活性对比
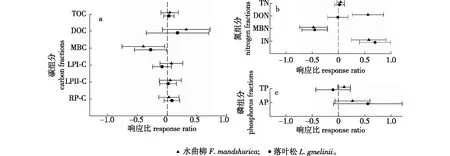
TOC.土壤总有机碳 soil total organic carbon;MBC.微生物生物量碳 microbial biomass carbon;LPI-C.活性碳库Ⅰ labile carbon pool I;LPⅡ-C.活性碳库Ⅱ labile carbon pool Ⅱ;RP-C.惰性碳库 recalcitrant carbon pool;DOC.溶解性有机碳 dissolved organic carbon;TN.土壤全氮 soil total nitrogen;DON.溶解性有机氮 dissolved organic nitrogen;MBN.土壤微生物生物量氮 microbial biomass nitrogen;IN.土壤无机氮 inorganic nitrogen;TP.土壤全磷 soil total phosphorus;AP.土壤有效磷 available phosphorus。图1 氮添加对水曲柳和落叶松人工林土壤碳、氮、磷组分的影响Fig.1 Effects of nitrogen addition on soil carbon, nitrogen and phosphorus fractions in F. mandshurica and L. gmelinii plantations
2.2 N添加对土壤C、N、P组分的影响
N添加对两种人工林土壤TOC以及酸水解法划分的土壤C组分均没有显著影响,但导致水曲柳和落叶松人工林的MBC含量均显著降低(图1a),降低幅度达32.9%和24.2%。N添加没有显著改变两种人工林的土壤TN含量,却显著增加了两种人工林的无机氮含量,并显著降低了水曲柳和落叶松人工林的MBN含量(图1b),降低幅度达37.7%和36.3%。N添加没有显著改变土壤TP和AP的大小(图1c)。回归分析显示,土壤微生物生物量随着土壤pH的降低而显著降低(图2a),却随着土壤无机氮含量的增加而显著降低(图2e)。
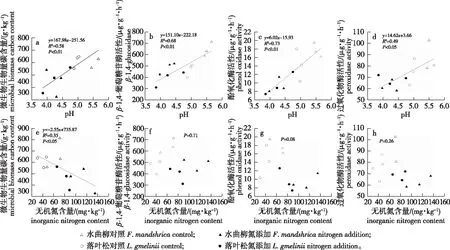
图2 水曲柳和落叶松人工林土壤微生物生物量碳以及胞外酶活性与土壤pH以及土壤无机氮间的关系Fig.2 Relationships between microbial biomass carbon or extracellular enzymes and soil pH or inorganic nitrogen in F. mandshurica and L. gmelinii
2.3 N添加对土壤酶活性的影响
N添加显著抑制了落叶松人工林的几丁质酶活性,但并不影响该人工林的其他酶活性(图3)。与落叶松人工林不同,N添加导致水曲柳人工林β-1,4-葡萄糖苷酶、酚氧化酶和过氧化物酶活性分别降低了24.5%、46.7%和28.6%,却显著促进几丁质酶活性提高27.0%。回归分析显示,β-1,4-葡萄糖苷、酚氧化酶和过氧化物酶活性随着土壤pH的减小而显著降低(图2b、2c、2d),但3种酶活性与土壤无机氮含量无关(图2f、2g、2h)。
3 讨 论
3.1 水曲柳和落叶松人工林土壤C组分比较
树种通过影响凋落物数量和质量以及改变土壤理化性质进而影响土壤C含量及其组分大小[24]。尽管Lin等[13]的整合分析发现丛枝菌根(AM)森林土壤C含量略高于外生菌根(ECM)森林,但在温带森林中AM和ECM林型间并没有显著差异,与本研究结果一致。通常低质量的凋落叶中因含有大量难分解物质,会导致土壤中累积更多的稳定性有机质[25]。但微生物效率-基质稳定假说(MEMS)认为微生物的C利用率及其残体输入是土壤稳定性有机C的主要决定者[17]。凋落物质量越高,凋落物分解过程中更多的C将会和土壤矿质形成更稳定的有机质,这可能导致水曲柳土壤惰性C比例显著高于落叶松。笔者研究发现水曲柳和落叶松人工林间土壤惰性C的绝对差值很小。这可能是因为土壤有机C的稳定性不仅取决于自身的化学组成,还依赖于微团聚体和矿质保护作用。本研究中两种林型位置相邻,这可能导致两种林型惰性C差异较小。微生物生物量大小主要受到土壤C和养分驱动[26],两种人工林的土壤TOC、TN、TP含量相同,一定程度解释了两种人工林具有相同的MBC。
3.2 水曲柳和落叶松人工林土壤微生物量及其胞外酶活性对N添加的响应
长期N添加显著降低了两种人工林的MBC、MBN含量。首先,N添加会引起土壤酸化和钙、镁离子的流失并抑制土壤微生物的生长[27]。本研究土壤MBC含量随土壤pH和IN的显著变化表明,N添加通过土壤酸化途径影响土壤微生物的生长。其次,该样地的前期研究发现N添加会导致两种人工林细根生物量显著降低[28],细根生物量的降低会减少根际分泌物,从而降低土壤微生物生物量。最后,本研究中N添加速率较大且时间较长,而N添加对土壤微生物生物量的抑制作用会随着N添加速率和时间的增加而增加[27, 29],这可能导致N添加对两种人工林MBC的抑制作用是全球平均水平的5.2倍[10]。
长期N添加降低了两种林型的β-1,4-葡萄糖苷酶和酚氧化酶活性。酚氧化酶活性的降低可能是因为N添加会抑制土壤中产生木质素降解酶的关键类群[白腐担子菌(White-rot,Basidiomycetessp.)和软腐子囊菌(soft-rot,Ascomycetessp.)]的生长[27, 30-31]。然而,落叶松人工林酚氧化酶活性的降低并不显著。落叶松凋落物分解速度很慢,其地表覆盖较厚枯落物,这可能需要微生物投入大量的C水解酶进行分解。此外,ECM真菌比AM真菌对惰性有机质的分解能力更强[32],这可能会抵消N添加的负面效应。两种林型的几丁质酶活性对N添加的响应也不相同。Jian等[30]和Xiao等[33]的整合分析都发现N添加不会显著影响几丁质酶活性,Chen等[34]的整合分析却发现N添加显著增加了几丁质酶活性,这表明N添加对几丁质酶的影响并无定论。并且,树种会显著改变微生物胞外酶活性对N添加的响应。Weand等[35]在美国卡茨基尔山脉地区比较了5种人工林微生物胞外酶活性对N添加的响应,结果发现不同树种氧化酶和水解酶活性对N添加的响应并不一致。此外,本研究仅在生长季旺期取样1次,由于酶活性具有很大的季节变异性,这也可能会导致不同研究间结论的不一致性。例如,Allsion等[36]在阿拉斯加黑云杉(Piceamariana)林中的研究发现N添加对β-1,4-葡萄糖苷酶和几丁质酶的影响均因季节而异。总之,树种和季节对土壤生态学过程的调控及其对N添加的响应还存在较大不确定性,潜在的机理还需要进一步研究。
3.3 水曲柳和落叶松人工林土壤C、N、P组分对N添加的响应
整合相关研究[37],分析结果显示N添加会通过抑制C分解、增加C输入来增加土壤有机C,这种正效应会随着N添加时间增长而增加[38],这与笔者的结果矛盾。这种矛盾可能主要由以下方面所致:首先,两种人工林表层TOC本底值很高(接近100 g/kg,表1),16年的N添加处理可能还难以导致TOC显著增加;其次,以往研究显示16年的N添加没有显著增加两种人工林的生产力[18],即N添加对地上植被生产力的促进效应在寒冷地区并不明显[39]。此外,前期研究发现N添加会导致两种人工林细根生物量显著降低[28],而细根比地上凋落叶含更多的木质素等难降解的物质,是土壤惰性C的主要来源[40-41]。全球尺度上的研究表明森林地下根系凋落物对土壤有机碳的贡献高达48%[42]。在北美五大湖区不同纬度阔叶林的研究发现细根凋落物对土壤惰性C的输入量是地上凋落叶的2倍以上[40]。因此,微生物分解作用的降低可能会被细根生物量的降低所抵消,导致人工林的TOC没有显著变化。N添加也没有引起DOC和酸水解法划分的C组分发生显著变化,这与涂利华等[43]以及林伟等[44]的研究相符。以往研究认为N添加通过降低氧化酶活性来减少惰性C分解,进而增加土壤惰性C库[5]。但最新C循环理论框架认为土壤有机C的形成取决于微生物分解代谢及其残体的输入,而微生物残体能够贡献土壤有机C储量的30%~60%[45]。一方面,16年的N添加没有降低落叶松人工林的氧化酶活性,这导致落叶松人工林土壤C组分并没有发生变化;另一方面,微生物残体输入可能会改变土壤C组分对N添加的响应。
N添加显著增加了IN含量却对TN含量没有显著影响。首先,TOC和TN之间具有紧密的耦合关系,N添加并不会改变这种关系[46];其次,N添加会促进净N矿化、反硝化等过程[47],进而加快土壤N向大气的释放。长期N添加并没有显著改变土壤TP和AP的大小,这可能是由于土壤P主要依赖于土壤母质特征[48],而表层土壤P的变化主要依赖于风化程度[49]以及植被在土壤剖面上的重新分配作用。
总之, N添加主要通过改变土壤pH来影响微生物生物量和C水解酶活性。N添加对两种人工林β-1,4-葡萄糖苷酶和氧化酶活性的不同响应可能与两种人工林凋落物质量和菌根类型不同有关。尽管N添加抑制了微生物生长并改变了胞外酶活性,但16年的N添加并没有增加土壤C含量和改变土壤C组分,表明未来需要从土壤有机C的来源(植物和微生物残体)和稳定性(矿质保护)等过程揭示N添加对土壤C的影响机制。
