BSA对FGF5基因编辑绵羊精液冷冻的效果分析
2022-10-19毛林军玛依拉杜鹏程阿拉达尔彭新荣
毛林军,玛依拉,杜鹏程,雷 熙,齐·阿拉达尔,彭新荣*
(1.新疆农业大学动物科学学院,乌鲁木齐 830052;2.新疆畜牧科学院生物技术研究所,乌鲁木齐 830011)
成纤维细胞生长因子(Fibroblast growth factors,FGFs)是具有多种生物活性的多肽生长因子。在脊椎动物发育过程中,FGF信号在各种进程的调节都表达和参与。FGFs通常很小,大约17~35 kDa,是一种分泌型的高度碱性蛋白质[1]。在哺乳动物的发育系统中有22个FGF成员根据其序列同源性和生化特性分为7个亚家族。成纤维生长因子5(fibroblast growth factor,FGF5)属于一种调控毛发生长周期的调控因子,诱导生长期的毛囊进入退行期,FGF5转基因突变小鼠的被毛长度比野生型明显增长[2,3],FGF5基因删除绵羊羊毛长度明显增加。通过对FGF5基因编辑绵羊表型数据的采集,整理和分析,其后代细毛长度和产量分别比野生型提高18.8%和30.3%。精液冷冻对畜牧业生产至关重要,利用精液冷冻技术将这些稀有和珍贵的品种以及品种优良的个体进行精液冷冻,并且能够促进动物遗传资源的长期保存和加速遗传多样性的传播;FGF5基因编辑绵羊的精液冷冻保存不仅可以将优秀的品种和基因资源进行长期保存,而且能有效减少基因编辑绵羊的存栏数,优化种质资源的配置。为长期保存基因编辑绵羊种资源提供理论依据和技术帮助,从而提高良好的推广价值和经济效益。精子的冷冻保存技术不仅可以大大减少必须保存的动物数量,更有效地存档基因改造品系,并便于与其他实验室交换品系,从而提高动物福利和成本效益;还可以将优良的种质资源进行长期保存,并能够使遗传优势品种得以广泛传播;同时也有助于在日常生活中推广人工受精,增加经济效益。精液冷冻保存可使因年老、疾病、残疾而被淘汰或死亡的优良品种仍然可以繁衍后代[4]。BSA是牛血清中的一种球状蛋白,是牛血清的主要成分,能与小分子物质及多种阴、阳离子结合,能为血液起到营养、载体蛋白、p H缓冲及维持渗透压等作用[5,6];在精液中,BSA与精子质膜中的磷脂相互作用,减小在精液冷冻保存过程中精子的损伤程度[7],可通过吸附和清理细胞膜外的离子及小分子物质,保持精子膜内外的渗透压平衡,减少精液在稀释、冷冻过程中对精子质膜的损伤,有效保护精子的质膜,提高精液冷冻保存效果[8]。BSA还可作为营养物质,在冷冻保存过程中给精子提供能量和运动等生理功能。本试验在常规精液冷冻保护中添加不同浓度的BSA,以期提高FGF5基因编辑绵羊精液冷冻效率。
1 材料与方法
1.1 试验动物
本实验以新疆畜牧科学院生物技术研究中心所属中澳绵羊育种研究所(绵羊繁殖实验基地)课题组成功构建的成年3只FGF5基因编辑绵羊为研究对象。
1.2 试验材料
精子全自动分析仪(南宁松景天伦生物科技有公司)、精子质膜完整性双重性荧光染色试剂盒(上海杰美基因医药科技有限公司)、精子顶体形态花生凝集素荧光染色试剂盒(上海杰美基因医药科技有限公司)等。
1.3 试验方法
1.3.1 精液的采集
选择一只个体大小与采精公羊相似,发情明显、性情温顺的母羊作为台羊,牵至采精场地保定好。将采精公羊赶到采精场外的栏里,把采精场地门打开让采精的公羊自己进入采精场地,防止采精公羊受惊或应激,不要用力拉拽进去。为了让公羊的性欲更旺盛和精液不受污染,采精公羊进入场地后不要让其立刻去爬胯母羊,将包皮周围的毛用毛巾擦拭清理干净[9,10],再让其自行爬胯台羊。采精人员右手持安装好集精杯的假阴道身体蹲于台羊的右后侧,假阴道前端呈三角形的内胶胎低于后端装好的集精杯,假阴道与地面呈40~45度的角靠近台羊的臀部,当公羊爬胯到台羊的背上伸出阴茎时,采精人员用左手及时托住阴茎包皮,将阴茎轻轻导入假阴道内,阴茎在假阴道内抽搐几下后,公羊的后躯急速向前猛力一冲,并弓腰后,射精完成[11,12]。绵羊的受精过程只有几秒钟,采精人员需集中精力。公羊从母羊身上跳落下来时,采精人员顺着公羊的动作取下假阴道,取下集精杯,将刚采下的精液送至实验室进行处理。
1.3.2冷冻液配方
1.3.3 稀释比例
本实验采用两次稀释法,采集精液后要迅速进行稀释,每次稀释都在等温的条件下添加A液和B液。稀释比例:各组的A液与精液的稀释比例为1∶1或按照精子的密度大小和直线前进的活力将稀释倍数至1∶2,B液的稀释量为鲜精与A液稀释后相等的量比例为1∶1。将各个冷冻液按照配方精确称量,加入双蒸水进行溶解,之后加入不同浓度的BSA,混匀后过滤分装,保存于-20℃备用。使用时将冷冻液放于37℃水浴锅中解冻融化,与采集后的鲜精等温稀释混合[13]。
1.3.4 BSA对FGF5基因编辑绵羊常温保存效果的影响
将采集的精液放于含不同浓度(0%、0.2%、0.5%、1%)的BSA精液冷冻保护剂中,于常温(18℃~20℃)保存,每隔6 h检测精子的活率,查看不同浓度的BSA对FGF5基因编辑绵羊精液保存时间的影响。
1.3.5 FGF5基因编辑绵羊的精液冷冻程序
1.3.5.1 精液平衡 本试验采用二次平衡法,第一次平衡,将刚采集来的新鲜精液在显微镜下(×400倍)观察精子的密度、活率、精子直线前进的活力,并记录,然后添加与精液量同等或2倍不含甘油各组的A液,轻轻摇晃,将标签贴在A液稀释后的15 mL的离心管盖上做好标记,各组稀释后的精液均置于室温10 min待温度降至自然温度后,用6~8层纱布将其包裹[14,15],移至4℃冰箱平衡,时间均为2 h,对平衡后的精液进行活率检测,做好记录。第二次平衡,将各组第一次稀释平衡后的FGF5基因编辑绵羊精液在冰箱里添加与A液和精液稀释后等量的含甘油的各组B液,轻摇混合后再放置4℃冰箱平衡2 h。对平衡后的精子活率进行检测,做好记录。精液平衡完后,将精液吸入0.25 mL细精管内分装好,将细精管平放于自制的铁架上,再将铁架缓慢放进提前准备好温度-125℃的泡沫箱里进行熏蒸,细精管与液氮面的距离在保持3 mL,熏蒸8 min,熏蒸完毕后将细精管投入液氮中进行冷冻;在泡沫箱里将细精管装入标记好的冻存管里放入纱布袋子放进液氮罐里保存[16,17]。用纱布胶带做好冻存时间、羊号等信息。冻精过程要严格把控温度。
1.3.5.2 解冻 用镊子从液氮罐中取出冻存的FGF5编辑绵羊的细精管,在空气中轻晃动8~10 s,置于38~40℃水浴中轻摇晃动解冻15~30 s,拿出用酒精棉球将细管擦拭,擦干后用消过毒的剪刀将其剪开置于1.5 mL的EP管里,然后剪断细精管的另一头,将精液自然流进EP管里,然后对精液进行品质检测[18]。
1.3.6 精液品质的检测
1.3.6.1 活率检测 采用伊红-苯胺黑染色法检测常温保存时的活率[19]。观察精子的染色情况,未着色的精子为白色即为活精,着色的精子即呈红色为死精,背景呈紫红色。利用迈朗精子全自动分析系统对冷冻后的精子进行基础指标检测。每个样本在显微镜(×400倍)镜下观察5个视野,每次计数200个精子,记录未着色(活精)的精子数量,计算未着色的精子占200个精子的百分比,即精子活率=未着色的精子数/总精子数×100%。
1.3.6.2 畸形率检测 本实验采用的是姬姆萨染色法检测精子的畸形率[20]。置于显微镜下放大400倍观察精子形态,数不同视野下200个精子,计算精子的畸形率:畸形率=(精子畸形数/200)×100%。
1.3.6.3 精子的质膜完整性检测 采用精子质膜完整性双重性荧光染色法[21],按试剂盒的说明进行试验检测,具体操作如下:
(1)取1 mL解冻后的FGF5基因编辑绵羊精液放于1.5 mL的离心管中;
(2)将有精液的离心管放于37℃培养箱内孵育30 min;
(3)取出离心管于微孔板迷你离心机离心5 min,600 g;
(4)小心抽取上清液弃掉;
(5)离心管内加入1 mL GENMED保存液(Reagent A),混匀颗粒群;
(6)吸取100 μL精子于新的1.5 mL的离心管力;
(7)加入10 μLGENMED染色液A(Reagent B),混匀;
(8)37℃培养箱孵育10 min,避免光照;
(9)取出离心管向内小心加入5 μLGENMED染色液B(Reagent C),混匀;
(10)37℃培养箱孵育10 min,避免光照。
(11)吸取50 μL到载玻片上,盖上盖玻片,镜下观察。
每次随机选择5个视野,每个视野中精子计数在200个。绿色荧光GENMED染色液A激发波长490 nm,散发波长520 nm。红色荧光GENMED染色液B激发波长488 nm,散发波长630 nm。镜下观察染色结果,整个精子头部呈现明亮绿色荧光说明质膜完整,整个或部分精子头部呈现红色荧光说明质膜完全损伤,整个精子头部呈现橘黄色荧光说明质膜损伤。置于显微镜下放大400倍观察精子形态,数不同视野下200个精子。质膜完整率=(总精子数-质膜不完整精子数)/200×100。
1.3.6.4精子顶体完整性检测 采用精子顶体形态花生凝集素荧光染色法[22]。按试剂盒的说明进行试验检测,具体操作如下:
(1)取1 mL解冻后的FGF5基因编辑绵羊精液放于1.5 mL的离心管中;
(2)将有精液的离心管放于37℃培养箱内孵育30 min;
(3)取出离心管于微孔板迷你离心机离心5 min,600 g;
(4)小心抽取上清液弃掉;
(5)离心管内加入1 mLGENMED保存液(Reagent A),混匀颗粒群;
(6)吸取100 μL精子于新的1.5 mL的离心管内;
(7)加入10 μLGENMED染色液A(Reagent B),混匀;
(8)室温孵育5 min,避免光照;
(9)取出离心管于微孔板迷你离心机离心5 min,600 g;
(10)小心抽取上清液弃掉;
(11)加入500 μLGENMED清理液(Reagent C),混匀颗粒群;
(12)取出离心管于微孔板迷你离心机离心5 min,600 g;
(13)小心抽取上清液弃掉;
(14)重复(11)-(13)一次;
(15)向离心管内加入100 μLGENMED保存液(Reagent A),混匀颗粒群;
(16)即刻移取20 μL置洁净的载玻片一端;
(17)用吸头或载玻片将精液轻推匀载玻片另一端;
(18)置于空气中晾干;
(19)加上200 μL预冷的GENMED固着液(Reagent D),覆盖样品表面;
(20)室温下孵育1 min;
(21)小心抽去固着液(用吸纸将固着液吸去);
(22)小心加上200 μL GENMED染色液B(Reagent E),覆盖样品表面;
(23)室温下孵育20 min,避免光照;
(24)小心抽去染色液(用吸纸将染色液吸去);
(25)小心加上200 μL GENMED清理液(ReagentC),覆盖样品表面;
(26)小心抽去清理液(用吸纸将清理液吸去),盖上盖玻片;
(27)荧光显微镜下观察计数,每次随机选择5个视野,每个视野中精子数在200个。
观察蓝色荧光GENMED染色液A(Reagent B):激发波长350 nm,散发波长460 nm,可见亮蓝白色荧光,表明死亡精子细胞;暗淡蓝色荧光,表明活体精子(注意:在GENMED固着液(Reagent D)处理之前,进行观察)。
观察绿色荧光-GENMED染色液B(Reagent E):滤波器激发波长490 nm,散发波长530 nm,可见绿色荧光,表明精子顶体区域。观察结果:整个顶体均匀明亮,呈绿色荧光说明顶体完整;顶体赤道面均匀,呈明亮绿色荧光,而20%顶体帽端无荧光显示,说明顶体分散不均;精子头部无荧光,说明顶体缺失。置于显微镜下放大400倍观察精子形态,数不同视野下200个精子。顶体完整率=(总精子数-顶体不完整精子数)/200×100。
1.3.7 统计分析
本试验所收集的数据使用Excel 2019版本软件进行整理分析,显著性分析用SPSS 26.0统计软件单因素方差分析(One-way ANOVA)进行,结果以平均值±标准差(Mean±SD)的形式表示,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析
2.1 不同浓度的BSA对FGF5基因编辑绵羊精液常温保存效果的影响
由表1显示FGF5基因编辑绵羊的精液在常温(18℃~20℃)的条件下保存,保存18 h前添加不同浓度BSA的保护剂在各时间点的精子活率均高于浓度为0%的BSA组,差异显著(P<0.05),精子活力都能保持60%以上;保存18 h后浓度为0.5%BSA在各时间点的精子活率高于其他组,差异显著(P<0.05)。

表1 不同浓度BSA对FGF5精子活率及存活时间的影响
2.2 不同浓度的BSA对FGF5基因编辑绵羊精液冷冻-解冻后活率、活力、直线速率(VSL)、侧摆幅值(ALH)的影响
通过迈朗精子全自动分析系统可以分析精子的活力、活率、运动速率和运动轨迹等相关信息。如表2所示,在精液冷冻保护剂中加入BSA可以显著提高FGF5基因编辑绵羊精液冷冻后精子的活率、活力。添加的浓度为0.5%的BSA精液解冻后的精子活率和活力、直线速率较对照组和浓度为0.2%和1%的试验组有着显著性差异(P<0.05),精子活率为39.81%。BSA浓度为0.2%和1%精液解冻后的精子活率和活力、直线速率均无显著差异(P>0.05);BSA的浓度为0.2%和1%精液解冻后的精子活率和活力较于对照组有显著性差异(P<0.05),直线速率无显著差异(P>0.05);经试验表明浓度为0.5%的BSA组优于其他组。

表2 冷冻液配方
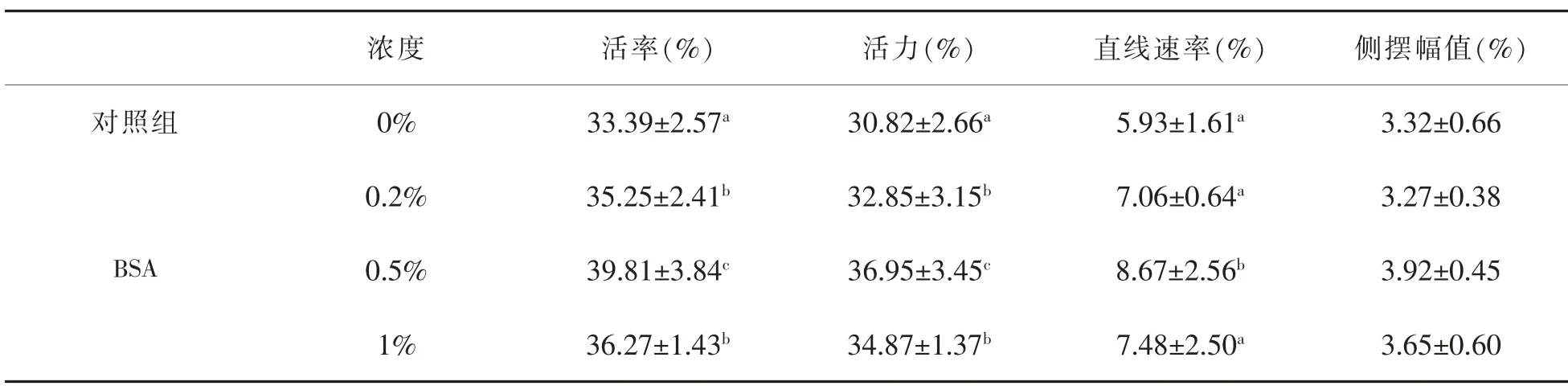
表2 不同浓度的BSA对FGF5基因编辑绵羊精液冷冻-解冻后的影响
2.3 不同浓度BSA对FGF5基因编辑绵羊精液冷冻-解冻后精子形态结构完整性的影响
表3表明了在精液冷冻保护剂中添加BSA对绵羊精液冷冻-解冻后精子结构完整性的影响。在常规精液冷冻保护剂中添加不同浓度的BSA后,精子的形态结构完整性均高于对照组,其中添加BSA的浓度为0.5%的效果相对优于其他组;添加BSA的浓度为0.5%精子顶体完整率显著高于BSA浓度为0.2%、1%和试验组(P<0.05),浓度为0.5%的精子畸形率显著低于其他试验组和对照组(P<0.05)。BSA浓度为0.2%、1%精子的形态结构无显著性差异(P<0.05)。

表3 不同浓度BSA对精液冷冻-解冻后精子形态结构完整性的影响
3 讨 论
FGF5已被证明是调节头发生长的一个强有力的候选基因,FGF5基因修饰可以促进毛发生长并延长毛囊的生长期,进而改善羊毛品质而且能稳定遗传[23]。FGF5通过促进毛囊从生长期转变为退化期,从而抑制毛囊的生长,负面调节毛囊生长周期。因此,FGF5基因在调节被毛长度等方面起着重要作用。最近,许多研究人员发现FGF5基因在许多物种中都是多态的,在几种哺乳动物物种中已经描述了与长毛表型相关的功能缺失突变[24]。然而,目前对FGF5基因的进化特征和生物学机制知之甚少。本研究以此前成功获得的FGF5基因编辑绵羊为研究对象,该绵羊具有高品质性状和优良的羊毛长度,显著提高了羊毛产量、伸直长度和自然毛长,且表型性状可稳定遗传。精液冷冻保存不仅可以长期将FGF5基因编辑绵羊基因资源进行长期保存,而且能有效减少基因编辑绵羊的存栏数,优化种质资源的配置。精子冷冻保存在畜牧业生产至关重要,它能够促进和加速遗传多样性的传播,并促进遗传优势动物在世界各地的分布[25~27]。有研究表明,在精子冷冻保存中精子活率、活力和精子细胞膜稳定性等是最重要的[28~30]。BSA对离子和小分子进行清除平衡精子质膜两侧的渗透压,并且阻止精子质膜与活性氧发生过氧化反应,从而有效地保护精子质膜。Rachmawati等[31]报道,在牛精液冷冻保护剂添加为浓度0.2%的BSA最适浓度,可防止精液在冷冻过程中发生休克。本试验研究结果显示,在常温保存条件下,常规冷冻保护剂中添加浓度为0.5%的BSA对FGF5基因编辑绵羊精液稀释保存时精子活率的保持情况最好,说明了浓度为0.5%的BSA有助于提高FGF5基因编辑绵羊精液的生存能力,这与李彦林等[32]的研究结果不一致,其研究结果是在精液稀释液中添加0.2%BSA对马鹿精子的保存效果更佳。在对添加BSA浓度的精子冷冻研究中,添加BSA的最适浓度结果有所差异,这可能是由于精子的冷冻保护剂和稀释液以及试验动物品种之间有差异性所导致。在本试验中发现,过多或少量的BSA都不利于FGF5基因编辑绵羊精子的生存能力和冷冻效果,这与崔凯[33]研究结果一致。在精液冷冻保存过程中,添加不同浓度的BSA对绵羊精液的冷冻保存有一定的改善和提高。此次试验筛选出浓度为0.5%的BSA对FGF5基因编辑绵羊精液冷冻效果最佳。为FGF5基因编辑绵羊的精子冷冻保存提供了合理的理论依据、技术帮助和有益的参考。
4 结论
本试验表明,在绵羊的常规冷冻保护剂中添加一定浓度的BSA对精液冷冻能起到改善作用,且在精液冷冻的生产实践中有一定的实际意义,在常规精液冷冻保护剂中添加0.5%的BSA能显著改善解冻后精子的各项指标,有利于FGF5基因编辑绵羊精液的冷冻保存。
