杜仲F1代叶表型变异分析及单株评价
2022-10-17孟益德刘辰露杜庆鑫杜红岩杜兰英黄海燕李相军
庆 军 孟益德 刘辰露 杜庆鑫 杜红岩 杜兰英 黄海燕 李相军 王 璐
(1. 中国林业科学研究院经济林研究所,河南 郑州 450003;2. 中国林业科学研究院经济林研究所经济林种质创新与利用国家林业局重点实验室,河南 郑州 450003;3. 中国林业科学研究院经济林研究开发中心,河南 郑州 450003;4. 中南林业科技大,湖南 长沙410000;5. 河南润友林业技术服务有限公司,河南 郑州 450008;6. 汉滨区林业局,陕西 安康 725000)
杜仲(Eucommia ulmoides)为单科单属单种植物,是我国特有经济树种,国家二级保护植物,也是我国战略树种,具有很高的经济价值和生态效益[1-2]。杜仲为传统的名贵药材,药用历史悠久,早在《神农本草经》中被列为上品,具有补肝肾、强筋骨、安胎的功效[3-4]。杜仲传统药用部位以树皮为主,由于从种植到剥皮周期较长,且剥皮后养护措施较为重要,如有处理不当将导致死亡[5]。杜仲皮主要含有环烯醚萜类、杜仲胶、苯丙素、木脂素及黄酮类等多种化合物,其中所占比例较大的为木脂素类及环烯醚萜类物质[6]。杜仲叶活性成分和药理作用与杜仲皮相似,也包含环烯醚萜类、苯丙素类、木脂素类、黄酮类、多糖类及杜仲橡胶等,也有抗炎、阵痛、抑菌、免疫调节等功,2015年杜仲叶被载入《中国药典》[4],2018年杜仲叶被纳入“药食同源”目录[7-9]。杜仲叶中苯丙素类的绿原酸,具有抗菌、抗病毒、提高免疫力等功效;环烯醚萜类的京尼平苷酸、京尼平苷具有理单、健胃、抗菌消炎等多种功效,桃叶珊瑚苷具有强筋健骨、治疗肝损伤及神经保护作用,车叶草苷等具有清除自由基、保护肝脏和降血压等作用[10-11]。
叶片表型特征可以直接影响植物的基本行为和功能,与植物生理生化特征和遗传育种、作物栽培等密切相关[12-13]。性状取决于植物的遗传特性,而且叶表型性状也是区分品种及鉴定品种的一个重要指标[14-15],对表型性状遗传变异规律研究是选育新品种的基础[13,16]。杜仲叶在2018年被列入药食同源植物,即杜仲叶可药用也可食用。基于杜仲叶药食同源的价值,对杜仲叶开展了多方面研究,也开发了多种产品,设计中成药、保健食品、茶叶等普通食品、饲料添加剂和日化用品等多种产品[17]。高燕等[18]研究表明,杜仲叶显著影响绵羊机体的糖代谢,提高糖酵解关键酶基因的表达,抑制糖异生相关转录因子及酶基因的表达,进而可以降低血糖。就杜仲产业发展而言,单一依赖杜仲皮的开发利用已经不能满足杜仲产业的发展,所以定向育种,培育出综合利用性高、经济价值高的杜仲新品种是必不可少的。
杂交育种是种质创新和新品种培育最有效的方法之一,在林木遗传育种中被广泛应用。因此,培育优良的杜仲叶用新品种,对增产杜仲栽培、发展杜仲药用产业具有重要意义。杂交育种过程中后代的杂种优势是育种成功的关键,对子代表型性状遗传变异规律研究是选育新品中的基础[19]。杜仲育种工作主要集中在苗木育种技术、造林技术、遗传改良及生态维护等[20-21]。目前,我国学者对不同区域的杜仲种质资源的表型多样性、活性成分多样性进行了初步探讨和研究[7,22]。杜仲叶片相关研究主要集中在不同种质资源的活性成分提取及活性成分,叶片表型遗传变异等方面[11]。而对杜仲杂交子代叶片表型性状的遗传变异规律尚未见报道。本研究基于杜仲杂交F1代的109子代个体,通过对杜仲叶片的5种主要药用活性成分及12个叶形态进行分析,通过多样性分析、相关性分析、t检验、隶属函数及杂种优势等分析方法,旨在筛选出具有连年稳定性状的优良单株,为杜仲良种选育、遗传育种研究供参考依据。
1 材料与方法
1.1 试验材料
以选育的杜仲良种“华仲8号”(♀)和“华仲12号”(♂)作为亲本进行杂交,杂交试验于2015年春季进行,2015年秋季收获杂交种子并进行沙藏,2016年早春季进行播种。播种前需对种子使用30 ℃水浸泡12 h后再进行播种,经播种后最终获得109株杜仲杂交子代幼苗。2017—2019年,以其109个杂交后代的F1群体为试验材料进行叶片采集和测量。所有试验材料均在中国林业科学研究院经济林研究开发中心河南省新乡市原阳县实验基地(34°55′18″N;113°14′35″E)的同一样地进行种植培育。杂交亲本“华仲8号”杜仲果实大,长1.00~1.29 cm,宽0.18~0.26 cm,果皮杜仲胶含量可达到12.72%~17.97%,“华仲12号”花期在3月上旬至4月中旬,雄花6~11枚簇生于当年生枝条基部,雄蕊长0.9~1.2 cm,叶片绿原酸含量可达4.9%。桃叶珊瑚苷和京尼平苷对照品购自于中国食品药品检验所,京尼平苷酸、绿原酸、车叶草苷对照品均购自于曼思特生物科技有限公司,实验所用水为超纯水,甲醇为色谱纯,其他试剂均为国产分析纯。
1.2 测定方法
叶表型相关性状不仅受本身基因型的影响,也受环境因素的影响,为减少实验误差,进行连续3 a的调查并进行分析。在2017—2019年的每年7月25日采取叶片,在每单株东西南北4个方向分别采3片成熟叶片。目测统计叶脉数(LV),使用游标卡尺(精确到0.01 mm)测量叶柄长度(PL)。利用万深LA-S植物叶片成像系统( 杭州万深科技有限公司,中国)扫描叶片,分析得出叶片长度(LL)、叶片宽(LW)、叶面积(LA)、叶周长(LP)、叶形指数(RWL)、红色成分(RC)、绿色成分(GC)、蓝色成分(BC)叶绿素参数值(CHR)等参数。采用HPLC法[23]测定杜仲叶片中5种主要活性成分。
1.3 数据分析
使用Excel 2016计算平均值、标准差和变异系数,用SPSS 18.0 软件对数据进行相关性分析和频率分析[24]。杂种优势包含中亲优势(Hm)、超亲优势(Hb)、中亲优势率(RHm)和超亲优势率(RHb)[12,25]。


式中:Fm表示杂交F1子代群体中的某一性状的平均值;中亲值(MPV)为双亲某一性状的平均值;高亲值(BPV)为双亲中某一性状较大的亲本值。某一性状在杂交F1代群体中Fm与双亲的MPV和BPV之差分别定位某一性状的Hm和Hb。
对连续3年的F1代群体的数量性状数据进行隶属函数值转换,并对同1 a所有性状转换后的数据进行隶属函数分析。隶属函数法综合各项指标进行F1代群体数量性状的评价,如公式(5)。
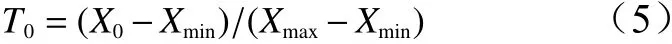
式中:T0表示杜仲F1代个体某性状的隶属函数值,X0表示杜仲F1代个体某性状的测定值,Xmax和Xmin表示杜仲F1代某性状最大值和最小值。
为获得连续3 a性状稳定型的优良单株,对2017年、2018年、2019年当年的活性成分加权和、形态性状加权和、综合性状加权和进行概率分级,I级小于X-0.5S,II级X-0.5S~X+ 0.5S和III级大于X+ 0.5,其中,X为平均值,S为标准差,并将3年概率分级中都存在于同一级的单株为性状稳定的单株。
2 结果与分析
2.1 F1代叶表型离散特征
由表1可知,杜仲F1代连续3 a叶片中的桃叶珊瑚苷、京尼平苷酸、车叶草甘、绿原酸和京尼平苷的变异系数为12.98%~40.72%、33.21%~48.21%、27.73%~38.57%、30.41%~43.39%和14.38%~22.43%。其中变异系数最大的为2017年的京尼平苷酸,变异系数最小的为2017年桃叶珊瑚苷。杜仲F1代叶片5种主要活性成分含量3 a的平均值从大到小依次为桃叶珊瑚苷含量、绿原酸、车叶草甘、京尼平苷酸和京尼平苷,其中京尼平苷酸与京尼平苷的含量几乎相等。2017年叶片12个形态性状变异系数为6.27%~22.28%,2018年为3.75%~43.05%,2019年为1.55%~20.72%。12个形态性状3 a平均变异系数最大的为叶脉数,平均变异系数为21.59%,变异系数最小的为叶绿素参考值,3 a平均变异系数为4.94%。杜仲F1代叶片活性成分变异系数相对形态性状变异系数较高,说明杜仲叶片活性成分具有更丰富的变异。

表 1 杜仲F1 代17 个叶表型性状分离特征Table 1 Statistic value of 17 leaf phenotypes of E. ulmoides F1 progeny
对杜仲F1代叶片17个表型性状变异情况进行统计分析(图1)。经K-S正态分布检验结果显示,2017年的桃叶珊瑚苷、京尼平苷酸、蓝色成分及叶绿素参考值等均不符合正态分布。2018年只有叶周长不符合正态分布,2019年的车叶草苷和京尼平苷酸均不符合正态分布。3 a中所有偏态分布的性状,由频率分布图来看,去掉两端拖尾数据,主要部分仍遵从正态分布,可看作为正态分布。因此,杜仲杂交F1代群体的17个叶表型可视为在2017—2019年期间均符合正态分布。对杜仲F1代叶片表型性状的连年测定为后期杜仲杂种优势分析以及选育叶片性状稳定的优良单株提供数据支撑。

图 1 2017至2019年F1代叶片17个叶表型相关性分析Fig. 1 Correlation analysis of 17 leaf phenotype of F1 progenies from 2017 to 2019

2.2 叶片性状相关性分析
2017—2019年,杜仲F1代群体叶片17个叶表型性状相性关性分析见图1。2017年中共有41对叶表型性状呈显著相关,24对为正相关,17对为负相关,其中相关系数的绝对值大于0.5且成极显著的共有12对(P< 0.01),9对为正相关和3对为负相关;2018年中共有32对显著相关(P< 0.05),19对为正相关,12对为负相关,其中有2对相关系数的绝对值大于0.5且极显著相关(P< 0.01),8对正相关和3对负相关;2019年共有34对显著相关(P< 0.05),其中26对为正相关,6对负相关,杜仲F1代叶片主要活性成分性状相关分析表明,3种环烯醚萜类物桃叶珊瑚苷、京尼平苷酸和车叶草甘至少2 a呈极显著正相关,除京尼平苷酸和车叶草苷在2017年的相关系数的绝对值于0.5,其余2018和2019年份相关系数分别为0.407和0.416且均呈极显著正相关(P< 0.01)。绿原酸与京尼平苷酸、车叶草苷、桃叶珊瑚苷均3 a均极显著相关,但在2017年与桃叶珊瑚苷相关系数为0.457,2018年与车叶草苷的相关系数为0.317和2019年与京尼平苷酸的相关系数为0.341。剩余12个叶形态中,叶长、叶宽、叶面积和叶形指数之间至少1 a存在极显著相关性(P< 0.01)且相关系数的绝对值大于5。叶片红色成分、蓝色成分、绿色成分和叶绿素参考值间具有一定的相关性。叶绿素参考值跟叶片红色成分相关连续3 a均呈极显著负相关(P< 0.01),相关系数的绝对值为分别为0.554、0.674和0.662,在2017年与叶片绿色成分相关系数的绝对值为0.707,且极显著负相关(P<0.01)。2018年叶片绿色成分与叶片红色成分成极显著正相关(P< 0.01),与叶片蓝色成分呈极显著负相关(P< 0.01)。综上可知,杜仲F1代叶片部分表型性状之间相互制约,部分表型性状具有相对较为稳定的关系,但是整体性状之间的相关性关系较为复杂。
2.3 叶表型杂种优势
由表2可知,杜仲杂交F1代叶片17个表型形状的Hm率为-90.3%~49.8%。经t检验结果表明,除叶片叶绿素参考值外,其他叶片表型性状Hm至少在1 a的性状达到极显著(P< 0.01)或显著(P< 0.0.5)的水平。桃叶珊瑚苷与叶片红色成分连续3 a均表现为正向Hm,说明2个性状的杂种优势在F1代群体中呈现上升趋势。杜仲F1代叶片其他表型性状Hm有正负2个方向的中亲优势,至少有1 a达到极显著或者显著,这也表明杜仲F1代叶表型性状的杂种优势复杂且具有遗传性。t检验结果表明,除车叶草苷、叶面积、叶片绿色成分和叶脉数等4个叶表型性状外,其他叶表型性状Hb至少有1 a达到显著或者极显著,其中桃叶珊瑚苷、京尼平苷、京尼平苷酸、绿原酸、叶形指数、叶片红色成分、叶片蓝色成分、叶炳长和叶周长达到了极显著负向超亲,表明杜仲F1代叶表型性状超亲分离现象未形成Hb。17个叶表型性状的RHb多数连续2 a或者2 a以上为负,这也再次验证了F1代叶片17个表型性状未形成超亲分离优势。
2.4 隶属函数法评价优良单株
2.4.1 隶属函数分析
通过隶属函数结果对F1代109个体进行评优。17个叶表型被分为活性成分相关性状和叶形态相关性状以及综合性状(表3)。对2017年、2018年、2019年当年的活性成分加权和、形态性状加权和、综合性状加权和进行概率分级,结果如表3所示,2017至2019年活性成分I级取值范围分别是0.10~0.36、0.17~0.45、0.16~0.44和包含单株个数分别是37、32、32,II级取值范围和单株个数分别是0.37~0.52、0.47~0.60、0.47~0.54和40、47、36株,III级取值范围和含单株数分别为0.54~0.91、0.61~0.96、0.55~0.92和32、30、41株。 2017—2019年叶形态相关性状I级取值范围分别是0.32~0.43、0.35~0.47、0.34~0.47和包含单株个数分别是29、33、33,II级取值范围和单株个数分别是0.44~0.50、0.47~0.52、0.47~0.54和49、45、45株,III级取值范围和含单株数分别为0.50~0.69、0.53~0.74、0.55~0.78和每年III级均为31株。综合性状加权和的I级取值范围分别是0.34~0.43、0.31~0.48、0.33~0.47和 包 含 单 株 个 数 分 别 是36、32、31,II级取值范围和单株个数分别是0.43~0.50、0.48~0.53、0.47~0.55和41、47、50株,III级取值范围和含单株数分别为0.50~0.59、0.54~0.68、0.55~0.72和32、30、28株。活性成分加权和所筛选出来的单株可为后期药用良种选育提供候选材料,形态性状加权和筛选的单株可为后期高产量叶片杜仲良种提供候选材料,综合性状加权和筛选的单株可为杜仲叶综合利用良种提后候选材料。
2.4.2 优良单株评价
通过隶属函数加权结果分析,筛选出2017至2019年F1代叶片17个叶表型连续3 a概率分级都存在于同一级的F1代单株为性状稳定的优良单株。如表4所示,最终筛选出29株连续3 a叶表型性状分布在同一级的F1子代单株,其中分布在I级的为8株,II级的为14株和III级的为7株。如果以杜仲叶片作为药用材料为主进行优良单株选择,则可从F1杂交群体中活性成分稳定型的H8-106、H8-101、H8-55、H8-19、H8-8、H8-47、H8-84、H8-63、H8-67、H8-49、H8-60、H8-10、H8-22、H8-37、H8-66、H8-7等活性成分加权和连年稳定的单株中选择,如果以叶片形态为主选择优良单株,可从H8-8、H8-1、H8-97、H8-96、H8-63、H8-51、H8-4、H8-109、H8-54、H8-105、H8-66、H8-104、H8-48、H8-101等F1代叶片形态性状加权和连年稳定的单株中选择。如果从综合利用,即叶片活性成分含量和叶形态均稳定为前提选、育优良单株,可从H8-40、H8-97、H8-8、H8-106、H8-55、H8-63、H8-60、H8-29、H8-109、H8-49、H8-67、H8-104、H8-66、H8-48等F1杂交子代中选择。F1代H8-8、H8-63和H8-66单株分别在I级、II级和III级活性成分加权和、形态性状加权和和综合性状加权和中均有出现,这证明不论是从活性成分还是叶形态性状以及综合性状方面它们都比其他单株更具有稳定性,不论从哪方面来选择,H8-8、H8-63和H8-66的叶表型性状是最稳定性状的单株。

表 2 杜仲F1 代叶片17 个表型性状的杂种优势的表现Table 2 Heterosis of 17 leaf phenotypes of E. ulmoides F1 progeny

表 3 杜仲F1代群体隶属函数值加权和Table 3 Weighted sum of membership function values of F1 progeny of E. ulmoides

表 4 F1代叶片表型性状稳定型优良单株Table 4 Elite individual plants with stable leaf phenotype in F1 progeny

续表 3
3 结论与讨论
在农林生产中,良种选育是植物资源开发利用的一项基础且重要的工作,而杂交育种可为杜仲良种选育提供种质资源。最近杜仲相关药理研究证明,杜仲叶片活性成分含量与杜仲皮相似,部分可用杜仲叶代杜仲皮用[25-26]。杜仲叶相比杜仲皮,不仅每年都可以采摘且产量远远高于杜仲皮,且不存在剥皮周期较长、剥皮后养护措施不当导致死亡等多种问题[25]。杜仲叶可药用也可食用,并且基于杜仲叶药食同源的价值,开发了多种产品,保健食品、茶叶、饲料添加剂和日化用品等多种产品[17]。随着杜仲产业发展,杜仲皮的产量已经不能满足杜仲产业的发展,综合开发利用杜仲多组织已经是不可或缺的内容。而选育出多功能、多途径利用的杜仲良种是杜仲产业的基础。杂交育种是转移优良性状或关键基因的一种技术,杂交子代不同单株之间的叶表型性状变异幅度较大,不同性状均出现明显分离[27-28]。目前,林木中有关杂交F1代杂种优势的研究已在柿子(Diospyros kaki)[12]、板栗(Castanea mollissima)[19]、油茶(Camellia oliefera)[28]、茶树(Camellia sinensis )[29]等多个树种中均有开展。
本研究分析杜仲杂交F1代109个单株叶片表型性状杂种优势及筛选出具有连年稳定表型性状的优良单株。结果表明,杜仲17个叶表型呈连续较好的正态分布,变异范围为1.55%~48.20%,2017—2019年叶片活性成分含量的平均值从大到小依次为桃叶珊瑚苷含量、绿原酸、车叶草甘、京尼平苷酸和京尼平苷,3 a平均变异最大的为京尼平苷酸,变异系数为39.51%。12个形态性状3 a平均变异系数最大的为叶脉数,平均变异系数为21.59%,变异系数最小的为叶绿素参考值,3 a平均变异系数为4.94%。活性成分和叶片形态相对其他组织性状具有较大的变异,这可能是因为叶片是植物组织中具有较为广泛的变异所导致。本研究中,叶片活性成分变异系数相对叶形态变异系数较高,表明杜仲叶片活性成分具有更丰富的变异,而杜仲雄花中也是活性成分含量相对形态性状具有更丰富的变异[7]。相关性分析结果表明,杜仲F1代叶片整体性状之间的相关性较为复杂,这与油茶F1代苗期叶表型性状结果是一致[28]。不论是在杜仲叶片还是杜仲雄花中,环烯醚萜类的京尼平苷酸、桃叶珊瑚苷和车叶草苷三种活性成分均具有一定的相关性,这与前人研究结果一致[30-31]。F1代杂种优势源于基因的异质性,杜仲为杂合基因型,F1代的性状必然存在分离和杂种优势衰退的现象[19],本研究中桃叶珊瑚苷与叶片红色成分连续3年均表现为正向中亲优势,说明两个性状的杂种优势在F1代群体中呈现上升趋势,且Hb为极显著,表现较强的杂种优势,推测可能是杂交子代产生了非加性效应[24]。杜仲叶表型性状差异较大,不同指标差异不同,不能采用单一指标对单株进行评判,需要观测多个指标综合评价优良单株。本研究通过隶属函数加权结果分析,筛选出2017—2019年F1代叶片17个表型性状连续3 a分级都存在于同一级的F1代单株为性状稳定的优良单株,为后期杜仲育种研究提供参考。
