基于BDNF/TrkB/CREB 途径探讨缺氧缺血性新生幼鼠海马神经元凋亡及脑发育损伤的机制研究
2022-10-13卢田甜陈秀灵贾雁平
卢田甜,张 耀,梁 彬,刘 敏,陈秀灵,贾雁平
(1.海口市妇幼保健院新生儿科,海南 海口 570203;2.海口市人民医院儿科,海南 海口 570208)
缺氧缺血性脑损伤(hypoxic ischemic brain injury,HIBI)是造成新生儿永久性神经系统损伤和死亡的主要原因之一[1]。研究显示:0.1%~0.2% 的新生儿出现由于围生期窒息引起的HIBI,死亡率高达20%,而40%的幸存者出现智力障碍、脑瘫、癫痫等严重并发症[2]。目前研究报道的HIBI 发生可能与炎症反应、氧化应激、能量耗竭、钙离子超载等多种病理生理机制相关,但仍未有统一的定论。脑源性神经营养因子(brain derived neurotrophic factor,BDNF)是一种神经营养因子,酪氨酸蛋白激酶B(TrKB)是BDNF 的特异功能受体,二者相互结合具有促进HIBI 后脑组织的修复及再生的作用[3]。环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)可以诱导BDNF 的基因转录进而调节其表达,与HIBI 后神经元的再生、修复等生理过程[4]。基于此,本研究以HIBI 幼鼠为研究对象,以BDNF/TrkB/CREB 通路为作用靶点,探索其在HIBI 发病中的作用,为临床防治HIBI提供参考。
1 材料与方法
1.1 实验动物
新生7 日龄Wistar 幼鼠95 只,体重(13.6 ±1.7)g,雌雄各半,由湖北医药学院实验动物中心提供,实验动物合格证号SCXK(鄂)2018-0005。本研究所使用的实验动物均遵守海南医学院伦理委员会标准,在实验过程中尽可能使动物在舒适的环境中完成,手术麻醉、给药时严格规范操作以减轻实验动物的痛苦,实验结束后动物采用安乐死的手段处死,并委托学校动物管理中心处理所有动物尸体。
1.2 试剂
原位末端转移酶标记(TUNEL)检测试剂盒(美 国Roche 公 司);2,3,5-氯 化 三 苯 基 四 氮 唑(TTC)试剂盒(美国Sigma 公司);BDNF、TrkB、CREB 慢病毒载体及空载体(上海吉凯基因化学技术有限公司);BCA 蛋白定量试剂盒、蛋白提取试剂(美国Thermo 公司);BDNF、TrkB、CREB、β-actin抗体(美国Proteintech 公司)。
1.3 HIBI 模型制备
参照Rice-Vannucci 经典方法复制新生幼鼠HIBI 模型[5]。幼鼠乙醚吸入麻醉,消毒后固定于手术台,分离左侧颈总动脉,结扎两端,中间剪断,缝合皮肤,放入装有母鼠粪便的垫料中2 h,然后置于含92% N2+ 8% O2混合气体的有机玻璃箱缺氧处理2 h,记录幼鼠一般行为。幼鼠出现自发向左转圈或夹尾尖叫证明模型复制成功,将幼鼠重新放回笼中母乳喂养。假手术组仅分离左侧颈总动脉,不进行结扎和缺氧,缝合后放回笼中母乳饲养。
1.4 实验分组
取10 只假手术组幼鼠作为对照1 组,另外取10只HIBI 模型幼鼠,检测幼鼠学习记忆能力、脑组织损伤及海马组织中BDNF、TrkB、CREB 蛋白的表达。取15 只假手术组幼鼠作为对照2 组,另外取60只HIBI 模型幼鼠分为阴性对照(NC)组、BDNF 过表达(LV-BDNF)组、TrkB 过表达(LV-TrkB)组、CREB 过 表 达(LV-CREB)组,每 组 15 只。LV-BDNF 组、LV-TrkB 组、LV-CREB 组分别 通过尾静脉注射滴度为1.7×109TU/mL 的BDNF 慢病毒 载 体5×107TU,滴 度 为2.1×109TU/mL 的TrkB 慢病毒载体1×107TU,滴度为1.4×109TU/mL)的CREB 慢病毒载体5×106TU,NC 组尾静脉注射滴度为2×109TU/mL 的空慢病毒载体1×106TU;每4 周1 次,连续2 次,8 周后结束实验。检测幼鼠学习记忆能力、脑组织损伤、海马神经元凋亡情况及Bcl-2、Bax、NF-κB 蛋白表达。
1.5 Y-迷宫测试记忆力和学习能力
Y-迷宫是一个底部可以通电的三等臂式反射箱,每臂端有一个信号灯,灯亮时为此臂安全未通电,另两臂通电(电压为50~70 V,强度为能使小鼠产生逃避行为)。实验时随机变更安全区,电击幼鼠后以其立即逃避到安全区为一次正确反应,连续9 次正确反应为学会,每次电击持续5 s。记录幼鼠学会所进行的训练次数,次数越少表示学习能力越好[6]。电击实验结束24 h 后检测记忆力,总共进行20 次,记忆能力为正确反应次数占总检测次数的百分比。
1.6 TTC 染色法测定脑梗死体积
每组随机取5 只幼鼠,断头处死,取出脑组织,置于0.15 mol/L 磷酸缓冲盐溶液,4 ℃冷冻5 min,间隔2 mm 冠状切片,切片浸入5 mL 含1% 的TTC 磷酸盐缓冲液,37 ℃避光孵育0.5 h,TTC 染色后,红色表示正常脑组织,白色表示梗死组织,取出脑片,放入10% 福尔马林中固定,逐层拍照,用Imagepro Plus 图像分析软件处理并统计,计算每层梗死面积,乘以层面为脑梗死体积。
1.7 TUNEL 检测海马区神经元凋亡水平
每组随机取5 只幼鼠断头处死,无菌条件分离海马组织,4% 多聚甲醛固定,乙醇脱水,常规石蜡包埋,冠状切片,厚3~5 μm,烤片、脱蜡、乙醇水合,蛋白酶k 消化30 min,PBS 洗涤3 次,加入TUNEL反应液,置于37 ℃暗温盒60 min,苏木素复染、乙醇脱水、二甲苯透明封片。每张切片选取5 个不重复视野,计数TUNEL 阳性神经元,取平均值。
1.8 Western blot 检测幼鼠海马组织BDNF、TrkB、CREB、Bcl-2、Bax 及NF-κB 蛋白的表达
每组随机取5 只幼鼠幼仔断头处死,低温下取幼鼠左侧海马组织,加入RIPA 充分裂解,12 000 r/min 低温离心15 min,取上清液,用BCA 法测定上清液中蛋白含量,取40 μg 蛋白,加入缓冲液变性,电泳、转膜、封闭、加入一抗BDNF、TrkB、CREB、Bcl-2、Bax、NF-κB、β-actin,4 ℃孵育过夜,TBST 洗涤,加入二抗,室温孵育2 h,TBST 洗涤,用ECL化学发光试剂显色后,化学发光仪成像。
1.9 统计学处理
数据统计分析采用SPSS 17.0 软件包,计量资料采用均数±标准差(±s)表示,两组间比较采用t检验,多组间差异比较采用单因素方差分析(One-way ANOVA),P<0.05 为差异具有统计学意义。
2 结果
2.1 造模后幼鼠学习记忆能力变化
与对照1 组幼鼠比较,HIBI 组幼鼠学习能力及记忆力测试正确反应率明显降低,差异均有统计学意义(P<0.05)。见表1。
表1 造模后幼鼠学习能力及记忆力测试正确反应率(%,n=10,±s)Tab 1 Correct response rate of learning ability and memory test in young rats after modeling(%,n=10,±s)
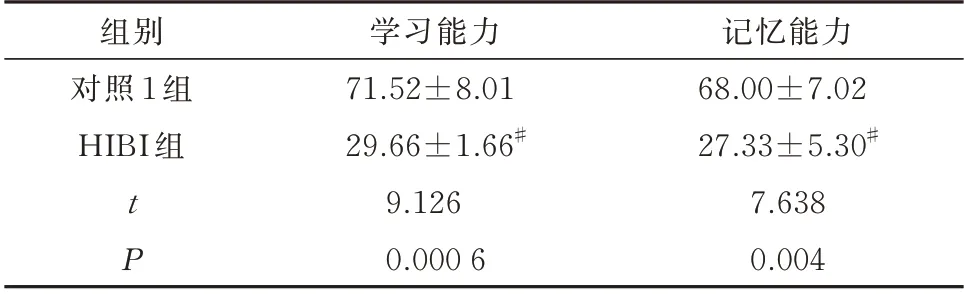
表1 造模后幼鼠学习能力及记忆力测试正确反应率(%,n=10,±s)Tab 1 Correct response rate of learning ability and memory test in young rats after modeling(%,n=10,±s)
注:与对照1 组比较,#P<0.01。
组别对照1 组HIBI 组记忆能力68.00±7.02 27.33±5.30#7.638 0.004 tP学习能力71.52±8.01 29.66±1.66#9.126 0.000 6
2.2 造模后幼鼠脑组织损伤
与对照1 组比较,HIBI 组幼鼠脑组织梗死体积明显增加,差异有统计学意义(P<0.05)。见表2。
表2 造模后幼鼠脑组织梗死体积(n=5,±s)Tab 2 Infarct volume of brain tissue in young rats after modeling(n=5,±s)

表2 造模后幼鼠脑组织梗死体积(n=5,±s)Tab 2 Infarct volume of brain tissue in young rats after modeling(n=5,±s)
注:与对照1 组比较,#P<0.01。
脑组织梗死体积(mm3)0.59±0.03 6.64±0.59#11.719 0.0001组别对照1 组HIBI 组tP
2.3 造模后幼鼠海马组织BDNF、TrkB、CREB 蛋白表达
与对照1 组幼鼠比较,HIBI 组幼鼠海马组织中BDNF、TrkB 明显升高,CREB 表达明显降低,差异均有统计学意义(P<0.05)。见表3。
表3 造模后幼鼠海马组织BDNF、TrkB、CREB 蛋白表达(n=5,±s)Tab 3 Expression of BDNF,TrkB and CREB proteins in the hippocampus of young rats after modeling(n=5,±s)
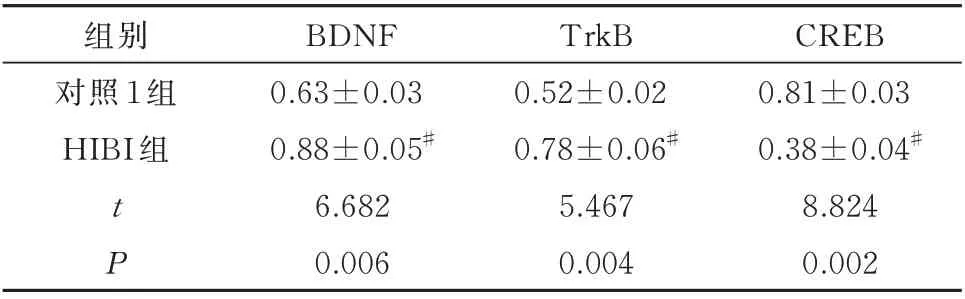
表3 造模后幼鼠海马组织BDNF、TrkB、CREB 蛋白表达(n=5,±s)Tab 3 Expression of BDNF,TrkB and CREB proteins in the hippocampus of young rats after modeling(n=5,±s)
注:与对照1 组比较,#P<0.01。
组别对照1 组HIBI 组CREB 0.81±0.03 0.38±0.04#8.824 0.002 tP BDNF 0.63±0.03 0.88±0.05#6.682 0.006 TrkB 0.52±0.02 0.78±0.06#5.467 0.004
2.4 调节BDNF、TrkB、CREB 表达对幼鼠学习记
忆能力的影响
与对照2 组比较,NC 组幼鼠学习及记忆力测试正确反应率明显降低,差异具有统计学意义(P<0.01);与NC 组幼鼠比较,LV-BDNF 组、LV-TrkB组、LV-CREB 组幼鼠学习及记忆力测试正确反应率明显升高,差异具有统计学意义(P<0.01)。见表4。
表4 调节BDNF、TrkB、CREB 表达后幼鼠学习能力及记忆力测试正确反应率(%,n=15,±s)Tab 4 Learning ability and correct response rate of memory test in young rats after regulation of BDNF,TrkB and CREB expression(%,n=15,±s)
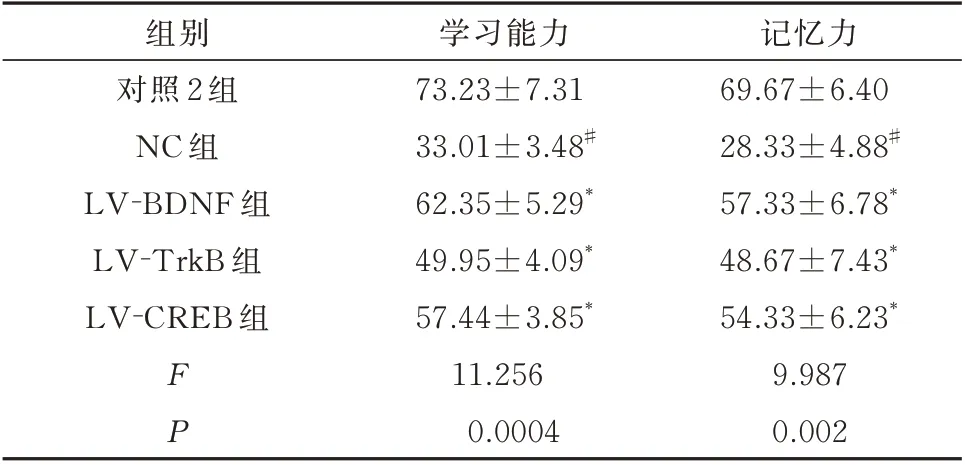
表4 调节BDNF、TrkB、CREB 表达后幼鼠学习能力及记忆力测试正确反应率(%,n=15,±s)Tab 4 Learning ability and correct response rate of memory test in young rats after regulation of BDNF,TrkB and CREB expression(%,n=15,±s)
注:与对照2 组比较,#P<0.01;与NC 组比较,*P<0.01。
记忆力69.67±6.40 28.33±4.88#57.33±6.78*48.67±7.43*54.33±6.23*9.987 0.002组别对照2 组NC 组LV-BDNF 组LV-TrkB 组LV-CREB 组FP学习能力73.23±7.31 33.01±3.48#62.35±5.29*49.95±4.09*57.44±3.85*11.256 0.0004
2.5 调节BDNF、TrkB、CREB 表达对幼鼠脑组织损伤的影响
与对照2 组比较,NC 组幼鼠脑组织梗死体积显明显增加,差异具有统计学意义(P<0.01);与NC组幼鼠比较,LV-BDNF 组、LV-TrkB 组、LV-CREB组幼鼠脑组织梗死体积明显减小,差异具有统计学意义(P<0.01)。见表5。
表5 调节BDNF、TrkB、CREB 表达后幼鼠脑组织梗死体积(n=5,±s)Tab 5 Infarct volume in young rat brain tissue after regulation of BDNF,TrkB and CREB expression(n=5,±s)
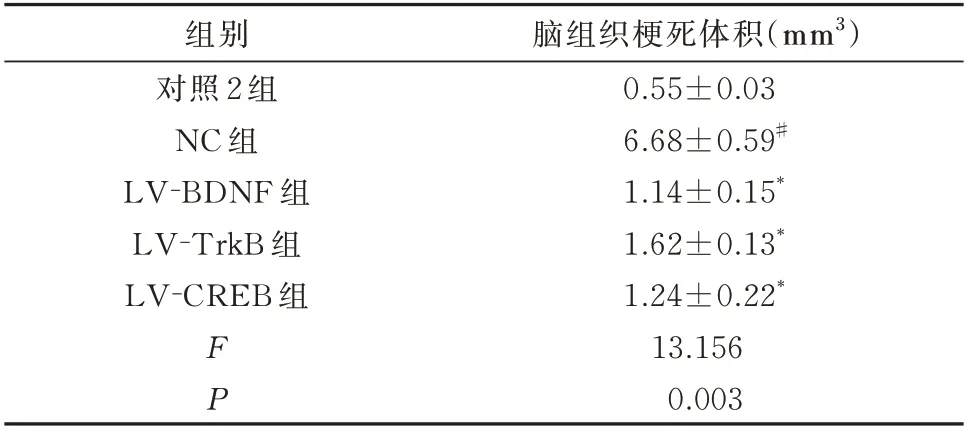
表5 调节BDNF、TrkB、CREB 表达后幼鼠脑组织梗死体积(n=5,±s)Tab 5 Infarct volume in young rat brain tissue after regulation of BDNF,TrkB and CREB expression(n=5,±s)
注:与对照2 组比较,#P<0.01;与NC 组比较,*P<0.01。
脑组织梗死体积(mm3)0.55±0.03 6.68±0.59#1.14±0.15*1.62±0.13*1.24±0.22*13.156 0.003组别对照2 组NC 组LV-BDNF 组LV-TrkB 组LV-CREB 组FP
2.6 调节BDNF、TrkB、CREB 表达对幼鼠海马神经元凋亡的影响
与对照2 组比较,NC 组幼鼠海马区TUNEL 阳性细胞数明显增加,差异具有统计学意义(P<0.01);与NC 组幼鼠比较,LV-BDNF 组、LV-TrkB组、LV-CREB 组幼鼠海马区TUNEL 阳性细胞数明显减少,差异具有统计学意义(P<0.01)。见表6和图1。
表6 调节BDNF、TrkB、CREB 表达后幼鼠海马组织神经元凋亡情况(个,n=5,±s)Tab 6 The apoptosis of hippocampal neurons in young rats after regulation of BDNF,TrkB and CREB expression(n=5,±s)
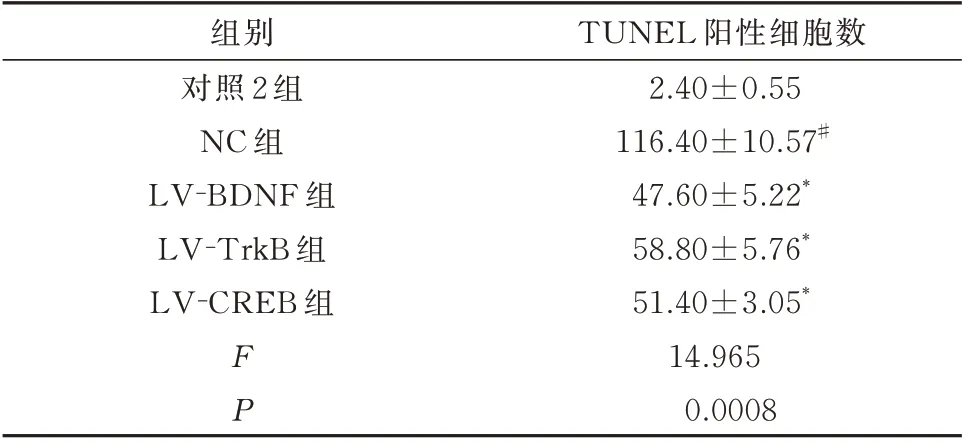
表6 调节BDNF、TrkB、CREB 表达后幼鼠海马组织神经元凋亡情况(个,n=5,±s)Tab 6 The apoptosis of hippocampal neurons in young rats after regulation of BDNF,TrkB and CREB expression(n=5,±s)
注:与对照2 组比较,#P<0.01;与NC 组比较,*P<0.01。
TUNEL 阳性细胞数2.40±0.55 116.40±10.57#47.60±5.22*58.80±5.76*51.40±3.05*14.965 0.0008组别对照2 组NC 组LV-BDNF 组LV-TrkB 组LV-CREB 组FP

图1 调节BDNF、TrkB、CREB 表达后幼鼠海马组织神经元凋亡情况(×100)Fig 1 The apoptosis of hippocampal neurons in young rats after regulation of BDNF,TrkB and CREB expression(×100)
2.7 调节BDNF、TrkB、CREB 表达对幼鼠海马组织Bcl-2、Bax 及NF-κB 蛋白表达的影响
与对照2 组比较,NC 组幼鼠海马组织中促凋亡蛋白Bax、NF-κB 蛋白表达明显增强(P<0.05),而抑凋亡蛋白Bcl-2 蛋白表达明显降低(P<0.05)。与NC 组 比 较,LV-BDNF 组、LV-TrkB 组、LV-CREB组幼鼠海马组织中Bax、NF-κB 蛋白表达明显降低(P<0.05),Bcl-2 蛋白表达明显增强(P<0.05)。见表7。
表7 调节BDNF、TrkB、CREB 表达后幼鼠海马组织Bcl-2、Bax及NF-κB 蛋白表达(n=5,±s)Tab 7 Bcl-2,Bax and NF-κB protein expression in hippocampal tissue of young rats after regulation of BDNF,TrkB and CREB expression(n=5,±s)

表7 调节BDNF、TrkB、CREB 表达后幼鼠海马组织Bcl-2、Bax及NF-κB 蛋白表达(n=5,±s)Tab 7 Bcl-2,Bax and NF-κB protein expression in hippocampal tissue of young rats after regulation of BDNF,TrkB and CREB expression(n=5,±s)
注:与对照2 组比较,#P<0.01;与NC 组比较,*P<0.01。
组别对照2 组NC 组LV-BDNF 组LV-TrkB 组LV-CREB 组NF-κB 0.91±0.06 2.21±0.11#1.44±0.08*1.36±0.06*1.25±0.07*15.015 0.0002 FP Bcl-2 0.85±0.05 0.25±0.05#0.59±0.05*0.69±0.06*0.61±0.04*9.987 0.005 Bax 0.69±0.04 1.67±0.09#0.95±0.06*0.85±0.08*0.82±0.06*12.365 0.0007
3 讨论
大鼠出生时的生理组织状态相当于人类新生儿的早产阶段,但其出生后脑组织的发育速度比人类新生儿快很多,7 日龄大鼠细胞增殖分化程度和脑室周围生发基质情况基本与新生儿相当。目前缺血缺氧脑损伤模型的制备方法最经典的即为Rice 改良方法,其操作简单且成功率较高,时间和症状程度易掌握且组织病理改变明显,因此,本实验选择7 日龄幼鼠,采用Rice 改良法复制新生幼鼠HIBI 模型。海马是HIBI 模型对损伤最敏感的部位,研究显示,缺血缺氧可造成新生幼鼠海马区神经元的大量凋亡[7,8]。经过TTC 染色发现模型组幼鼠大脑皮层、海马等区域有大片明显的白色梗死区域,梗死体积明显增加,提示实验模型复制成功。有研究报道,HIBI 对幼鼠海马区影响较大的是CA1 区的机体认知和神经元功能[9,10]。本研究结果发现HIBI 幼鼠学习能力、记忆能力明显减弱,与文献报道一致。综上可知,HIBI 可以诱导新生幼鼠海马组织神经元凋亡,进而促使大鼠学习、记忆能力下降。
BDNF 属神经营养因子家族成员,广泛存在于脑组织,在海马区含量较多,可促进神经元生殖、发育、分化、再生,增强中枢神经的营养支持、保护及功能的表达[11],在缺血缺氧应激刺激下,高表达的BDNF 具有保护神经元的作用。有研究显示:对HIBI 新生大鼠侧脑室注射BDNF 可以明显抑制海马CA1 区 神经元死亡[12]。TrkB 是BDNF 的特异性受体,可以传递信号,反应性引起细胞内各信号通路的活化,促进神经细胞的发育、损伤后的修复以及再生[13]。当HIBI 发生后,BDNF、TrkB 蛋白在受损区高度表达,二者大量结合可以促使CREB 的活化,维持神经细胞存活并促进其修复[14,15]。李亚琴等[16]研究显示,HIBI 小鼠过表达BDNF 后,脑组织中TrkBmRNA 和蛋白表达增强,加强神经细胞的修复作用。CREB 是一种重要的转录因子核蛋白,能够通过Ca2+途径、调控一些营养因子表达等调节BDNF 的表达,抑制神经元凋亡等[17]。本研究发现,模型组幼鼠海马区CREB 蛋白表达明显降低,BDNF、TrkB 蛋白表达明显升高。为进一步探讨其发生机制,本研究采用尾静脉注射BDNF、TrkB、CREB 慢病毒载体的方法对幼鼠进行干预,结果显示,过表达BDNF、TrkB、CREB 后,幼鼠学习能力、记忆能力明显增强,脑组织梗死体积明显缩小,TUNEL 阳性细胞数明显减少,说明幼鼠神经元功能、机体认知功能得到改善。
Bcl-2 是一种重要的抗凋亡基因,研究证实,Bcl-2 表达下调会导致细胞凋亡[18,19]。Rousset 等[20]研究发现,缺血缺氧可以促进Bax 从抗凋亡因子复合体中释放出来,从而进入线粒体激活细胞凋亡的发。NF-κB 是细胞信号转导过程中一个重要的免疫应答因子,参与调控细胞免疫应答、细胞增殖、细胞凋亡等多种细胞应激行为,NF-κB 可以通过调控抗凋亡因子、凋亡诱导配体等的表达或信号传递,促进细胞凋亡的发生。研究发现,新生大鼠缺血缺氧后,脑部NF-κB 表达量将会上调,抑制NF-κB 可以有效降低HIBI 大鼠神经元凋亡水平[21]。本研究检测幼鼠海马组织中Bcl-2、Bax 及NF-κB 蛋白表达,结果发现模型组幼鼠Bax、NF-κB 蛋白表达明显升高,Bcl-2 蛋白表达明显降低,说明HIBI 能引起海马组织神经细胞凋亡的发生,与文献报道一致;而过表达BDNF、TrkB、CREB 组幼鼠Bax、NF-κB 蛋白表达明显降低,Bcl-2 蛋白表达明显升高,表明调节BDNF、TrkB、CREB 表达可能是通过调节凋亡蛋白等表达抑制神经细胞的凋亡,改善模型幼鼠脑组织损伤病变的。
综上所述,HIBI 模型幼鼠存在BDNF、TrkB、CREB 表达异常,过表达BDNF、TrkB、CREB 可以改善幼鼠学习记忆能力,修复脑组织损伤,抑制海马区细胞凋亡,因此,HIBI 的发生机制可能与BDNF、TrkB、CREB 途径有关。
作者贡献度说明:
卢田甜:实验设计、实验操作、指标检测,撰写论文;张耀、梁彬:协助实验造模、指标检测;刘敏、陈秀灵:收集数据,统计分析;贾雁平:实验指导、论文修改、审阅。
本文所有作者声明无任何利益冲突。
