益生元对HCT- 8细胞炎症和树突状细胞成熟的影响
2022-10-11颜毛毛徐笑非彭思敏吴少辉郝占西魏远安
颜毛毛, 徐笑非, 彭思敏, 吴少辉, 郝占西, 魏远安,*
(1.量子高科(广东)生物有限公司, 广东 江门 529081;2.华南理工大学 生命科学研究院, 广东 广州 510006)
益生元是一类选择性地被宿主微生物吸收代谢,从而赋予宿主有益影响的化合物。益生元已被广泛用于保健食品添加以调节机体代谢或增强机体免疫力,近期也被用于临床上干预和预防许多免疫相关疾病[1-3]。由于目前认为益生元主要通过调节肠道微生物的组成及代谢,依赖其代谢产物(比如短链脂肪酸)作用于宿主细胞,从而激活相关分子通路发挥调节宿主代谢或免疫功能作用[4-5],且增殖双歧杆菌和乳酸杆菌一直以来都作为判断是否为益生元的标准[6],不同的益生元往往被认为具有相同或相似的功能。因此,目前实际应用中益生元往往被当作类似物使用。然而越来越多的研究表明益生元除了通过肠道菌群间接发挥作用以外,还可以直接作用于宿主细胞发挥调节炎症和增强免疫作用[7-8]。虽然不同益生元通过肠道菌群发挥的功效具有一定的相似性,其直接作用于宿主细胞发挥的功效是否也类似目前所知甚少。另外,很多应用实例表明:在应用这些益生元预防或干预某些疾病时,并不是所有的益生元都有很好的效果,同一种益生元也不是对所有人群有效,暗示不同的益生元可能有不同的功效,适合应用的特征人群也可能不同。为此,益生元精准化应用的概念应运而生,即通过深入研究不同益生元的生理作用机制,针对不同人群或个体的菌群、疾病状态、代谢、营养特征和需求,以独立或协同作用的方式,实现益生元在健康产品、生物医药研发、医疗服务上的精准化定制和科学配方[9]。为了实现益生元的精准化,就必须从细胞生物学及分子生物学的层面研究清楚各种益生元的生理功能及机制。
由于益生元进入人体肠道之后能够直接作用于人体的肠上皮细胞和树突状细胞[10],且小鼠及临床上的数据表明某些益生元对于肠道屏障功能紊乱及炎症性肠病有较好地缓解作用[11-13]。而肠上皮细胞在致病菌刺激下的炎症响应及树突状细胞的成熟与炎症性肠病的发展息息相关[14],因此,本研究将探讨目前市场上可售的6种益生元[蔗果三糖(1-kestose,GF2)、2′-岩藻糖基乳糖(2′-fucosyllactose,2′-FL)、低聚果糖(fructooligosaccharides,FOS)、低聚半乳糖(galactooligosaccharides,GOS)、低聚甘露糖(mannooligosaccharides,MOS)及菊粉(Inulin)]对于由出血性大肠杆菌(enterohemorrhagicEscherichiacoli,EHEC)引起的人肠上皮细胞炎症响应及人树突状细胞成熟的影响,旨在为益生元的精准化应用提供指导方向及数据依据。
1 材料与方法
1.1 材料与试剂
人肠上皮HCT- 8细胞系(产品编号CCL- 244)、EHEC(enterohemorrhagicE.coli,菌株O157:H7,产品编号ATCC43894),美国ATCC细胞库;胎牛血清(产品编号16000044),美国Gibco公司;RPMI- 1640培养基(产品编号PM150110),武汉Procell公司;GF2(质量分数≥85%)、2′-FL(质量分数≥90%)、FOS(质量分数≥95%)及GOS(质量分数≥90%),江门量子高科(广东)生物有限公司;MOS(低聚甘露糖,质量分数≥90%),恩施天天佳生物科技有限公司;Inulin(菊粉,质量分数≥92%),比利时Beneo- Orafti公司。
phospho- NF- κB p65 (Ser536) (93H1) Rabbit mAb(产品编号3033)、NF- κB p65 (L8F6) Mouse mAb(产品编号6956)、I- κB- α(L35A5) Mouse mAb(产品编号4814)、GAPDH(14C10) Antibody(产品编号2118),美国Cell Signalling Technologies公司;Pacific BlueTManti-human CD11b Antibody(产品编号101224)及APC anti-human CD83 Antibody(产品编号305312),美国BioLegend公司;免疫印迹所用二抗辣根过氧化物酶标记山羊抗小鼠IgG(产品编号G- 21040)及辣根过氧化物酶标记山羊抗兔IgG(产品编号G- 21234),美国Thermo Fisher公司;BeyoECL Plus化学发光试剂盒(产品编号P0018S),上海碧云天生物技术有限公司;Trizol试剂(产品编号15596- 026)、FastKing一步法除基因组cDNA第一链合成预混试剂(产品编号KR118)、Talent荧光定量检测试剂盒(SYBR Green)(产品编号FP209),北京天根生化科技有限公司;淋巴细胞分离液Lymphoprep(产品编号AS1114547),挪威Axis- shield公司;细胞因子GM- CSF(产品编号300- 03- 5)和IL- 4(产品编号200- 04- 20),美国PeproTech公司。
1.2 仪器与设备
Cytoflex型流式细胞仪,美国Beckman公司;GeneQuant100型分光光度计,英国Biochrom公司;Cytation imaging reader型酶标仪,美国BioTek公司;Roter Gene- Q型荧光定量PCR仪,德国Qiagen公司;ChemiScope6000EXPTouch型化学发光成像系统,上海勤翔科学仪器有限公司。
1.3 献血者信息
30名献血志愿者,平均年龄38.47±1.60岁,男女比例5∶1,所有志愿者都签署了知情同意书。
1.4 实验方法
1.4.1免疫印迹法
配置质量分数为10%的SDS- PAGE胶,15孔1.5 mm上样梳。每孔上样10 μL样品,100 V电泳分离样品中蛋白质,之后通过转膜仪将分离开的蛋白质印迹至0.2 μm孔径硝酸纤维素膜上。膜经过质量分数5%的脱脂奶粉水溶液封闭1 h之后,分别与phospho- NF- κB p65 (Ser536) (93H1) Rabbit mAb、NF- κB p65 (L8F6) Mouse mAb、I- κB- α (L35A5) Mouse mAb、GAPDH(14C10) Antibody在4 ℃孵育过夜,之后用TBST buffer洗涤3次,每次10 min。再与相应的二抗在室温孵育1 h。膜经TBST buffer洗涤3次,每次10 min之后,通过BeyoECL Plus化学发光试剂盒显色,其显色图像用化学发光成像系统采集。
1.4.2实时荧光定量PCR法
HCT- 8细胞以30%~40%愈合度接种于6孔板中,总共8孔,其中6孔分别加入终质量浓度10 mg/mL的不同益生元,待细胞培养48 h之后,加入感染复数MOI=100的EHEC(在加入前一天用LB培养基37 ℃摇菌培养过夜,之后用分光光度计测量OD595 nm,按1 OD=1×108个/mL计算细菌浓度)刺激3 h,收取细胞,离心去除培养基,用400 μL Trizol试剂重悬溶解。室温放置10 min之后,加入等体积三氯甲烷混匀,12 000 r/min离心取上层水相,加入150 μL异丙醇混匀,12 000 r/min离心,弃上清液,沉淀用体积分数75%乙醇清洗一遍,再用20 μL 焦碳酸二乙酯(DEPC)水溶液溶解得总RNA(含总mRNA)。取4 μL总RNA与FastKing一步法除基因组cDNA第一链合成预混试剂配制成对应体系,42 ℃孵育15 min,95 ℃灭活3 min得cDNA。用Talent荧光定量检测试剂盒及对应引物在Roter Gene- Q荧光定量PCR仪上检测各实验组样品cDNA中TNF- α、IL- 6及GAPDH的扩增曲线。根据扩增曲线用Roter Gene- Q series software分析得到各曲线的循环数阈值(cycle threshold,ct)。以GAPDH为对照计算各组cDNA中的TNF- α及IL- 6的Δct,再以培养基对照组的TNF- α及IL- 6的Δct为基准计算实验组TNF- α及IL- 6的ΔΔct,最终各实验组的TNF- α及IL- 6的相对mRNA的转录水平则由式(1)计算得到。
相对mRNA表达量=2-ΔΔct。
(1)
1.4.3益生元对HCT- 8细胞活性影响的测定
HCT- 8细胞以每孔2 000个的密度接种到96孔板中,同时分别加入对照培养基(NC组)或终质量浓度为10 mg/mL的不同益生元(GF2组、2′-FL组、FOS组、GOS组、MOS 组和Inulin组),每组6个平行实验孔。48 h之后加入MTT溶液至终质量浓度为0.5 mg/mL,继续培养4 h。加入100 μL甲臜(formazan)溶解液,待紫色结晶全部溶解用酶标仪测定OD570 nm作为细胞活性指标。最终各实验组的相对细胞活性值为各实验组与NC组的OD570 nm比值。
1.4.4EHEC诱导HCT- 8细胞炎症响应时间的测定
HCT- 8细胞以30%~40%愈合度接种于24孔板中,细胞培养48 h之后,加入感染复数MOI=100的EHEC刺激,之后分别在刺激的0、20、40、60、80、100 min时吸去培养基,并迅速加入1倍浓度的 sample loading buffer刮取细胞,细胞裂解液在100 ℃加热10 min充分变性。最后通过免疫印迹法分析得到细胞裂解液中各蛋白的相对蛋白表达水平。
1.4.5益生元对HCT- 8细胞炎症响应影响的测定
HCT- 8细胞以30%~40%愈合度接种于24孔板的14个孔中,分为7组,分别加入对照培养基或终质量浓度为10 mg/mL的不同益生元,待细胞培养48 h后,加入感染复数MOI=100的EHEC刺激,之后每组的两个孔分别在刺激的0 min和 40 min 时收取细胞裂解液样品。最后通过免疫印迹法分析得到细胞裂解液中各蛋白的相对蛋白表达水平。
1.4.6树突状细胞的分离
无菌抽取人外周血,用PBS等体积稀释后,用淋巴细胞分离液按说明书步骤分离单个核细胞。用质量分数0.84% NH4Cl水溶液裂解红细胞10 min,离心,PBS清洗一遍后,细胞计数。调整细胞浓度至1×107个/mL后,以每孔1 mL的量加入24孔平底细胞培养板37 ℃贴壁2 h,去除贴壁的单个核细胞,剩余细胞按2×106~5×106个/mL浓度每孔100 μL接种到96孔平底细胞培养板。
1.4.7益生元对树突状细胞成熟影响的测定
加入新鲜配制的含有GM- CSF和IL- 4的细胞因子溶液至终质量溶度为0.1 ng/mL,同时分别加入对照培养基或终质量浓度为5 mg/mL的不同益生元处理,细胞继续在37 ℃体积分数5% CO2培养箱中孵育培养。第3天进行半量换液,继续培养至第6天,收取树突状细胞。离心弃上清,每个96孔板的孔所有细胞用100 μL 1倍浓度的PBS重悬,加入1 μL Pacific BlueTManti-human CD11b Antibody及1 μL APC anti-human CD83 Antibody。混匀后于室温避光孵育15 min。300 g离心5 min,弃上清。用200 μL 1倍浓度的PBS重悬,并用流式细胞仪检测表面表型并分析。
1.5 数据处理
Western blot产生的灰度图用ImageJ进行灰度定量,所有数据用GraphPad Prism 5软件双边配对t检验进行统计分析,*代表P<0.05;**代表P<0.01;***代表P<0.001;****代表P<0.000 1。
2 结果与分析
2.1 益生元对HCT- 8细胞活性的影响
在比较不同益生元的功效之前,需要确定一个使用浓度。由于母乳中低聚糖的总质量浓度大约为10 mg/mL[15],因此本研究选用同一浓度10 mg/mL的不同益生元去处理肠上皮细胞,来比较不同益生元对于肠上皮细胞炎症的影响。在此之前,检测了该质量浓度下各益生元对于细胞活性的影响,以确保接下来的实验结果存在生理学上的意义。分别用不同益生元处理HCT- 8细胞48 h,然后通过MTT实验检测不同组细胞的相对活性,见图1。
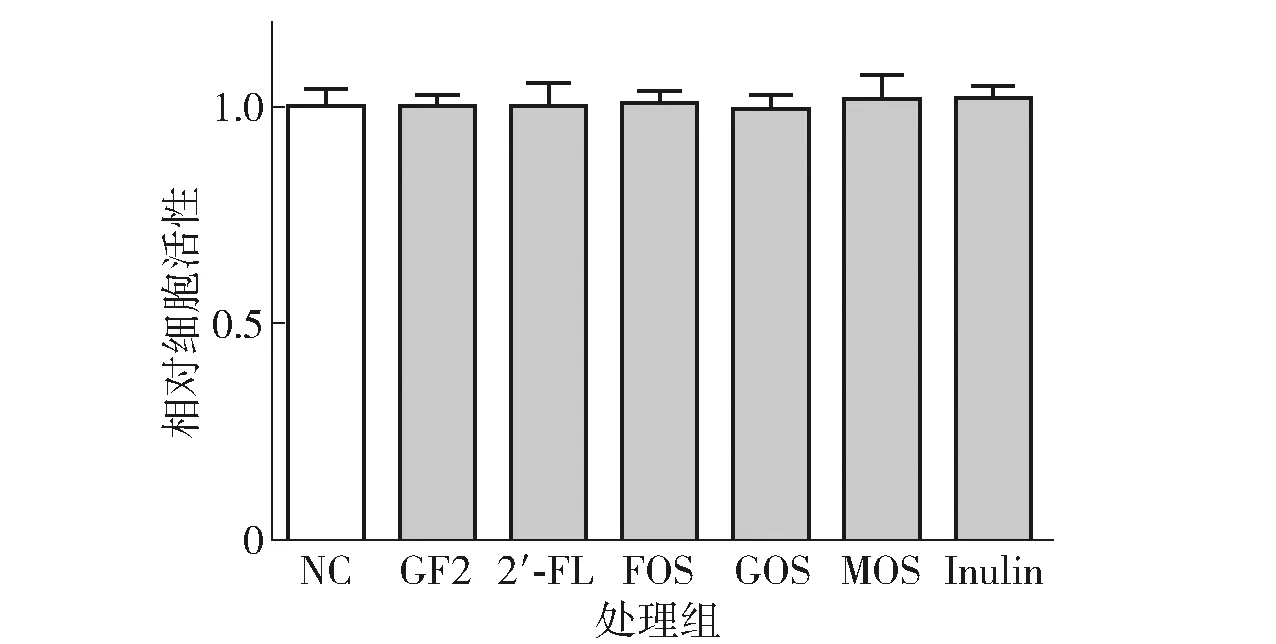
图1 6种益生元对于HCT- 8细胞活性的影响Fig.1 Effect of 6 kinds of prebiotics on cell viability of HCT- 8 cells
由图1可知,10 mg/mL的6种益生元都不影响HCT- 8细胞的活性。
2.2 EHEC诱导HCT- 8细胞炎症响应时间曲线
为了比较不同益生元对于细胞炎症的影响,本研究首先利用EHEC刺激HCT- 8细胞以建立细胞炎症模型,并检测炎症激活的响应时间曲线。HCT- 8细胞用EHEC刺激后,在不同的时间点收取细胞裂解液,免疫印迹检测裂解液中炎症信号通路中关键蛋白NF- κB p65的磷酸化情况,见图2。
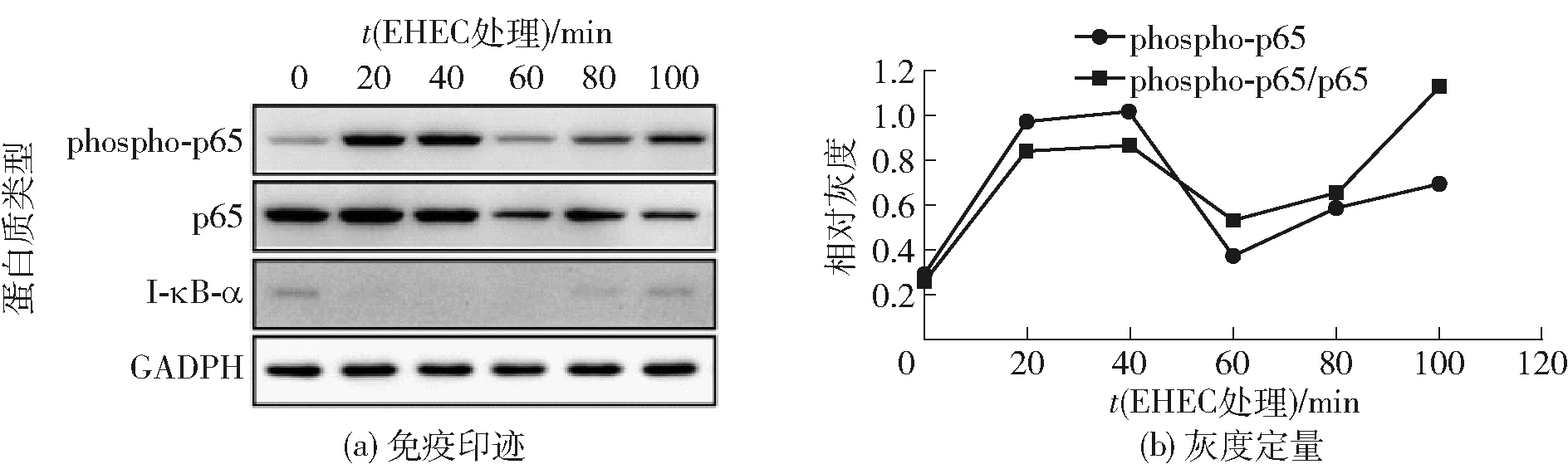
图2 EHEC诱导的HCT- 8细胞中NF- κB炎症信号通路激活时间曲线Fig.2 Time-course of EHEC-induced activation of NF- κB inflammatory signal pathway in HCT- 8 cells
由图2可知,HCT- 8细胞在受到EHEC刺激后,NF- κB信号通路被激活,NF- κB p65蛋白的磷酸化水平(phospho-p65)迅速升高,在40 min左右达到峰值,之后出现下降,再升高。这与前期文献报道的脂多糖LPS刺激下NF- κB信号通路激活曲线类似[16]。另外,本研究的结果显示磷酸化的p65占总p65的比例也出现了同样的变化趋势。因此接下来本研究选取EHEC刺激40 min时的NF- κB信号通路激活水平来比较不同益生元对于EHEC诱导的NF- κB激活的影响。
2.3 益生元对HCT- 8细胞炎症响应的影响
用10 mg/mL质量浓度的不同益生元预处理HCT- 8细胞48 h,再用EHEC刺激产生细胞炎症,在刺激后的40 min收取细胞裂解液,分析其中NF- κB p65的磷酸化情况,结果见图3。

*,**,***分别代表P<0.05,P<0.01及P<0.001。图3 6种益生元对于EHEC诱导的HCT- 8细胞NF- κB炎症信号通路激活的影响Fig.3 Effect of 6 kinds of prebiotics on EHEC-induced activation of NF- κB inflammatory signal pathway in HCT- 8 cells
由图3可知,EHEC刺激40 min时,无论对照组(NC)还是益生元处理组,磷酸化的p65(phospho-p65)的量及磷酸化的p65占总p65的比例(phospho-p65/p65)相比EHEC刺激前(0 min)都出现显著的增加。但EHEC刺激40 min后,对照组与不同益生元处理组的p65的磷酸化水平及磷酸化的p65占总p65的比例存在明显的差异。与不加益生元处理的对照组相比较,加2′-FL或GOS的处理组p65的磷酸化水平及磷酸化的p65占总p65的比例明显偏低,且统计学上存在显著性差异,说明2′-FL或GOS处理显著降低EHEC诱导的NF- κB p65的磷酸化激活,即炎症响应。相同处理情况下,检测NF- κB下游效应因子TNF-α及IL- 6的mRNA表达水平,结果也与NF- κB本身激活水平类似[见图3(d)和图3(e)]。GF2处理组的p65的磷酸化水平及磷酸化的p65占总p65的比例的平均值也比对照组低,且3次独立实验的每一次结果(未显示)也都比对照组低。只不过由于3次实验之间的误差相对较大,3次重复实验不足以显示统计学显著性差异。另外,GF2处理组其下游效应子TNF-α的mRNA表达水平也显著低于对照组,因此可以说GF2处理也降低EHEC诱导的肠上皮细胞炎症响应。而FOS及MOS处理组则对于抑制EHEC引起的炎症响应并无一致性效果。
2.4 益生元对树突状细胞成熟的影响
为了测试不同聚糖类益生元对于人源树突状细胞成熟的影响,本研究首先从志愿者的周环血中分离得到未成熟单核树突状细胞,并在体外培养及诱导成熟分化的过程中加入不同的益生元,观察其成熟情况。CD83分子与其配体的结合是树突状细胞实现抗原呈递功能的基础,而树突状细胞成熟的最典型变化就是抗原呈递能力的增强,因此CD83分子很早就被公认为成熟树突状细胞的标志物[17]。而最近的文献又表明:CD11b分子通过与整合素分子的相互作用参与细胞迁移过程,在炎症因子刺激的情况下,CD11b从细胞表面内在化转运到细胞内,从而促进树突状细胞往淋巴结迁移[18]。因此,本研究通过流式细胞术分析树突状细胞表面CD11b及CD83分子的水平来监测树突状细胞的成熟情况,结果见图4。
由图4可知,图4(a)多边形框中为成熟的树突状细胞,相对于未成熟细胞其CD11b表达下降,CD83表达上升。红色字体表示成熟的树突状细胞占总树突状细胞的比例。本研究将益生元处理组的成熟比例除以对照组的成熟比例,得到益生元处理带来的成熟比例变化倍数,然后取对数之后统计分析30个志愿者收集到的数据,结果显示2′-FL(上升次数比例22/30)及Inulin(上升次数比例19/30)处理显著增加树突状细胞的成熟比例,而GOS(下降次数比例22/30)显著降低树突状细胞的成熟比例。GF2(上升次数比例8/14)及MOS(上升次数比例18/30)处理也促进树突状细胞成熟,但统计未发现显著性差异。FOS(上升次数比例14/30)处理则对于树突状细胞成熟没有一致性影响。
3 结 论
免疫调节是益生元应用的重要方向,而应用益生元辅助治疗炎症性肠病则是免疫调节方向的一个典型运用[19]。肠上皮细胞在炎症因子刺激下的过度炎症响应是造成炎症性肠病的关键因素[14]。之前有研究报道指出2′-FL可以明显地降低脂多糖LPS引起的HCT- 8肠上皮细胞炎症响应[8],且其他多项已经报道的工作也提出2′-FL可以抑制TLR4/NF- κB炎症信号通路[11-12, 20-21]。考虑到LPS被认为是EHEC上刺激细胞炎症响应的主要因子之一[22],本研究结果与之前报道相符。另外,本研究还发现GOS以及GF2也可以直接抑制EHEC引起的肠上皮细胞炎症响应,目前还没有相关的文献报道类似结果。FOS中含有很大比例的GF2(约50%),但却没有发现明显的抑制作用,可能是FOS中其他非GF2组分不具有抑制炎症效果或者反而干扰GF2的抑制炎症效果,暗示益生元组分的纯度可能对于其发挥功能至关重要。
树突状细胞的成熟可以显著的增强树突状细胞的抗原呈递能力,因此对于机体尽快启动特异性免疫清除外源炎症刺激因子起到很重要的作用[23]。之前有文献提出2′-FL处理并不能直接影响人树突状细胞成熟[24],但本研究的结果发现2′-FL处理可以显著促进树突状细胞的成熟。这其中的差异可能是由于文献中处理细胞时使用的2′-FL浓度不够,本研究使用的质量浓度(5 mg/mL)要高于文献所用质量浓度(0.5 mg/mL),这也提示了益生元使用剂量的重要性。之前有文献表明2′-FL可以直接结合树突状细胞表面受体蛋白DC- SIGN(dendritic cell-specific intracellular adhesion molecule-3-grabbing non-integrin)[25],而DC- SIGN受体可以通过激活细胞内ERK1/2-NF- κB等信号通路促进树突状细胞成熟及细胞因子分泌[26],2′-FL是否通过与DC- SIGN结合从而激活NF- κB信号通路促进树突状细胞成熟还需要实验验证。另外,本研究的研究发现Inulin虽然对于EHEC引起的肠上皮细胞炎症没有明显的调节作用,但却可以显著地促进树突状细胞的成熟。GOS可以明显地抑制EHEC引起的肠上皮细胞炎症,但同时也会抑制树突状细胞的成熟。FOS虽然含有大比例的GF2,但似乎FOS中除了GF2以外的其他组分发挥着与GF2相反的效果,导致FOS总体上对于肠上皮细胞炎症及树突状细胞成熟都无明显效果,提示提升FOS中GF2含量的必要性。虽然GOS、Inulin及GF2都能影响树突状细胞的成熟,但具体分子机制如何还需进一步研究。据笔者所知,目前还没有与它们结合的受体及它们直接调节树突状细胞的相关报道,可能是由于糖类化合物的相互作用蛋白不容易鉴定。不过随着相关糖蛋白组学技术[27-29]的发展,相信未来各种糖类益生元的直接细胞生物学功能机制也将逐渐被揭露出来。总的来说,本研究的结果说明不同的益生元其对宿主的生理作用都具有其特异性,还有很多种的益生元以及更多相关的生物学功能有待被研究,这样的研究将有助于了解清楚不同益生元细致的作用机制,促进益生元的精准化应用。
