SDHIs和QoIs杀菌剂抗性研究进展
2022-10-11周明国
高 静,周明国
(南京农业大学植物保护学院,南京 210095)
使用化学杀菌剂是防治农作物病害的重要措施之一,极大地保障了农作物高产、稳产。随着科学技术的进步,杀菌剂逐渐从单一的多作用位点杀菌剂发展为高效选择性杀菌剂,琥珀酸脱氢酶抑制剂(SDHIs)和甲氧基丙烯酸酯类(QoIs)杀菌剂是目前市面上使用体量较大的选择性杀菌剂,但是随着药剂使用时间、范围、频率的不断增加,杀菌剂抗药性问题也变得越来越普遍和严重,常突发性暴发导致防治失败,造成农作物减产、减质,极大地增加了有害生物的防治难度。本文结合国内外杀菌剂抗性进展,详细介绍了SDHI和QoIs 2类药剂的抗性发生现状和抗性机制,并总结了抗药性监测手段,提出了抗药性治理建议,旨在为我国有害生物科学防控、杀菌剂抗性治理提供理论参考。
1 杀菌剂抗性发生现状
1.1 琥珀酸脱氢酶抑制剂类
琥珀酸脱氢酶抑制剂(SDHIs)类杀菌剂在分子上均有(苯)酰胺结构,故又名酰胺类杀菌剂,是杀菌剂抗性行动委员会(FRAC)于2009年划分出来的一类作用机制和抗性机理相似的化合物。该类杀菌剂作用机制为抑制病原菌线粒体呼吸电子传递链和三羧酸循环中琥珀酸脱氢酶活性,干扰呼吸作用,阻碍能量产生,从而杀死病原菌。最早的SDHIs杀菌剂——萎锈灵于19世纪60年代上市,主要用于防治谷类作物锈病和黑粉病等担子菌病害,因其易氧化和光解,多用于种子处理[1]。直到2003年,巴斯夫公司创制出第一个能够用于喷雾和具有广谱杀菌活性的杀菌剂——啶酰菌胺[2],推动了SDHIs类杀菌剂的快速发展。目前,一系列新型SDHIs,如氟吡菌酰胺、异丙噻菌胺、氟唑菌酰羟胺和联苯吡嗪菌胺等,已被广泛用于防治多种作物白粉病、叶斑病、菌核病、灰霉病、赤霉病等真菌病害。其中氟吡菌酰胺还可通过土壤处理防治多种作物根结线虫病。
SDHIs药剂均含有酰胺基(-CONH-)基团,相似的化学结构也决定了该类药剂作用机理相似——与作用靶标琥珀酸脱氢酶单位点结合,靶标位点突变即可产生抗药性。19世纪90年代,Leroux[3]研究报道了生产上首例真菌褐黑粉菌(Ustilago nuda)对萎锈灵产生了抗药性。在啶酰菌胺上市4年后,Zhang等[2]报道了田间和实验室灰霉病菌(Botrytis cinerea)对啶酰菌胺产生了抗药性。随着田间用药的增加,抗性问题也日益突出。灰霉病菌对SDHIs的抗性问题呈高发趋势,Hu等[4]发现田间分离的草莓灰霉菌株对啶酰菌胺、氟吡菌酰胺、氟唑菌酰胺和吡噻菌胺的抗性频率在3年内分别增加至30.0%、1.0%、5.5%和7.4%。除了灰霉病菌以外,多种田间病原菌也对该类药剂产生抗性,如桃褐腐病菌[5]、黄瓜白粉病菌[6]均对啶酰菌胺产生抗性,大麦网班病菌对大多数SDHIs药剂产生抗性[7],以及杀菌剂抗性行动委员会(FRAC)报道田间发现大豆锈病、油菜菌核、大麦叶斑抗性菌株等。除抗性发生频率外,抗性菌株生物活性、适合度和药剂交互抗性数据对后续用药也具有重要指导意义,如发现核盘菌的啶酰菌胺抗性菌株适合度降低,且与萎锈灵存在正交互抗性[8],则萎锈灵抗性菌株不可使用啶酰菌胺防治。FRAC基于不同的SDHI交互抗性模式、抗药性变异频率、抗药性水平及适合度等因素,评估SDHIs的抗药性风险为中等至高等。因此,随着SDHIs药剂的使用时间延长和应用规模扩大,抗性问题也将进一步加重。
1.2 甲氧基丙烯酸酯抑制剂类
甲氧基丙烯酸酯抑制剂(QoIs)类杀菌剂作用于呼吸链复合物Ⅲ细胞色素氧化酶bc1复合物(泛醌氧化酶)外侧,杀菌基团是其分子上的甲氧基丙烯酸酯活性基团。该类化合物抗菌谱广,对半知菌、子囊菌、担子菌和卵菌都有较好的抗菌活性。
19世纪90年代,嘧菌酯和醚菌酯进入市场,随后肟菌酯、啶氧菌酯、吡唑醚菌酯相继上市。由于作用方式单一,QoIs极易产生抗药性。QoIs上市2年后,德国北部地区发现小麦白粉病菌对醚菌酯产生抗性[9],且抗性发展较快。此后,小麦赤霉病、白粉病、叶枯病,大麦网斑病,水稻纹枯病、稻瘟病,大豆褐斑等多种作物病害对该类药剂表现出抗性[10]。在瓜果类作物中,霜霉病抗性问题比较严重。QoIs类杀菌剂在法国和意大利上市4年后即检测到葡萄霜霉菌株对其产生抗性[11]。随着用药的不断增加,葡萄霜霉病对QoIs类杀菌剂已经发展出严重抗性,美国佐治亚州3个葡萄园39株葡萄霜霉菌株全部表现出抗性[12]。随着药剂的不断扩大使用,瓜类白粉病、果树黑星病、瓜果炭疽病等病原菌也对QoIs产生抗性。研究发现,苹果黑星病菌对嘧菌酯产生了严重抗性,抗性频率为96.4%[13]。中国不同地区162株黄瓜靶斑病菌对吡唑醚菌酯均已产生较高抗性,且抗性菌株适合度比敏感菌株更高[14]。温室中采集到的黄瓜褐斑病菌对QoIs类杀菌剂的抗性高达100%,且对6种QoIs药剂表现出较强的正交互抗性[15]。不同的是,经过多年的使用,QoIs类杀菌剂在田间锈病病菌中极少未进化出抗药性,原因是锈病抗性菌株发生氨基酸突变后适合度大大降低,不能在田间形成抗性群体。结合抗性产生和发展情况,FRAC将QoIs杀菌剂归类为高抗性风险杀菌剂。
2 杀菌剂的抗性机制
2.1 琥珀酸脱氢酶类抑制剂
SDHIs药剂的作用靶标为病原菌呼吸作用电子传递链上的复合体Ⅱ,由黄素蛋白(Fp,SdhA)、铁硫蛋白(Ip,SdhB)和另外2种嵌膜蛋白(SdhC和SdhD)等4个亚基组成。
目前,研究发现病原菌对SDHIs产生抗性主要是因为靶标复合物Ⅱ发生氨基酸突变。药靶蛋白发生氨基酸突变后,与药剂的结合受阻,亲和力降低,从而使药剂丧失杀菌作用。其中,大多数突变发生于SdhB、SdhC和SdhD,发生于SdhA的突变极少,具体可见表1。灰霉病菌发生SdhB-P225L、SdhC-G85A和I93V点突变后,对氟唑菌酰羟胺产生抗性[16]。据统计,灰霉病菌SdhB亚基中与SDHIs抗性有关的突变为P225F/L/T/H、N230I、H272R/Y/L/V[17],SdhD亚基中为H132R[18]。286株链格孢霉对啶酰菌胺的抗性菌株基因中有11种突变,80%为SdhB的氨基酸突变(7种:H277Y/R/L,P230A/R,N235D/T),其余为SdhC(1种:H134R)、SdhD(3种:D123E,H133R/P)[19]。西瓜蔓枯病菌的氟唑菌酰羟胺抗性菌株同样为SdhB(H277Y)突变[22]。有趣的是,同一种氨基酸突变会对不同的SDHI类药剂产生不同的效果,如灰霉病菌SdhB(H272R)对除氟吡菌酰胺外的所有SDHIs均产生抗性,SdhB(H272Y)则产生氟吡菌酰胺超敏反应[24]。这可能是因为不同的药剂化学基团不同,药靶氨基酸突变后与药剂的结合模式差异较大,从而产生了截然不同的抗性结果。此外,发生在不同的真菌物种中的同源氨基酸突变也会产生不同的影响,如M.graminicola的P220位点突变和B.cinerea的P225位点突变[25]。
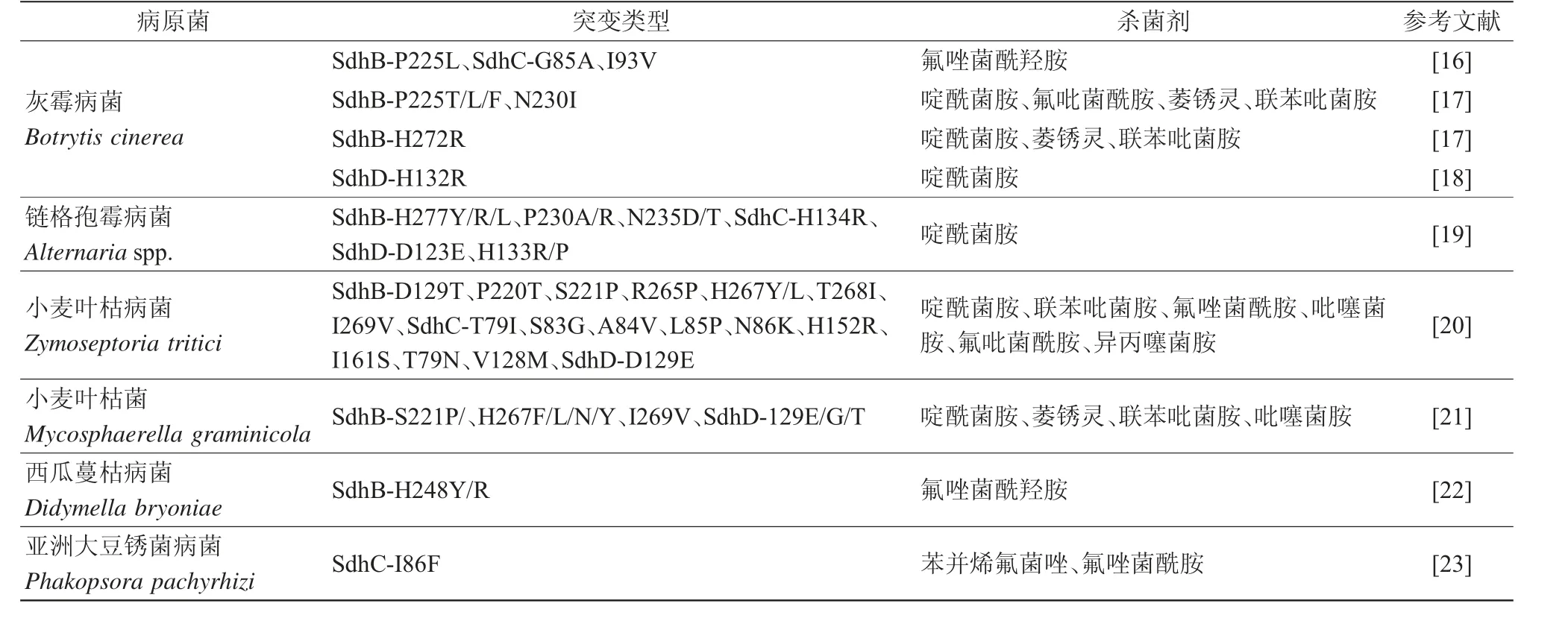
表1 SDHIs杀菌剂抗性菌株氨基酸突变类型
除了氨基酸突变以外,靶标的遗传分化也会导致药剂抗性。赤霉病菌存在2个SdhC的遗传分化,降低了对SDHIs的敏感性。除赤霉病菌外,小麦叶枯病菌分化出一个SdhC的同源基因——alt-SDHC,该基因介导了对氟唑菌酰羟胺、氟吡菌酰胺等SHA-SDHIs亚类杀菌剂的天然抗性。Alt-SDHC与其他3个SDH亚基结合可产生功能齐全的酶,其蛋白中的独特Qp位残基赋予了SHA-SDHI抗性。欧洲小麦叶枯病菌群体中20%~30%菌株存在alt-Sdhc基因,且该基因的表达水平、剪切效率可直接影响菌株对氟唑菌酰羟胺等药剂的抗性水平,这种现象表明了靶标的分化对药剂抗性的重要影响作用[26]。
2.2 甲氧基丙烯酸酯类杀菌剂
QoIs和SDHIs同属于呼吸抑制剂,均结合于线粒体呼吸作用电子传递链上的复合物,但QoIs主要结合于复合物Ⅲ中细胞色素b(Cyt b)的Qo位点,从而抑制氢醌与Qo位点的结合,中断复合物Ⅲ的电子传递,使病原菌不能产生ATP,进而造成能量代谢紊乱[27]。
细胞色素b由线粒体DNA编码,容易发生氨基酸突变产生抗药性。已报道的病原菌对该类杀菌剂的抗性突变类型是G143A、F129L和G137R,表2统计了常见病原菌的抗性突变类型。第一种,G143A为核苷酸密码子由GGT突变为GCT,丙氨酸取代甘氨酸,药剂与靶标的结合能力受到较大影响,因此产生了高水平抗药性。G143A在田间抗性菌株中十分常见,像苹果黑星病菌27株抗性菌株均为G143A点突变[13],黄瓜靶斑病菌162株抗性菌株中均检测到了G143A点突变[14]。G143A引发的抗性倍数可高达数百倍,大大影响了QoIs单剂在田间的药效[30]。菜豆锈菌等143位密码子后存在内含子,突变后抗性菌株不能在田间生存,因此很少有高水平抗药性发生[31]。灰霉病菌存在143位密码子后包含和不包含内含子2种基因型,在QoIs药剂广泛使用后,自然界形成了G143A高水平抗药性基因型病原菌群体[32]。第二种,苯丙氨酸转变为亮氨酸(F129L)使得Cyt b空间上更靠近血红素bL,干扰QoIs杀菌剂毒性基团发挥作用,进而产生高水平抗性,但抗药性水平略低于G143A。F129L抗药性变异对致病性的影响比较大[28]。第三种,甘氨酸被精氨酸取代(G137R)产生的抗性多为低抗和中抗,且抗性变异的适合度代价较大,难以在田间存活。

表2 QoIs杀菌剂抗性菌株氨基酸突变类型
除氨基酸突变外,旁路氧化途径(又名替代氧化途径)也是导致QoIs产生抗性的重要原因之一。旁路氧化途径指的是电子从NADH经FMN、Fe-S、UQ、FP,由旁路氧化酶(AOX)传至氧,该过程不经过复合物Ⅲ。很多真菌的AOX为诱导表达型,即正常条件下表达水平很低或者不表达,但如果以细胞色素为介导的呼吸途径被阻断或线粒体蛋白的合成受到抑制,AOX则会被诱导表达[27]。嘧菌酯、肟菌酯都可激活甜橙炭疽病菌的旁路氧化途径,从而导致抗性增加[33]。旁路氧化途径合成的ATP只是经过复合物III合成能量的40%,因此通过增加旁路氧化酶活性而表现抗药性的菌株适合度低,不是生产实际中产生抗药性的主要机制。
3 杀菌剂的抗药性监测
目前,化学防治仍是防控真菌病害最有效的方法。由于病原微生物具有较高的繁殖率,在药剂选择压力下,少数抗药性突变菌株在较短时间内就可能通过侵染和繁殖形成抗药性群体,导致杀菌剂突然失效,防控措手不及,造成重大损失。因此,抗药性群体发展态势监测及早期预警十分重要。
抗药性监测和治理大概可分为4个阶段[9]:第一步是在杀菌剂投入市场之前,在实验室测定病原菌对药剂的敏感性,建立敏感基线。通过敏感基线可以比较不同病原菌对杀菌剂敏感性的时空变化,有利于掌握病原菌抗性发展动态[34]。从实验室数据中评估药剂的抗药性风险,制定药剂的初步使用策略。第二步是在杀菌剂前期使用阶段,此阶段可能会出现一些抗性个例。采集田间抗性菌株,确定是否产生抗性、与其他药剂是否有交互抗性及适合度变化等问题,调整药剂使用策略并加强抗药性监测。第三步是在抗性问题比较普遍情况下,通过抗性监测认识到抗性的传播速度、发展速度,探究抗性机制,进一步调整药剂使用策略(多分为继续使用和禁用2种)。第四步指的是药剂被禁用的情况下,继续监测病原菌的抗性发展情况,为同类药剂的使用提供理论参考。
传统的抗药性监测方法主要是敏感性测定和区分剂量法[35]。敏感性测定指的是通过菌丝生长速率法或孢子萌发法将病原菌放置到含药培养基或喷洒药剂的植物组织上,检测病原菌对药剂的敏感性。该方法通过计算EC50值(引起群体50%个体死亡的药剂浓度)确定病原菌的抗性水平,计算抗性频率,判断抗性产生情况,评估该群体的抗药性风险。区分剂量法指的是通过测定病原菌对药剂的EC50值和MIC值(药剂完全抑制病原菌生长的最小浓度),确定一个鉴别剂量,以病原菌是否可以在该浓度生长来判断其敏感或抗性[9]。传统方法主要适用于抗性机制还不完全明确的药剂,比如检测番茄灰霉病菌对苯醚甲环唑的抗性[36]。该方法对病原菌的抗性检测是比较准确和灵敏的,但是过程费时费力,工作量比较大,不适合在田间展开。
随着科学技术的进步,现代分子检测法开始被应用。第一类方法为基于核酸检测水平的分子技术,通过检测已知的抗性位点来判断抗性发展情况。单核苷酸多态性(SNPs),是指由于单个核苷酸改变而导致的核酸序列多态[9],是研究生物遗传变异的重要依据。由于药剂靶标发生氨基酸突变而产生的抗性,可通过SNPs相关技术被监测到,具体可包括Simoes等[23]利用物种特异性RT-PCR定性、定量检测引发大豆锈病病菌对SDHIs抗性的C-I86F突变;Battistini等[37]采用微滴数字PCR检测引发小麦叶枯病菌对QoIs抗性的典型突变G143A;Samaras等[17]应用高分辨率熔解(HRM)可快速识别对SDHIs有抗性的B.cinerea病菌SdhB上的P225H/F/L/T、N230I、H272L/R/Y突变[17];利用环介导等温扩增(LAMP)技术可以监测和评估B.cinerea对QoIs药剂的抗性发展风险[38-39],而且不受实验设备的限制,能够直接用于现场快速检测;采用实时定量荧光PCR技术[40]也可以实现抗性监测等。第二类方法为分析靶标蛋白与药剂的结合方式,如分子对接法,该方法是基于相关软件模拟靶标蛋白与药剂的结合,通过各个参数预测二者的结合方式和结合能力,从而推断出抗性机制。陶丽红等[41]利用分子对接研究了5种SDHIs与灰葡萄孢菌SDH的结合模式,并分析了氨基酸突变导致结合部位的结构变化。综上比较可得,分子检测技术相比于传统检测技术,检测速度快,可批量检测大批样本,但适用范围有限,成本比较高。
4 杀菌剂的抗药性治理
田间出现抗药性主要是因为长期频繁使用同一种作用机制的药剂,病原菌长期受到同一种筛选压力,便容易进化出抗性群体。因此,抗药性治理最重要的措施是合理规范用药。
我们应充分了解病害的发生特点、药剂的作用机理和抗性监测情况,保证药效的同时减少抗性群体的产生。在药剂的选择上,应考虑防治对象的特性、不同杀菌剂作用机制的差异、抗性机制的差异、抗性群体的生物学特性和适合度变化等因素。关于防治对象,明确病原菌的抗性风险级别,像小麦白粉病菌、灰霉病菌为高风险病原菌,小麦纹枯病菌为中风险病原菌,锈病菌为低风险病原菌,再结合药剂特点进行组合用药。关于药剂的选用,应考虑药剂作用机制和抗性机制,明确所用药剂的抗性风险等级。避免使用FRAC中同一个亚类的药剂,因为同一亚类的药剂多有交互抗性(大多数SDHIs有正交互抗性;QoIs中代码11的嘧菌酯、丁香菌酯、醚菌胺等有正交互抗性),建议使用无交互抗性(QoIs中代码11和代码11A)或有负交互抗性的药剂;限制同一类作用机制药剂的使用量,将不同作用机制的药剂复配使用,目前药剂混用多分为交替使用和混合使用2种,研究表明混合使用时效果更好[42];对已经产生抗药性的病原菌,根据其抗性特点合理安排药剂,如对QoIs代码11的药剂产生抗性的G143A突变体,可使用代码11A的药剂防治。关于抗性群体的形成,通过检测抗性菌株的菌丝生长、孢子萌发、致病力等生物学特性判断其是否可以在田间形成抗性群体或成为病原菌的优势群体。适合度降低的情况下可继续使用此类药剂(G137R抗性菌株可继续使用QoIs),适合度增加的情况下则不可使用(黄瓜靶斑抗性菌株不可使用吡唑醚菌酯)。探明SDHIs不同品种抗药性突变类型及交互抗性模式后,制定合适的药剂使用方案。
除此之外,确保用药时间、用药量和施药方式正确。QoIs可有效抑制孢子萌发,应在病原菌孢子萌发阶段使用。当药效降低的时候不要盲目增加药量,首先确认施药方式是否正确,避免药剂浪费影响药效。最后,根据抗药性监测的结果及时调整用药策略。QoIs可引起毒素含量增加,故不建议防治赤霉病,而井冈霉素与戊唑醇组合使用防治小麦赤霉病可达到抑菌降毒的效果,一举多得[43]。
5 展望
随着遗传一致性的农产品商业化生产、气候变暖以及保护地种植面积的不断增加,农作物病害的发生与流行将会越来越严重。安全、高效的选择性杀菌剂仍是应急防治农作物病害的主要武器。然而,伴随选择性杀菌剂广泛应用,抗药性问题是植物病害可持续绿色防控面临的严峻挑战。通过种植抗病品种和健康栽培等农艺措施可以降低病害防治压力;通过科学安全使用农药和采用综合防治策略可以降低杀菌剂选择压力,二者结合必将能够延缓抗药性发展、延长杀菌剂使用寿命。此外,加强病原菌生物学基础研究,不断发现新的药物分子靶标及解析分子靶标的药敏性结构特征,创制新型靶向杀菌剂将是治理抗药性的根本策略。
