药用与食用黄精次生代谢产物差异分析及改善胰岛素抵抗的活性成分与作用机制研究
2022-10-11刘友平陈鸿平
陈 林,王 敏,胡 媛,刘友平,陈鸿平,王 福
成都中医药大学药学院 西南特色中药资源国家重点实验室,成都 611137
胰岛素抵抗(insulin resistance,IR)一般是指正常浓度下胰岛素靶细胞对定量浓度的胰岛素生物学应答敏感性降低,即胰岛素促进葡萄糖摄取和利用作用受损,导致胰岛素分泌代偿性增多,引起骨骼肌、肝脏、脂肪等组织对胰岛素敏感性下降和对葡萄糖的利用障碍[1]。其中,IR是2型糖尿病重要的发病机制之一,贯穿于2型糖尿病全过程[2]。目前,治疗IR的药物主要为胰岛素增敏剂,但存在骨折、水肿、肝损伤等副作用[3]。
黄精PolygonatumsibiricumRed.为百合科黄精属植物,为《中国药典》2020年版收载的3种黄精之一,以干燥块茎入药,为常见药食两用品,因其外形呈结节状弯柱形类似鸡头,俗称鸡头黄精,广泛分布于四川、湖南、江西等地区,性味甘平、无毒,具有补气养阴,健脾,润肺,益肾的功效,用于治疗脾胃气虚,体倦乏力,内热消渴等证[4],主要含有多糖、皂苷、黄酮、生物碱及蒽醌等成分[5]。临床上,黄精复方被广泛用于2型糖尿病的治疗,对气阴两虚型2型糖尿病可以缓解患者的中医证候,降低血糖、血脂,改善胰岛功能[6]。文献报道黄精复方改善胰岛功能的机制认为,其活性成分通过作用于PI3K和STAT3等靶点,进一步影响蛋白质丝氨酸/苏氨酸活动、PI3K-AKT等信号通路而发挥作用[7];黄精单味药改善胰岛功能的机制研究认为,黄酮类化合物通过作用于突触后膜,改变细胞对药物的敏感性、细胞神经递质受体活性等生物过程及调控钙离子、激素抵抗等信号通路起到了改善IR的作用[8]。
目前,HPLC、LC-MS/MS、UPLC-Q-TOF-MS等技术常用于黄精化学成分的定性与定量研究,已报道黄精含有黄酮类成分以及生物碱等化学成分[9],但普遍存在检测成分数量少,难以反映黄精中所含全部代谢产物。近年来,随着代谢组学技术的发展,基于UPLC-ESI-MS/MS的广泛靶向代谢组学技术广泛用于中药代谢产物的研究,与传统常见色谱技术相比具有高灵敏度、低成本、高通量的优势[10,11]。由于目前尚未见药用与食用黄精整体次生代谢产物差异分析报道,本文以药用黄精(PolygonatumsibiricumRed.)以及食用黄精(互叶卷黄精PolygonatumalternicirrhosumHand.-Mzt.,俗称水果黄精)为研究对象,首次采用UHPLC-ESI-MS/MS广泛靶向代谢组学技术对其次生代谢产物进行全面检测,并采用主成分分析(PCA)、HCA聚类分析以及正交偏最小二乘法判别分析(OPLS-DA)对代谢产物进行比较分析,筛选差异代谢物;其次对药用黄精与食用黄精差异代谢物相对含量变化前十且上调的化合物进行改善胰岛素抵抗的网络药理分析,并对活性成分和关键靶点进行分子对接,选用HepG2细胞进行细胞实验验证。一方面以期全面了解药用与食用黄精差异代谢物,为黄精品质评价奠定基础,另一方面拟筛选治疗IR的潜在活性成分,为阐述黄精治疗IR的作用机制提供依据。
1 材料与方法
1.1 实验材料
超高效液相色谱-质谱联用仪(ultra-high performance liquid chromatography,UHPLC,Shim-pack UFLC SHIMADZU CBM30A,Tandem mass spectrometry,MS/MS,Applied Biosystems 6500 QTRAP);色谱柱(Waters T3 C181.8 μm,2.1 mm×100 mm);FA2003电子分析天平(上海浦春);MM400球磨仪(德国莱驰);TGL-16台式高速离心机、2500-A台式低速离心机(湖南湘仪实验仪器有限公司);冻干机(Scientz-100F);移液枪(德国Eppendorf公司);HCB-1300V洁净工作台、HCP-168二氧化碳培养箱(青岛海尔生物医疗股份有限公司);B25-12D超声波清洗仪(宁波新艺超声波设备有限公司);UPT-12D优普系列超纯水机(成都超纯科技有限公司);GR85DA高压灭菌锅(美国ZEALWAY INSTRUMENT INC);NIKON DS-U3成像系统(日本尼康);Allegra X-12R冷冻离心机(Beckman Coulter);CKX53显微镜(奥林巴斯有限公司);3001酶标仪(Thermo Fisher Scientific Oy);HB120-S金属浴、D1008掌上离心机、MX-S可调式混匀仪(大龙兴创实验仪器有限公司);EPS-300数显式稳压稳流电泳仪、VE-180B垂直电泳槽、VE586转移电泳槽(上海天能科技有限公司);TS-2脱色摇床(海门市其林贝尔仪器制造有限公司)。
乙腈(美国Fisher chemical,色谱纯);娃哈哈纯净水;甲酸(美国,MREDA Technology Inc);甲醇、乙醇(北京化工厂,分析纯);二甲亚砜(成都市科隆化学品有限公司,分析纯);二甲基亚砜(Sigma,细胞级,批号SHBK2703);胰酶细胞消化液(Biosharp,批号70090500);胎牛血清、PBS缓冲液(BI,批号分别为2106044、2138268);青霉素-链霉素双抗溶液(美国HyClone公司,批号J190033);DMEM培养基(Gibco,批号8121557);DMEM高糖培养基、脱脂奶粉(北京索莱宝科技有限公司,批号分别为20211124、107B055);BCA蛋白定量试剂盒、化学发光检测试剂盒、PAGE凝胶快速制备试剂盒、SDS-PAGE蛋白上样缓冲液、TBST、快速转膜缓冲液、电泳缓冲液、RIPA裂解液、BSA蛋白标准、三色预染Marker、PVDF膜(上海雅酶生物科技有限公司,批号分别为01543050、024B1100、024A1250、01461050、034B1200、01451040、034B1200、014B1070、01542050、02552410、280659340);噻唑蓝(安耐吉生物,批号EQ9RED6D);葡萄糖测定试剂盒(上海荣盛生物药业有限公司,批号为20211208137);辣根过氧化物酶标记山羊抗兔、辣根过氧化物酶标记山羊抗小鼠、兔抗AKT1、兔抗mTOR、兔抗VEGF(碧云天生物技术研究所,批号分别为A0208、A0216、AF1777、AF1648、AF0312);β-actin、鼠抗AMPK、鼠抗PI3K(景杰生物,批号分别为RL080946、ML081163、L011304);异鼠李素、野漆树苷(上海同田生物技术有限公司,批号分别为21041623、21080923);异野漆树苷(西力生物,批号为BBP01924);精蛋白人胰岛素混合注射液(通化东宝药业股份有限公司,国药准字S20030004);盐酸二甲双胍缓释片(山东司邦得制药有限公司,国药准字H20060230)。
实验所用细胞为人肝癌细胞系HepG2细胞,来自于成都中医药大学药学院;实验所用样品采集于重庆市秀山土家苗族自治县八家路村,收集时间为2020年7月9日,经成都中医药大学严铸云教授鉴定,样品1为互叶卷黄精(PolygonatumalternicirrhosumHand.-Mzt.)新鲜全株;样品2为药用黄精(PolygonatumsibiricumRed.)新鲜全株。1号样品为地方野生食用品种,该品种因多糖含量高,口感甜,俗称水果黄精(SGHJ);2号样品为药典收载药用品种(HJ)。样品1与2各收集3批次,编号标记,返回实验室后,将样品块茎放置于冻干机中真空冷冻干燥,采用研磨仪研磨(30 Hz,1.5 min)至粉末状,保存于-80 ℃冰箱,备用。
1.2 实验方法
1.2.1 样品制备
取药用与食用黄精干燥样品(过四号筛)100 mg,量取1.0 mL甲醇水溶液(70%甲醇)溶解,超声0.5 h,低温静置12 h,期间涡旋3次,离心并吸取上清,过滤,于进样瓶中备用。
1.2.2 色谱与质谱条件
质谱与色谱条件参考文献报道方法[12]。液相条件主要包括:(1)色谱柱:Agilent SB-C181.8 μm,2.1 mm×100 mm;(2)流动相:A相为超纯水(加入0.1%的甲酸),B相为乙腈(加入0.1%的甲酸);(3)洗脱梯度:0.00 min B相比例为5%,9.00 min内B相比例线性增加到95%,并在95%维持1 min,10.00~11.10 min,B相比例降为5%,并以5%平衡至14 min;(4)流速0.35 mL/min;柱温40 ℃;进样量4 μL。质谱条件主要包括:LIT和三重四极杆(QQQ)扫描是在三重四极杆线性离子阱质谱仪(Q TRAP),AB4500 Q TRAP UPLC/MS/MS系统上获得的,该系统配备了ESI Turbo离子喷雾接口,可由Analyst 1.6.3软件(AB Sciex)控制运行正负两种离子模式。ESI源操作参数如下:离子源,涡轮喷雾;源温度550 ℃;离子喷雾电压(IS)5 500 V(正离子模式)/-4 500 V(负离子模式);离子源气体I(GSI)、气体II(GSII)和帘气(CUR)分别设置为50、60和25.0 psi,碰撞诱导电离参数设置为高。在QQQ和LIT模式下分别用10和100 μmol/L聚丙二醇溶液进行仪器调谐和质量校准。QQQ扫描使用MRM模式,并将碰撞气体(氮气)设置为中等。通过进一步的DP和CE优化,完成了各个MRM离子对的DP和CE。根据每个时期内洗脱的代谢物,在每个时期监测一组特定的MRM离子对。
1.2.3 代谢物定性定量原理
代谢物结构解析参考了MassBank(http://www.massbank.jp)、KNAPSAcK(http://kanaya.naist.jp/KNApSAcK)、HMDB(http://www.hmdb.ca)、MoToDB(http://www.ab.wur.nl/moto)、METLIN(http://metlin.scripps.edu/index.php)、MWDB(metware database)等已有的质谱数据库。代谢物定量是利用三重四级杆质谱的多反应监测模式(multiple reaction monitoring,MRM)分析完成。MRM模式中,四级杆首先筛选目标物质的前体离子(母离子),排除掉其他分子量物质对应的离子以初步排除干扰;前体离子经碰撞室诱导电离后断裂形成很多碎片离子,碎片离子再通过三重四级杆过滤选择出所需要的一个特征碎片离子,排除非目标离子干扰,使定量更为精确,重复性更好。
根据新村金矿床原生晕及各项地球化学参数的研究,绘制矿床成矿元素空间分布示意图(图5)。从示意图中可以看出,成矿热液由矿区北北西侧深部沿构造通道多次分期上侵至矿区。根据矿床原生晕的大致分带情况可知,矿区的原生晕轴向分带为以Mo-Ni-Co-Cu为后尾晕,以W-Au-Ag-As-Sb为中心晕,以Mn-Ba-Zn-Pb-Hg为前缘晕。而示意图中实线所标示的原生晕中心正是新村金矿主要矿体部分,故可以推断在-60中段的下方,仍旧有大部分金矿体的存在,同时也表明矿区北北西侧深部仍有较大找矿空间。
1.2.4 代谢物定性定量分析
图1A所示为混合样品的总离子流图(TIC),纵坐标为离子流强度,横坐标为保留时间。基于“1.2.3”所列代谢数据库,对本实验所有样本的代谢物进行了质谱定性定量分析。为了比较所检测到代谢物的含量差异,对检测到的每个代谢物的质谱峰进行校正。获得不同样本的代谢物质谱分析数据后,对所有物质质谱峰进行峰面积积分,并对其中同一代谢物在不同样本中的质谱出峰进行积分校正。
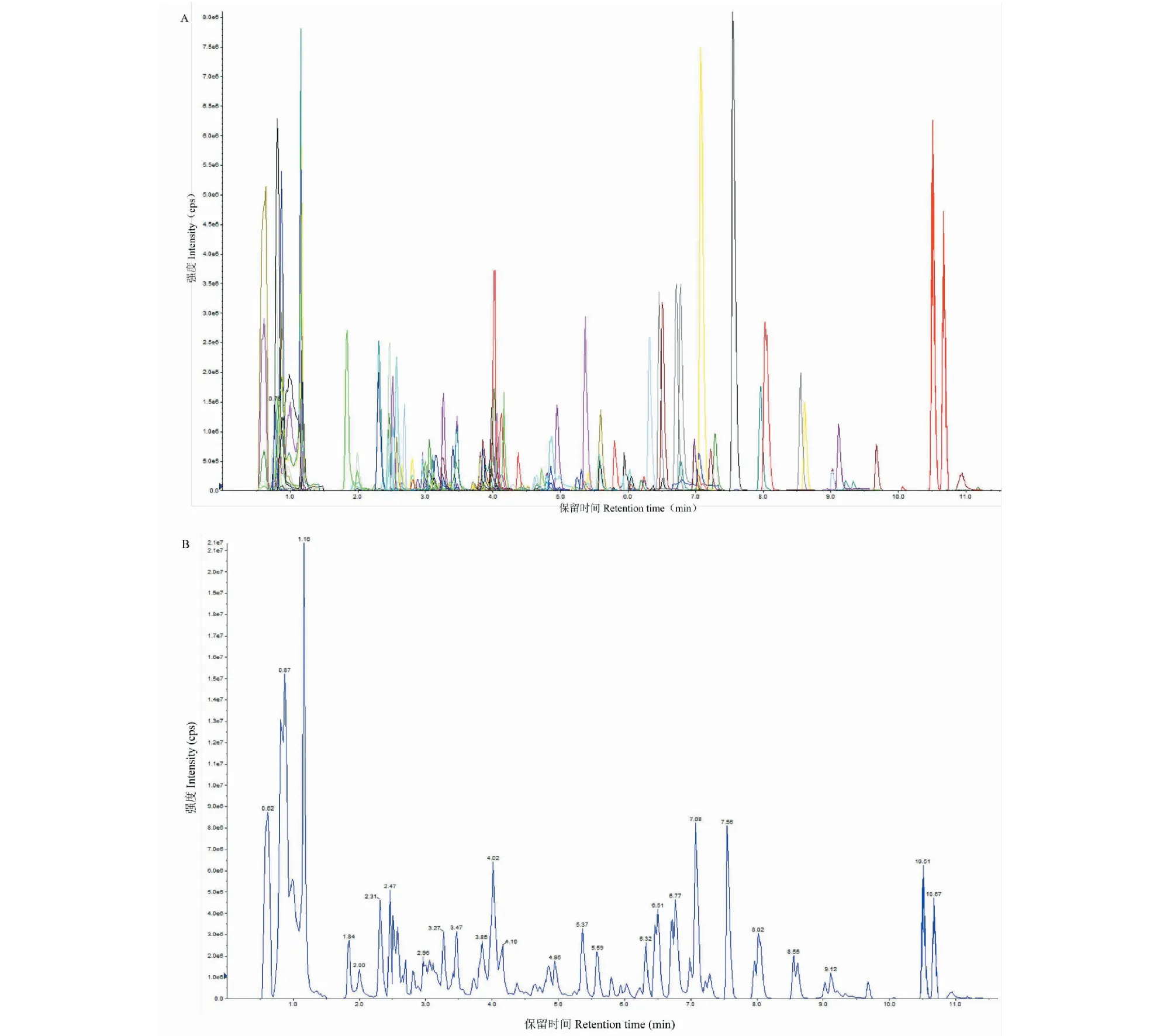
图1 QC样本质谱检测TIC重叠图(A)与混合样品TIC图(B)Fig.1 TIC overlapping map of QC sample (A) and TIC map of mixed sample (B)
1.2.5 样本质控分析
在实验过程中,为确保实验的准确性,在每2个检测分析样本中插入一个质控样本,以监测分析过程中的重复性。通过对不同质控样本质谱检测分析的总离子流图(见图1B)进行重叠展示分析,可以判断代谢物提取和检测的重复性,即技术重复。仪器的高稳定性为数据的重复性和可靠性提供了保障。
1.2.6 网络药理分析
1.2.6.1 药物成分及靶点筛选
使用PubChem数据库获得药用黄精与食用黄精差异代谢物相对含量变化前10且上调的化合物的结构,导入Swiss Target Prediction数据库,取预测得分大于0的靶标作为药物靶点。
1.2.6.2 IR疾病靶点蛋白的确认
以“insulin resistance”为检索词检索DisGeNET、CTD、GeneCards与OMIM数据库获取IR的疾病靶点蛋白,去除重复值后运用UniProt数据库对其进行蛋白名称标准化,以备进一步分析。运用R 3.6.0将黄精的药物靶点与IR的疾病靶点取交集,作为黄精治疗IR的潜在作用靶点。
1.2.6.3 药物-成分-靶点-疾病网络构建
使用Cytoscape 3.7.2软件,构建“药物-成分-靶点-疾病”网络图,使用Network Analyzer功能对黄精的主要活性成分进行分析,将黄精潜在活性成分与药物-疾病共同靶点输入Cytoscape软件中,绘制出“药物-成分-靶点-疾病”相互作用的网络图。
1.2.6.4 PPI网络构建
将上述药物-疾病共同靶点输入到STRING数据库中进行检索,设置蛋白种类为“Homo sapiens”,最低相互作用阈值为0.4,构建蛋白相互作用的PPI网络。
1.2.6.5 分子对接验证
运用AutoDock Vina软件(1.2.2)和Pymol软件对“1.2.6.1”和“1.2.6.2”筛选活性成分与关键靶点进行对子对接,评价黄精活性成分与关键靶点之间的结合活性,并以结合能来评价其结合活性。
1.2.7 细胞实验验证
1.2.7.1 HepG2细胞培养
HepG2细胞复苏后,用含10%胎牛血清和1%青链霉素混合液的DMEM完全培养基于37 ℃、5% CO2培养箱培养,待细胞贴壁且汇合度达80%以上,用0.25%胰酶消化传代,取对数生长期的细胞用于实验。
1.2.7.2 MTT法检测野漆树苷、异野漆树苷、异鼠李素对HepG2细胞存活率的影响
将对数生长期的HepG2细胞以4 000个/孔的密度接种于2块96孔板中,每孔100 μL,培养箱培养24 h,吸弃培养基。设置空白组、对照组和药物处理组。空白组仅加入不含药DMEM完全培养基,不接种细胞,对照组加入不含药DMEM完全培养基,药物处理组加入用不含血清的DMEM培养基配制的不同浓度的野漆树苷(浓度处理分别为:30、15、7.5、3.8、1.9、1 μg/mL)、不同浓度的异野漆树苷(浓度处理分别为100、50、25、12.5、6.3、3.2、1.6 μg/mL)、不同浓度的异鼠李素(浓度处理分别为200、100、50、25、12.5、6.3 μg/mL),每组浓度设3个复孔,培养箱培养24 h后每孔加入20 μL MTT液(5 mg/mL),培养4 h后吸弃培养基,每孔加入150 μL DMSO,摇床震荡10 min,于570 nm处测每孔吸光度值并计算细胞存活率,公式如下:
细胞存活率=(药物处理组OD值-空白组OD值)/
(对照组OD值-空白组OD值)×100%
1.2.7.3 建立HepG2细胞胰岛素抵抗(IR)模型与药物干预处理
取对数生长期的HepG2细胞,以悬液浓度为8×105个/皿的密度接种于直径为100 mm的细胞培养皿中,培养箱培养至细胞贴壁且汇合度达80%,吸弃培养基,PBS清洗2次,加入无血清培养基饥饿培养12 h,将饥饿培养后的细胞随机分组为对照组、模型组、阳性对照组、野漆树苷组、异野漆树苷组、异鼠李素组,饥饿培养后吸弃培养基,PBS清洗2次,对照组加入DMEM完全培养基,其他组加入新配制的含有胰岛素(胰岛素浓度为:1×10-6mol/L)的DMEM高糖完全培养基,于培养箱中继续培养24 h即得胰岛素抵抗(IR)模型。24 h后,对照组加入DMEM完全培养基,模型组加入含有胰岛素的培养基,阳性对照组加入含有二甲双胍和胰岛素的培养基,根据MTT实验结果,野漆树苷组加入含有胰岛素和野漆树苷的培养基,异野漆树苷组加入含有胰岛素和异野漆树苷的培养基,异鼠李素组加入含有胰岛素和异鼠李素的培养基,于培养箱中培养24 h。24 h后取培养基上清,离心,按照葡萄糖检测试剂盒说明书操作,计算细胞葡萄糖消耗量。
1.2.7.4 Western blot检测PI3K、AKT1、VEGF、mTOR、AMPK信号通路相关蛋白表达情况
将药物干预后的细胞弃去培养基,用预冷的PBS清洗2次,加入新配制的RIPA裂解液并收集细胞于预冷的1.5 mL离心管中,用枪头反复吹打细胞裂解液数次,冰上裂解30 min,于4 ℃、13 000 r/min离心30 min,取上清,用BCA法测蛋白浓度,蛋白加入5×loading buffer于98 ℃煮8 min,使蛋白变性,煮完后冰上预冷,涡旋,离心,放-20 ℃保存备用。制备蛋白上样样品,取蛋白样品10 μg进行SDS-PAGE电泳,湿法转膜,转膜后加入适量含5%脱脂奶粉的TBST封闭液于摇床上室温封闭2 h,封闭完成后,用TBST洗膜,共3次,每次10 min,洗膜完成后加入一抗,4 ℃孵育过夜。次日回收一抗,用TBST洗膜,共3次,每次10 min,加入二抗,于摇床上室温孵育1 h,用TBST洗膜,共3次,每次10 min,洗膜后ECL法显影。采用Image J软件对目的条带进行灰度值分析:目的蛋白表达量=目的蛋白灰度值/β-actin灰度值。
1.2.7.5 数据分析

2 实验结果
2.1 样品中次生代谢产物的鉴定
经过分析本文共鉴定出319种次生代谢产物,包括酚酸类86种,黄酮类96种,蒽醌类5种,木脂素与香豆素25种,鞣质3种,生物碱51种,萜类11种,甾体21种,其他类21种。代谢物含量数据采用极差法进行归一化处理,通过R软件(www.r-project.org/),对代谢物在不同样本间的积累模式进行聚类分析(hierarchical cluster analysis,HCA)。通过聚类分析(见图2A)可知,同一品种不同批次的药用黄精和食用黄精存在次生代谢物差异,种内次生代谢物变异较大;不同批次药用黄精与食用黄精次生代谢物分别聚为一类,可以明显区分。从热图可以判断,药用黄精与食用黄精次生代谢产物差异较大,药用黄精次生代谢物相对含量普遍高于食用黄精,且相对含量较高的次生代谢物数量占优。

图2 药用黄精与食用黄精代谢物的聚类(A)与主成分(B)分析Fig.2 HCA (A) and PCA (B) analyses of medicinal and edible Polygonati Rhizoma
2.2 主成分分析(PCA)与正交偏最小二乘判别分析(OPLS-DA)
本文通过主成分分析方法将次生代谢物的差异通过降维处理以直观反映样本之间的代谢物差异情况。图2B中可以看出,主成分PC1与PC2的占比分别达到了48.01%和20.36%,积累贡献率达到了68.37%。药用黄精与食用黄精分别聚为一类,可明显区分,实验结果与聚类分析一致;正交偏最小二乘判别分析(OPLS-DA)被广泛用于代谢组数据的分析,由于其分析方法可以最大化组间差异常被用于差异代谢物的筛选。在OPLS-DA分析中,Q2是一个重要的参数,若数值大于0.9,则可以反映该模型的可靠性与稳定性。图3A中可以看出,药用黄精与食用黄精比较组OPLS-DA模型中Q2为0.996,其数值大于0.90,证实该模型可以用以下一步的差异代谢物分析。

图3 药用黄精与食用黄精代谢物的OPLS-DA(A)与差异代谢物分析(B)图Fig.3 OPLS-DA (A) and volcanic plots (B) of differential metabolites of medicinal and edible Polygonati Rhizoma
2.3 差异代谢物的筛选、注释与富集
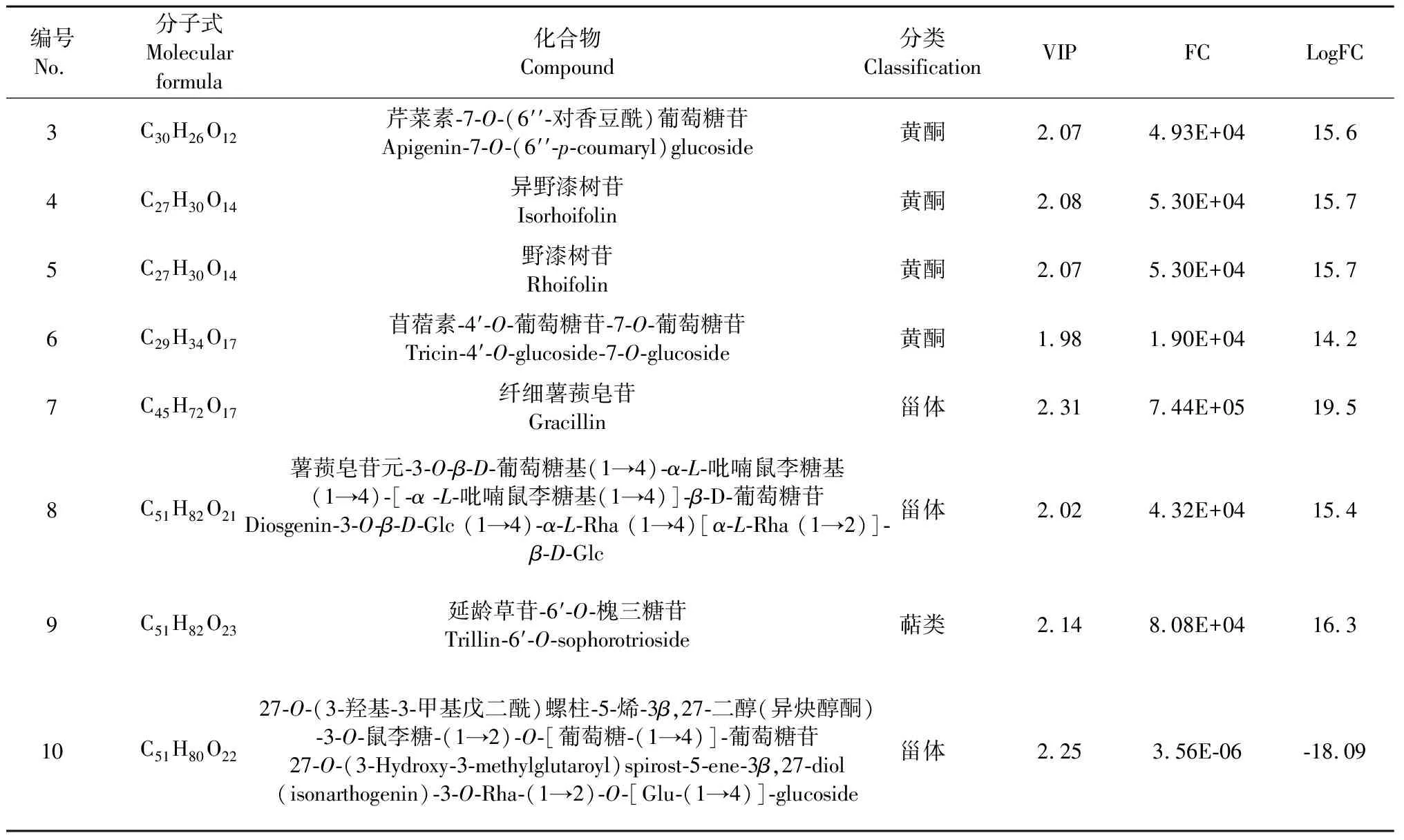
本文结合单变量分析的差异倍数值(fold change)与多变量分析OPLS-DA模型中变量重要性投影(variable importance in project,VIP)数值进行样品之间的差异代谢物筛选。筛选标准为选取fold change≥2或fold change≤0.5和VIP≥1的差异代谢物,即代谢物在组间差异为2倍以上或0.5倍以下以及VIP≥1,则认为差异显著。结果表明,药用黄精与食用黄精共计筛选出106种差异代谢物,从图3B中可以看出,上调化合物85种,下调化合物21种。药用黄精与食用黄精样品之间差异代谢物经过数据库KEGG注释,其分类结果显示(见图4A),差异代谢物主要参与次级代谢生物合成、黄酮类生物合成、黄酮与黄酮醇生物合成、异黄酮生物合成与生物碱生物合成;KEGG富集结果显示(见图4B),差异代谢物富集主要集中于黄酮、异黄酮与黄酮醇代谢途径。为进一步了解药用黄精与食用黄精次生代谢物含量差异变化较大物质,筛选了差异代谢物相对含量变化前十的化合物(见表1)。药用黄精与食用黄精比较相对含量上调的9种,分别为:异鼠李素、薯蓣皂苷元-3-O-葡萄糖苷、芹菜素-7-O-(6′′-对香豆酰)葡萄糖苷、异野漆树苷、野漆树苷、苜蓿素-4′-O-葡萄糖苷-7-O-葡萄糖苷、纤细薯蓣皂苷、薯蓣皂苷元-3-O-β-D-葡萄糖基(1→4)-α-L-吡喃鼠李糖基(1→4)-[-α-L-吡喃鼠李糖基(1→4)]-β-D-葡萄糖苷、延龄草苷-6′-O-槐三糖苷;相对含量下调的化合物1种:27-O-(3-羟基-3-甲基戊二酰)螺柱-5-烯-3β,27-二醇(异炔醇酮)-3-O-鼠李糖-(1→2)-O-[葡萄糖-(1→4)]-葡萄糖苷。

图4 药用黄精与食用黄精差异代谢物KEGG分类图(A)与富集图(B)Fig.4 KEGG classification (A) and KEGG enrichment statistics (B) of medicinal and edible Polygonati Rhizoma

表1 药用黄精与食用黄精差异代谢物相对含量变化前10的化合物
续表1(Continued Tab.1)
2.4 网络药理分析
将药用黄精与食用黄精差异代谢物相对含量变化前十的化合物作用的靶点与IR的疾病靶点用R 3.6.0取交集后获取靶点59个,为药用黄精改善IR的作用靶点,用Venny 2.1做出韦恩图,如图5A所示,黄色代表IR的疾病靶点,蓝色代表化合物的作用靶点,重合部分为化合物靶点与疾病靶点的交集靶点,其中仅5种化合物与IR疾病靶点相重合。从“药物-成分-靶点-疾病”相互作用的网络图(见图5B)可以看出,异鼠李素、野漆树苷、异野漆树苷3种黄酮类化合物通过PI3K、AKT1、VEGFA、mTOR、AMPK等核心靶点作用于PI3K-Akt、mTOR、VEGF、AMPK等信号通路,同时通路中各靶点蛋白相互作用(见图5C~5D)。KEGG富集图(见图5E)结果表明,PI3K-Akt信号通路、mTOR信号通路等信号通路富集明显。分子对接结果表明(见图6),异鼠李素、野漆树苷、异野漆树苷与核心靶点PI3K、AKT1、VEGFA、mTOR、AMPK结合度好,其结合能均≤20.9 kJ/mol。


图5 黄精与治疗疾病的网络药理分析Fig.5 Network pharmacological analysis of Polygonati Rhizoma and therapeutic diseases注:(A)黄精与胰岛素抵抗靶点韦恩图;(B)药物-成分-靶点-疾病相互作用的网络图;(C~D)蛋白相互作用网络;(E)黄精治疗胰岛素抵抗的KEGG富集分析。Note:(A) Venn diagram of Polygonati Rhizoma and insulin resistance targets;(B) Network diagram of drug-component-target-disease interactions;(C-D) Protein-protein interaction network;(E) KEGG enrichment analysis of Polygonati Rhizoma for insulin resistance.
2.5 野漆树苷、异野漆树苷、异鼠李素对HepG2 细胞活性的影响
采用MTT法检测野漆树苷、异野漆树苷、异鼠李素对HepG2细胞活性的影响,结果如图7所示。与对照组相比,HepG2细胞经不同浓度的药物处理24 h后,细胞活性发生明显改变,野漆树苷药物处理组中30、7.5 μg/mL浓度处理组的细胞存活率较高,异野漆树苷药物处理组中25、3.2、1.6 μg/mL浓度处理组的细胞存活率较高,异鼠李素药物处理组中100、50 μg/mL浓度处理组的细胞存活率较高。基于药物对细胞活性的影响、药物浓度的有效性以及药物配制过程中的误差,本实验选择7.5 μg/mL野漆树苷、3.2 μg/mL异野漆树苷和100 μg/mL异鼠李素进行下一步的实验。
2.6 野漆树苷、异野漆树苷、异鼠李素对IR HepG2细胞葡萄糖消耗量的影响
野漆树苷、异野漆树苷、异鼠李素对IR HepG2细胞葡萄糖消耗量的影响的结果如图8所示,与对照组比较,经过胰岛素处理后,模型组细胞培养基中的葡萄糖含量升高,差异有统计学意义(P<0.01),说明模型组细胞葡萄糖消耗量降低,模型组细胞产生了IR作用,IR模型建立成功。与模型组比较,野漆树苷和异野漆树苷组细胞葡萄糖含量升高,且差异不具有统计学意义,说明野漆树苷和异野漆树苷干预后不能改善HepG2细胞IR状态;与模型组比较,异鼠李素组和阳性对照组细胞葡萄糖含量降低,差异有统计学意义(P<0.05),表明异鼠李素组细胞葡萄糖消耗量增加,异鼠李素干预后能改善HepG2细胞IR状态,选择异鼠李素进行下一步的实验。

图6 异鼠李素、野漆树苷、异野漆树苷与核心靶点PI3K、AKT1、VEGFA、mTOR、AMPK分子对接结果Fig.6 Docking results of isorhamnetin,rhoifolin and isorhoifolin with core targets PI3K,AKT1,VEGFA,mTOR and AMPK注:A1~A5分别为异鼠李素与靶点PI3K、AKT1、VEGFA、mTOR、AMPK对接图;B1~B5分别为野漆树苷与靶点PI3K、AKT1、VEGFA、mTOR、AMPK对接图;C1~C5分别为异野漆树苷与靶点PI3K、AKT1、VEGFA、mTOR、AMPK对接图。Note:A1-A5 are docking diagrams of isorhamnetin with target PI3K,AKT1,VEGFA,mTOR and AMPK respectively;B1-B5 are docking diagrams of rhoifolin and target PI3K,AKT1,VEGFA,mTOR and AMPK respectively;C1-C5 are docking diagrams of isorhoifolin and target PI3K,AKT1,VEGFA,mTOR and AMPK respectively.
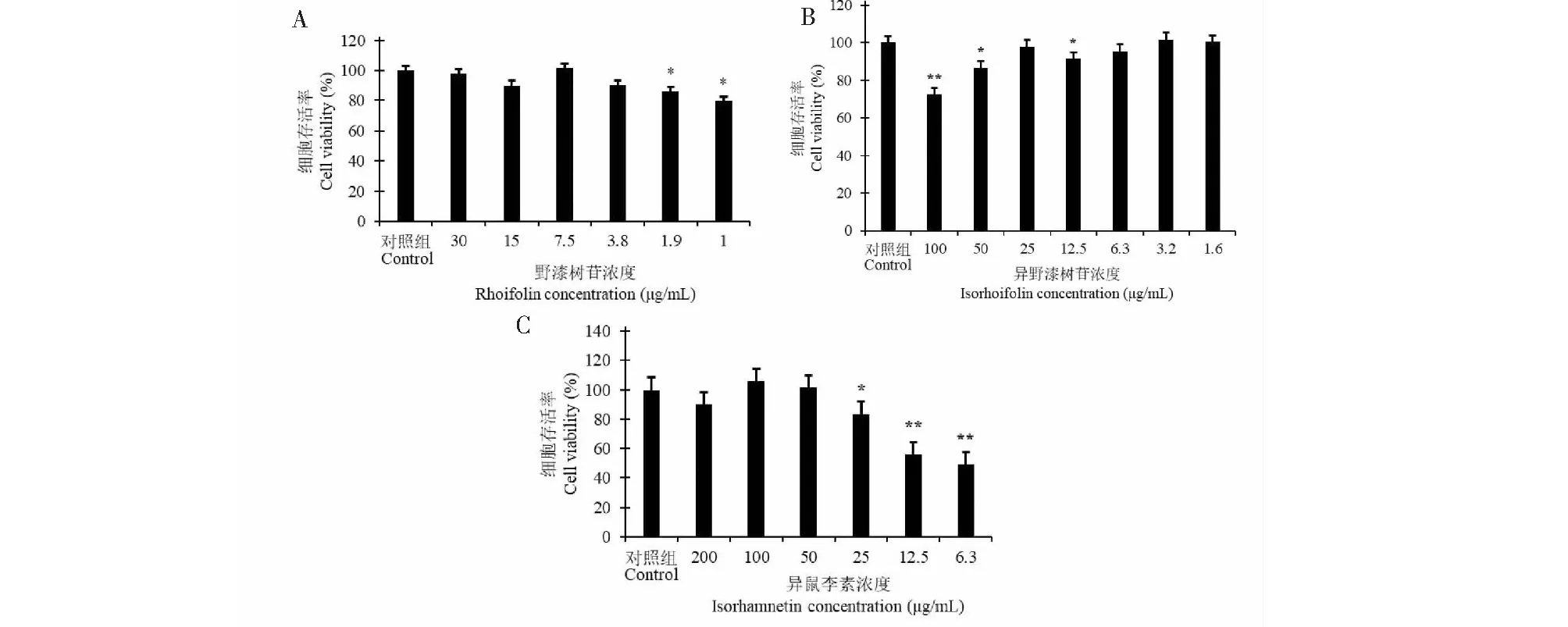
图7 野漆树苷(A)、异野漆树苷(B)、异鼠李素(C)对HepG2 细胞活性的影响Fig.7 Effects of rhoifolin (A),isorhoifolin (B) and isorhamnetin (C) on HepG2 cells 注:与对照组比较,*P<0.05,**P<0.01。Note:Compared with control group,*P < 0.05,**P < 0.01.

图8 野漆树苷、异野漆树苷、异鼠李素对IR HepG2细胞葡萄糖消耗量的影响Fig.8 Effects of rhoifolin,isorhoifolin and isorhamnetin on glucose consumption of IR HepG2 cells 注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。Note:Compared with control group, *P<0.05,**P<0.01;Compared with model group,#P<0.05,##P<0.01.
2.7 异鼠李素对IR HepG2细胞PI3K、AKT1、VEGF、mTOR、AMPK信号通路相关蛋白表达的影响
如图9所示,本实验选取β-actin作为内参蛋白,结果显示内参表达水平趋于一致,表明该实验具有可靠性。与对照组比较,模型组细胞PI3K、AKT1蛋白表达均显著降低(P<0.05),VEGF、mTOR蛋白表达均显著升高(P<0.05),AMPK蛋白表达虽升高,但不具有显著性差异;与模型组比较,异鼠李素药物干预后PI3K、AKT1蛋白表达均显著升高(P<0.05),VEGF和mTOR蛋白表达均显著降低(P<0.05),且均与阳性对照趋势一致。实验结果表明异鼠李素主要通过影响PI3K、AKT1、VEGF和mTOR蛋白表达从而改善HepG2细胞IR状态。

图9 异鼠李素对IR HepG2细胞PI3K、AKT1、VEGF、mTOR、AMPK信号通路相关蛋白表达的影响Fig.9 Effects of isorhamnetin on expression of PI3K,AKT1,VEGF,mTOR and AMPK signaling pathway related proteins in IR HepG2 注:C:对照组;M:模型组;P:阳性对照组;A:异鼠李素组。与对照组比较,*P<0.05;与模型组比较,#P<0.05。Note:C:Control group;M:Model group;P:Positive group;A:Isorhamnetin group.Compared with control group,*P<0.05;Compared with model group,#P<0.05.
3 讨论与结论
本文基于UHPLC-ESI-MS/MS技术的代谢组学方法对药用黄精与食用黄精的次生代谢产物进行分析。结果共鉴定出319种次生代谢产物,包括酚酸类86种,黄酮类96种,蒽醌类5种,木脂素与香豆素25种,鞣质3种,生物碱51种,萜类11种,甾体21种,其他类21种。药用黄精与食用黄精所含次生代谢物差异较大,PCA与HCA均可显著区别。另药用黄精与食用黄精比较组中共筛选出106种差异代谢物,其中上调化合物85种,下调化合物21种,药用黄精在次生代谢产物数量与相对含量方面具有明显优势。为进一步比较药用黄精与食用黄精次生代谢物的变化规律,将差异代谢物经过数据库KEGG注释,由KEGG分类与富集结果表明,药用黄精在黄酮、黄酮醇、异黄酮、生物碱代谢途径发生明显富集,这可能与药用黄精品质形成相关。由文献报道可知[13],植物在生长过程中,由于生长环境或逆境的胁迫会产生种类丰富的次生代谢产物,这些代谢产物往往具有抗旱、抵御病害、虫害等特定的生物功能,同时这些次生代谢物的积累也有利于植物药用部位药效品质的提升。如:黄酮类成分的积累有利于抗氧化、抗炎、抗肿瘤功效的提高[14];生物碱类成分积累则表现出有较高的抗肝癌作用及抑制α-糖苷酶活性的作用[15];甾体皂苷具有多样生物活性的成分,如抗炎,抗肿瘤等[16]。因此,在对这些差异积累的黄酮类、生物碱类以及甾体类化合物的深入分析,有利于筛选出与药用黄精品质相关的质量标志物。
目前《中国药典》2020年版一部黄精项下并未对黄酮、生物碱类等次生代谢产物进行含量限定。本研究对药用黄精与食用黄精差异代谢物相对含量变化前十的化合物进行比较发现,50%的代谢物属于黄酮类化合物,这与差异代谢物KEGG分类与富集结果一致。其中药理活性较高的代谢物,如:异鼠李素具有较好的抗肿瘤、抗心肌缺氧、缺血,缓解心绞痛,抗心律失常,治疗冠心病和高血压,清除氧自由基,降低血清胆固醇,保护心血管,促进血流通畅等多种生物学效应,广泛应用于临床[17,18];纤细薯蓣皂苷在抗肿瘤、抗菌、杀灭寄生虫、溶血、降血脂、抗骨质疏松、抗突变等方面也有一定的生理活性[19,20]。而异鼠李素与纤细薯蓣皂苷仅在来源于黄精PolygonatumsibiricumRed.这一物种表现出明显差异上调。基于此,下一步可以食用黄精(水果黄精)为对照,探究来源于药典收载的滇黄精PolygonatumkingianumColl.et Hemsl.、多花黄精PolygonatumcyrtonemaHua以及地方可药用黄精品种(如:四川南充、重庆秀山、湖南新化等地广泛种植的大叶黄精)干燥块茎为实验组,基于广泛靶向代谢组分析各比较组次生代谢产物的变化规律,进而结合特定类别代谢物的生物活性筛选出中药黄精品质相关代谢物,为正品黄精的品质评价与质量控制提供依据。
为了进一步验证代谢组学筛选出的差异上调化合物的活性,本文结合黄精传统功效健脾以及主治内热消渴证,以IR为疾病模型进行网络药理分析,通过KEGG通路分析的结果可以看出:异鼠李素、野漆树苷、异野漆树苷3种差异上调化合物于PI3K-Akt信号通路、mTOR信号通路、VEGF信号通路、雌激素信号通路、AMPK等信号通路富集显著性程度较高,通过对既往文献进行查阅并分析可以发现:PI3K/AKT信号通路涉及细胞周期、细胞凋亡、细胞增殖和葡萄糖代谢,而胰岛素主要作用于肌肉、肝脏和脂肪组织,它通过与胰岛素受体结合来激活PI3K/AKT信号通路,从而调控葡萄糖和脂肪代谢过程[21];mTOR信号通路通过参与调控骨骼肌葡萄糖摄入量及胰岛素抵抗,通路激活可提高胰岛素敏感性,然而当其过度激活时则会抑制胰岛素的敏感性[22];VEGFA作为VEGF信号通路的重要靶点蛋白,通过提高脂肪和肌肉中胰岛素的敏感性来改善IR,进而控制血糖[23];腺苷酸活化蛋白激酶(AMPK)是调节机体能量代谢的重要物质,研究表明多种天然化合物能激活AMPK,增强胰岛素的敏感性,是改善胰岛素抵抗的潜在靶点[24]。此外,黄精改善IR的作用靶点还可能通过作用于雌激素信号通路等相关通路,调节垂体-肾上腺轴及其他组织器官,直接或者间接起到了改善IR的作用[25]。以上研究结果与文献报道单体成分异鼠李素治疗糖尿病结果一致[26]。另通过分子对接技术进一步揭示黄精对改善IR的功效的作用机制,结果显示PI3K-Akt信号通路、mTOR信号通路、VEGF信号通路、雌激素信号通路、AMPK等信号通路关键靶点与异鼠李素、野漆树苷、异野漆树苷对接效果好,结合能均≤-20.9 kJ/mol。因此推测黄精活性成分与关键靶点的结合可能是黄精发挥治疗IR的关键。通过进一步的细胞实验验证发现差异代谢物中异鼠李素可以有效改善HepG2细胞IR状态,主要通过影响PI3K、AKT1、VEGF和mTOR信号通路相关蛋白的表达,结果表明异鼠李素可以使IR HepG2细胞PI3K、AKT1蛋白表达水平升高,VEGF、mTOR蛋白表达水平降低。
综上所述,本文通过广泛靶向代谢组学技术准确、全面地鉴定了药用与食用黄精中的次生代谢物,药用黄精与食用黄精相比差异上调化合物异鼠李素等通过PI3K、AKT1、VEGFA和mTOR等核心靶点作用于PI3K、AKT1、VEGF和mTOR等信号通路起到了改善IR的目的,充分体现了中药多成分-多靶点-多途径的药效特点。该研究结果为黄精活性成分的筛选与品质评价奠定了基础、为阐述黄精治疗IR作用机制提供了依据。
