不同方法测定花生花粉活力的比较研究
2022-10-10王金花张健琴成良强吕建伟胡廷会饶庆琳
王金花,张健琴,成良强,吕建伟,胡廷会,饶庆琳,姜 敏,王 军
(1.贵州省农业科学院油料研究所,贵阳 550006; 2.安顺学院,贵州 安顺 561000)
花生(ArachishypogaeaL.)是重要的油料作物和经济作物,我国花生产量和单产均位居世界第一位,在保障国家油料供给安全、推进农业结构调整中具有重要作用[1-3]。杂交育种是我国培育花生新品种的主要手段之一[4],但花生杂交授粉成功率相对较低,在授粉之前检验花粉的生活力,掌握不同花生品种的花粉生活力,对于提高杂交育种授粉效率、合理进行杂交育种具有重要意义[5]。近年来,对于其他作物花粉活力检测方法的研究较多,例如,通关藤[6]、思茅松[7]适合用I2-KI染色法,马蹄莲[8]、玉米[9]适合用TTC染色法,细香葱[10]适合用联苯胺染色法,但是关于花生花粉活力测定方法的报道较少。本试验利用TTC染色法、卡宝品红染色法、醋酸洋红染色法、I2-KI染色法、红墨水染色法以及离体萌发法等6种方法对花育23、四粒红、吉花23进行花粉活力测定,通过不同测定方法的比较分析,筛选出适合花生花粉活力快速检测的方法,为花生杂交育种提供参考。
1 试验材料与方法
1.1 试验材料
试验采用吉花23、花育23及四粒红等3个花生品种,试验材料种植于贵州省农业科学院试验基地,2021年6月24日播种,进行常规田间管理,于盛花期,选择晴天07:00—08:00时采集盛开的花蕾,带回实验室取花粉进行试验。
1.2 试验方法
1.2.1TTC染色法
在离心管中滴入1~2滴0.4%的TTC溶液,使花粉散在溶液中,将离心管置于35 ℃恒温箱中放置1.5 h,取出后用移液枪吸取花粉悬浮液于载玻片上,镜检,有活力的花粉呈红色,有微弱活力的花粉呈淡红色,无活力或不育的花粉无色。
1.2.2卡宝品红染色法
滴1~2滴卡宝品红溶液于载玻片上,取少许花粉,搅拌均匀后盖上盖玻片,染色5~10 min,镜检,有活力的花粉被染成紫红色,浅红色的活力次之,未被染色或者无变化的花粉不具有活力。
1.2.3醋酸洋红染色法
滴1~2滴1%的醋酸洋红溶液于载玻片上,取少许花粉,搅拌均匀后盖上盖玻片,染色5~10 min,镜检,具有活力的花粉被染成红色,无活力的花粉不被染色。
1.2.4I2-KI染色法
配制0.5% I2+2% KI溶液,贮于棕色瓶中,滴1~2滴I2-KI溶液于载玻片上,取少许花粉,搅拌均匀后盖上盖玻片,染色5~10 min,镜检,有活力的花粉呈红棕色,无活力的花粉呈黄褐色。
1.2.5红墨水染色法
配制5%的红墨水溶液,滴1~2滴于载玻片上,取少许花粉,搅拌均匀后盖上盖玻片,立刻镜检,有活力的花粉不被染色,无活力的花粉被染成红色。
1.2.6离体萌发法
配制花粉萌发培养基(15%蔗糖+0.5%硼酸+1%琼脂,pH值5.8~6.2),放在4 ℃冰箱保存备用,用镊子将花粉涂抹在预先准备好的培养基上,做好标记后,将培养皿置于28 ℃恒温箱中培养,培养1.5 h后在显微镜下观察花粉萌发的情况,以花粉管长度超过花粉直径作为萌发标准,统计花粉萌发率:
萌发率(%)=(已萌发的花粉粒数/总花粉粒数)×100%。
1.3 数据统计
每个处理制作3个玻片,在OLYMPUS-IX 83倒置显微镜下观察并拍照,每个玻片选取5个视野,统计花粉粒总数量不少于500个,计算花生花粉活力:
花粉活力(%)=(有活力的花粉数量/总花粉数量)×100%。
1.4 数据处理
所得试验数据采用Excel 2016和SPSS 26.0 软件进行处理。
2 试验结果
2.1 TTC染色法
TTC染色法对花生花粉的染色效果见图1 A,TTC染色液处理后,所有的花粉呈黄褐色,未观察到被染成红色的花粉,花粉活力测定结果均为0,说明TTC染色法不易使花生花粉着色,因此,不适合用来测定花生花粉活力。
2.2 卡宝品红染色法
卡宝品红染色法对花生花粉的染色效果见图1 B,所有的花粉都被染色,大部分花粉被染成紫红色,少数畸形花粉被染成浅紫色,花粉活力检测结果均为100%。因此,利用卡宝品红染色法不能辨别出花生花粉是否具有活力,不适合花生花粉活力的测定。
2.3 醋酸洋红染色法
醋酸洋红染色法对花生花粉活力的染色效果见图1 C,几乎所有的花生花粉都被染成红色,少数畸形花粉未被染色。醋酸洋红染色法测得的3个花生品种的花粉活力分别为97.31%、93.80%和97.56%,3个品种的平均值为96.20%,最小值为76.92%,最大值为100.00%(见表1)。该方法测定结果偏高,不适合花生花粉活力的测定。
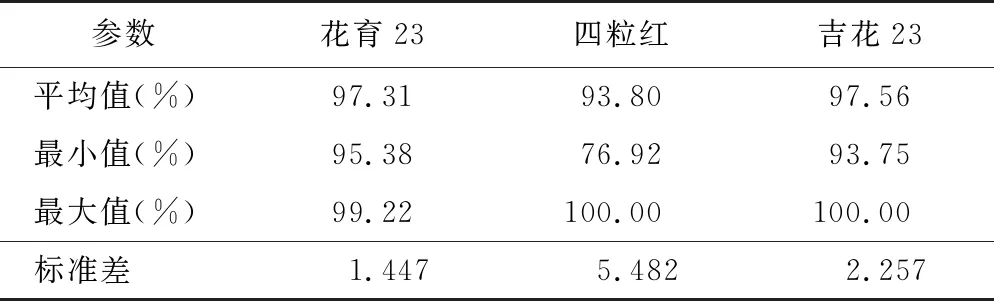
表1 醋酸洋红染色法检测花生花粉活力统计结果Table 1 Statical results of peanut pollen vitality detected by acetic acid magenta solution staining
2.4 I2-KI染色法
I2-KI染色法对花生花粉活力的染色效果见图1 D,有活力的花粉淀粉含量高,被染成红棕色,而无活力的花粉淀粉含量低,不被染色,呈黄褐色。I2-KI染色法测得的3个花生品种的花粉活力分别为84.88%、91.68%和87.99%,平均值为88.19%,最小值为73.91%,最大值为98.89%(见表2)。I2-KI染色法染色速度快,操作简单,有活力的花粉与无活力的花粉差异明显,适合用于测定花生花粉活力。
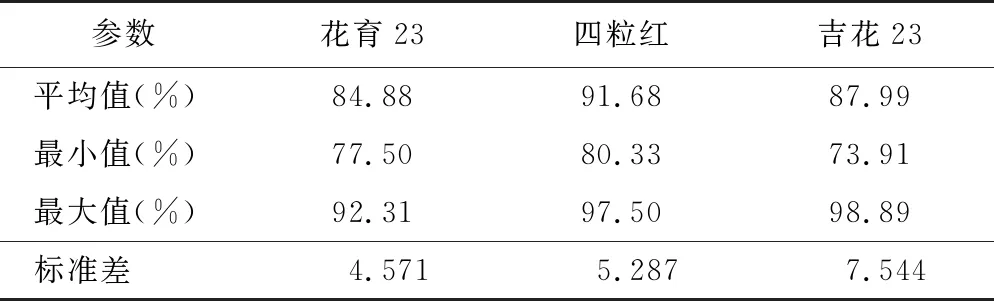
表2 I2-KI染色法检测花生花粉活力统计结果Table 2 Statical results of peanut pollen vitality detected by I2-KI staining
2.5 红墨水染色法
红墨水染色法对花生花粉活力的染色效果见图1E,有活力的花粉其细胞膜具有选择透性,不能被红墨水染色,无活力的花粉具有完全渗透性,被染成红色。红墨水染色法测得的3个花生品种的花粉活力分别为64.29%、63.86%和64.30%,平均值为64.15%,最小值为40.74%,最大值为81.48%(见表3)。红墨水染色法染色速度快,操作简单,有活力的花粉与无活力的花粉差异明显,适合用于测定花生花粉活力。
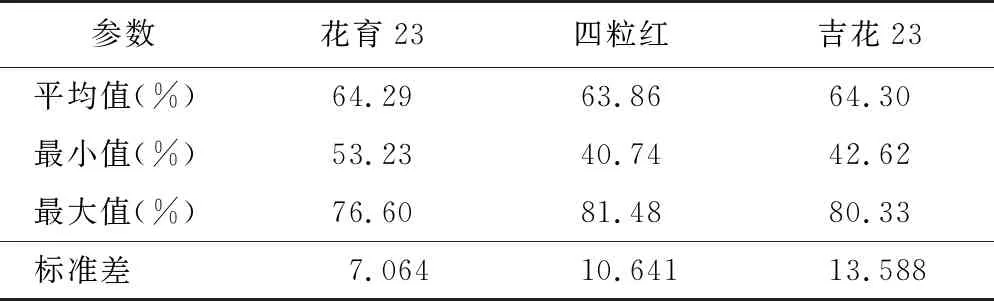
表3 红墨水染色法检测花生花粉活力统计结果Table 3 Statical results of peanut pollen vitality detected by red ink staining
2.6 离体萌发法
花生花粉在萌发培养基上的萌发情况见图1 F,3个花生品种的花粉萌发率分别为60.50%、57.49%和57.90%,平均值为58.47%,最小值40.00%,最大值80.00%(见表4)。离体萌发法能直观地反映花粉萌发情况,测定结果相对准确,但该方法对于培养温度、营养成分、pH值要求较高,花费时间较长。
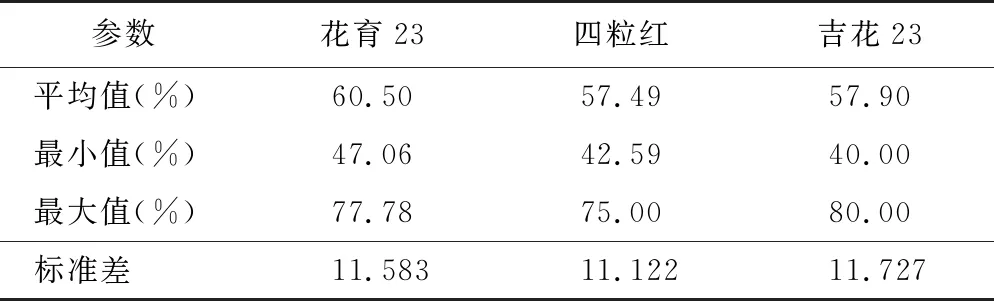
表4 离体萌发法检测花生花粉活力统计结果Table 4 Statical results of peanut pollen vitality detected by in vitro germination method
2.7 不同花粉活力测定方法的比较
TTC染色法不能使花生花粉着色,所测的花粉活力值均为0,因此未进行花粉活力比较分析。由表5可知,不同方法测定的花粉活力值差异较大,其大小关系为:卡宝品红染色法>醋酸洋红染色法>I2-KI染色法>红墨水染色法>离体萌发法;差异显著性分析结果表明,5种方法间存在极显著差异,卡宝品红染色法、醋酸洋红染色法、I2-KI染色法测定结果显著高于红墨水染色法和离体萌发法(p<0.05);在花育23和吉花23中,卡宝品红染色法与醋酸洋红染色法测定结果差异不显著,两者均显著高于I2-KI染色法的测定结果,在四粒红中,卡宝品红染色法测定结果显著高于醋酸洋红染色法和I2-KI染色法,而醋酸洋红染色法和I2-KI染色法测定结果差异不显著;红墨水染色法的测定结果最接近离体萌发法,在花育23和吉花23中,红墨水染色法与离体萌发法的测定结果在p<0.05水平上差异不显著,而在四粒红中,红墨水染色法与离体萌发法的测定结果在p<0.01水平上差异不显著(表5)。
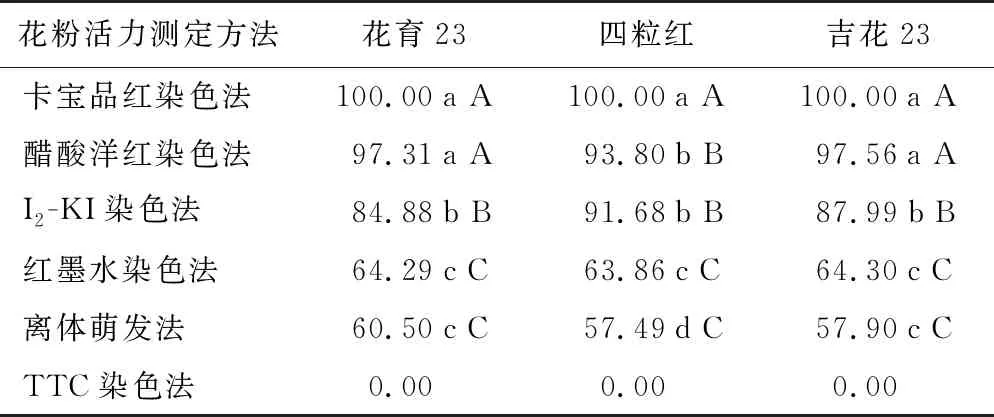
表5 花生花粉活力不同测定方法的结果比较Table 5 Comparison of determination methods of peanut pollen vitality
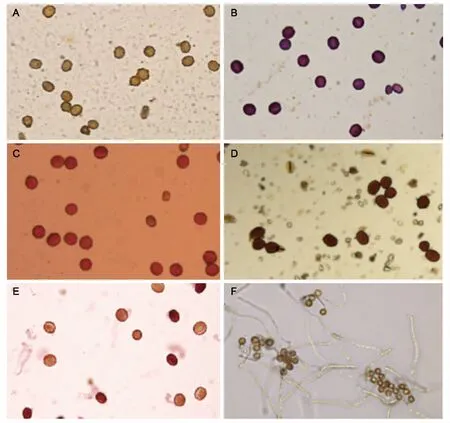
注:A为TTC染色法;B为卡宝品红染色法;C为醋酸洋红染色法;D为I2-KI染色法;E为红墨水染色法;F为离体萌发法。 图1 不同方法检测花生花粉活力镜检结果Fig.1 Microscopic examination results of peanut pollen vitality detected by different methods
3 讨论与结论
离体萌发法可以直接观测到花粉的萌发情况,本试验中,3个花生品种的花粉均能较好地萌发,并且萌发率基本稳定,是花粉活力测定的首选方法,这与在马蹄金[11]、卵叶海桑[12]中的研究结果是一致的,但是该方法操作复杂,花费时间长,不适合花粉活力的快速检测。染色法具有快速简便的优点,能够在一定程度上直接反映花粉的活力,但受花粉特性的影响较大,不同植物适用不同的染色法[13],本研究中,红墨水染色法染色效果好,操作简单,且测定结果最接近离体萌发法,是快速测定花生花粉活力最适合的方法,在王伟伟等[14]的研究中,蓝墨水染色法是快速测定柳树花粉活力最合适的方法。红墨水染色法的测定原理是有活力的花粉其细胞膜具有选择透性,不能被红墨水染色,无活力的花粉具有完全渗透性,被染成红色,但随着染色时间的延长,多数花粉会失去选择透性,这与任飞艳等[12]的研究结果一致,因此在使用该方法时操作要迅速,染色后立即拿到显微镜下观察。
I2-KI染色法是靠淀粉使花粉着色,染色效果除了受淀粉含量的影响外,还受支链淀粉和直链淀粉比例高低的影响[15],直链淀粉与碘的结合物呈蓝色, 支链淀粉与碘的结合物呈紫色[16],多数情况下,I2-KI溶液将有活力的花粉染成蓝色或蓝黑色,例如,通关藤[6]、思茅松[7]、牡丹[17]和芍药[18],少数研究中I2-KI溶液可将有活力的花粉染成红棕色,如滇重楼[19],本研究中,有活力的花生花粉粒着红棕色,说明花生花粉内淀粉主要为支链淀粉,此外,I2-KI染色法对花生花粉染色效果明显,有活力花粉和无活力花粉容易区分,是较好的花生花粉活力测定方法,但测定结果显著高于离体萌发法(p<0.05)。
醋酸洋红溶液和卡宝品红染色法测定结果显著高于其他测定方法。醋酸洋红溶液几乎使所有的花生花粉着色,少数畸形花粉未着色,这与醋酸洋红溶液对柱花草的染色效果相似[20];而卡宝品红染色法使所有的花粉均着色,大部分花粉被染成紫红色,个别花粉被染成浅紫色,而在岳玲等[21]的研究中,卡宝品红染色法是适宜君子兰花粉活力测定的方法,与本试验结果差别较大,具体原因有待进一步研究。
TTC染色法是靠呼吸作用产生的NADH2或NADPH2使花粉着色,在花粉活力测定中具有广泛的应用,例如,钝裂银莲花[22]、毛叶铁线莲[23]、黄牡丹[24]都适合用TTC染色法,而在本试验中,TTC染色法对花生花粉的染色效果不佳,未能观测到被染成红色的花粉粒,有研究表明,TTC染色法也不能使毛棉杜鹃花[25]、锦带[26]、肉果秤锤树[27]、君子兰[21]的花粉着色,可能是因为花粉外壁太厚或者花粉呼吸产生的脱氢酶较少,具体原因还有待进一步研究。
综上所述,离体萌发法是检测花生花粉活力最准确有效的方法,TTC染色法、卡宝品红染色法和醋酸洋红染色法不适合花生花粉活力的测定;I2-KI染色法和红墨水染色法操作简单、染色效果明显,是较好的花生花粉活力快速检测方法,其中,红墨水染色法的测定结果与离体萌发法的测定结果最接近,是最适合用于花生花粉活力快速检测的方法。
