猪GSKIP基因ceRNA调控网络及其蛋白互作分析
2022-10-08代红梅刘志朋曾日彬常勇诚霍金龙
代红梅, 刘志朋, 张 霞, 杨 忠, 曾日彬, 王 配, 常勇诚, 霍金龙
(1.云南农业大学动物科学技术学院,云南 昆明 650201;2.吕梁学院生命科学系,山西 吕梁 033001;3.云南生物制药有限公司,云南 昆明 650503)
GSKIP(GSK3β interaction protein),也称GSK3β结合蛋白,是结合丝氨酸/苏氨酸激酶(PKA)的A激酶锚定蛋白AKAP家族成员[1],在包括心、肝、肾、肺、皮肤、卵巢、子宫、胎盘、前列腺、睾丸、肌肉、骨骼、结肠、直肠等人体组织中广泛表达[2],且在无脊椎动物到脊椎动物中均高度保守[3].GSKIP还是糖原合成酶激酶3β的相互作用蛋白[4],包含蛋白激酶A调节亚基结合(PKA-RII)域和GSK3β相互作用域,能直接与蛋白激酶(PKA)和糖原合成激酶3β(GSK3β)结合以调节PKA和GSK3β的活性[5],其全长蛋白和C端片段均可以不同的方式阻止已引发和未引发底物的磷酸化[4].GSKIP作为GSK3β的负调控因子参与Wnt信号通路[6],通过负调节GSK3β可增强Wnt诱导的信号传导,从而维持β-catenin的稳定性和核积累[7],β-catenin的细胞核积累可激活经典Wnt信号通路[8],该通路是一种高度保守的细胞间信号通路,在细胞周期进程、胚胎发育、稳态的维持、免疫调节和受损组织的再生等不同生物过程中起关键作用[9],与癌症、阿尔茨海默症、2型糖尿病和帕金森等疾病有关[10].GSKIP还通过与GSK3β相互作用促进β-连环蛋白的不稳定磷酸化,以及通过PKA介导的β-连环蛋白的稳定性磷酸化微调Wnt信号通路[7].GSKIP在氧化应激下具有促生存和抗氧化功能[11],可通过抑制GSK3β增强Nrf2活化,从而保护心肌细胞免受缺氧/复氧诱导的细胞凋亡和氧化应激,是心脏保护的分子靶点[12].GSKIP在cAMP/PKA/Drp1信号轴中作为锚定蛋白与GSK3β一起发挥作用,以调节Drp1磷酸化,并与线粒体的伸长和裂变有关[13],此外,GSKIP还参与cAMP/GSKIP/GSK3/PKA/Tau轴信号传导,并在阿尔茨海默症的发展中发挥关键作用,GSKIP产生的磷酸化Tau可作为阿尔茨海默症潜在的生物标志物[14].GSKIP还是家族性骨髓增生性肿瘤的易感基因[15],GSKIP的生殖系重复易于发展为具有常染色体显性遗传的家族性骨髓增殖性肿瘤,GSKIP过表达可增强巨核细胞祖细胞的分化[16-17]、增加SHSY-5Y神经母细胞瘤细胞的β-连环蛋白依赖性增殖[18],GSKIP还被证明与肝细胞癌的肿瘤发生和化学抗性有关[19].在小鼠中,GSKIP的缺失会引起腭架融合的发育缺陷,最终导致小鼠胚胎早期致死[1].
版纳微型猪近交系(banna mini-pig inbred line, BMI)是培育了42年的高度近交系封闭群体,其基因高度纯合、遗传背景清楚,生理生化、解剖和疾病发生机理等与人类极为相似,是生命科学研究的良好试验动物模型[20].基于GSKIP组织表达的广泛性和功能的重要性,本试验以BMI为研究对象,克隆GSKIP编码区序列,分析其分子特征,利用生物信息学对其进行功能分析,注释基因并构建其睾丸ceRNA转录调控网络,进一步构建其PPI蛋白相互作用网络,为深入探究GSKIP基因在BMI睾丸中的功能奠定基础.
1 材料与方法
1.1 试验样品及处理
屠宰3头来自昆明原种猪场的12月龄版纳微型猪近交系公猪并取睾丸组织,经液氮速冻后,利用RNA提取试剂(TaKaRa:9767)获得睾丸组织总RNA,用核酸蛋白测定仪检测RNA的浓度及纯度,用琼脂糖凝胶电泳检测RNA的完整性,合格样品用反转录试剂盒(TaKaRa:6210A)反转录为第一链cDNA并储存于-20 ℃冰箱备用.
1.2 基因扩增及序列测定
利用NCBI数据库猪GSKIP序列(登录号:NM_001243496)设计特异引物(F:TCCGGAGGGAAGAAGAGGAC;R:CCTGCGATGACCATATGCAA),以BMI睾丸cDNA为模板扩增GSKIP基因全长编码区.反应体系25 μL:Premix TaqTM12.5 μL,10 μmol·L-1GSKIP上下游引物各1 μL,25 ng·μL-1cDNA 1 μL,H2O 9.5 μL;扩增程序:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 45 s,72 ℃ 45 s,循环30次;72 ℃ 10 min.扩增产物送昆明擎科生物公司测序.
1.3 GSKIP的功能注释和ceRNA调控网络构建
利用Uniprot进行GO(gene ontology)功能注释;利用课题组之前获得的版纳微型猪近交系睾丸RNA-seq数据进行miRNA和lncRNA分析;使用miRanda 3.3和RNAhybrid 2.1.2软件分析潜在调控GSKIP的miRNA和lncRNA,并用Cytoscape 3.8.2绘制可视化ceRNA调控网络.
1.4 GSKIP功能分析
使用NCBI的ORFfinder查找分析GSKIP的开放阅读框;用ProtParam程序预测GSKIP蛋白质的分子质量、分子式、等电点、正负电荷残基数;使用SOPMA、ProtScale和Prosite分别预测GSKIP蛋白质的二级结构、疏水结构和功能位点;通过TMHMM 2.0和SignalP 5.0工具分别预测GSKIP蛋白的跨膜结构和信号肽;使用MEGA-X软件构建GSKIP蛋白的多物种系统发育树.
1.5 GSKIP相互作用蛋白PPI网络构建
用Weblogo工具对GSKIP多物种结构域区的氨基酸序列进行保守性分析,用String 11.5进行蛋白互作网络分析.
2 结果与分析
2.1 GSKIP基因特征信息
利用GSKIP引物扩增GSKIP基因的完整编码区(CDS)及部分非编码区(UTR),获得543 bp的产物(图1),编码139个氨基酸(图2).GSKIP基因全长20 630 bp,含4个外显子和3个内含子(图3A).开放阅读框(ORF)分析表明,存在6个ORF,其中全长开放阅读框ORF1(即完整CDS区)420 bp为正确的编码ORF(图3B),含有1个保守结构域DUF727(图3C).
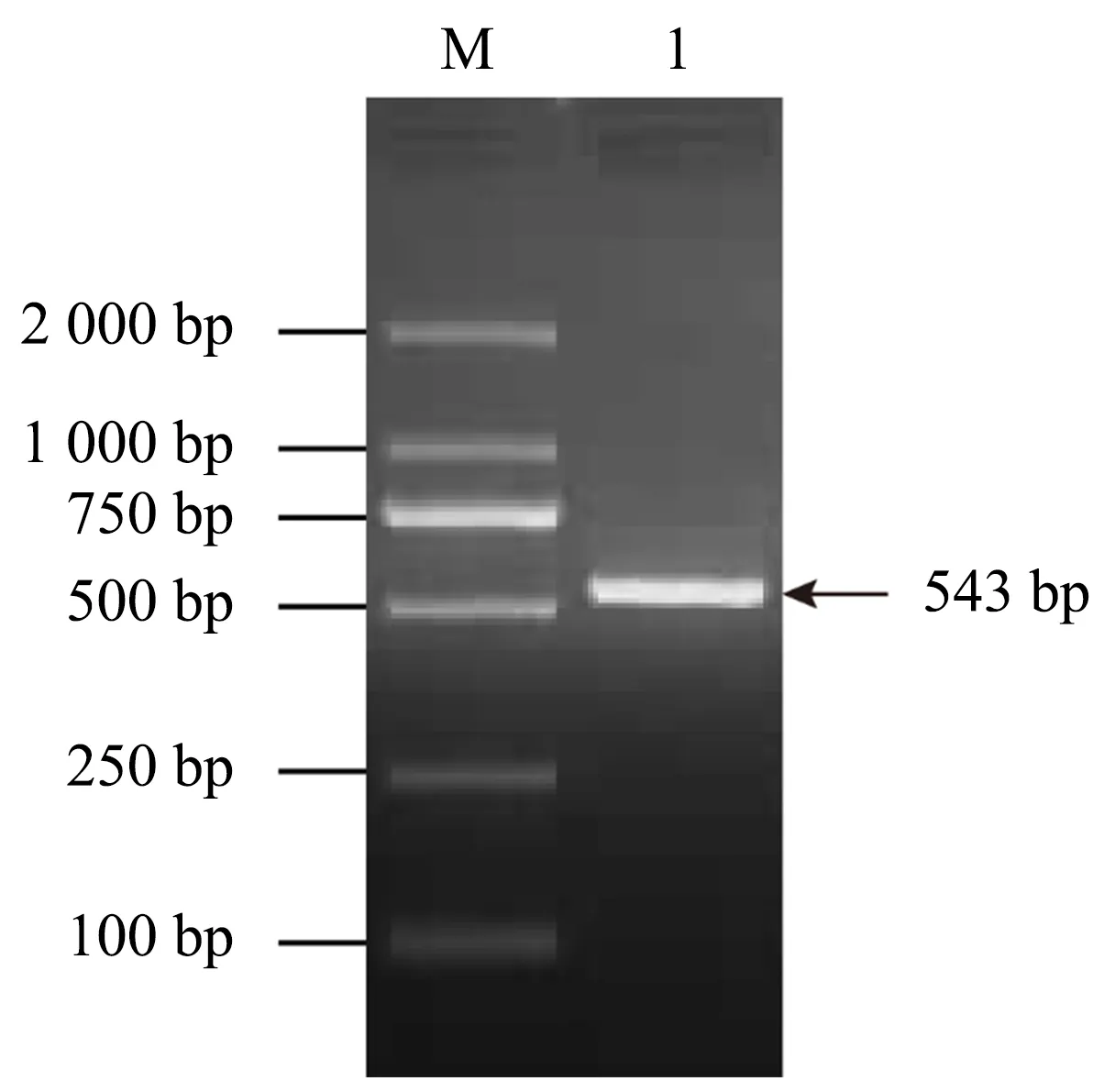
M为DL2000 DNA分子量标准,1为GSKIP PCR产物.

双下划线表示起始密码子,单划线为保守结构域DUF727(33~133位氨基酸),*表示终止密码子;上一行字母为核酸序列,对应的下一行为其编码的氨基酸序列.
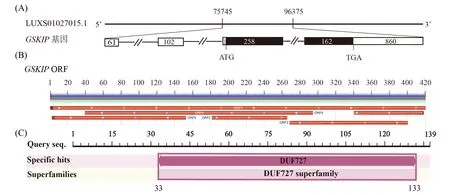
A:染色体位置;B:开放阅读框;C:蛋白质保守结构域.
2.2 猪GSKIP功能注释及ceRNA调控网络
对猪GSKIP进行功能注释发现,在细胞组分(cellular component)方面,主要定位于细胞质、细胞核.在分子功能(molecular function)方面,主要涉及蛋白激酶结合、激酶调节活性、蛋白质结合、β-catenin结合、蛋白激酶抑制剂活性、蛋白激酶A调节亚基结合.在生物学过程(biological process)方面,主要涉及调节Wnt信号通路、响应氧化应激的内在凋亡信号通路、正调控Wnt信号通路、蛋白激酶的负调控(图4).ceRNA网络分析发现:猪GSKIP主要受5个miRNA的靶向调控(图4).并且有7个lncRNAs与GSKIP竞争性结合ssc-miR-181a,3个lncRNAs与GSKIP竞争性结合ssc-miR-181b,5个lncRNAs与GSKIP竞争性结合ssc-miR-181c,6个lncRNAs与GSKIP竞争性结合ssc-miR-335,2个lncRNAs与GSKIP竞争性结合ssc-miR-664-5p(图4).
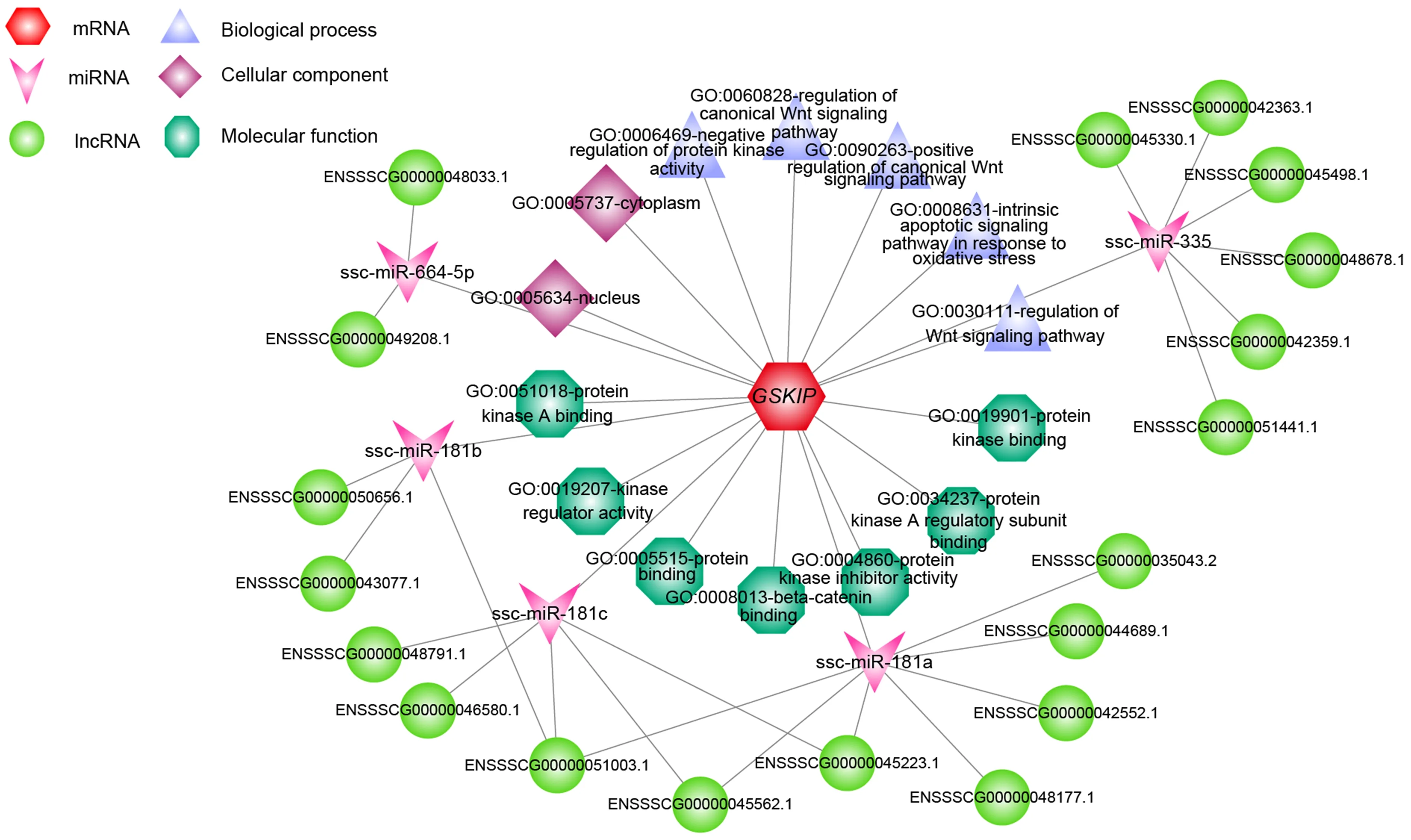
图4 GSKIP的功能注释及潜在的ceRNA调控网络
2.3 GSKIP蛋白质序列及结构分析
猪GSKIP蛋白质分子质量15.59 ku,分子式C672H1042N182O227S9,等电点4.19,负电荷残基为26,正电荷残基为10.GSKIP蛋白质139个氨基酸的二级结构中α螺旋占比最多,包含61个氨基酸;无规则卷曲次之,包含51个氨基酸;延伸链19个氨基酸;β转角最少,有13个氨基酸(图5A).GSKIP蛋白质三级结构分析表明(图5B),第44位氨基酸具有最大疏水值2.022,第71位处具有最小疏水值-2.211,N端和C端均疏水.含有酶磷酸化、亮氨酸富集的核输出信号.不含信号肽和跨膜结构.
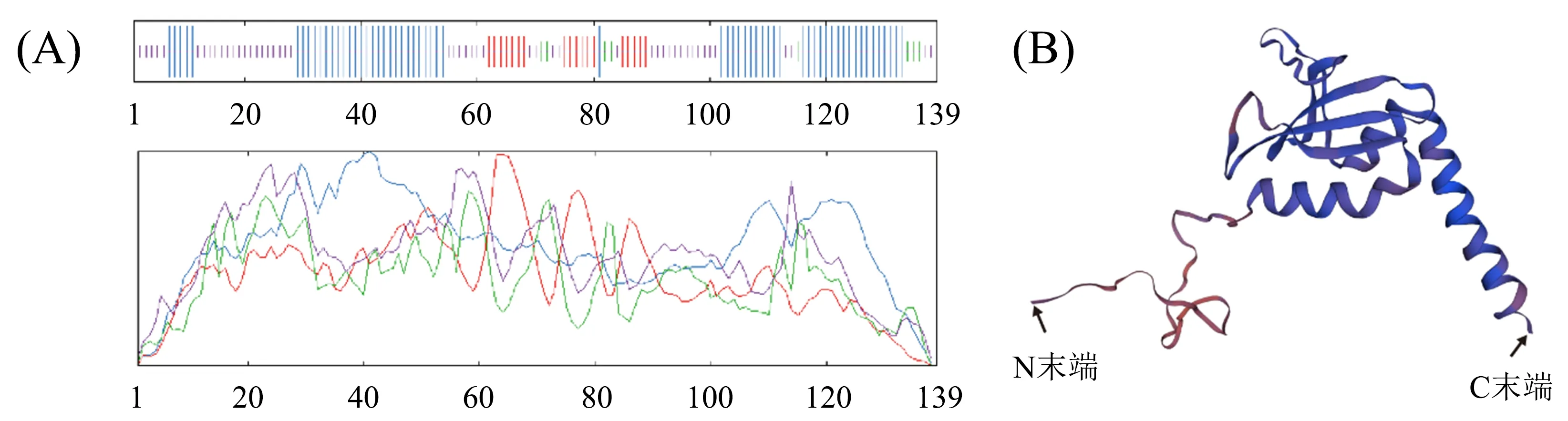
A:二级结构;B:三级结构.
2.4 GSKIP多物种氨基酸序列同源性
8个哺乳动物GSKIP氨基酸序列分析表明,版纳微型猪近交系与绵羊(XP_027813176.1)、牛(NP_001071524.1)、羊驼(XP_006213965.1)、大鼠(XP_00624058)、土拨鼠(KAF7464783.1)、人(BAA91380.1)、恒河猴(NP_001181120.1)的同源性分别为93.8%、93.1%、92.4%、90.3%、89.0%、92.4%、93.1%,同源性均≥89%.猪与绵羊、牛、羊驼聚为一大支,大鼠与土拨鼠聚为一支,人和恒河猴聚为一支,表明猪GSKIP与绵羊、牛、羊驼在进化上关系最近(图6).结构域分析表明,猪GSKIP氨基酸33~133位点处的DUF727结构域在不同物种间的氨基酸差异位点仅24个(图7),说明DUF727结构域在哺乳动物间保守性较高.
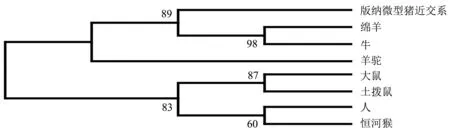
图6 GSKIP氨基酸序列系统进化树

A:氨基酸保守性;B:差异分析.
2.5 GSKIP蛋白互作网络
蛋白互作网络(PPI)分析显示,BMI GSKIP与10个蛋白可能存在相互作用,包括GSK3β、GSK3α、ATG2A、ATG2B、NBR1、ZNF10、ENSSSCG00000002499、EPB41L3、PRUNE、AKAP11,其中与GSK3β作用关系最强(图8).
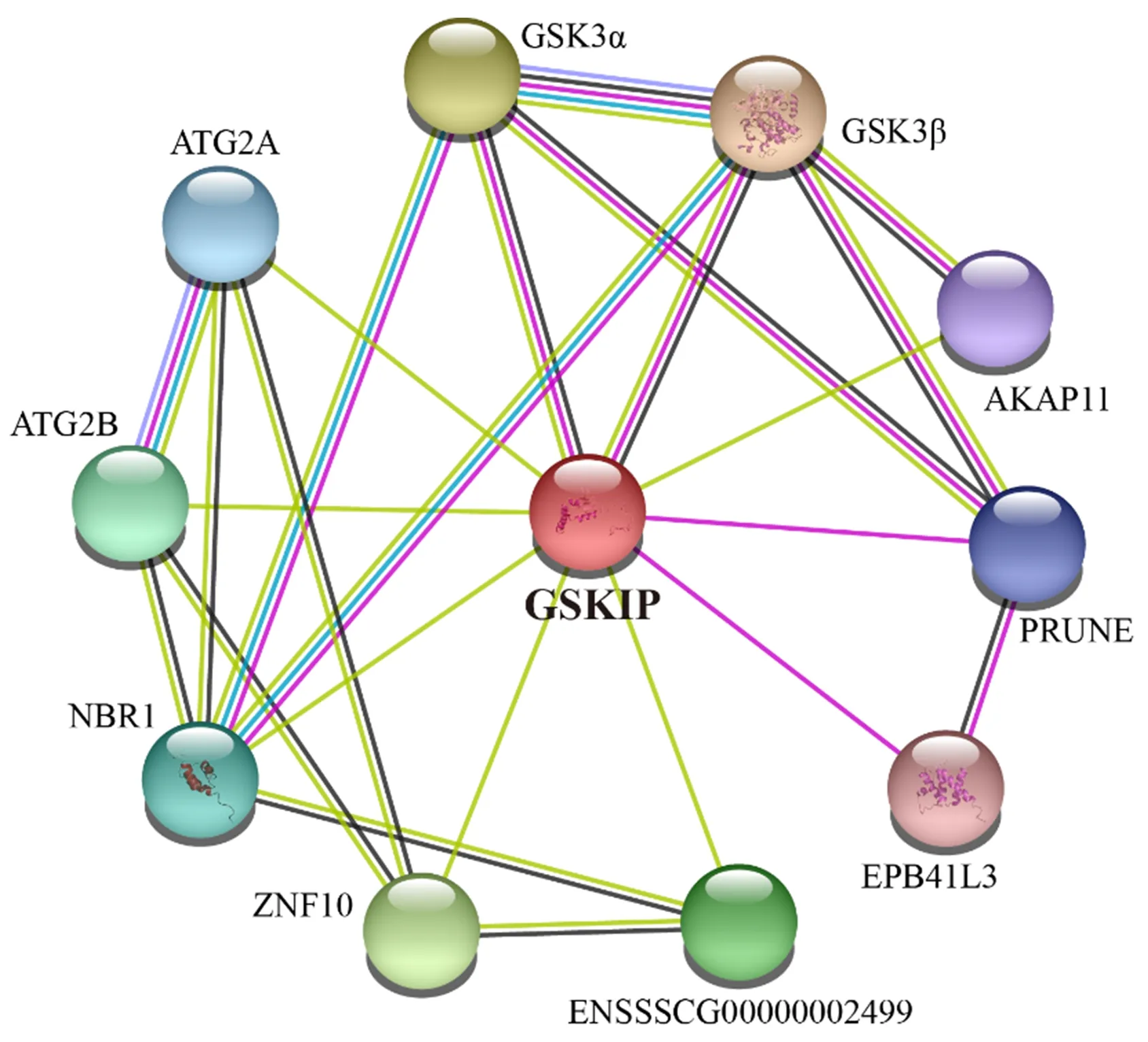
线表示不同蛋白质之间的相互作用,线越多置信度越高.
3 讨论
本试验利用BMI睾丸cDNA扩增获得了GSKIP基因序列543 bp,其中,CDS序列420 bp,编码139个氨基酸,序列提交GenBank获得基因登录号为OL449474.GSKIP含有1个功能域DUF727,是根据不同物种的蛋白质的序列相似性引入,这些蛋白质可能是GSKIP的直系同源物[21],在BMI中对应于GSKIP氨基酸的33~133位.GSKIP在L130保留了1个具有25个氨基酸的区域,与Axin的GSK3β相互作用域(GID)同源,在V41/L45处保留了PKA RII结合位点[22].GSKIP和GSK3β之间通过GID的相互作用在脊椎动物和无脊椎动物中高度保守,而它与PKA RII亚基的相互作用仅限于脊椎动物,这表明它仅在脊椎动物中作为AKAP起作用[5].8种动物GSKIP氨基酸序列系统进化树分析表明,共分为灵长目、啮齿目和偶蹄目三支,其中BMI与绵羊、牛聚在一起,并与羊驼聚为一大类,属于偶蹄目,与物种的系统分一致,并且8种哺乳动物GSKIP氨基酸序列同源性均≥89%,说明GSKIP在进化上具有高度的保守性和序列同源性.
竞争性内源RNA(competing endogenous RNA, ceRNA),可通过竞争共享的microRNAs(miRNAs)调节其他RNA转录本[23].对BMIGSKIP基因功能注释及潜在ceRNA调控网络图分析表明,有5个潜在的miRNAs靶向调控GSKIP,分别是ssc-miR-181a、ssc-miR-181b、ssc-miR-181c、ssc-miR-335和miR-644-5p.其中,ssc-miR-181a、ssc-miR-181b和ssc-miR-181c均来源于mir-181家族,mir-181家族基因通过调节肿瘤相关基因的表达与多种肿瘤的发生相关,miR-181a不仅参与细胞增殖、生长、维持、存活和死亡[24],还是T细胞敏感性和选择的内在调节剂,在T细胞发育过程中充当内在抗原敏感性“变阻器”[25].miR-181b是慢性淋巴细胞白血病进展的生物标志物[26],此外,miR-181b可通过靶向人类癌细胞系中的BCL2调节多药耐药性[27].mir-181c-5p能够通过靶向GSKIP基因抑制宫颈鳞状细胞的癌细胞特征和侵袭特性[28].ssc-miR-335来源于mir-335家族,miR-335调控人间充质干细胞的增殖、迁移和分化[29].miR-664-5p控制肌细胞生成中的SRF和经典的Wnt/β-catenin信号通路[30].miR-644-5p通过靶向细胞p53抑制卵巢颗粒细胞凋亡,提示miR-644-5p有治疗卵巢功能早衰和恢复卵巢功能的潜力[31].
蛋白互作网络分析结果表明,GSKIP与GSK3β、GSK3α、ATG2A、ATG2B、NBR1、ZNF10、ENSSSCG00000002499、EPB41L3、PRUNE、AKAP11等10个蛋白存在相互作用.其中,ENSSSCG00000002499还未注释基因名字;GSK3β与GSK3α是哺乳动物中糖原合成激酶3(GSK3)的2个亚型,它们具有90%以上相同的催化结构域[32].GSKIP被鉴定为GSK3β相互作用蛋白,其与GSK3β相互作用参与了经典的Wnt信号通路,GSKIP作为GSK3β的负调控因子,是GSK3β的良好底物,GSK3β参与了胚胎发育、细胞周期进程、糖原代谢和免疫调节等不同生物过程的调节,GSK3β失调与癌症、阿尔茨海默症(AD)、2型糖尿病、双相情感障碍、心脏肥大炎症和帕金森病等多种疾病相关[33-37].GSK3α的活性受到Wnt信号传导的调节与GSK3β类似[38].GSK3β和GSK3α都在精子中表达,但GSK3α的表达超过GSK3β[39],而在其他组织中都是GSK3β的表达超过GSK3α[40],在精子中GSK3α和GSK3β的丝氨酸磷酸化与其运动性成正比[39].ATG2A和ATG2B是哺乳动物中Atg2的直向同源物,Atg2可引发细胞自噬,是吞噬细胞增殖所必需的,在酵母中其可将隔离膜的边缘链接到内置网,并介导脂质从内质网转移,使隔离膜扩张,在人类中,ATG2A和ATG2B都具有脂质转移活性[41-42],并且ATG2B参与降解前与溶酶体融合的自噬体的形成[17].NBR1对于热诱导的自噬囊泡的形成是必须的[43],并且是调节肿瘤细胞异质性和转移性疾病的关键决定因素[44],其自噬降解可限制乳腺肿瘤进展过程中的转移生长[45].ZNF10可通过β-catenin信号通路促进乳腺浸润性导管癌的癌变和进展[46].ZNF10通过与NF-κB和Sp1结合模体的相互作用抑制HIV-1 LTR活性[47].EPB41L3在维持神经元和神经胶质细胞结合以及髓鞘的节点排列方面发挥作用,EPB41L3可与CD44的C端结合并将信号传输到细胞骨架,它与阿尔茨海默症的生物标志物呈负相关,并且是多种癌症的候选肿瘤抑制基因[48].PRUNE在细胞运动及中枢神经系统的正确发育中起重要作用,其基因突变会引起小头畸形、皮质和小脑萎缩并伴随整体发育迟缓等的复合神经发育障碍[49],此外,PRUNE还是nm23-H1的负调节因子[50].AKAP11蛋白在精子发生和成熟精子中高表达,并有助于生殖细胞和体细胞的细胞周期控制[51],它还能与蛋白激酶A(PKA)的调节亚基结合,将PKA限制在细胞中的离散位置,以靶向特定底物进行磷酸化和去磷酸化,此外,AKAP11的选择性自噬激活cAMP/PKA以促进线粒体代谢和肿瘤细胞生长[52].这些与GSKIP相互作用蛋白的发现,为进一步研究GSKIP的功能提供了依据.
