Al3+对电位滴定仪测定游离酸的干扰及其消除研究
2022-09-29李子尚张志勇彭小燕
李子尚 张志勇 彭小燕 杨 林 陈 述
(长沙矿冶研究院有限责任公司,长沙 410012)
溶液的酸度是选冶、化工与环保工艺过程中一个非常重要的参数,其对溶液稳定性、金属提取、产品性能及设备腐蚀有着重要的影响。准确、快速地测定各类生产及科研中液体物料的游离酸含量对优化工艺流程、促进资源综合利用和节能降耗减排、提升产品质量有着重要的意义[1-4]。酸碱滴定法是溶液中游离酸含量测定的最主要方法,但采用酸碱滴定法测定游离酸含量时,水解性阳离子会发生水解或生成沉淀而消耗碱液,引起测量结果的偏差,比如含Al3+的溶液;另外,有些水解性阳离子本身也存在颜色,使终点无法判断,如含Fe3+、Cu2+的溶液;总之,水解性阳离子水解和阳离子溶液本身存在的颜色,使得游离酸含量的测定存在困难。消除阳离子水解对游离酸含量测定干扰的方法有离子交换法、沉淀分离法、溶剂萃取法和配位掩蔽法[2,5]。与离子交换法、沉淀分离法、溶剂萃取法等方法相比,配位掩蔽法操作更便捷、快速。常用的掩蔽方法有CaCl2-EDTA掩蔽法、草酸钠掩蔽法、氟化氢铵掩蔽法等[1,3]。
电位滴定法通过电位变化来判断终点,无需加入指示剂,因此终点判断不受待测溶液本身颜色的影响;且全自动电位滴定仪配备了高分辨率的配液器,使得标准溶液体积计量的准确度大大提高;滴定过程自动控制,数据由设备程序进行处理,自动读出滴定终点,与手工滴定管滴定过程相比,极大地降低了人为误差,提高了检测速度和检测精度[6-7]。电位滴定法在酸碱滴定方面的应用也越来越普遍,在湿法冶金和化工生产行业均有相关报道[6,8-10]。Al3+是影响游离酸含量测定的主要金属离子之一[1,11],利用电位滴定曲线考察Al3+对游离酸测定的干扰过程及消除方法,有助于理解干扰产生及其消除的机理;利用电位滴定仪滴定并自动识别终点,还可以提高游离酸测定的分析速度和精度。本文通过溶液化学计算分析了Al3+对溶液中游离酸测定的影响机理及NaF溶液掩蔽Al3+的化学反应机理[12-13],建立了NaF溶液掩蔽-电位滴定法测定含Al3+溶液中游离酸含量的方法,并通过精密度实验、加标回收实验和可靠性检验分析验证了该方法的可靠性。
1 实验部分
1.1 主要试剂
Al3+溶液(10 g/L)、稀硫酸溶液(0.31 mol/L)、NaF溶液(25 g/L)。氢氧化钠标准溶液的配制(0.1 mol/L):先将氢氧化钠固体配成饱和溶液,注入塑料桶中密闭静置,使用前用塑料管虹吸上层澄清溶液,然后量取5 mL氢氧化钠饱和溶液,注入盛有不含二氧化碳蒸馏水的烧杯中,稀释至1 000 mL,搅匀,转入试剂瓶中,盖紧橡皮塞,摇匀备用。
氢氧化钠标准溶液的标定:准确称取在110~120 ℃烘至恒重的基准试剂邻苯二甲酸氢钾0.5~0.6 g,置于250 mL烧杯中,加入50 mL不含CO2的蒸馏水溶解,于自动电位滴定仪上用氢氧化钠标准溶液滴定至终点,平行测定3次,同时做空白实验,按照公式(1)计算氢氧化钠标准溶液的浓度。
(1)
式中:m—称取的邻苯二甲酸氢钾的质量,g;V1—氢氧化钠标准溶液的消耗量,mL;V0—空白试验氢氧化钠标准溶液的消耗量,mL;204.22—邻苯二甲酸氢钾的摩尔质量,g/mol;C1—氢氧化钠标准溶液的浓度,mol/L。甲基红指示剂(0.10%,无水乙醇溶液)。
1.2 设备
Metrohm916型电位滴定仪(瑞士万通仪器有限公司),pH复合电极6.0262.100(瑞士万通仪器有限公司)
1.3 实验方法
准确移取V2含Al3+待测溶液于250 mL烧杯中,加入5 mL NaF溶液(具体加入量可根据Al3+的含量而定),加入适量的二次水,插入pH复合电极,设置滴定速度为最优,搅拌速度为6 r/s,在自动电位滴定仪上,用氢氧化钠标准溶液进行滴定,终点EP所消耗的氢氧化钠标准溶液的体积由电位滴定仪的自带程序读出V3,按照式(2)计算游离酸的含量。
(2)
式中:C2—游离酸的浓度,mol/L;C1—氢氧化钠标准溶液的浓度,mol/L;V2—移取待测溶液的体积,mL;V3—氢氧化钠标准溶液的消耗量,mL。
2 结果与讨论
2.1 Al3+水解对游离酸测定的影响
测定含Al3+溶液的游离酸含量时,随着NaOH标准溶液的加入,Al3+发生水解,产生沉淀使滴定终点无法识别。因而分析Al3+在溶液中不同pH值下的水解反应平衡,对于研究Al3+对游离酸测定的影响机理及探索干扰消除方法非常重要。
Al3+与水溶液中的OH-发生一系列络合反应,各级水解反应的逐级反应式和逐级平衡常数K1、K2、K3、K4分别为[12]式(3)~(6):

(3)

(4)

(5)

(6)
由此可计算得到Al3+各级水解反应相应的累积平衡常数分别为β1、β2、β3、β4,其值分别为10-4.99、10-9.30、10-15.00、10-23.0,从而得到不同pH值下Al(Ш)的组分分布图,见图1。

图1 Al(Ш)在不同pH值下的组分分布图Figure 1 Composition distribution of Al(Ⅲ) at different pH values.
由图1可知,Al3+在pH=4.5左右时即开始明显水解,随着pH值的升高,Al3+水解愈严重,且在pH=5.0左右即有Al(OH)3沉淀产生,Al3+水解产生H+,影响溶液中游离酸含量的测定。
2.2 NaF溶液对Al3+的掩蔽
为了验证NaF溶液掩蔽Al3+的可行性,计算了Al3+在NaF溶液中不同pH值下的组分分布系数,绘制了Al3+在NaF溶液中不同pH值下的组分分布图,如图2所示。由图2可知,溶液pH值在3.0~7.0时,Al3+主要以AlF4-和AlF3络合物形式存在,表明在整个滴定过程中,NaF溶液与Al3+发生以下络合反应,有效避免Al3+的水解,从而消除Al3+的水解对游离酸测定的干扰。


2.3 电位滴定仪滴定参数的选择
2.3.1 滴定条件的选择
Metrohm 916型电位滴定仪滴定速度有三个选项:慢、最优、快。设置搅拌速度为6 r/s,对三个滴定速度选项,用已知含量的稀硫酸溶液进行精密度实验(表1)。

表1 滴定速度对测定的影响Table 1 Influence of titration speed on determination
由表1可知对滴定速度慢、最优和快三个选项进行精密度实验,相对标准偏差分别为1.61%、1.59%和3.33%,结果表明滴定速度为慢或最优时相对标准偏差均较小,但滴定速度为慢时耗时较长;滴定速度为快时耗时最短,但其相对标准偏差也最大,综合考虑,选择滴定速度为最优。
2.3.2 搅拌速度的选择
在电位滴定仪上设置滴定速度为最优,用已知含量的稀硫酸溶液对搅拌速度进行条件实验(表2)。

表2 搅拌速度对测定的影响Table 2 Influence of stirring speed on determination
由表2可知,测定结果都和参考值相差不大,为了在确保游离酸浓度被准确测出的前提下尽量缩短分析时间,选择搅拌速度为6 r/s。
2.4 Al3+干扰的消除
NaF在溶液中电离出F-,络合溶液中的Al3+,防止Al3+在酸碱滴定过程中水解,从而消除Al3+对游离酸测定的干扰。
2.4.1 NaF溶液掩蔽Al3+的用量实验
为了考察掩蔽Al3+所需NaF溶液的用量,优化NaF溶液掩蔽-电位滴定法测定游离酸含量的实验条件,抽取6份1 mL Al3+溶液及1 mL稀硫酸溶液于250 mL烧杯中,各加入0、1、3、5、7、9 mL NaF溶液,加水至100 mL,其余步骤按照实验方法进行,结果如表3所示。

表3 NaF溶液用量实验Table 3 NaF solution dosage experiment
由表3可知NaF溶液可以掩蔽Al3+,当加入5 mL NaF溶液时可将10 mg的Al3+掩蔽,终点易于观察。10 mg的Al3+的物质的量为0.37 mmol,5 mL NaF溶液中F-的物质的量为2.98 mmol,Al3+与F-的络合比为1∶3或1∶4,5 mL NaF溶液足够络合10 mg Al3+。故实验选择NaF溶液的加入量为5 mL。
2.4.2 NaF溶液加入前后电位滴定曲线对比分析
抽取3份1 mL稀硫酸溶液于250 mL烧杯中分别记为1#、2#、3#,2#加入1 mL Al3+,3#加入1 mL Al3+和5 mL NaF溶液,加水至100 mL,其余步骤按照实验方法进行,1#、2#、3#的滴定曲线分别如图3~5所示。
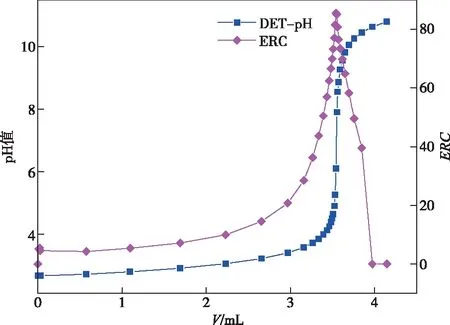
图3 1#稀硫酸溶液中游离酸含量测定的滴定曲线Figure 3 Titration curve for determination of free acid in 1# dilute sulfuric acid.
图3为1#稀硫酸溶液中游离酸含量测定的滴定曲线,其滴定终点为pH=6.833,V=3.54 mL;图4为2#没有加入NaF溶液时含Al3+水样中游离酸含量测定的滴定曲线,出现了三个滴定终点,且有白色沉淀产生,表明Al3+发生了水解反应,终点失真。图5为3#加入NaF溶液后含Al3+水样中游离酸含量测定的滴定曲线,由图5可知此曲线光滑尖锐,出现了唯一的非常明显的突跃,其滴定终点为pH=6.933,V=3.58 mL,测定结果与加入的游离酸的量一致,说明加入的NaF溶液完全消除了Al3+水解对游离酸含量测定的干扰。

图4 2#含Al3+水样中游离酸含量测定的滴定曲线Figure 4 Titration curve for determination of free acid in 2# water sample containing Al3+.

图5 3#加入NaF溶液的含Al3+水样中游离酸含量测定的滴定曲线Figure 5 Titration curve for determination of free acid in 3#water sample containing Al3+ when NaF solution was added.
2.5 方法的可靠性分析
2.5.1 方法精密度实验
抽取4#、5#、6#含Al3+的水样1 mL各7份,按照实验方法进行精密度实验,实验结果如表4所示。

表4 电位滴定仪滴定含Al3+溶液中游离酸含量的精密度实验Table 4 Precision test of titration of free acid content in solution containing Al3+ by potentiometric titrator(n=7)
由表4可知,三个样品各7组结果的RSD分别为1.50%、0.76%和0.60%,精密度满足生产分析要求。
2.5.2 加标回收实验
对4#、5#、6#三个含Al3+的水样进行加标回收实验,抽取4#、5#、6#水样1 mL各2份,其中4#加入2 mL、5#和6#各加入3 mL含量为0.31 mol/L的稀硫酸溶液,其余步骤按照实验方法进行,计算其回收率,实验结果见表5。

表5 电位滴定仪滴定含Al3+水样中游离酸的回收率实验Table 5 Recovery test of free acid in water sample containing Al3+ titrated by potentiometric titrator
由表5可知,方法的加标回收率都在98.9%~102%,说明电位滴定法测定含Al3+溶液中游离酸含量的准确度较高,能满足一般科研和生产分析要求。
2.5.3 方法比对实验
取10组Al3+含量在5~20 g/L水样各2份,分别用电位滴定仪和手动滴定法测定游离酸的含量,实验结果见表6。
由表6可知,电位滴定法和手动滴定法的平均偏差为0.001 0 mol/L,在95%置信度、自由度f=n-1=9时采用t检验,t=0.25 表6 电位滴定仪与手动法比对实验Table 6 Comparison test between potentiometric titrator and manual method(n=10) /(mol·L-1) Al3+在酸碱滴定过程中易水解,从而对溶液中游离酸含量的测定产生干扰。测定含Al3+溶液中游离酸含量时,加入NaF溶液可有效掩蔽待测溶液中的Al3+,从而避免Al3+水解干扰游离酸的测定,并通过溶液化学分析论证了NaF溶液掩蔽Al3+的可行性;NaF溶液的加入量可根据Al3+的含量而定,略有剩余即可,根据实际生产需求,实验选择加入5 mL NaF溶液(25 g/L)。通过精密度、加标回收实验和可靠性检验,表明本方法具有结果稳定、准确度高的优点,能广泛适用于各类含Al3+溶液中游离酸含量的测定。
3 结论
