持续冷暴露通过循环miRNA影响小鼠血脂代谢的实验研究
2022-09-29姬寒蕊吴圣贤
姬寒蕊,吴圣贤
高脂血症是指由于脂肪代谢或运转异常而使血液中脂质水平异常的一种疾病。近年来,随着膳食结构的改变和社会老龄化的加速,高脂血症已成为动脉粥样硬化、缺血性脑卒中、急性心肌梗死等疾病的主要危险因素,可直接或间接地导致以上疾病发生或加重,提高其致残率及死亡率,积极探究血脂代谢紊乱的调控机制十分必要。近年来,发现了一类天然存在的非编码RNA,称为microRNA(miRNA),miRNA为脂质代谢的关键调节因子[1-2],在调节血脂代谢和动脉粥样硬化发展进程中具有关键作用,探究miRNA表达与血脂代谢的关系,对于防治高脂血症具有重要意义。
1 材料与方法
1.1 动物模型的建立 实验选用C57BL/6J雄性小鼠建立高脂饮食诱导的高脂血症模型,将90只小鼠随机分为两组,即4 ℃冷暴露组和30 ℃等热区对照组,每组45只。4 ℃冷暴露组常温下饲养4周后转入18 ℃环境饲养箱内适应性饲养1周后,转入4 ℃环境饲养箱内饲养4周;30 ℃等热区对照组结束常温饲养4周后直接转入30 ℃环境饲养箱内饲养5周。高脂饮食配方为15%脂肪、0.25%胆固醇,12 h/12 h光/暗循环。
本实验中所有动物饲养条件以及动物实验操作均严格遵守医院重点学科实验室动物实验伦理委员会制定的相关规定。
1.2 血脂水平检测 取200~300 μL小鼠血清,应用全自动生化分析仪检测血脂四项,即总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)。
1.3 病理学检测 取出固定于4%多聚甲醛中的脂肪组织,清洗切块后放置于石蜡组织包埋盒中,盒外标记信息。包埋盒置于自动脱水石蜡组织制备仪中脱水、过夜,切片机切片,40 ℃温水台中使切片舒展开,将水控干后烤片,常温干燥环境中保存以备用。取小鼠脂肪组织的石蜡包埋切片,进行常规免疫组织化学染色和苏木精-伊红(HE)染色,免疫组化一抗使用兔抗线粒体解偶联蛋白1(UCP1)抗体(货号AB-10983),购自Abcam公司,二抗为兔二步法检测试剂盒(货号PV-9001),购自北京中杉金桥生物技术有限公司。中性树胶封片后,光学显微镜下观察并摄片。观察小鼠肩胛区、腹股沟区、附睾区脂肪组织HE染色情况,比较各部位脂肪组织细胞面积大小、数目、小房室形成情况;并分析各部位脂肪组织棕色化标志物UCP1免疫组化阳性染色面积。
1.4 二代测序及初步分析 使用Trizol法进行血清外泌体RNA提取和纯化,Agilent2100检测各样本RNA浓度。采用BGISEQ-500测序技术,对富集到的18-30nt small RMA片段进行测序。对测序得到的目标序列进行分类注释,将数据与第22版的miRBase数据库进行比对,挑选出比对上的miRNA的成熟体和前体信息;同时miRNA的前体能够形成发夹二级结构,使用miRDeep2软件进行新的miRNA预测。使用TPM对每个样品的表达量进行标准化后对组间样本进行miRNA差异表达分析,找到表达上调和下调的miRNA。通过R语言对miRNA的表达量进行差异性分析。使用miRanda和TargetScan靶基因预测软件对鉴定得到的差异表达miRNA进行靶基因预测,借助GeneOntology 数据库和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)进行基因本体(GO)功能显著性富集分析和信号通路显著性富集分析。测序过程由武汉华大基因研究所完成。

2 结 果
2.1 两组体重、血脂水平比较 与30 ℃等热区对照组相比,4周4 ℃持续冷暴露可使小鼠体重减轻约12.85%(P<0.001),TC水平降低16.10%,LDL-C水平降低约23.41%,TG水平降低约26.51%,差异均有统计学意义(P<0.05)。详见表1。
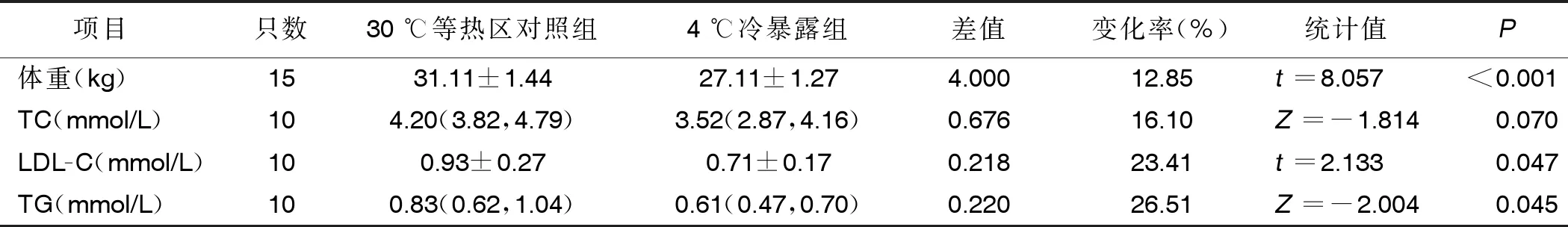
表1 两组体重、血脂水平比较
2.2 免疫组化和HE染色结果 对小鼠肩胛区棕色脂肪组织进行HE染色,结果显示,4 ℃冷暴露组与30 ℃等热区对照组相比,脂肪细胞体积明显缩小,体型苗条,显微镜下可以看到细胞核染色较深,呈现出棕色化表现。此外,腹股沟脂肪组织HE染色发现,在30 ℃等热区对照组小鼠的脂肪组织中,染色较浅,为细胞圆润的单房脂滴;而4 ℃冷暴露组脂肪组织染色较深,为相对瘦小的多房脂滴。两组附睾区脂肪组织HE染色无明显区别。UCP1免疫组织化学染色提示,与30 ℃等热区对照组相比,4 ℃冷暴露组UCP1可见明显阳性表达。详见图1~图6。

图2 两组腹股沟区脂肪组织HE染色图

图5 两组腹股沟区脂肪组织UCP1免疫组化图

图6 两组附睾区脂肪组织UCP1免疫组化图
2.3 两组小鼠miRNA表达谱分析 对两组样本进行miRNA差异表达分析,找到上调和下调的miRNA。结果显示,4 ℃持续冷暴露组与30 ℃等热区对照组间miRNA表达谱对比,筛选出组间显著差异表达miRNA 共451条,其中140条miRNA表达显著上调,311条miRNA表达显著下调。显著差异表达的前10位未知及已知的miRNA见表2及表3。

表2 两组显著差异表达的未知miRNA(前10位)

表3 两组显著差异表达的已知miRNA(前10位)
2.4 靶基因预测和GO功能注释 结合靶基因预测结果与查阅文献发现,显著差异表达的前20位miRNA中,预测到的novel_mir114、novel_mir389、novel_mir431可靶向作用于低密度脂蛋白受体(LDLR)基因(NM_010700)。此外,查阅既往研究发现,mmu-miR-344b-3p、mmu-miR-23b-5p、mmu-miR-149-5p、mmu-miR-130b-5p等与脂肪细胞形成、分化以及肝脏脂质代谢等密切相关,可作用于调控血脂代谢的相关基因。同时4 ℃冷暴露组和30 ℃等热区对照组miRNA差异表达分析发现,这4条miRNA表达水平均显著下调。
GO显著性富集分析结果见图7,分别以不同颜色标注。同时分析结果显示,4 ℃冷暴露组与30 ℃等热区对照组相比,差异表达miRNA靶基因涉及的生物学过程主要为生物调节(biological regulation)、细胞过程(cellular process)、代谢过程(metabolic process)、单生物过程(single-organism perocess)。详见表4。

图7 GO显著性富集分析结果(红色为基因的分子功能;绿色为细胞成分;蓝色为参与的生物学过程)

表4 两组差异表达miRNA GO生物学过程(前10位)
2.5 KEGG信号通路分析 通过KEGG显著性富集能确定差异表达小RNA的靶基因参与的最主要生化代谢途径和信号转导途径。分析显示,主要富集的生化代谢途径和信号转导途径包括细胞进程(cellular processes)、环境信息处理(environmental information processing)、遗传信息处理(genetic information processing)、人类疾病(human diseases)、新陈代谢(metabolism)、有机体系统(organismal systems)等。RichFactor系差异小RNA的靶基因中位于该信号通路条目的基因数目与所有有注释基因中位于该信号通路条目的基因总数的比值,富集的程度越大,则RichFactor越大。Q值是经过多重假设检验校正之后的P值,取值范围为0~1,越接近于零,代表富集越显著。详见表5、图8。

表5 两组差异表达miRNA信号通路条目(前20位)

图8 信号通路富集统计散点图(排名前20位)
3 讨 论
随着膳食习惯的改变及社会老龄化的速度加快,我国成人血脂异常患病率大幅上升,城镇居民肥胖、高脂血症、动脉粥样硬化、脑卒中等代谢性疾病的发生率亦不断增加。根据《中国心血管报告2018》[3]报告中描述,目前我国心脑血管疾病的现患人数已达到2.9亿人,其中脑卒中为1 300万人,冠心病1 100万人。心脑血管疾病已成为导致人类死亡的首位原因[4-5]。关于血脂代谢的内在机制及临床治疗,仍有众多问题亟待解决。大量流行病学研究显示,在全世界范围内,冬季心血管事件显著高发[6-7],脑卒中和心肌梗死与环境气温下降具有明显的相关性[8-9],然而寒冷导致心血管事件增加的原因,一直没有得到满意的解答。miRNAs作为一种基因表达的调控因子,在肥胖、糖尿病、动脉粥样硬化和高尿酸血症等代谢疾病的发生、发展中起重要作用,在高脂血症中的作用更为明显。已有众多研究提示,miRNA在转录后参与调控极低密度脂蛋白的分泌、胆固醇的内源性合成、胆固醇逆向转运(reverse cholesterol transport,RCT)以及肝脏LDLR的表达等过程。外泌体是一种特殊的细胞间信号传输载体[10-11],脂肪细胞为其主要来源,并可作用于包括肝脏在内的多种靶器官[12]。
本研究发现,4周4 ℃持续冷暴露可使小鼠体重明显减轻,TC、TG、LDL-C水平下降;病理学研究显示,小鼠皮下棕色脂肪活化、白色脂肪棕色化增加,且免疫组化显示UCP1增量表达,表明寒冷暴露后皮下脂肪动员,进而UCP1依赖性脂解。此外,课题组前期研究显示,肝脏受到冷刺激后LDLR增量表达,从而导致血脂水平下降。为了进一步探究其内在机制,本研究对小鼠血清外泌体中的miRNAs进行了二代测序。
表达谱初步分析发现,与30 ℃等热区对照组相比,mmu-miR-344b-3p、mmu-miR-23b-5p、mmu-miR-149-5p、mmu-miR-130b-5p等在4 ℃持续冷暴露组小鼠血清中显著下调,其中mmu-miR-344b-3p变化最显著,而miR-130b-5p研究最为充分,且与脂质代谢相关,不过多数研究认为过氧化物酶体增殖剂激活受体家族(PPAR)可能为其调控脂质代谢的潜在靶标[13-16]。靶基因预测结果显示,mmu-miR-149-5p可预测LDLR、 极低密度脂蛋白受体(VLDLR)、前蛋白转化酶枯草溶菌素9(PCSK9)、环磷酸腺苷反应元件结合蛋白(CREB)的转录激活因子2(CRTC2)、胰岛素受体(INSR)等多种脂质代谢相关基因。Zhao等[17]通过高脂饮食诱导建立胰岛素抵抗小鼠模型,采用二代高通量测序筛选差异表达miRNA并进行实时定量聚合酶链式反应(PCR)验证,结果显示,与正常小鼠相比,肝脏中miR-122-5p、miR-149-5p等显著差异表达,miR-149-5p靶基因预测显示可预测到CRTC2、INSR、信号传导及转录激活因子3(Stat3)等与代谢稳态相关的基因。
肝LDLR是肝脏胆固醇清除的主要途径,其表达受到严格而精细的调节。本研究发现,新预测到的未知miRNA包括novel_mir349、novel_mir114和novel_mir287等表达显著上调,novel_mir116、novel_mir431、novel_mir416、novel_mir389等显著下调。靶基因预测初步发现novel_mir114、novel_mir389、novel_mir431等可直接靶向作用于LDLR基因。未知miRNA参与亦可能是持续冷暴露下的血脂代谢的调控机制之一。
综上所述,4 ℃持续冷暴露小鼠血清外泌体中差异表达的miRNA可能与血脂代谢的调控机制有关。血清中的miRNA可能来源于冷暴露后活化的皮下脂肪组织,并以外泌体为载体到达肝脏,进而参与肝脏中的LDLR胆固醇清除途径。但目前尚无明显证据表明其来源及具体作用靶点,后续可通过实时定量聚合酶链式反应、细胞实验、荧光素酶报告基因检测等技术手段开展深层次探究。
