公用设施计算机化系统验证研究与应用
2022-09-27钱贵珍
芮 丽 ,王 哲,王 剑,钱贵珍
(1.兰州生物制品研究所有限责任公司,甘肃 兰州 730046;2.兰州兰生血液制品有限公司,甘肃 兰州 730046)
随着电子技术快速发展,公用设施计算机化系统广泛应用于制药企业的各辅助生产工艺环节,国内外对制药行业《药品生产质量管理规范》(GMP)相关的公用设施计算机化系统验证提出了严格要求。计算机化系统的验证是制药行业在满足患者安全、产品质量、数据完整性方面不可或缺的质量风险管理部分,单纯的设备、工艺验证不再满足现有计算机化系统的合规管理,自2015年12月1日GMP附录《计算机化系统》《验证与确认》的实施[1],制药企业所涉及的GMP相关计算机化系统的验证越来越得到企业的重视,并成为国家药监局重点审查对象[2]。文中以《良好自动化生产实践指南》(GAMP 5)为指导,依据GMP附录《计算机化系统》《确认与验证》要求,结合实际工作经验,对公用设施计算机化系统验证进行深入研究及实例应用,以期为制药企业公用设施计算机化系统验证的实施提供参考。
1 计算机化系统
计算机化系统是由软件、硬件(固件)、网络组件和可控的功能以及人员和相关文件组成,如图1所示。根据GAMP5,又将计算机化系统软件分为基础设施软件、不可配置软件、可配置软件和定制应用软件4种类别,硬件分为标准硬件组件和定制内置硬件组件[3]。
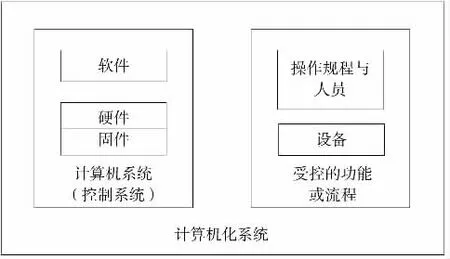
图1 计算机化系统
2 公用设施计算机化系统
公用自动化系统通常是由多个单一设备构成,包括上位机、打印机、HMI、PLC、变频器、阀门、传感器等仪器仪表及现场设备。单个或多个自动化系统以及人员、流程、文件构成一个完整的计算机化系统。制药企业公用设施计算机化系统一般包括:制水系统、空调自控系统、冷库自控系统、生化培养罐系统、脉动真空灭菌器系统等,这些公用设施计算机化系统为制药企业药品生产提供良好的基础辅助,并和产品质量相关联,为了确保药品生产过程符合《现行良好生产质量管理规范》(CGMP),与药品生产相关的公用设施计算机化系统在整个生命周期内必须始终处于验证状态并稳定运行[4]。目前,制药企业计算机化系统验证主要参照国际制药工程协会(ISPE)GAMP5。公用设施计算机化系统的软件通常是为具体业务或工艺流程而定制的软件产品,一般被归类为GAMP类别4,通常采用由3个阶段的规范与核实组成的验证方法。涵盖这3个阶段所需要的文件数量要根据系统的复杂性与影响来确定。可配置产品(类别4)的验证V模型,如图2所示。

图2 可配置产品的验证V模型
3 公用设施计算机化系统验证
本研究以公用系统冷库计算机化系统为例进行验证研究与应用分析。设计的冷库计算机化系统包括:远程监控系统、温度控制器、调制解调器、制冷机组、冷库等。用于储存原材料、半成品、成品以及实验用品等,系统通过温度控制器控制制冷机组的运行启停,上传至远程监控平台实现对冷库温度的控制和监视,并生成报警记录和事件记录,关键温度参数具有历史趋势查询功能。制冷机组分别由冷风机、压缩机、冷凝风机以及电磁阀等组成。图3是典型的冷库制冷系统电气控制原理图。
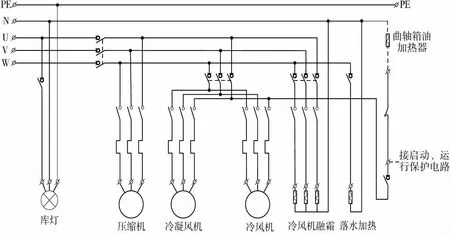
图3 冷库制冷系统电气控制原理图
3.1 验证范围确认
GMP附录《计算机化系统》第四章第六条规定“计算机化系统验证包括应用程序的验证和基础架构的确认,其范围与程度应当基于科学的风险评估。风险评估应当充分考虑计算机化系统的适用范围和用途。”[5]本研究通过系统差距分析和风险评估确定冷库计算机化系统的验证范围与程度。
3.1.1 差距分析
GxP评估[6]冷库计算机化系统为GMP关键,对于GMP关键系统进行计算机化系统验证差距分析,首先通过系统的失效模式,分别从患者安全、产品质量、数据完整性3个方面的影响性来判定系统影响级别,如图4所示。
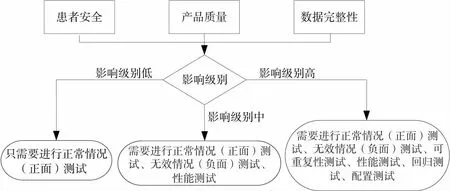
图4 计算机化系统影响级别
通过系统的失效模式分析,判定冷库计算机化系统影响因子为中,为直接影响系统,根据系统影响级别在差距分析及验证措施中采取对应的测试活动。
差距分析采用现行冷库计算机化系统目前状态与中国GMP附录《计算机化系统》、GAMP5的要求进行对比,通过法规要求提取问题进行分析,对提出的问题给出符合实际情况的最终结果以发现系统存在的潜在差距。差距分析的执行过程如图5所示。
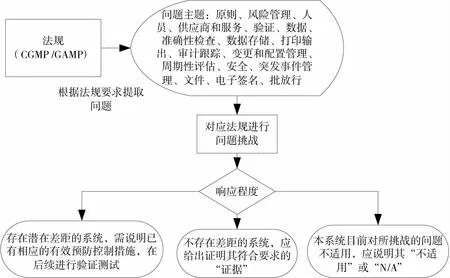
图5 差距分析执行过程
基于上述分析所发现的差距,开展相关改进活动在后续的验证及管理程序中加以处理和弥补,并在后续运行阶段持续进行维护,从而使系统持续整体合规。
3.1.2 风险评估
对评估为直接影响的冷库计算机化系统进行关键部件和功能评估,对判定为关键性的部件和功能进行风险评估以确定出所有的潜在危险及其对产品的影响。首先根据部件和功能对产品的影响来评估其GMP关键程度,部件和功能的GMP影响评估以产品的5个质量参数为基础(功效、特性、安全、纯度、质量),对于每一项会对产品质量产生影响的功能、所有提供该功能的设备、部件或仪表都归类为关键和非关键两种。部件和功能的关键性评估如表1所示。

表1 部件和功能的关键性评估
对归类为关键的部件和功能应用失败模式效果分析,对已经识别的或潜在的风险及问题进行分析,根据经验和维修历史数据进而确认每个风险的严重性(Severity)、发生的可能性(Probability of occurrence)及可检测性(Detection),对风险进行深入的描述,并综合上述因素确认一个风险的等级[7]。
根据风险等级与可接受标准的对应关系,做出是否对该风险采取措施的决定,对风险级别高的关键部件和功能进行风险控制,采取相应的纠正和预防措施后使风险处于可接受程度[8],在整个计算机化生命周期内使系统处于可控状态。
3.2 设计功能验证
计算机化系统设计功能(FS)验证包括软件设计功能(SDS)确认和硬件设计功能(HDS)确认,确认系统满足用户需求(URS)和CGMP的要求[9]。FS的编写参照GAMP5-遵从GxP计算机化系统监管的风险管理方法中关于计算机化系统功能规范附录D2。冷库计算机化系统FS规范文件主要包含系统硬件、软件结构,功能、数据、界面以及非功能属性等。
3.2.1 硬件设计功能确认
冷库计算机化系统硬件包括:操作员站上位机(主机、显示器、键盘等)、现场温度控制器、调制解调器、制冷机组、冷库主体等主要部件。硬件功能确认需要对评估为计算机化系统的关键部件进行规格型号、供应商、技术参数的确认。确认冷库计算机化系统满足最初的硬件设计要求和用户需求以及符合相关法规,并在实际运行过程中始终保持高效且符合现阶段自动化系统技术要求。冷库计算机化系统硬件结构如图6所示。
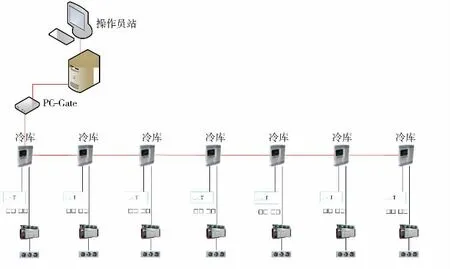
图6 冷库计算机化系统硬件结构
3.2.2 软件设计功能确认
软件设计功能确认通常包括:软件结构、系统控制功能、数据处理功能、人机界面、系统访问控制、系统安全,以及系统备份恢复等。对冷库计算机化系统软件功能进行确认使其满足最初的软件设计要求和用户需求以及符合相关法规,并符合现阶段系统智能化管理。
3.3 验证方案确认
根据中国GMP附录(2010修订)《确认与验证》《计算机化系统》的要求,通过验证方案对运行阶段的冷库计算机化系统进行再次确认,以符合现行中国GMP(2010修订)法规要求并保证系统正常、可靠地运行,以确保产品的存储稳定性,使冷库计算机化系统在运行阶段始终保持验证状态。
验证确认方案包含:安装确认(IQ)、运行确认(OQ)和性能确认(PQ),具体见表2。

表2 验证方案确认内容
3.4 验证确认及报告阶段
验证确认阶段主要是对验证确认方案的实施,根据冷库计算机化系统的功能规范要求,通过一系列的测试手段,确认系统硬件、软件功能满足设计要求、相关文件处于可控状态、系统运行性能稳定可靠,满足计算机化系统相关法规要求。
验证确认完成后,对确认方案范围、确认方案项目执行情况、项目完成情况以及偏差与变更情况进行总结得出结论,并依据中国GMP(2010修订)第九十条规定“应当按照操作规程和校准计划定期对生产和检验用衡器、量具、仪表、记录和控制设备以及仪器进行校准和检查,并保存相关记录。校准的量程范围应当涵盖实际生产和检验的使用范围。”,中国GMP(2010修订)附录《确认与验证》第十六条规定“运行确认完成后,应当建立必要的操作、清洁、校准和预防性维护保养的操作规程,并对相关人员培训。”以及中国GMP(2010修订)附录《计算机化系统》第二十条规定“企业应当建立应急方案,以便系统出现损坏时启用。应急方案启用的及时性应当与需要使用该方案的紧急程度相关。”等相关要求,对冷库计算机化系统提出运行维护建议以满足法规要求使冷库计算机化系统始终处于验证状态,形成最终的确认报告。
4 结论
制药企业公用设施计算机化系统运行多年,自GMP附录《计算机化系统》2015年12月1日施行以来,制药企业在这方面的验证还不够充分,本研究对运行阶段的公用设施计算机化系统的验证实施进行深入研究分析,使公用设施计算机化系统在满足GMP法规要求的基础上,对提升企业运营效益、降低管理成本做出突出的贡献。
