石榴ATG基因家族鉴定及其在非生物胁迫下的表达模式分析
2022-09-27刘司瑜林艺灵王令宇夏家欣杨毓贤房经贵上官凌飞
刘司瑜, 林艺灵, 王令宇, 夏家欣, 杨毓贤, 房经贵, 王 晨, 上官凌飞
(南京农业大学园艺学院 江苏省果树品种改良与种苗繁育工程中心, 江苏 南京 210095)
石榴(PunicagranatumLinn.)为千屈菜科(Lythraceae)石榴属(PunicaLinn.)的果树,栽培历史悠久,种质资源丰富[1]。石榴是一种集观赏、经济、生态和保健于一体的优良果树,因其果实富含维生素、蛋白质、矿物质、鞣质和类黄酮等,越来越受到消费者的喜爱[2]。与其他果树一样,石榴在栽培过程中也常受高盐、干旱、营养缺乏和病原菌侵染等胁迫影响,干旱胁迫下植株的生长和生理功能,尤其是光合特性等会发生一系列变化。王紫彤等[3]研究发现,干旱胁迫影响大蒜(AlliumsativumLinn.)叶绿素的合成,从而抑制叶绿体的发育,光合效率降低,使植株生长迟缓。石榴虽为一种较为耐旱的植物,但卓热木·塔西等[4]研究发现土壤相对含水量从70%自然降到30%期间,植株光合等生理指标下降,生长受到限制。细胞自噬是生物体降解蛋白质过程中一条非常重要的途径,存在于真核单细胞生物、植物和动物中。调控细胞自噬形成与发生的基因称作自噬相关基因(autophagy-relatedgene,ATG)[5]。除了正常生长发育与衰老外,当植物体受到外界环境的刺激而处在逆境条件下,植物体内的细胞也会在ATG等基因的调控下,形成自噬小体,将受损的蛋白质或者细胞器包裹起来,运输到液泡进行水解,产生的物质和能量被植物体循环利用[6]。
目前,在非生物胁迫方面,研究较多的是ATG5、ATG7、ATG8和ATG18等基因,例如:核桃(JuglansregiaLinn.)ATG18a基因能响应逆境,参与核桃适应不良环境[7];小麦(TriticumaestivumLinn.)ATG18s基因及其参与的自噬过程与小麦对白粉菌侵染的免疫反应密切相关,也与小麦响应非生物胁迫环境相关[8];当番茄(SolanumlycopersicumLinn.)受到高温胁迫时,ATG5和ATG7基因表达量上调,而将ATG5和ATG7基因沉默后,番茄株系对高温的耐受性显著下降[9]。但到目前为止,对石榴ATG基因家族的研究还少见报道。脱落酸(ABA)可以调节植物对外界胁迫的响应[10]。Qian等[11]研究认为,在干旱胁迫下,60 μmol·L-1ABA能够显著提高石榴对干旱胁迫的耐受性。
自2017年,石榴品种‘大笨籽’(‘Dabenzi’)、‘泰山红’(‘Taishanhong’)和‘突尼斯’(‘Tunisia’)的基因组测序陆续完成,获得了更高质量的石榴基因组序列[12-14],也为在全基因组水平上鉴定与分析基因家族提供了可能性。本研究从目前基因组质量最高的石榴品种‘突尼斯’基因组中挖掘ATG基因,并对其进行生物信息学分析,同时探究其在不同非生物胁迫下的表达情况,为后续深入分析ATG基因在石榴响应非生物胁迫中的功能奠定研究基础。
1 材料和方法
1.1 基因组数据来源
石榴基因组数据(ASM220158v2)[14]下载自NCBI数据库(https:∥www.ncbi.nlm.nih.gov),拟南芥〔Arabidopsisthaliana(Linn.)Heynh.〕基因组数据下载自EnsemblPlants数据库(http:∥plants.ensembl.org/Arabidopsis_thaliana/Info/Index),葡萄(VitisviniferaLinn.)基因组数据下载自EnsemblPlants数据库(ftp:∥ftp.ensemblgenomes.org/pub/release-33/plants/gtf/vitis_vinifera)[15]。石榴转录组数据下载自NCBI-SRA数据库(http:∥www.ncbi.nlm.nih.gov/Traces/sra)[11,16]。
1.2 方法
1.2.1 石榴ATG基因家族成员的鉴定 根据已报道的拟南芥和水稻(OryzasativaLinn.)ATG基因核酸序列,利用BLASTx程序(ftp:∥ftp.ncbi.nlm.nih.gov/blast/executables/blast+/LATEST/)从石榴蛋白质序列集中检索潜在的石榴ATG序列(E≤10-5);利用NCBI网站的CDD在线工具(https:∥www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)批量鉴定石榴ATG基因家族成员序列的功能域,筛选并剔除其中的假阳性序列,获得候选的石榴ATG基因家族成员。
1.2.2 石榴ATG家族成员的蛋白质理化性质分析 运用在线软件Protparam(http:∥us.expasy.org/tools/protparam.html)对候选的石榴ATG家族成员进行蛋白质理化性质分析,获得石榴ATG家族成员氨基酸序列的氨基酸残基数、理论相对分子质量、理论等电点和不稳定系数。
1.2.3 石榴ATG基因家族成员染色体定位和基因结构分析 利用MG2C网站(http:∥mg2c.iask.in/mg2c_v2.1/)绘制石榴ATG基因家族成员染色体定位图。根据石榴全基因组的GFF格式的注释文件,提取石榴ATG基因家族成员序列中的非翻译区、编码序列和内含子的结构信息。利用TBtools软件[17]分析其基因结构,生成相应的基因结构图。
1.2.4 石榴ATG家族成员的氨基酸序列对比和系统进化树构建 使用MEGA7.0软件[18]中的MUSCLE方法对石榴和拟南芥ATG家族成员的氨基酸序列进行多序列比对,采用最大似然法(maximum likelihood,ML)生成进化树,设置校验参数Bootstrap的重复次数为1 000。使用iTOL在线软件[19](https:∥itol.embl.de/)修饰美化进化树。
1.2.5 石榴ATG基因家族成员共线性分析 运用MCScanX软件[20]对石榴ATG基因家族成员进行共线性分析,选出具有显著共线性的成员。此外,利用TBtools软件绘制石榴、拟南芥和葡萄ATG基因家族成员的共线性图谱,并计算石榴具有显著共线性成员的Ka/Ks值,其中Ka为非同义替换率,Ks为同义替换率。若Ka/Ks值大于1,则认为存在正向选择;若Ka/Ks值等于1,则认为存在中性选择;如果Ka/Ks值小于1,则认为存在纯化选择。
1.2.6 石榴ATG基因家族成员在非生物胁迫下的表达信息挖掘 根据石榴ATG基因家族成员基因ID号,利用前人发表的转录组数据[11,16]分析石榴ATG基因家族成员在ABA缓解干旱胁迫和NaCl胁迫下的表达量,利用TBtools软件绘制热图。
1.2.7 石榴ATG基因家族成员在非生物胁迫下的表达验证 石榴品种‘突尼斯’2年生苗(购自山东振邦生态农业科技有限公司)种植于盆口直径20 cm、高25 cm的塑料盆中,栽培基质为育苗专用基质(江苏兴农基质科技有限公司),每盆1株,置于南京农业大学白马实践基地温室中进行培养。
参考Qian等[11]的实验设计,挑选长势基本一致的12株植株用于干旱胁迫处理,将12株植株随机分为4组,每组3株。干旱胁迫时间为31 d(4月13日至5月13日),胁迫期间保持土壤含水量为30%~35%。在干旱胁迫的同时,其中3组每天分别全株喷洒30、60和90 μmol·L-1ABA溶液10 mL,剩余1组作为对照,喷洒等体积的蒸馏水(即0 μmol·L-1ABA溶液)。处理结束后收集各植株的全部叶片,立即在液氮中冷冻后储存于-80 ℃冰箱,用于提取RNA。
参考Liu等[16]的实验设计和获得的表达信息,发现NaCl胁迫第6天基因的应答强烈,同时根中响应基因较叶片中多,因此本研究的实时荧光定量PCR(real-time fluorescence quantitative PCR,qRT-PCR)以0和6 d根系为材料分析石榴ATG基因表达特点。参考Liu等[16]的实验设计,挑选长势基本一致的6株植株用于NaCl胁迫处理,将6株植株随机分为2组,每组3株。NaCl胁迫时间为6 d(4月13日至4月18日),其中一组用200 mmol·L-1NaCl溶液施肥1次,每盆施用1 L;于4月13日收获未进行NaCl胁迫处理组植株的全部根系作为对照。实验期间NaCl胁迫处理组每盆下面放置1个碟子收集渗滤液并倒回塑料盆中。第6天(处理结束后)收集NaCl胁迫处理组各植株的全部根系,立即在液氮中冷冻后储存于-80 ℃冰箱,用于提取RNA。
所有样品使用CTAB法[21]提取RNA,使用Nanodrop-100a超微量分光光度计(美国赛默飞公司)检测RNA浓度,使用质量体积分数1%琼脂糖凝胶电泳检查完整性。利用PrimeScript RT reagent Kit(Perfect Real Time)试剂盒〔宝生物工程(大连)有限公司〕逆转录合成cDNA。利用Primer Premier 5.0软件设计特异性引物(表1)用于qRT-PCR分析,引物由通用生物股份有限公司合成,参照关晓弯等[22]的研究使用PgActin为内参基因。按照SYBRPremixExTaqTM试剂盒〔宝生物工程(大连)有限公司〕说明书,采用qRT-PCR测定基因的相对表达量。反应体系总体积20.0 μL,包括cDNA 1.0 μL、反应MIX〔宝生物工程(大连)有限公司〕10.0 μL、正向和反向引物各0.8 μL,超纯水7.4 μL。反应程序:95 ℃预变性5 min;95 ℃变性30 s、58 ℃退火20 s、72 ℃延伸30 s,循环40次。每个样品3次重复。采用2-ΔΔCT计算方法,以对照计算相对表达量。

表1 用于实时荧光定量PCR的引物
1.3 数据统计和处理
利用EXCEL 2010和LinReg PCR软件[23]分析实验数据,利用GraphPad Prism 8.0软件作图。
2 结果和分析
2.1 石榴ATG基因家族鉴定及蛋白质理化性质分析
通过BLASTx检索和CDD批量鉴定和筛选,初步鉴定出58个石榴ATG基因家族成员,并对其进行命名。
蛋白质理化性质分析结果(表2)表明:石榴ATG家族成员的氨基酸残基数变化幅度较大,介于94~3 708之间,其中PgATG5a的氨基酸残基数最多,PgATG12的氨基酸残基数最少。该家族成员的理论相对分子质量为10 550~413 118,其中PgATG5a的理论相对分子质量最大,而PgATG12的理论相对分子质量最小。该家族成员的理论等电点为pI 4.69~pI 9.39,其中35个家族成员的理论等电点小于pI 7,其余23个家族成员的理论等电点大于pI 7。该家族成员的不稳定指数介于30.41~70.17之间,其中PgATG2、PgATG8c-1、PgATG8c-2、PgATG8c-3、PgATG10和PgATG16这6个家族成员的不稳定指数小于40。
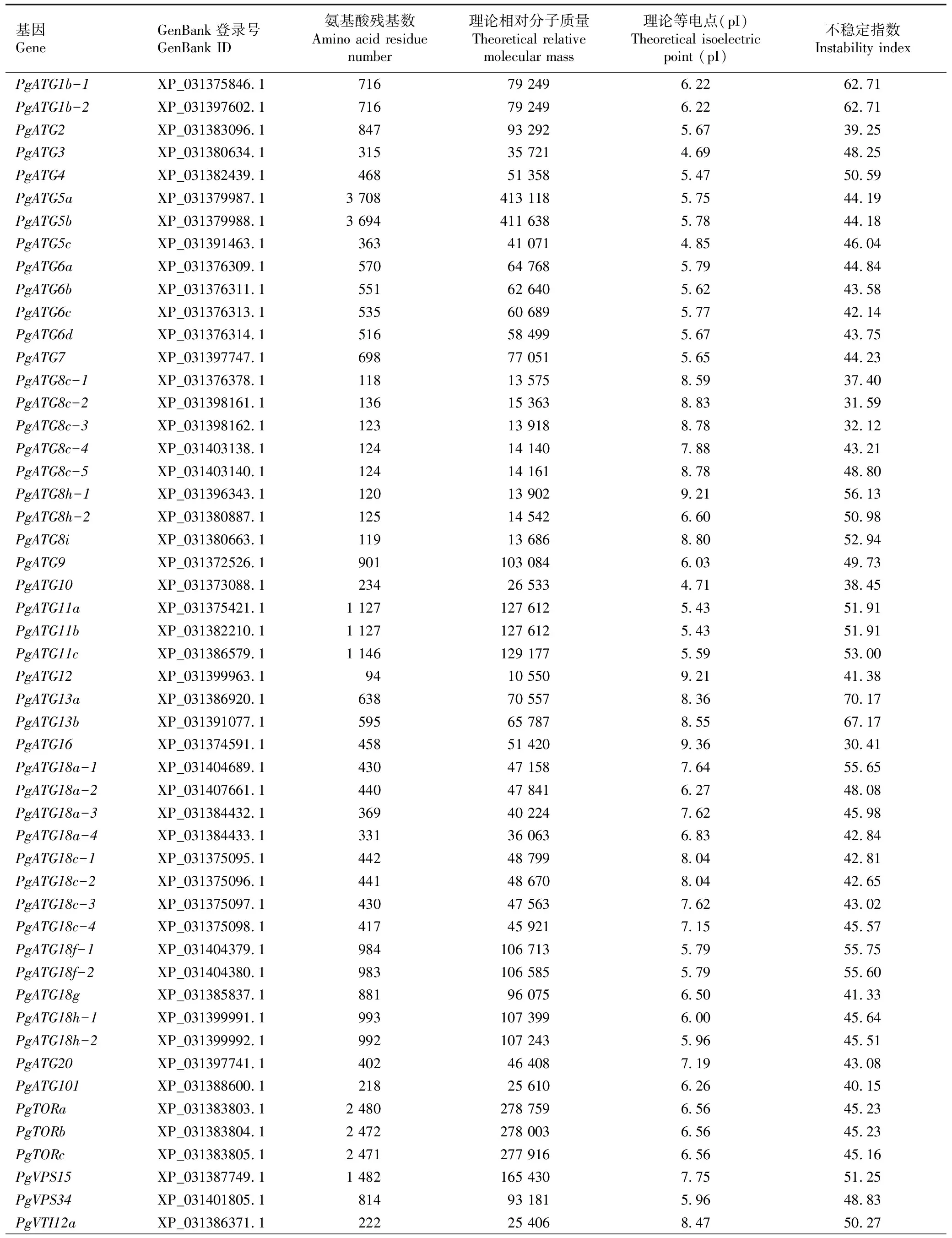
表2 石榴ATG基因家族成员编码氨基酸序列的理化性质
2.2 石榴ATG基因家族的染色体定位和基因结构分析
染色体定位分析结果(图1-A)显示:58个石榴ATG基因家族成员分布于8条染色体上。其中,Pg06染色体上的石榴ATG基因家族成员数量最少,只有4个;Pg02染色体上分布的石榴ATG基因家族成员最多,有14个。其余6条染色体上分布的石榴ATG基因家族成员数量为5~8。石榴ATG基因家族成员在同一条染色体上的分布是不均匀的,大多分布在各染色体的上端、中上端和下端,除了Pg01、Pg02和Pg08染色体上的ATG基因家族成员分布较为集中外,其余染色体上的ATG基因家族成员分布较为分散。此外,PgATG1b-1、PgATG11a和PgVTI12b-2这3个基因的染色体定位信息不足。

Pg01-Pg08: 染色体Chromosomes.: 非翻译区Untranslated region; : 编码序列Coding sequence; ─: 内含子Intron.
基因结构分析结果(图1-B)显示:58个石榴ATG基因家族成员均含有内含子。成员之间结构差异较大,其中PgTORa、PgTORb和PgTORc基因的结构最复杂,有56个外显子,而PgATIa-3基因的结构最简单,仅有1个外显子。
2.3 石榴ATG家族的系统进化分析
系统进化分析结果(图2)显示:58个石榴ATG家族成员可以分为A、B、C、D、E和F 6个亚族。其中A亚族是最大的亚族,含有23个石榴ATG家族成员,主要包括PgATG8、PgATG5、PgATG18f和PgATG18h;B亚族含有17个石榴ATG家族成员,主要包括PgATG1b、PgATIa、PgATG13、PgTOR和PgATG6;C亚族含有5个石榴ATG家族成员,包括PgVTI12和PgATG101;D亚族仅含有PgATG11的3个家族成员;E亚族为最小的亚族,仅含有PgVPS15这1个石榴ATG家族成员;F亚族含有9个石榴ATG家族成员,包括PgATG18a、PgATG18c和PgVPS34。此外,石榴ATG家族成员与拟南芥ATG家族成员的进化关系相似。

Pg: 石榴Punica granatum Linn.; At: 拟南芥Arabidopsis thaliana(Linn.)Heynh.
2.4 石榴ATG基因家族的共线性分析及Ka/Ks分析
共线性分析结果(图3)显示:58个石榴基因家族成员中存在3对共线关系,说明石榴ATG基因家族的扩张来源于串联重复事件。在石榴与拟南芥ATG基因家族成员间存在45对共线关系,石榴与葡萄ATG基因家族成员间则存在41对共线关系,说明石榴与拟南芥的共线性多于葡萄。
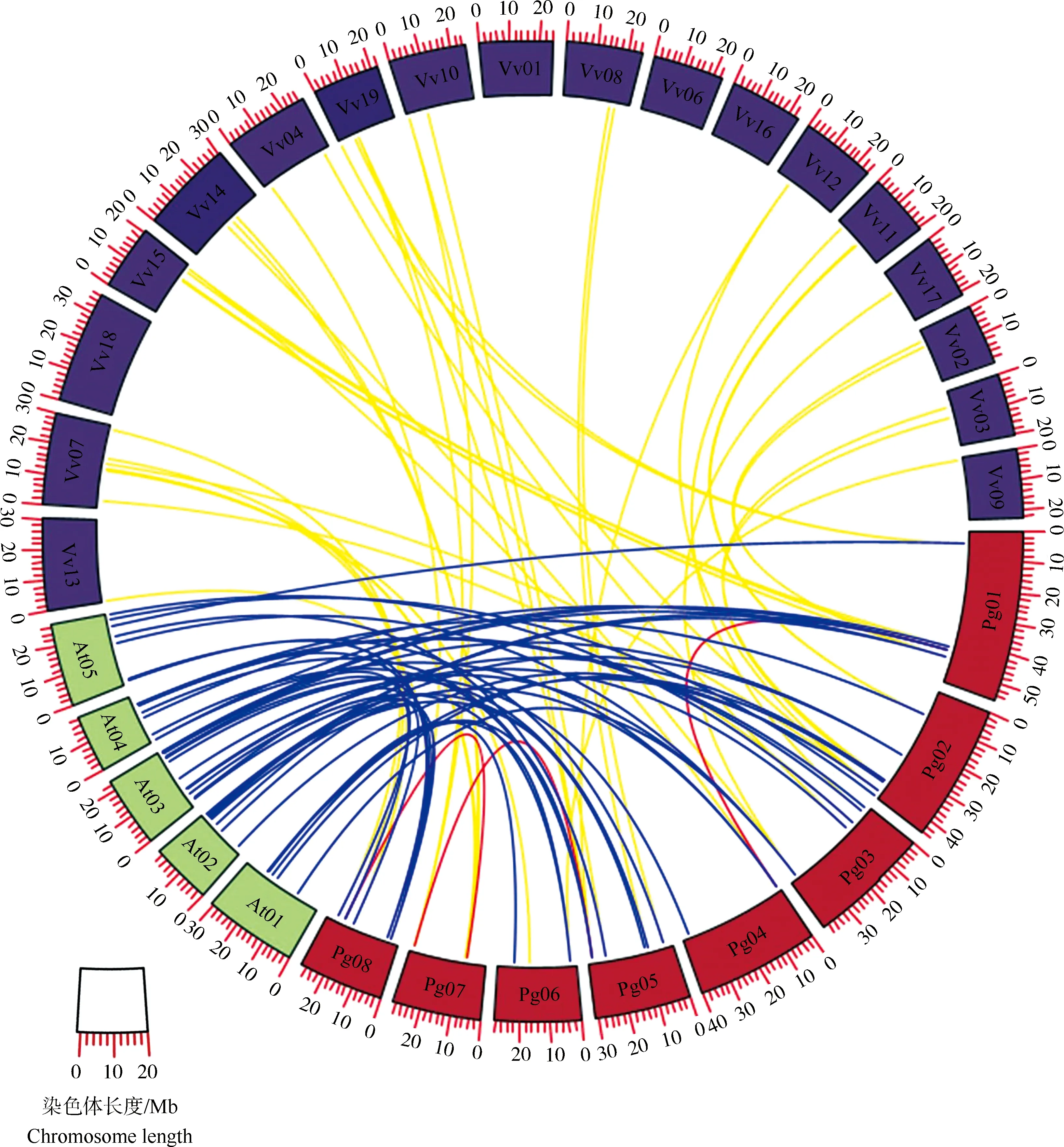
Pg01-Pg08: 石榴染色体Chromosomes of Punica granatum Linn.; At01-At05: 拟南芥染色体Chromosomes of Arabidopsis thaliana(Linn.)Heynh.; Vv01-Vv19: 葡萄染色体Chromosomes of Vitis vinifera Linn.红色线条为石榴种内的共线基因对,蓝色线条为石榴和拟南芥间的共线基因对,黄色线条为石榴和葡萄间的共线基因对The red lines are the collinear gene pairs within P. granatum, the blue lines are the collinear gene pairs between P. granatum and A. thaliana, and the yellow lines are the collinear gene pairs between P. granatum and V. vinifera.
根据Ka/Ks分析结果(表3)显示:石榴中3个共线基因对的Ka/Ks值均小于1,说明其在进化过程中受到了纯化选择。

表3 石榴ATG基因家族成员中共线基因对的Ka/Ks分析
2.5 石榴ATG基因家族的表达分析
为了进一步了解石榴ATG基因在非生物胁迫下可能发挥的作用,利用转录组数据分析石榴ATG基因在ABA缓解干旱胁迫和NaCl胁迫下的差异表达情况(图4)。通过转录组数据挖掘后发现,有5个石榴ATG基因参与ABA缓解干旱胁迫进程(图4-A)。干旱胁迫下,60 μmol·L-1ABA处理的PgVTI12b-1基因表达量显著高于其他浓度ABA处理;PgATG1b-1、PgATG8c-2和PgATG8c-3基因的表达量随着ABA浓度的提高而不断上调,说明这3个基因的表达在干旱胁迫下受到ABA浓度的正调控;而30 μmol·L-1ABA处理的PgATG8h-1基因的表达量较高。
在NaCl胁迫下,石榴根和叶中分别有11和8个基因响应NaCl胁迫(图4-B,C)。石榴根中响应NaCl胁迫的11个基因中,除了PgATG1b-2和PgATG6b基因下调外,PgATG5b、PgATG18c-1、PgTORa、PgTORb、PgVPS34、PgATG5c、PgATG11a、PgATG2和PgATG5a9个基因均上调,其中,PgATG5c、PgATG11a、PgATG2和PgATG5a基因均随胁迫时间延长而不断上调,PgTORa、PgTORb和PgVPS34基因则在胁迫第3天时出现更为明显的上调情况。石榴叶中响应NaCl胁迫的8个基因中,随着胁迫时间的延长,PgATG13b、PgATG8c-1、PgATG12、PgATG8c-4和PgTORb基因不断上调,PgATG6b基因则下调,而PgATG11b基因先下调后上调;PgATG1b-2基因则在胁迫第3天出现较为明显的上调。同时,PgATG6b、PgTORb和PgATG1b-2基因在根和叶中均差异表达,且PgTORb基因在根和叶中均上调,而PgATG6b基因则均下调,由此推测PgATG6b和PgTORb基因同时参与石榴根和叶对NaCl胁迫的响应。
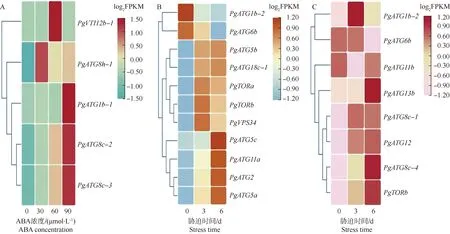
FPKM: 表达丰度Expression abundance.
利用qRT-PCR并结合转录组数据,在ABA缓解干旱胁迫和NaCl胁迫下各随机选取6个石榴ATG基因进行表达模式分析。结果(图5)显示:干旱胁迫下,不同浓度ABA处理的6个石榴ATG基因中PgATG1b-1、PgATG8h-1、PgATG18a-2、PgVTI12b-1和PgATIa-4基因的表达模式与其转录情况基本一致,而PgATG8c-3基因的表达模式则与其转录情况不同,推测可能是本研究中的干旱胁迫时间(31 d)比获得转录组数据的时间(90 d)短造成的,可能PgATG8c-3基因需要较长的时间才能参与改善石榴响应ABA缓解干旱胁迫的进程。NaCl胁迫处理下,PgATG1b-2、PgATG5a、PgATG5b、PgATG6b、PgATG18c-1和PgTORb基因的表达模式则与其转录情况相似。

:qRT-PCR; : RNA-Seq.
3 讨 论
细胞自噬是生物进化和生长发育过程中一个不可缺少的重要机制,在稳定细胞内环境、提高细胞物料利用率、延缓细胞衰老以及增强植物抗逆性方面具有正向作用。ATG基因在多种植物中都存在,如拟南芥中有32个ATG基因[24],水稻中有33个ATG基因[25],辣椒(CapsicumannuumLinn.)[26]和葡萄[15]中分别有29和35个ATG基因。本研究基于石榴品种‘突尼斯’全基因组数据,首次从石榴中鉴定出58个ATG基因家族成员,相对于其他植物较多,说明石榴ATG基因可能在进化过程中发生了基因复制。同时,ATG基因家族成员编码氨基酸序列的氨基酸残基数介于94~3 708之间,理论相对分子质量在10 550~413 118之间,58个ATG基因家族成员中有52个成员的不稳定系数均大于40,因此,该基因家族整体较不稳定,这些与胡杨等[27]对蚕豆(ViciafabaLinn.)ATG基因鉴定中的蛋白质理化性质研究结果类似。58个石榴ATG基因家族成员不均匀地分布在8条染色体上,这与拟南芥[28]的研究结果类似,说明即使是同一家族的成员,在染色体上的定位也是不同的。系统进化树分析结果显示:58个石榴ATG家族成员分为A、B、C、D、E和F 6个亚族,并且与拟南芥ATG家族成员的进化关系相似,表明石榴ATG家族成员与拟南芥亲缘关系较近,这与葡萄中发现的ATG基因与双子叶植物拟南芥的亲缘关系更近相同[29]。同时,通过共线性分析发现,58个石榴ATG基因家族成员中存在3对共线关系,石榴与拟南芥和葡萄ATG基因家族成员间分别存在45和41对共线关系,说明这些基因在进化上高度同源,且在进化过程中十分保守。
已有研究结果显示:蚕豆[27]、拟南芥[28]、番茄[30]、苹果(MaluspumilaMill.)[31]和水稻[32]中响应干旱胁迫的ATG8和ATG18基因家族成员较多。例如:蚕豆中VfATG8a基因能够响应干旱胁迫[27];拟南芥中ATG8f/At4g16520和ATG8i/At3g15580基因对低温、高温和干旱等外界环境极为敏感,且参与了整个植株对多种非生物胁迫的响应[28]。本研究通过转录组数据分析了58个石榴ATG基因家族成员在ABA对干旱胁迫的缓解作用下的表达,初步鉴定出PgVTI12b-1、PgATG1b-1、PgATG8h-1、PgATG8c-2和PgATG8c-3基因可能是石榴响应ABA缓解干旱胁迫的基因,且不同基因的响应模式不同。60 μmol·L-1ABA能明显提高石榴耐旱性,且PgVTI12b-1基因是该浓度ABA缓解石榴干旱胁迫的响应基因。同时,PgATG1b-1、PgATG8c-2和PgATG8c-3基因的表达量随ABA浓度的提高不断上调,说明这3个基因可能响应高浓度ABA对干旱胁迫的缓解。石榴在栽培过程中也受到高盐的影响。沈徐悦等[33]对3种木兰科(Magnoliaceae)植物的研究发现,中低浓度NaCl胁迫下,3种植物可通过自身调节减轻NaCl胁迫带来的伤害;而高浓度NaCl胁迫下叶片细胞膜受到不可逆损伤。由此推测,ATG基因也有可能参与调节盐胁迫的分子机制,但具体情况有待进一步验证。本研究通过探索发现,石榴根中有11个ATG基因(包括PgATG1b-2、PgATG2、PgATG5a、PgATG5b、PgATG5c、PgATG6b、PgATG11a、PgATG18c-1、PgTORa、PgTORb和PgVPS34)响应NaCl胁迫,叶中有8个ATG基因(包括PgATG1b-2、PgATG6b、PgATG8c-1、PgATG8c-4、PgATG11b、PgATG12、PgATG13b和PgTORb)响应NaCl胁迫。苏万龙[34]研究发现,200 mmol·L-1NaCl诱导杨树(Populusspp.)中PagATG18a基因的表达量升高,过表达PagATG18a基因的植株通过提高植物体内的抗氧化酶活性增强了转基因植物对NaCl胁迫的耐受性。孙鸿等[8]研究发现,高盐(200 mmol·L-1NaCl)、干旱、低温黑暗和缺氮培养等逆境处理均能够上调小麦中TaATG18s基因的表达。说明ATG8和ATG18基因在多种植物中响应NaCl胁迫,这也为进一步研究石榴耐盐ATG基因提供了候选基因及思路。黄成等[35]研究发现,甘蓝型油菜(BrassicanapusLinn.)BnAPs家族成员中同源基因BnAP36.A04/C08和BnAP39.A06/C03均在花发育时期高表达,且具有相同的表达模式和qRT-PCR验证结果,推测二者在甘蓝型油菜中可能有相似的功能。通过共线性分析发现,58个石榴ATG基因家族成员中存在3个共线基因对,同源性较高,分别为PgATIa-4/PgATIa-1、PgATG8c-2/PgATG8c-5和PgATG18a-1/PgATG18a-2,但这3个共线基因对均未显示出石榴对ABA缓解干旱胁迫和NaCl胁迫的响应。
同时,本研究中qRT-PCR结果与转录情况相似,进一步证实了结果的准确性。但本研究未发现任何石榴ATG基因家族成员同时响应ABA缓解干旱胁迫和NaCl胁迫,推测在石榴中ATG基因家族不同的成员参与不同非生物胁迫的响应,与拟南芥中ATG8f/At4g16520和ATG8i/At3g15580基因参与低温、高温、干旱等多种环境胁迫不同[28]。结合系统进化树发现,响应ABA缓解干旱胁迫以及NaCl胁迫的PgATG8和PgATG5相关成员基因位于A亚族,由此可以推测A亚族在石榴应对非生物胁迫方面起着重要的调控作用,也可推测进化树对基因功能分类有一定参考作用[36]。
4 结 论
基于石榴品种‘突尼斯’全基因组数据,初步鉴定了58个石榴ATG基因,明确了其蛋白质理化性质、系统进化关系、基因结构和基因表达等,且筛选出的PgVTI12b-1、PgATG1b-1、PgATG8h-1、PgATG8c-2和PgATG8c-3基因可能是石榴对ABA缓解干旱胁迫的响应基因。NaCl胁迫下,石榴中11个ATG基因在根中响应,8个ATG基因在叶中响应,且PgATG6b、PgTORb和PgATG1b-2基因同时在根和叶中响应NaCl胁迫,为后续开展ATG基因调控石榴干旱和盐胁迫机制研究与功能验证奠定了基础,并提供了靶标基因。
致谢:本研究得到南京农业大学生物信息学中心高性能计算平台的支持,在此表示感谢!
