紫连膏家兔皮肤重复给药4周毒性研究
2022-09-27杨宏博叶建州梅晶袁芳刘明超刘红斌李勇师廷川王京昆
杨宏博,叶建州,梅晶,袁芳,刘明超,刘红斌,李勇,师廷川,王京昆✉
(1.云南省药物研究所,云南 昆明 650111;2.云南省中药和民族药新药创制企业重点实验室,云南 昆明 650111;3.云南省中医医院,云南 昆明 650111)
紫连膏(Zilian Cream)又名黄金万红膏,是云南省中医医院临床应用30 多年的经验方,由紫草、黄连、生地黄、当归、黄芩、虎杖、生地榆、冰片等中药及基质(白凡士林)组成,方中紫草清热解毒、生肌敛疮,入血分,可升可降;黄连清热燥湿、泻火解毒,质坚味厚,降而微升;生地黄清热凉血、养阴生津,三者共为君药。黄芩清热燥湿、泻火解毒;生地榆凉血止血,助君药加强清热解毒、敛疮止痛之功,为臣药。当归补血活血,虎杖活血散瘀、解毒消肿,为佐药。冰片善通诸窍、散郁火、辟秽浊,清热消毒止痛为使药。全方共奏清热解毒、凉血消斑、活血止痛、祛腐生肌、燥湿收敛之功效[1]。该药作为云南省中医医院的院内制剂已获批准[批准文号:滇药制字(Z)20082571A],其膏呈紫红色,均匀细腻,主要用于治疗烫伤、烧伤、银屑病、婴儿尿布皮炎(婴儿红臀)等属热毒内盛者[2-3]。
目前,关于紫连膏研究多集中在临床疗效和适应证上,如耳廓湿疹[4]、糖尿病足皮肤病[5]、Ⅱ期压疮[1]、张力性水疱[6]等,而对其临床使用是否具有毒性作用(副反应)以及其严重程度的研究尚不深入,目前文献中还未见其相关报道。在研究完成紫连膏经皮肤单次给药毒性的基础上,本课题组在通过国家认证的GLP条件下,进一步对其经完整皮肤重复给药4 周的慢性毒性进行研究,通过研究了解受试物在家兔体内可能产生的毒性作用特点及可逆性、延迟毒性等特征,分析判断其可能的毒性靶器官/靶组织,从而为临床用药安全及不良反应监测提供参考。
1 材料
1.1 主要仪器
电子天平(美国双杰兄弟集团有限公司常熟市双杰测试仪器厂,型号:TC-30K);血液分析仪(Siemens Healthcare Diagnoseics.Inc,型号:ADVIA 2120);凝血分析仪(DIAGNOSTICA STAGO.Inc,型号:STA Compact);全自动生化分析仪(Beckman Coulter.Inc,型号:Unicel DxC600);十六道生理信号采集分析系统(美国BIOPAC 公司,型号:MP150);生物显微镜(广州市明美光电技术有限公司,型号:ML31);病理切片扫描系统(宁波江丰生物信息技术有限公司,型号:KFPRO-005);动物麻醉机(上海任谊生物科技有限公司,型号:MSS-4S)。
1.2 药物及试剂
紫连膏(云南省中医医院,批号:20200604,20 g/盒,含量:每1.0 g 相当于饮片0.3 g,按滇ZJGF-396-2019 标准检测,符合标准要求);白凡士林(江西益普生药业有限公司,批号:20200901);异氟烷(天津普瑞生物药业有限公司,批号:20191201)。
1.3 实验动物
普通级新西兰家兔40只,4~5月龄,雌雄各半,体质量2.5~3.5 kg,购于山东艾莱克生物科技有限公司,许可证号:SCXK(鲁)20190006,质量合格证编号:370839210100001742。全部家兔饲养于通过国家GLP认证的普通环境动物实验室内,采用50 cm×40 cm×40 cm(长×宽×高)不锈钢干养式实验笼单笼饲养,每日每只家兔投放80 g兔生长繁殖饲料,自由摄食饮水。温度16~26 ℃(最大日温差≤4 ℃),湿度40%~70%,换气次数≥8 次/h,气流速度≤0.2 m/s,氨浓度(动态)≤14 mg/m,光照12 h/12 h明暗交替,动物照度100~200 lx,工作照度≥200 lx,噪声≤60 dB;直径90 mm 平皿敞开放置0.5 h,置37 ℃温箱培养48 h,≤30个/皿。
试验动物使用过程均符合动物福利要求,并通过实验动物管理和使用委员会(IACUC)的审查批准,审查编号:动(伦)IACUC-2021-003-01。
2 方法
2.1 对照品的选择
白凡士林作为紫连膏制剂唯一的基质成分,因其具有良好的防水性,对任何类型的皮肤都没有刺激性[7],是一种非常好的保湿用品,同时作为药用及化妆品辅料,广泛用于制备药膏、皮肤保护油膏、化妆品乳膏、香脂化妆油等[8],故本研究仅以市售白凡士林作为辅料对照,不再单独设阴性对照。
2.2 动物分组
参照国家食品药品监督管理总局制定的《药物非临床研究质量管理规范》和《药物重复给药毒性研究技术指导原则》要求,选择一般健康状况及去毛处皮肤情况良好的成年新西兰家兔40 只,用Excel 进行随机区组设计法将家兔分为4 组,即辅料对照组和紫连膏低、中、高剂量组,各组动物体质量差异均不超过单性别动物平均体质量的20%,每组10 只,雌雄各半。
2.3 剂量设置及依据
依据紫连膏说明书的用法、用量,用于烧伤、烫伤和银屑病,每天最大用量为0.1 g/cm2,每天2 次,间隔8 h。其中,治疗烧伤、烫伤使用2 周,治疗银屑病使用3周。课题组以往已经完成了家兔每次以50.0 mg/cm2剂量于10%体表面积的背部皮肤涂擦紫连膏,24 h内涂擦3次,每次间隔(4.0±0.5)h的单次毒性试验实验,以及家兔每次以50.0 mg/cm2剂量于10%体表面积的背部皮肤涂擦紫连膏,24 h 内涂擦2 次,每次间隔(4.0±0.5)h的重复给药7 d毒性试验。
两个试验研究结果表明,紫连膏对完整皮肤家兔均未表现出明显的毒性反应作用。因此,为充分暴露受试物的毒性,尽可能获得受试物的最大剂量下的毒性信息,依据国家食品药品监督管理总局制定的《化妆品安全技术规范》,在本研究中紫连膏低、中、高3个剂量组均于动物最大可给予的10%体表面积[9],每次分别以15.0、32.5、50.0 mg/cm2单位面积剂量涂擦紫连膏,24 h 内给予2 次。辅料对照组给予与紫连膏高剂量组面积、容积及次数相同的白凡士林。给药面积以5 cm2作为动物给药的最小精度面积,给药面积计算方法见公式(1)[10]。剂量设置情况具体见表1。
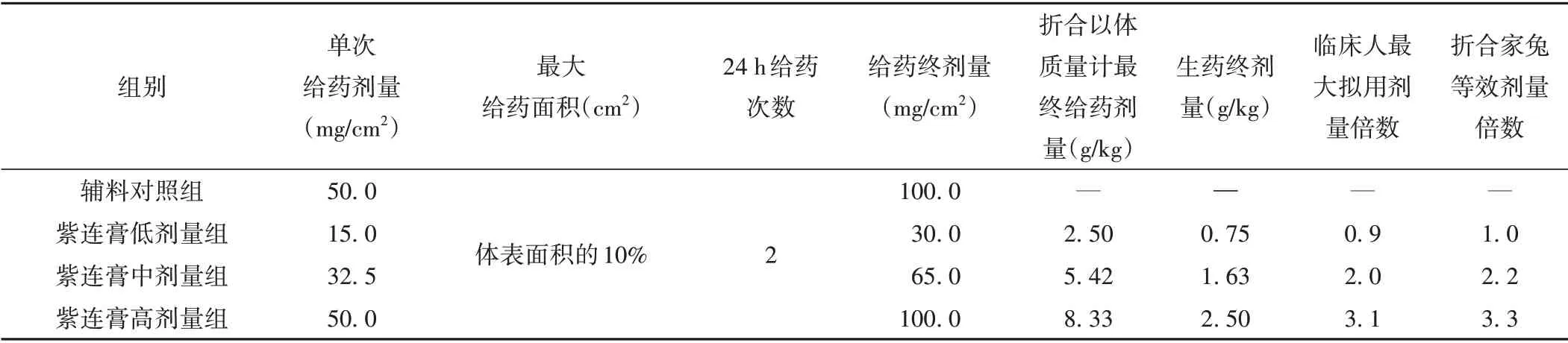
表1 各组剂量设置情况
其中,A为体表面积(m2),W为体质量(kg),K为体型系数(家兔为0.101 4)。
2.4 动物去毛
使用电推剪紧贴皮肤直接去除动物背毛。动物分组前进行首次去毛,去毛面积较大于给药面积,从而保证为覆盖物预留足够的固定面积。给药期及恢复期每周去毛1~2 次,具体依据是否影响给药及局部皮肤刺激性观察而定。
2.5 动物给药
于首次给药前以及给药后每个周期(7 d)的固定时间称量动物体质量,以此计算下一周期动物的给药量,期间内给药剂量不变。每次给药前准确称量药物,均匀缓慢涂擦于相应给药面积的去毛背部皮肤上,随后用空白膏药贴覆盖,固定给药部位,并同时用脖圈固定动物头部,保证样品与皮肤充分接触。各组动物每天给药2 次,每次药物停留时间(4.0 ± 0.5)h,结束后取下脖圈,使用医用干棉球反复轻擦去除受试物,至擦除干净为止。按以上操作,连续给药4周[11]。
2.6 指标检测方法和频率
2.6.1 一般临床症状、体征以及给药局部刺激性
给药前,每天观察动物一般症状、体征1 次。给药期间,每次给药后立即连续观察动物反应1 h,并在擦除受试物0.5 h 后至下一次给药前,观察给药局部皮肤刺激反应情况。恢复期间,每天观察动物一般症状、体征以及给药局部刺激性反应情况2 次,连续4 周。观察内容包括家兔外观、行为、分泌物、排泄物、给药局部情况、死亡情况及中毒反应症状及其起始时间、严重程度、持续时间、是否可逆及恢复时间等。具体如下:
①外观、体征情况:口、眼、鼻分泌物(颜色),角弓反张、惊跳反射,皮肤、黏膜潮红(部位),呃逆、流涎(颜色、质地),红斑、丘疹(部位),紫绀(部位),瘙痒、肿胀(部位),尿液和粪便的变化(颜色、性状),竖毛、昏迷、休克,大、小便失禁,死亡等;
②行为、活动状况:俯卧、运动失调、步态不稳、活动减少、无法站立、抽搐、惊厥、角弓反张、震颤、麻痹、剧烈挣扎、反抗尖叫等;
③精神状态:兴奋、烦躁、困倦、萎靡等;
④呼吸情况:呼吸困难、呼吸暂停、呼吸急促、喘息、腹式呼吸等;
⑤给药局部情况:给药部位皮肤情况、有无刺激反应等,主要包括局部皮肤有无红斑、水肿、结痂等。具体参照皮肤刺激性试验中“皮肤刺激反应评分标准”和“皮肤刺激强度评价标准”[12-13]对动物给药局部反应情况进行评价。
计算方法见公式(2),情况见表2、表3。

表2 皮肤刺激反应评分标准

表3 皮肤刺激强度评价标准
其中,M平为每组动物每次刺激反应的平均积分;A为总积分,即组内每只动物每次各皮肤刺激反应评分之和;n为组内动物只数。
2.6.2 摄食量
各组动物按A、B、C三级半定量法进行评价。A级:全部吃完或仅剩少量食物;B 级:剩余1/3~1/2 食物;C级:未吃或仅吃少量食物。试验期间,每天上午喂饲前评价1次,并在每一个周期(7 d)进行1次总评价。
2.6.3 体质量
给药前、给药期和恢复期间,每周固定时间称重1次。
2.6.4 体温
兽用体温计测量动物肛温,给药前测量1 次,给药期和恢复期的第2、4周各测量1次。
2.6.5 心电(ECGⅡ)
给药前、给药期第4 周和恢复期第4 周各检测1 次。ECGⅡ指标包括:P 波振幅(mV)、ST 偏移量(mV)、R波振幅(mV)、T波振幅(mV)、心率(HR,次/min)和RR间期(s)。
2.6.6 血常规及血清生化、电解质
给药前、给药期第4周及恢复期第4周分别采集家兔耳中央动脉血液,每次采血动物需提前禁食不禁水12~15 h,待确定所有动物血样满足检测要求后再进行喂饲。具体检测内容包括:
①血液学指标:用EDTA-K2管采集血液样本2.0 mL,分别测定血红蛋白(HGB)、平均红细胞血红蛋白(MCH)、平均红细胞血红蛋白浓度(MCHC)。
②凝血指标:用柠檬酸钠管采集血样2.0 mL,分别测定凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)。
③血清生化及电解质指标:用全血管采集全血3.0~5.0 mL,分别测定γ-谷氨酰转肽酶(GGT)、甘油三酯(TG)、血糖(GLU)、乳酸脱氢酶(LDH)、肌酸磷酸激酶(CK)、肌酐(CREA)。
2.6.7 系统解剖和肉眼观察
4 周给药结束后,各组动物自第1 只开始,间隔选择处死3 只,共12 只。4 周恢复期结束后,处死剩余全部动物。各动物在解剖前需禁食不禁水12~15 h,按解剖顺序吸入异氟烷麻醉,待动物达到深度麻醉后,大腿双侧股动脉放血处死。解剖时,肉眼观察家兔外观、毛色、给药局部皮肤、外生殖器等有无异常,脏器有无病变。再按由上至下,从外到内的顺序分别摘取动物各脏器和解剖前大体观察时发现的异常组织、肿块等。脏器摘取后,除眼(连带哈氏腺)用改良Davidson's 液固定、睾丸及附睾用Bouin 液固定外,其余各脏器、组织置于10%中性缓冲福尔马林液中固定,以备后续切片、HE染色和组织病理学检查。
2.6.8 脏器重量、系数及脏脑比
解剖后,分别称取脑、心、肝、脾、肺脏、左肾、右肾、肾上腺(双侧)、胸腺、左睾丸、右睾丸、附睾(双侧)、子宫、卵巢及输卵管的重量,并计算肾脏(左肾+右肾)、睾丸(左睾丸+右睾丸)的重量和脏器系数,若脏器系数组间比较有显著性差异或有明显改变,则需进一步计算脏器与脑重比值。
2.6.9 骨髓象检查
摘取家兔胸骨,制作骨髓标本,对骨髓细胞指标进行计数检查。具体检查指标如下:
①粒细胞系统:原始粒、早幼粒、中性粒(中幼、晚幼、杆状、分叶核)、嗜酸性粒(中幼、晚幼、杆状、分叶)和嗜碱性粒(中幼、晚幼、杆状、分叶);
②红细胞系统:原始红、早幼红、中幼红和晚幼红;③其他:淋巴细胞、单核细胞、浆细胞、巨核细胞、增生程度、粒细胞系统/有核红以及细胞形态。
2.7 数据统计处理方法
采用SPSS 24.0统计软件进行数据统计分析。计量数据组间比较时,正态分布、方差齐性检验结果显著(P>0.05)的数据,采用LSD检验,非正态分布或方差不齐的数据以及加权后的半定量指标均采用非参数检验(即Nonparametric Test 中的K-independent samples 进行Kruskal~Wallis H检验),以P<0.05代表差异具有统计学意义。恢复期各组动物样本数量较少(♀/♂:2/2),故在统计时仅计算平均值及标准差,不进行显著性差异分析。
3 结果
3.1 各组家兔一般症状、体征情况
在给药及恢复期间观察可见,辅料对照组及紫连膏低、中、高剂量组各动物皮毛光泽、行为活动、精神状态、呼吸情况等均无异常,一般状况良好,由此表明紫连膏对家兔一般症状、体征无明显影响。
3.2 各组家兔给药局部皮肤刺激性症状比较
给药期间,辅料对照组各动物给药部位皮肤一般状况良好,无红斑、水肿等局部皮肤刺激性反应症状。紫连膏高剂量组个别动物在给药第4 周出现轻度水肿皮肤刺激反应症状。从观察到红斑或/和水肿刺激反应症状的动物数量和严重程度上看,紫连膏的皮肤刺激性具有随着剂量增加和给药时间持续而随之增加的趋势。停药恢复期,出现红斑或/和水肿刺激反应的动物症状逐渐减轻,恢复正常。同时,从皮肤刺激反应评分统计结果可见,紫连膏高剂量组最高平均积分为0.90,处于轻度刺激性(0.5~2.99)的标准范围内。由此可见,紫连膏高剂量对家兔完整皮肤表现出轻度刺激性。因恢复期剩余动物局部皮肤刺激性反应症状评价的平均积分,不能代表各组动物皮肤刺激性反应的整体情况,故以总积分表示。见表4。
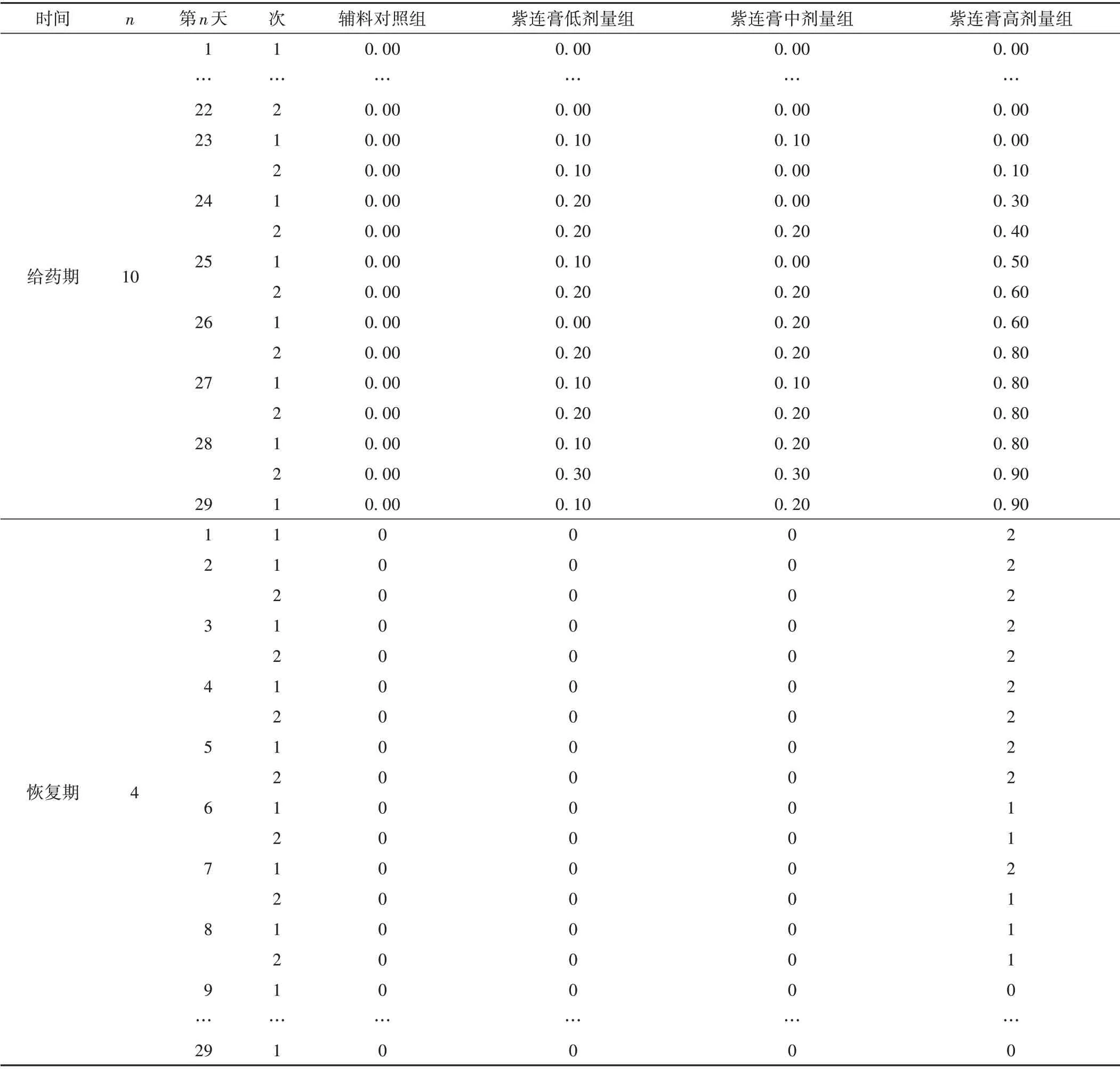
表4 各组家兔给药局部皮肤刺激性反应症状积分比较
3.3 各组家兔摄食量评价
给药前、给药期及恢复期间,各组动物摄食正常,可见紫连膏对家兔的摄食量无明显影响。
3.4 各组家兔体质量及增长幅度比较
给药前饲养期,紫连膏低、中、高剂量组动物平均体质量均有明显增加,表明动物处于正常生长状态。给药期间,紫连膏各剂量组动物平均体质量呈现先降后升的状态,其增长幅度均以给药后第1 周下降最为明显,至给药第4 周结束,各组动物平均体质量及增长幅度均明显增加。恢复期,各动物体质量生长正常。与辅料对照组比较,给药第4 周时紫连膏低、中剂量组增长幅度明显更高(P<0.01),其原因主要是由于动物对给药方式的应激反应所致,之后随着给药时间的不断增加,动物逐渐适应,应激反应逐渐消失。因此可以认为紫连膏对家兔体质量无明显影响。见图1。
3.5 各组家兔体温情况比较
紫连膏各剂量组给药前、给药期以及恢复期间,每只家兔的体温实测值及其平均值均在正常体温范围(38.0~39.8 ℃)[14-15]内波动,其中给药第2周时,以辅料对照料组和紫连膏高剂量组下降较为明显,近于正常体温下限38.0 ℃。与辅料对照组比较,紫连膏低、中剂量组体温明显更高(P<0.01)。出现该波动变化的原因推测为与给药容量相关,随着给药容量的增加,动物的应激反应随之增加,使体温出现明显下降,随着给药时间的持续,动物逐渐产生适应性,自身对体温调节作用增强,因此在给药期结束时,家兔体温接近给药前,恢复期结束时与给药前持平。在给药期结束时,各组平均体温均有所升高,恢复期间与给药前基本一致,因此可以认为紫连膏对家兔体温无明显影响。见图2。
3.6 各组家兔心电(ECG Ⅱ)指标比较
给药4周和恢复4周结束,紫连膏低、中、高剂量组ECG Ⅱ以振幅相关指标及RR 间期、心率(HR)指标波动较为明显,但从统计结果上看,各指标均无明显剂量-反应的规律性变化趋势。与辅料对照组比较,紫连膏低、中剂量组ST 偏移量明显偏低(P <0.05,P <0.01),但未见明显的异常ST 段正向或负向偏移和特征性形态学变化,因此认为产生以上明显波动变化的指标应与动物自身的生理波动直接相关,而与药物无明显相关性。由此可见紫连膏对家兔ECG Ⅱ各指标无明显影响。见表5。
表5 各组家兔心电指标比较(±s)
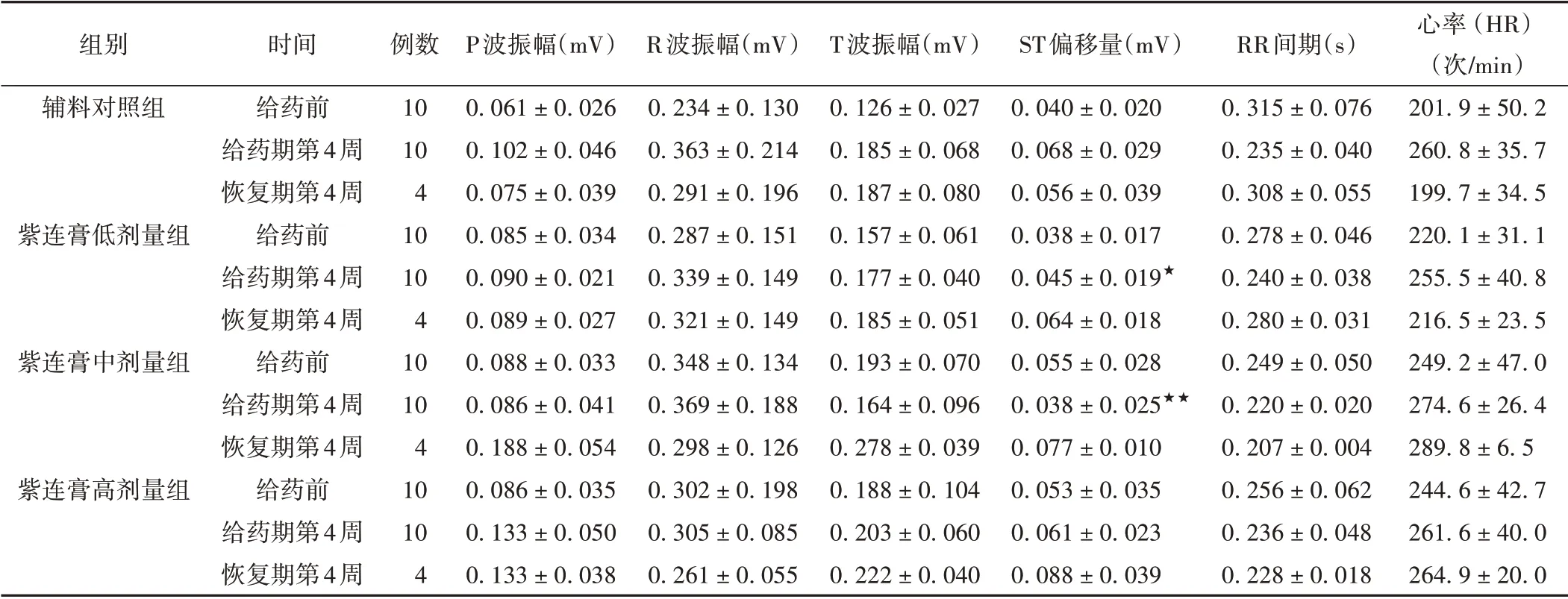
表5 各组家兔心电指标比较(±s)
注:与辅料对照组比较,★P <0.05,★★P <0.01。
组别辅料对照组紫连膏低剂量组紫连膏中剂量组紫连膏高剂量组心率(HR)(次/min)201.9±50.2 260.8±35.7 199.7±34.5 220.1±31.1 255.5±40.8 216.5±23.5 249.2±47.0 274.6±26.4 289.8±6.5 244.6±42.7 261.6±40.0 264.9±20.0时间给药前给药期第4周恢复期第4周给药前给药期第4周恢复期第4周给药前给药期第4周恢复期第4周给药前给药期第4周恢复期第4周例数10 10 4 10 10 4 10 10 4 10 10 4 P波振幅(mV)0.061±0.026 0.102±0.046 0.075±0.039 0.085±0.034 0.090±0.021 0.089±0.027 0.088±0.033 0.086±0.041 0.188±0.054 0.086±0.035 0.133±0.050 0.133±0.038 R波振幅(mV)0.234±0.130 0.363±0.214 0.291±0.196 0.287±0.151 0.339±0.149 0.321±0.149 0.348±0.134 0.369±0.188 0.298±0.126 0.302±0.198 0.305±0.085 0.261±0.055 T波振幅(mV)0.126±0.027 0.185±0.068 0.187±0.080 0.157±0.061 0.177±0.040 0.185±0.051 0.193±0.070 0.164±0.096 0.278±0.039 0.188±0.104 0.203±0.060 0.222±0.040 ST偏移量(mV)0.040±0.020 0.068±0.029 0.056±0.039 0.038±0.017 0.045±0.019★0.064±0.018 0.055±0.028 0.038±0.025★★0.077±0.010 0.053±0.035 0.061±0.023 0.088±0.039 RR间期(s)0.315±0.076 0.235±0.040 0.308±0.055 0.278±0.046 0.240±0.038 0.280±0.031 0.249±0.050 0.220±0.020 0.207±0.004 0.256±0.062 0.236±0.048 0.228±0.018
3.7 各组家兔血液学及凝血指标比较
给药第4周,紫连膏低、中、高剂量组的PT和APTT指标表现出相对明显的升高/下降趋势变化,且具有明显的剂量-反应趋势。与辅料对照组比较,紫连膏高剂量组PT明显升高(P<0.01);紫连膏中剂量组MCHC明显下降(P<0.01),但无明显剂量-反应的规律性变化趋势,且在其相关的HGB、MCH指标中也未见相应的变化趋势,因此推测MCHC指标在紫连膏中剂量组中产生的显著性差异存在一定的偶然性,虽有统计学意义,但可认为无明显的生理学意义。恢复期间,紫连膏各剂量组指标也未见明显异常变化。综合上述结果认为,紫连膏对家兔PT和APTT凝血指标可能存在一定的影响,且具有一定的剂量-反应关系。见表6。
表6 各组家兔血液学及凝血指标比较(±s)
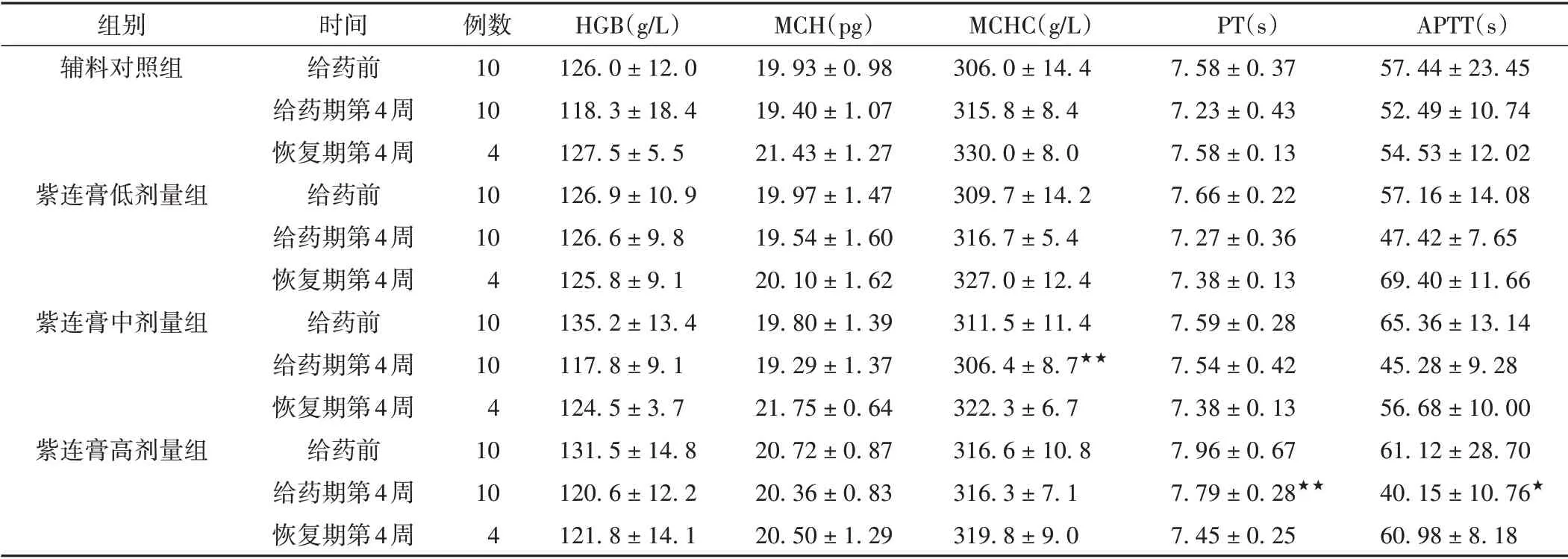
表6 各组家兔血液学及凝血指标比较(±s)
注:与辅料对照组比较,★P <0.05,★★P <0.01。
APTT(s)57.44±23.45 52.49±10.74 54.53±12.02 57.16±14.08 47.42±7.65 69.40±11.66 65.36±13.14 45.28±9.28 56.68±10.00 61.12±28.70 40.15±10.76★60.98±8.18组别辅料对照组紫连膏低剂量组紫连膏中剂量组紫连膏高剂量组时间给药前给药期第4周恢复期第4周给药前给药期第4周恢复期第4周给药前给药期第4周恢复期第4周给药前给药期第4周恢复期第4周例数10 10 4 10 10 4 10 10 4 10 10 4 HGB(g/L)126.0±12.0 118.3±18.4 127.5±5.5 126.9±10.9 126.6±9.8 125.8±9.1 135.2±13.4 117.8±9.1 124.5±3.7 131.5±14.8 120.6±12.2 121.8±14.1 MCH(pg)19.93±0.98 19.40±1.07 21.43±1.27 19.97±1.47 19.54±1.60 20.10±1.62 19.80±1.39 19.29±1.37 21.75±0.64 20.72±0.87 20.36±0.83 20.50±1.29 MCHC(g/L)306.0±14.4 315.8±8.4 330.0±8.0 309.7±14.2 316.7±5.4 327.0±12.4 311.5±11.4 306.4±8.7★★322.3±6.7 316.6±10.8 316.3±7.1 319.8±9.0 PT(s)7.58±0.37 7.23±0.43 7.58±0.13 7.66±0.22 7.27±0.36 7.38±0.13 7.59±0.28 7.54±0.42 7.38±0.13 7.96±0.67 7.79±0.28★★7.45±0.25
3.8 各组家兔血清生化及电解质指标比较
给药第4 周,紫连膏低、中、高剂量组的GGT、CK和LDH指标明显下降,TG、CREA、GLU指标明显升高。与辅料对照组比较,紫连膏高剂量组的GLU 明显升高,LDH 明显下降(P<0.05),且具有明显的剂量-反应关系,因此认为紫连膏对GLU 和LDH 指标可能有一定影响,且以高剂量组较为明显。见表8。
3.9 各组家兔骨髓象情况
给药和恢复期结束后,紫连膏低、中、高剂量组动物有核细胞增生活跃,粒细胞系统、红细胞系统以及其他细胞形态及计数均无明显异常,表明紫连膏对家兔骨髓细胞增生及分化无明显影响。
3.10 各组家兔系统解剖观察情况
给药及恢复期结束后解剖,除肉眼可见部分动物胸腺及睾丸、附睾外形体积偏小外,各动物脏器无其他明显异常。从出现脏器异常的数量和性别差异上看,各剂量组间无明显的剂量-反应趋势和性别-反应趋势,且与辅料对照组亦无明显差异,结合组织病理学检查结果,综合分析认为上述异常脏器应为动物本身自发病变或生理改变所致,非药物对动物产生的影响。
3.11 各组家兔脏器重量和脏器系数情况
给药结束后,紫连膏各剂量组动物胸腺、子宫、附睾(总)、左睾丸、右睾丸和睾丸(总)脏器重量及系数均表现出相对较大的波动变化,但无明显的规律性。结合组织病理学检查结果,综合判断认为该脏器重量及系数的波动变化应属于动物自身原因所致,与药物影响无明显相关性。因此认为紫连膏对家兔各脏器重量和系数无明显影响。
3.12 各组家兔组织病理学检查
给药及恢复期结束后,紫连膏各剂量组有个别动物出现肾小管坏死、间质炎细胞浸润,肝细胞空泡变性、肝细胞小灶状坏死,睾丸生精小管上皮空泡变性、生精细胞层次不全,附睾内未见成熟精子,以及给药部位棘细胞层增厚和真皮层炎细胞浸润组织病理改变,且在给药结束后,组织病理学检查发现个别动物出现胸腺萎缩和给药部位皮下肉芽组织形成的病理改变。上述镜检结果与解剖时肉眼观察的异常脏器结果具有完全对应关系。分析以上病变产生的原因,主要与动物自发性病变(肾脏、肝脏、睾丸和附睾)、年龄/健康状态(胸腺)和反复涂擦操作物理刺激(棘细胞层增厚和皮层炎细胞浸润)直接相关。病变检查结果见图3。从各剂量观察到的病变程度和发生比例结果可见,组间无明显的剂量-反应趋势,与辅料对照组比较,紫连膏各剂量组给药后病变结果差异也无统计学意义(P>0.05),可见紫连膏对家兔的各组织器官无明显影响。
表7 各组家兔血清生化及电解质指标比较(±s)
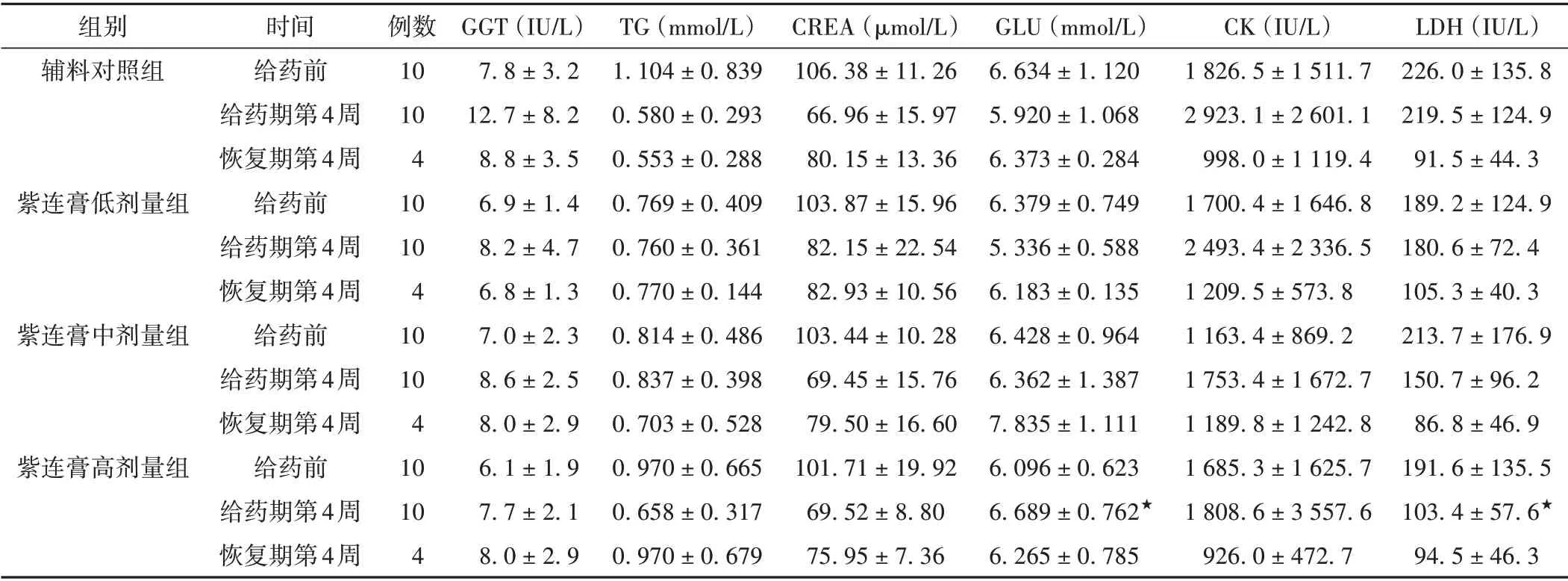
表7 各组家兔血清生化及电解质指标比较(±s)
注:与辅料对照组比较,★P <0.05。
组别辅料对照组紫连膏低剂量组紫连膏中剂量组紫连膏高剂量组LDH(IU/L)226.0±135.8 219.5±124.9 91.5±44.3 189.2±124.9 180.6±72.4 105.3±40.3 213.7±176.9 150.7±96.2 86.8±46.9 191.6±135.5 103.4±57.6★94.5±46.3时间给药前给药期第4周恢复期第4周给药前给药期第4周恢复期第4周给药前给药期第4周恢复期第4周给药前给药期第4周恢复期第4周例数10 10 4 10 10 4 10 10 4 10 10 4 GGT(IU/L)7.8±3.2 12.7±8.2 8.8±3.5 6.9±1.4 8.2±4.7 6.8±1.3 7.0±2.3 8.6±2.5 8.0±2.9 6.1±1.9 7.7±2.1 8.0±2.9 TG(mmol/L)1.104±0.839 0.580±0.293 0.553±0.288 0.769±0.409 0.760±0.361 0.770±0.144 0.814±0.486 0.837±0.398 0.703±0.528 0.970±0.665 0.658±0.317 0.970±0.679 CREA(µmol/L)106.38±11.26 66.96±15.97 80.15±13.36 103.87±15.96 82.15±22.54 82.93±10.56 103.44±10.28 69.45±15.76 79.50±16.60 101.71±19.92 69.52±8.80 75.95±7.36 GLU(mmol/L)6.634±1.120 5.920±1.068 6.373±0.284 6.379±0.749 5.336±0.588 6.183±0.135 6.428±0.964 6.362±1.387 7.835±1.111 6.096±0.623 6.689±0.762★6.265±0.785 CK(IU/L)1 826.5±1 511.7 2 923.1±2 601.1 998.0±1 119.4 1 700.4±1 646.8 2 493.4±2 336.5 1 209.5±573.8 1 163.4±869.2 1 753.4±1 672.7 1 189.8±1 242.8 1 685.3±1 625.7 1 808.6±3 557.6 926.0±472.7
4 讨论
紫连膏组方科学精妙,制剂工艺简单可靠,用于治疗烧伤、烫伤和银屑病等皮肤性疾病,疗效显著。本研究依据《药物重复给药毒性研究技术指导原则》进行试验设计,给药采用与临床拟用途径一致的外用涂擦方式,实验系统选择体型小、性情温和、易于驯化捉取、皮肤较薄且敏感、背景资料丰富、来源充足的家兔作为研究对象[16-17],并以临床上治愈烧伤、烫伤的拟用周期2周为依据,设置重复给药周期4周。
在剂量设计上,重复给药毒性试验原则上至少应设低、中、高3 个剂量组,以及1 个溶媒(或辅料)对照组;原则上要求高剂量使动物产生明显的毒性反应,低剂量等于或高于动物药效剂量或临床使用剂量的等效剂量,中剂量应结合毒性作用机制和特点在高剂量和低剂量之间设立,以考察毒性的剂量-反应关系[18]。结合开展完成的以50.0 mg/cm2最大单位面积剂量的皮肤单次毒性和重复给药7 d 毒性试验无明显毒性反应的研究结果,综合考虑本重复皮肤给药毒性试验设置,以50.0 mg/cm2作为每次皮肤涂擦给药的高剂量,以临床拟使用的15.0 mg/cm2剂量作为低剂量,并选择处于低、高剂量之间的32.5 mg/cm2作为中剂量。
在研究过程中,通过观察一般症状、体征,评价摄食量,测量体质量、体温、ECGⅡ、脏器重量,计算脏器系数,检查血常规、血清生化及电解质、骨髓象,以及解剖后的组织病理学等方法手段,考察紫连膏对完整皮肤家兔可能产生的毒性反应情况,并将局部毒性安全性评价中的药物刺激性试验整合其中[19-21],一并进行考察。结果表明,与辅料对照组比较,可见PT 和GLU(紫连膏中、高剂量组)明显升高,APTT 和LDH 明显下降,且表现出一定的剂量-反应关系。其中,紫连膏高剂量组的GLU 和LDH 比较,具有统计学意义(P<0.05),PT具有极显著统计学意义(P<0.01)。
关于家兔给药部位的刺激性,从局部皮肤刺激反应观察结果可见,紫连膏各给药组家兔皮肤均观察到红斑,紫连膏高剂量组甚至有水肿出现,利用“皮肤刺激反应评分标准”和“皮肤刺激强度评价标准”对动物给药局部刺激反应情况进行评价,认为紫连膏高剂量组涂擦部位皮肤达到轻度刺激性的标准。通过组织病理学检查结果可见,各剂量组给药部位皮肤不同几率地出现真皮层炎细胞浸润和棘细胞层增厚的病理改变,病变程度及发生比例无明显规律,其发生率、病变程度经组间比较差异无统计学意义(P>0.05),故认为紫连膏对家兔给药部位皮肤无组织病理学意义上的皮肤刺激性。通过分析,虽肉眼观察评价及组织病理学检查均表明部分动物给药部位皮肤均存在一定的刺激症状反应,但由于皮肤产生的刺激反应较轻,仅在肉眼评价上表现出轻度刺激性,还尚未达到排除操作产生的刺激因素外的组织病理学刺激性病变因素的组间差异程度,故两种方法获得的评价结果具有一定的差异。因此,从皮肤刺激的评价标准判断,认为紫连膏高剂量可能对家兔涂擦部位皮肤产生轻度刺激性。
综上所述,在本试验条件下,紫连膏以终剂量50.0 mg/cm2(剂量为8.33 g/kg,相当于人临床最大拟用剂量的3.1 倍)给药4 周,可对涂擦部位皮肤产生轻度刺激。在临床应用中,完整皮肤经长期重复涂擦给药后,应重点监测凝血指标和LDH、GLU 指标的变化,以及涂擦部位皮肤刺激反应情况。另外,通过上述紫连膏的功能主治,且无破损皮肤的使用禁忌,故推测其在破损性皮肤疾病中也可使用,因此本团队关于紫连膏对破损皮肤重复给药毒性安全性也进行了研究,安全性评价结果将在另外一篇文章中进行报道。
