家蚕Piwi亚家族基因的克隆、表达及进化分析
2022-09-22刘飞玲洪喜雄彭睿智肖花美
刘飞玲,廖 珍,洪喜雄,彭睿智,肖花美*,李 飞
(1.宜春学院生命科学与资源环境学院,江西省作物生长发育调控重点实验室,江西宜春 336000;2.浙江大学昆虫科学研究所,杭州 310058;3.南京农业大学植物保护学院,南京 210095)
非编码RNA (non-coding RNA,ncRNA)一度被认为在生物体内无功能,随着研究的深入,研究人员发现ncRNA在生物体内不可或缺,依据其生物起源、大小、长度和功能等,可将ncRNA分为microRNAs (miRNAs)、小干扰RNA (siRNAs)、piwi-RNAs (piRNAs)等,广泛参与细胞增殖、分化、发育、繁殖、病毒防御等生理生化过程(Setoetal.,2007;Ku and Lin,2014;Ponnusamyetal.,2017;Ozataetal.,2019)。Argonaute蛋白家族是RNA沉默复合体(RNA-induced silencing complex,RISC)的重要组成部分,在生物体内高度保守(Carmelletal.,2002;Jamesetal.,2005;Hocketal.,2007),其组织特异性和定向性决定了不同非编码RNA的表达和功能(Ponnusamyetal.,2017)。依据不同物种间的序列同源性和功能区域,Argonaute蛋白家族可分为AGO亚家族(与拟南芥ArabidopsisthalianaAGO1同源)、PIWI亚家族(与黑腹果蝇DrosophilamelanogasterPiwi同源)和WAGO亚家族。在细胞质中,AGO与miRNA和siRNA相互作用促进转录后基因的沉默(Valdmanisetal.,2012;Volleretal.,2016)。而piRNA 3′端甲基化修饰的2′-氧基团只与AGO家族的PIWI亚家族相结合,沉默转录元件(Coxetal.,1998;Girardetal.,2006;Klenovetal.,2011),调控基因表达,在哺乳动物中还可以抑制逆转录转座子的表达(Ponnusamyetal.,2017)。piRNA与PIWI在细胞质中结合后转移至细胞核(Saitoetal.,2010),形成的复合体根据定位以及伴侣蛋白的不同而产生不同的功能(Ponnusamyetal.,2017),对于受精(Dingetal.,2013;Rooversetal.,2015)、维持生殖干细胞自我更新(Peteretal.,2005;Palakodetietal.,2008)、胚胎发育(Manietal.,2014;Navarroetal.,2015;Rooversetal.,2015)、神经突触可塑性(Rajasethupathyetal.,2012)、代谢过程(Jonesetal.,2016;Henaouietal.,2017)、组织修复及再生(Rinkevichetal.,2010;Rizzoetal.,2014)等过程具有重要作用。
PIWI结构域是Argonaute蛋白中重要的功能结构域,位于Argonaute蛋白的羧基端,由400~600个氨基酸残基组成。在哺乳动物(Aravinetal.,2006;Girardetal.,2006;Grivnaetal.,2006;Lauetal.,2006)、线虫Caenorhabditiselegans(Batistaetal.,2008;Dasetal.,2008)、斑马鱼Daniorerio(Houwingetal.,2007)和昆虫的性腺(Saitoetal.,2006;Vaginetal.,2006)中均能检测到piRNA和PIWI,在哺乳动物的肺、心脏、肝、肾、脑、胰腺、卵巢、精巢中均有PIWI的表达(Setoetal.,2007;Ku and Lin,2014;Ponnusamyetal.,2017;Ozataetal.,2019)。在细胞质中,PIWI可以不通过piRNA的辅助,直接与受体或信号分子相互作用,调控转录后修饰进而调控靶标蛋白的生物功能(Zhangetal.,2012;Ponnusamyetal.,2017;Sivagurunathanetal.,2017;Tanetal.,2017)。Houwing等(2007)通过原位杂交发现,斑马鱼中的Piwi亚家族成员只在雌性成鱼的生殖细胞中有表达,在不含有生殖细胞的睾丸中无Piwi亚家族的成员的表达。Williams和Rubin等(2002)发现黑腹果蝇Drosophilamelanogaster中3个Piwi亚家族成员(Piwi、Aub、Ago3)也只在生殖细胞中表达,此外,Saito等(2006)通过Western blot等相关实验也同样证明黑腹果蝇中的3个Piwi亚家族蛋白只在精巢、卵巢和胚胎中表达,而在S2细胞中无表达。
目前对Piwi亚家族蛋白的研究主要集中于哺乳动物或模式生物,如黑腹果蝇、线虫等。昆虫占已知动物种类的60%以上,影响涉及医学、经济、农业等多个领域。但昆虫Piwi亚家族基因的生物学研究大多局限于黑腹果蝇(Lin and Spradling,1997;Setoetal.,2007;Ewen-Campenetal.,2013;Ku and Lin,2014;Ponnusamyetal.,2017;Ozataetal.,2019)。本文克隆了家蚕BombyxmoriPiwi亚家族蛋白基因全长,并对全长转录本进行了生物信息学分析;研究了Piwi亚家族蛋白基因在家蚕各个发育阶段和组织中的表达情况,为家蚕Piwi亚家族蛋白功能及piRNA的研究奠定基础,为理解家蚕piRNA和Piwi互作对家蚕生殖调控提供思路。
1 材料与方法
1.1 材料
供试虫源:家蚕(品系:7091)由中国农业科学院蚕业研究所提供,在温度26±1℃,相对湿度60%~75%,光周期16 L ∶8 D的条件下采用人工饲料及桑叶交替饲养。人工饲料购自山东省蚕业研究所烟台绿宝蚕用饲料厂。
试剂:RNA提取试剂TRIzol©Reagent,RACE反应试剂GeneRacer Kit购自Invitrogen (美国);Marker、Ex Taq DNA聚合酶、r-Taq DNA聚合酶、oligo (dT) 18、EcoRI限制性内切酶、Reverse Transcriptase M-MLV (RNase H-)、Universal Genomic DNA Extraction Kit Ver.3.0以及荧光定量试剂盒SYBR©Premix Ex Taq(Prefect Real Time) (TakaRa,中国北京)均购自宝日医生物技术(北京)有限公司;Plasmid Mini Kit I购自Omega Bio-Tek (美国);AxyPrep DNA Gel Extraction Kit购自Axygen (美国);M-MLV反转录酶和pGEM-T easy载体购自Promega (美国);PCR引物及3′RACE接头由上海生工生物工程有限公司合成。
1.2 方法
1.2.1Piwi亚家族蛋白的预测
从家蚕基因组数据库SilkDB下载家蚕的基因组序列,利用BioEdit软件建立本地家蚕基因组数据库。以“piwi mRNA,complete cds”为条件检索NCBI核酸数据库,筛选所有符合条件的序列并获取相应的蛋白质序列,通过在线blastp检测相似度。将13个已知的Piwi蛋白序列(BAA93706、BAA93705、AAN75583、NP_899181、ACH96370、XP_344106、AAC97371、BAC81341、BAC81343、BAC81342、AAD08705、ABO26294、NP_476734)作为检索序列,采用TBLASTN分别同源搜索家蚕基因组,参数保持缺省,E值小于1E-20。搜索家蚕EST序列时,匹配的序列必须满足如下的标准:(1)序列相似性超过95%;(2)匹配的序列长度必须大于160 bp。
1.2.2总RNA提取及cDNA第1链的合成
取25~30 mg家蚕卵(产下6 h内)、新蜕皮1~5龄幼虫、蛹和成虫;解剖5龄幼虫的精巢、卵巢、马氏管、丝腺、头和中肠共6种组织,每组样本准备3个重复。5 min液氮速冻后在预冷的匀浆器中迅速研磨至粉末状,采用TRIzol©Reagent,依据说明书提取总RNA。总RNA的浓度及纯度用分光光度计(Eppendorf公司,德国)检测,完整性经1%琼脂糖凝胶检测。参照Reverse Transcriptase M-MLV方法合成cDNA第一链。参照GeneRacer Kit试剂盒合成5′-RACE-Ready cDNA;参照M-MLV反转录酶转录方法,用3′RACE接头替换oligo (dT) 18,合成3′-RACE-Ready cDNA第一链,3′RACE接头序列同SMART RACE cDNA Amplification Kit 试剂盒中3′RACE接头序列(由上海生工合成)。
1.2.3引物设计
依据预测的家蚕Piwi蛋白基因序列,利用primer premier 5.0软件设计引物。5′RACE的引物根据GeneRacer kit要求设计;3′RACE的引物根据SMART RACE cDNA Amplification Kit要求设计。本实验中所用引物序列详见表1。
1.2.4家蚕siwi1和siwi2中间片段的克隆
依据预测的家蚕Piwi蛋白序列,利用primer premier 5.0软件设计引物(表1)进行cDNA片段克隆,以1.2.2中反转录cDNA为模板,使用ExTaqDNA聚合酶进行RT-PCR扩增,50 μL反应体系:10 ×ExTaq Buffer 5 μL,dNTPs (2.5 mmol/L) 4 μL,上下游引物(10 mmol/L)各2 μL,cDNA 0.5 μL,Taq酶0.25 μL,ddH2O 32.25 μL。siwi1RT-PCR反应条件:94℃ 5 min;35 cycles×【94℃ 50 s,55℃ 50 s,72℃ 2 min】;72℃ 10 min。siwi2RT-PCR反应条件:94℃ 5 min;3 cycles (每降1度) ×【94℃ 50 s,65℃~53℃梯度退火50 s,72℃ 2 min】;20 cycles ×【94℃ 50 s,50℃ 50 s,72℃ 2 min】;72℃ 10 min。siwi1全长PCR反应条件:94℃ 5 min;35 cycles ×【94℃ 50 s,53℃ 50 s,72℃ 3 min】;72℃ 10 min。产物采用2%琼脂糖凝胶进行电泳,再对目标产物进行回收,采用AxyPrep DNA Gel Extraction Kit纯化回收PCR产物,经连接、转化、提取质粒,酶切和测序双检测,确定目的基因正确插入质粒并表达,克隆产物送往南京博亚公司测序。
1.2.5家蚕siwi1和siwi2末端序列的RACE扩增
依据获得siwi1和siwi2中间片段信息,设计特异性引物(表1),进行RACE扩增,50 μL反应体系:10×ExTaq Buffer 5 μL,dNTPs (2.5 mmol/L) 4 μL,Mg2+(25 mol/L) 4 μL,UPM(通用引物,Universal Primer) 3 μL,GSP (10 mmol/L) (基因特异性引物,Gene-specific primer)1 μL,RACE cDNA 2 μL,Taq酶0.25 μL,ddH2O 30.75 μL。RACE PCR参照GeneRacer Kit试剂盒,RACE巢式PCR反应体系同前,仅将UPM换为nupm,GSP换为ngsp,反应产物稀释100倍作为模板。PCR产物回收纯化后,按照1.2.4中方法进行克隆测序。

表1 引物列表Table 1 List of the primers
1.2.6实时荧光定量PCR
取新生卵(Egg,产下6 h内)、初孵1龄幼虫(1 L)、新蜕皮2~5龄幼虫(2 L、3 L、4 L、5 L)、蛹和成虫共8个时期,以5龄期家蚕Piwi蛋白基因表达量为参照;取精巢、卵巢、马氏管、丝腺、头和中肠共6种组织,以丝腺中siwi2基因的表达量为参照。在1次反应中,重复3次;制备2套cDNA模板进行2个独立的荧光定量PCR反应。参照SYBR©Premix Ex Taq (Prefect Real Time)试剂盒,按照95℃预变性10 s;95℃变性5 s,60℃复性延伸31 s,40个循环进行定量反应。
1.2.7基因结构、保守结构域
通过NCBI中的ORFfinder分析克隆获得的Piwi亚家族蛋白基因的开放阅读框,并用Gene-Explorer软件推导其氨基酸序列;将Piwi亚家族蛋白基因的核酸序列与家蚕基因组数据库进行比对,分析其基因结构;利用推导的氨基酸序列搜索NCBI蛋白质保守结构域数据库(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),预测Piwi亚家族蛋白中保守的结构域。利用在线版的InterPro软件(http://www.ebi.ac.uk/interpro/)对蛋白序列进行分析(Mitchelletal.,2019)。
1.2.8进化分析
利用“Piwi”为关键词搜索NCBI,搜集已知的所有物种Piwi蛋白及其类似物Piwil,采用MEGA 7.0.26软件对获取的蛋白序列进行ClustalW序列比对,参数为默认值。根据邻接法(Neighbor-Joining)构建系统进化树,选择Poisson Correction(泊松修正)模型,自举检验Bootstrap重复1 000次。利用在线软件iTOL (Interactive Tree Of Life) (http://itol.embl.de/index.shtml)对进化树进行优化处理。
1.3 数据分析
运用2-ΔΔCT法对定量数据进行分析。
2 结果与分析
2.1 家蚕Piwi亚家族蛋白基因的预测与克隆
利用13个已知的Piwi亚家族蛋白在家蚕基因组中进行同源搜索,发现2个Piwi蛋白基因,分别命名为siwi1和siwi2。siwi1共1 482 bp;siwi2共1 530 bp。依据预测的siwi1和siwi2的基因序列,设计特异性引物进行PCR扩增。2%琼脂糖凝胶电泳获得2条PCR产物条带大小,其中1条约1 800 bp,另1条约600 bp,测序结果与预测的siwi1和siwi2基因序列比较分析发现,siwi1条带长度为1 835 bp,与预测大小相似,siwi2条带长度为581 bp,与预测结果差异较大(图1)。
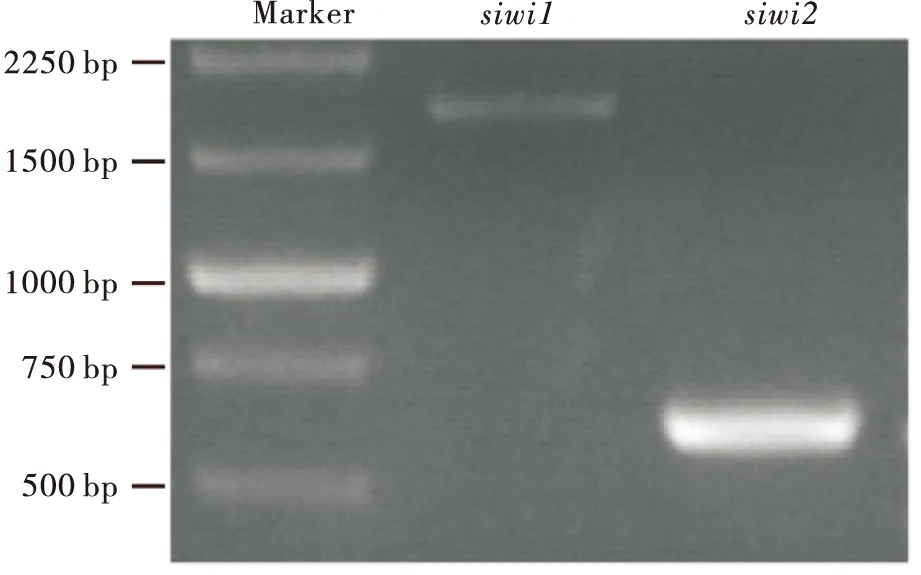
图1 家蚕两个Piwi亚家族蛋白基因的克隆Fig.1 Cloning of two Piwi subfamily genes from Bombyx mori
2.2 家蚕Piwi亚家族基因全长克隆
合成siwi1和siwi2的5′及3′RACE模板,采用持家基因ActinA3进行PCR反应检测模板质量。2%琼脂糖凝胶电泳检测显示,5′及3′RACE模板均能扩增获得ActinA3的阳性克隆产物(图2-A),表明模板质量可行。依据克隆获得的基因片段,利用RACE技术分别扩增siwi1和siwi2的5′和3′末端,2%琼脂糖凝胶电泳结果以及测序分析结果表明,成功克隆获得了siwi1和siwi2基因的3′末端cDNA,siwi1 3′末端cDNA序列长度为1 444 bp,siwi2 3′末端cDNA序列长度为305 bp,而仅有基因上游特异引物gsp或ngsp、仅有3′RACE下游通用引物upm或nupm以及没有模板的阴性对照blank中均不能检测到条带(图2-B,C)。但多次试验后仍不能克隆获得siwi1和siwi2的5′端序列,可能是合成的5′RACE模板中,siwi1和siwi2基因的表达丰度不高。将克隆获得的siwi1和siwi2基因序列与RACE技术扩增获得的siwi1和siwi2序列分别进行拼接,拼接后的siwi1序列长度为2 746 bp,siwi2序列长度为823 bp。为获取siwi1基因cDNA序列全长,利用已知Piwi亚家族蛋白搜索家蚕EST序列,找出所有可能的siwi1基因的EST序列,再将拼接获得的siwi1序列与搜索出来的EST序列比对,拼接出siwi1基因cDNA序列全长。最后,对获得的siwi1基因序列设计特异性引物进行PCR扩增,产物经2%琼脂糖凝胶电泳检测,测序分析结果显示该条带为目标基因siwi1,而只有单引物F和R以及无模板的阴性对照中均不能检测到相同条带(图2-D),该基因cDNA全长3 277 bp (GenBank登录号:MH780859),包含部分5′UTR、编码899个氨基酸的完整开放阅读框和一段576 bp的3′UTR,其中3′UTR包含一段由40个腺苷酸组成的poly A尾巴,比对NCBI发现该基因为BmPiwi。而siwi2基因,仅获得了823 bp的转录本序列,编码239个氨基酸,其中3′UTR区共103 bp,含有一段由30个腺苷酸组成的poly A尾巴,比对NCBI发现该基因为BmAgo3。
2.3 家蚕Piwi亚家族蛋白的特征分析
与家蚕基因组序列比对发现,BmPiwi基因含有18个外显子和17个内含子,其中第2个内含子跨度最大,共3 828 bp(表2)。通过搜索NCBI蛋白质保守结构域数据库发现,BmPiwi含有Argonaute蛋白家族特征性的保守结构域:PAZ(位于氨基酸序列的316~451残基)和PIWI(位于氨基酸序列的437~879残基)(图2-E),在PAZ结构域中包含小RNA3′位点,PIWI结构域中包含5′RNA引导链锚定位点和剪切三联体活性位点(DDH:Asp-Asp-Asp/His/Glu/Lys)。
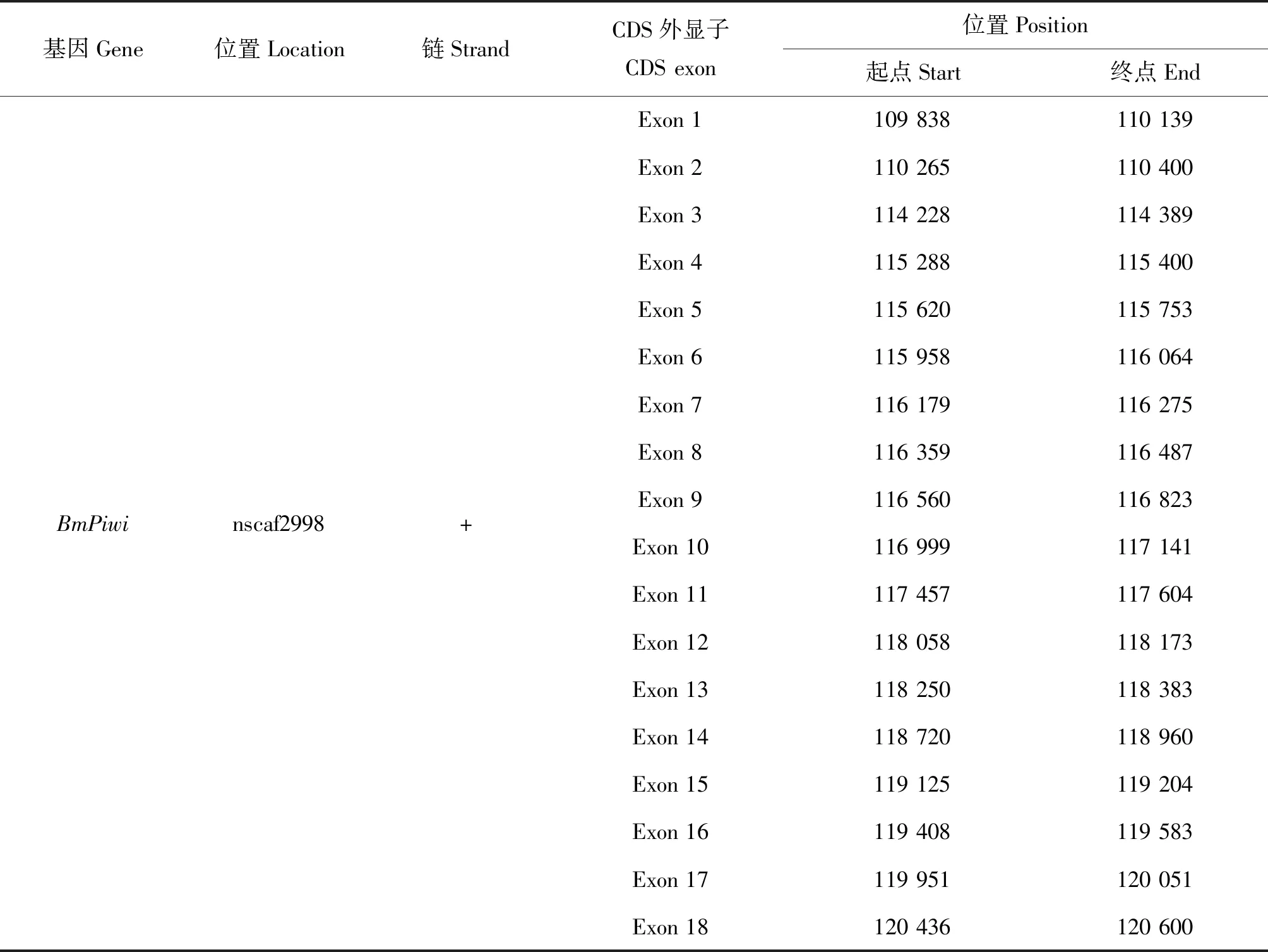
表2 BmPiwi在染色体上的定位Table 2 Chromosome locations ofBmPiwi
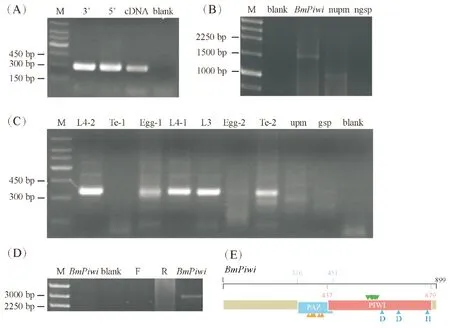
图2 家蚕2个Piwi亚家族蛋白基因的全长克隆及结构分析Fig.2 Full lengthcloning and structure analyzing of two Piwi subfamily genes from Bombyx mori注:(A),PCR扩增持家基因Actin A3检测模板质量;(B),RACE扩增BmPiwi 3′末端;(C),RACE扩增BmAgo3 3′末端,分别以精巢、卵、3龄幼虫、4龄幼虫的3′RACE模板进行RT-PCR扩增;(D),PCR扩增BmPiwi全长;(E),BmPiwi结构与分析。Te,精巢;L,幼虫;-1,第一组;-2,第二组;M,Marker;blank,不含模板的阴性对照;gsp/ngsp,单上游基因特异引物;upm/nupm,单下游3′RACE通用引物;F,上游引物;R,下游引物;金黄色小三角代表核酸给合位点,绿色小三角代表5′RNA引导链锚定位点,蓝色小三角代表剪切三联体活性位点(DDH:Asp-Asp-Asp/His/Glu/Lys)。Note:(A),Check the RACE templates with housekeeping gene Actin A3 by PCR;(B),3′RACE PCR of BmPiwi;(C),3′RACE PCR of BmAgo3,RT-PCR performed with 3′RACE templates of testis,egg,3rd instar larvae and 4th instar larvae,respectively;(D),PCR amplification of BmPiwi full-length;(E),Structure analysis of BmPiwi. Te,Testis;L,Larvae;-1,First group;-2,Second group;M,Marker;blank,Negative control without template;gsp/ngsp,Single upstream gene-specific primer;upm/nupm,Single downstream 3′RACE universal primer;F,Upstream primer;R,Downstream primer;Golden yellow triangles represented nucleic acid binding sites;Green triangles represented 5′NA guiding strand anchoring sites;Blue triangles represented shear triplet activity site (DDH:Asp-Asp-sp/His/Glu/Lys).
2.4 家蚕Piwi亚家族蛋白的进化分析
构建不同物种PIWI亚家族蛋白系统发生树,进化分析结果(图3)显示,PIWI亚家族蛋白在进化过程中高度保守,PIWI亚家族蛋白依据不同家族类别进行聚集,在脊椎动物中尤为明显。PIWI亚家族蛋白主要存在于脊椎动物中,约占已知PIWI蛋白的一半,在鱼类和哺乳动物中存在多种不同类型的PIWI-like蛋白(Piwil),如人Homosapiens和猴子Macacamulatta中发现4种Piwil蛋白。昆虫已知的PIWI蛋白数仅次于脊椎动物。家蚕Piwi亚家族蛋白与乳草长蝽Oncopeltusfasciatus、黑腹果蝇、柑橘小实蝇Bactroceradorsalis、优雅蝈螽Gampsocleisgratiosa、斯氏按蚊Anophelesstephensi、褐飞虱Nilaparvatalugens的PIWI蛋白以及东亚飞蝗Locustamigratoria的PIWI2和PIWI3蛋白亲缘关系最近,和三疣梭子蟹Portunustrituberculatus的PIWI2和PIWI3同为一支,与脊椎动物的PIWIL2和刺胞动物的PIWI相似性也较高(图3)。
家蚕AGO3蛋白与小菜蛾AGO3亲缘关系最近,与西方玉米根虫Diabroticavirgiferavirgifera、白蜡窄吉丁Agrilusplanipennis的AGO3及东亚飞蝗Locustamigratoria的PIWI1同属一支,与橘小实蝇的AGO3同属一总支;与海绵动物和刺胞动物的PIWI蛋白以及栉水母门动物的海醋栗Pleurobrachiabachei的PIWI蛋白相似性也较高(图3)。AGO蛋白的种类明显多于PIWI蛋白,丹参Salviamiltiorrhiza中AGO蛋白总数可达10种之多,尘螨Dermatophagoidesfarinae和番茄Solanumlycopersicum中的AGO蛋白也有8种,陆生植物AGO蛋白种类普遍较多。同一类型的AGO蛋白呈同一聚簇,与PIWI蛋白呈现明显的分支,但家蚕AGO3蛋白以及锥虫属的AGO1蛋白却与PIWI蛋白同属一支(图3)。

图3 已知Piwi和Ago亚家族成员系统发生树Fig.3 Phylogenetic tree of known Piwi and Ago subfamily members注:Piwil,Piwi like protein,Piwi类似蛋白。Note:Piwil represented Piwi like protein.
2.5 家蚕Piwi亚家族蛋白基因的时空表达谱
2.5.1家蚕Piwi亚家族蛋白基因的组织表达情况
采用持家基因ActinA3进行RT-PCR反应检测模板质量,2%琼脂糖凝胶电泳检测结果(图4-A)显示样品无基因组污染,模板质量可行,BmPiwi和BmAgo3基因在卵巢中条带稍暗,在精巢中的条带明显亮于其他组织,表明家蚕2个Piwi亚家族蛋白基因在卵巢中的表达弱于精巢组织,在精巢组织中高表达。此外,在家蚕的消化道、头部也能检测到BmPiwi的表达,但在马氏管和丝腺中表达量较低。在家蚕头部中也能检测到BmAgo3基因的表达。
荧光定量PCR结果(图4-B)显示,在选取的不同组织中,BmPiwi基因的表达量都明显高于BmAgo3基因(4~13倍)。BmPiwi和BmAgo3两个基因在丝腺中的表达量最低,在消化道中的表达量略高于丝腺,但略低于马氏管;在精巢中的表达明显高于其他组织,是丝腺中的10倍;在卵巢中表达仅次于精巢,是丝腺中的6倍。BmPiwi在头部的表达量略低于卵巢,高于丝腺、马氏管和消化道,但BmAgo3基因在头部表达丰度最高。
2.5.2家蚕Piwi亚家族蛋白基因不同发育时期表达情况
荧光定量PCR检测家蚕2个Piwi亚家族蛋白基因在不同发育时期的表达(以5龄家蚕Piwi表达量作为参照),结果(图4-C)显示,家蚕2个Piwi亚家族蛋白基因在新生卵(产下6 h内)中表达量最高,分别是5龄期的44倍(BmPiwi)和32倍(BmAgo3)。进入幼虫期,其表达量迅速下降,整个幼虫期均维持低表达状态,蛹期开始表达量迅速上升。BmPiwi在4龄期表达量最低,5龄开始表达量略微回升,成虫期表达量上升至5龄期的15倍,达到不同发育阶段BmPiwi表达量的第2高点。BmAgo3与BmPiwi表达趋势大体相同,但不同于BmPiwi的是,BmAgo3在2龄期表达量明显高于1龄期,且在5龄期表达量达到最低。此外,BmAgo3在蛹期表达量为5龄期14倍,并持续该状态至成虫期。

图4 家蚕两个Piwi亚家族蛋白基因在不同组织和不同发育阶段的表达Fig.4 Detection of BmPiwi and BmAgo3 expression in different tissues and different developmental stages of silkworm注:(A),RT-PCR检测BmPiwi和BmAgo3在家蚕不同组织中的表达情况;(B),定量PCR检测BmPiwi和BmAgo3在家蚕不同组织中的表达情况;(C),定量PCR检测BmPiwi和BmAgo3在家蚕不同发育阶段的表达情况。MT,马氏管;AT,消化道;SG,丝腺;He,头;Te,精巢;Ov,卵巢;L,幼虫。Note:(A),Detection of BmPiwi and BmAgo3 expression in different tissues of silkworm by RT-PCR;(B),Expression profile of BmPiwi and BmAgo3 expression in different tissues of silkworm by quantitative real time PCR;(C),Expression profile of BmPiwi and BmAgo3 in different developmental stages of silkworm by quantitative real time PCR.MT,Malpighian tube;AT,Alimentary tract;SG,Silk gland;He,Head;Te,Testis;Ov,Ovary;L,Larvae.
3 结论与讨论
1997年在果蝇卵巢中发现了第1个Piwi亚家族蛋白(Lin and Spradling,1997),此后发现Piwi亚家族蛋白与小RNA结合形成piRNA,作为沉默复合体的核心蛋白而行使功能(Aravinetal.,2006)。研究表明PAZ和PIWI结构域是该家族蛋白的保守结构域,PIWI结构域具有与RNaseH相似的结构特征(Parkeretal.,2004;Songetal.,2004;Rivasetal.,2005;Rashidetal.,2007)。小鼠Musmusculus神经元中的PIWIL1结构域分析表明,PIWIL1中的RNA结合PAZ结构域和RNA加工PIWI结构域对其在神经元迁移中不可或缺(Zhaoetal.,2015)。本研究克隆获得了BmPiwi基因的全长,分析发现其包含PAZ和Piwi结构域。进化分析结果显示,BmPiwi与BmAgo3在不同物种中高度保守,但不同类型的Piwi及Piwi类似物Piwil聚集在不同的分支中,可能是因为Piwi亚家族蛋白具有功能多样性。例如生殖干细胞Piwil2的异位表达与肿瘤干细胞的发育相关,同时也是修复各种遗传毒物诱导的DNA损伤过程所必需的(Yinetal.,2011);Piwil3在各种癌症中过表达,可以促进胃癌细胞的增值、转移和侵袭;在生殖细胞中表达的PIWIL4,在精子发生的第一阶段起重要作用,同时也是转录沉默所必需的(Munozetal.,2014)。BmPiwi与BmAgo3在进化树中处于不同分支,距离相对较远,推测可能是由于功能不同所致。
早期研究表明PIWI蛋白在生殖细胞中表达,并参与生殖细胞的发育、维持、分裂和分化(Coxetal.,1998)。Piwi突变可以导致果蝇雌雄生殖干细胞的增殖能力消失(Lin and Spradling,1997)。近期研究显示,Piwi可以通过激活表观遗传的调节、沉默转座子和维持染色质结构来保护生殖细胞,同时也参与包括细胞增殖、分化和生存在内的许多重要生物过程(Ponnusamyetal.,2017)。本研究检测了家蚕BmPiwi与BmAgo3的发育表达谱,发现BmPiwi与BmAgo3在新生卵中高表达,在1龄幼虫中表达量都显著下降,BmPiwi表达量维持下降趋势至4龄幼虫达到最低值,而BmAgo3在2龄时表达量出现回升,但3龄开始表达量再次下降,到5龄达到最低值。与Alfons Navarro等人(Navarroetal.,2015)对人肺胚胎发生阶段的Piwil mRNA表达分析结果相似,PIWIL1在7周胚胎中高表达,并在随后的6~13周表达量显著下调,而PIWIL2在8周时表达水平出现回升持续到10周后再次下降。Zhao等(Zhaoetal.,2015)利用原位杂交实验分析发育中的小鼠脑中PIWIL1 mRNA表达情况,结果显示PIWIL1在胚胎13周高表达,随后表达量显著下调。对果蝇的相关研究显示,Piwi是果蝇卵巢生殖干细胞维持和分化必须的核糖核蛋白,PIWI可以通过抑制体细胞小生境(由临近生殖干细胞的细胞组成)中的c-FOS的表达从而调控生殖干细胞功能和卵巢体细胞的细胞组织,组织形态和产卵(Coxetal.,1998;Kleinetal.,2016)。由此推测家蚕piwi亚家族蛋白基因在卵期高表达对细胞的分裂分化具有重要作用。
PIWI/piRNA的动态表达模式对于哺乳动物卵子发生以及早期胚胎发生都有着显著的影响,但即使在相同器官中,发挥功能的Piwi也不尽相同。例如,PIWIL1和PIWIL2在成人卵巢卵母细胞中高表达,胚胎卵母细胞中只有PIWIL2高表达(Rooversetal.,2015),而牛卵巢仅表达PIWIL1,但是在提取的牛卵泡卵母细胞中却发现成熟的卵母细胞特异性强烈表达PIWIL3(Rooversetal.,2015)。此外,小鼠MIWI在新生卵巢中高表达,随着卵巢的成熟表达量下调,而在成年小鼠的初级卵泡、次级卵泡以及卵母细胞中都可以检测到MIWI的表达,表明Piwi在卵细胞中高表达,且与卵母细胞的成熟与激活息息相关(Dingetal.,2013)。本研究在家蚕卵巢中检测到BmPiwi与BmAgo3的高表达,BmPiwi表达量显著高于BmAgo3,推测是由于BmPiwi在家蚕卵巢中起主要作用。PIWI对于雄性生殖也具有重要作用,对突发性非梗阻性无精子症患者的研究证实HIWI2 (PIWIL4)是正常精子发生第一时期所必须的,HIWI2基因遗传多态性与精子形成和男性不育密切相关(Zeeba Kamaliyanetal.,2017;Rewiczetal.,2018)。对家蚕精巢Piwi基因的检测显示,BmPiwi的表达量明显高于BmAgo3,推测其在精巢中起主要作用。
除生殖器官精巢和卵巢,Piwi基因在多个器官中均有分布,包括脑、心脏、肺、肝脏、肾脏、胰腺、胃等,除病理情况,Piwi在生殖器官中表达量普遍偏高。本研究发现BmPiwi在家蚕头部的表达量仅次于卵巢,而BmAgo3在头部表达量最高,在家蚕预蛹期阶段,BmAgo3的表达量明显高于BmPiwi,家蚕的发育受激素和神经双重调控,而头部是昆虫感觉中心,故BmPiwi和BmAgo3在头部高表达。研究显示,小鼠PIWIL1可以通过调控微管相关蛋白来调控神经元的极化与迁移(Zhaoetal.,2015),因此,BmAgo3很可能对家蚕神经元起调控作用。此外,在家蚕消化道、丝腺、马氏管均检测到BmPiwi和BmAgo3基因的表达,马氏管中的表达量略高于消化道和丝腺,但在家蚕幼虫期BmPiwi和BmAgo3的表达量均不高。已有文献报道,Piwi家族成员参与代谢活动,例如,果蝇中Piwi和piRNA参与脂肪代谢过程(Jonesetal.,2016),小鼠Piwi蛋白及其相关的piRNA通过控制β细胞调控糖类代谢(Henaouietal.,2017),但对于消化道、丝腺和马氏管,Piwi基因可能并不发挥主要调控作用。Kawaoka等对家蚕Piwi情况进行了探究,但其主要关注于精子发生和卵子形成,且采用的是芯片数据分析Piwi家族的表达谱,未进行RT-PCR验证(Kawaokaetal.,2008)。本研究补充了家蚕Piwi亚家族基因从卵至成虫时期表达情况,并探究了Piwi基因在各个组织中的表达情况,对家蚕的后续研究具有指导作用。
