对虾池塘养殖过程中纤毛虫的动态变化及改性粘土防控初探*
2022-09-21刘正宇俞志明宋秀贤曹西华
刘正宇 俞志明 宋秀贤 曹西华
对虾池塘养殖过程中纤毛虫的动态变化及改性粘土防控初探*
刘正宇1, 2, 3, 4俞志明1, 2, 3, 4①宋秀贤1, 2, 3, 4曹西华1, 2, 3, 4
(1. 中国科学院海洋研究所海洋生态与环境科学重点实验室 山东青岛 266071; 2. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室山东青岛 266237; 3. 中国科学院大学 北京 100049; 4. 中国科学院海洋大科学研究中心 山东青岛 266071)
纤毛虫是一类单细胞原生动物, 部分类群是对虾池塘养殖过程中的病害生物。该研究跟踪了2020年7~10月凡纳滨对虾()养殖过程中纤毛虫的动态变化情况, 分析了多种环境因素对其动态变化的影响。通过现场喷洒, 发现改性粘土对纤毛虫有一定的控制作用; 故结合室内实验, 探究了改性粘土对水体中纤毛虫的去除作用和机制。研究结果表明, 虾池内纤毛虫及2~5 µm微微藻的密度变化呈现出一定的捕食-被捕食关系, 后者可通过食物丰歉的方式上行控制纤毛虫; 虾池水温为20~25 °C时更易于纤毛虫生长; 纤毛虫偏好较低盐度的环境。在养殖过程中使用改性粘土调控水质会在一定程度上降低水体中的纤毛虫的密度; 进而通过室内实验初步探讨了改性粘土对水体中的纤毛虫的去除作用及机制, 发现氧化复合改性的硫酸铝改性粘土(MC II)可有效去除纤毛虫, 该研究将为对虾养殖过程中纤毛虫病害的防控工作提供参考。
对虾养殖; 环境因素; 纤毛虫动态变化; 改性粘土; 防控方法
纤毛虫是一类高度分化、结构复杂的原生动物, 其在水体中的危害作用较大, 有些种类可引发赤潮或通过产生毒丝泡或黏丝泡来危害水体(宋微波等, 1993)。病害性纤毛虫可引发对虾病害, 产生致死效应(Azam, 1983; 吴淑波, 2009); 或抑制对虾游动、摄食, 阻碍其生长(刘志玲等, 2014; 邓楠楠, 2018)等。故病害性纤毛虫被认为是一类在对虾养殖过程中危害较大的生物类群, 且一些经济型养殖生物如鱼类、海参、鲍鱼等也极易受到纤毛虫的侵害(王印庚等, 2005; 徐力文等, 2005; 陈建国等, 2007; 王孟华, 2012)。研究表明纤毛虫病害会显著影响养殖生物质量, 甚至会导致其大量死亡, 进而造成巨大经济损失(宋微波等, 2003; 王娅宁等, 2009)。
如何防控纤毛虫病害一直是水产养殖领域的研究热点。研究表明, 化学试剂, 如甲醛、高锰酸钾等, 可以有效灭杀水体中的纤毛虫(邱彦涛, 2003; 宫春光等, 2007); 一些抗生素能有效抑制纤毛虫的种群动态变化(杜明磊, 2020); 使用当归、黄连等中草药制成的中药组合物也可有效治疗纤毛虫引发的病害(袁进洪, 2019)。但在养殖环境中滥用药物、试剂, 会产生诸多不良效应, 如破坏水体中生物群落的稳定性、胁迫养殖动物、使病害生物产生抗药性等, 甚至会诱发其他病害(俸成荣, 2017)。
凡纳滨对虾()在世界范围内被广泛养殖, 是我国主要的对虾养殖品种(Lu, 2015; 张庆起等, 2017)。近年, 国内外对纤毛虫的分类鉴定及致害作用的研究较多, 而缺乏对虾养殖水域中纤毛虫动态变化的相关研究。本研究跟踪研究了2020年7~10月凡纳滨对虾养殖过程中纤毛虫的动态变化, 考察了各种环境因素的影响; 发现国内外普遍使用的有害藻华应急处置材料——改性粘土对纤毛虫有一定的控制作用(Yu, 2017); 结合室内实验, 探究了改性粘土对水体中纤毛虫的去除作用和机制, 以期为对虾养殖过程中纤毛虫病害的防控提供参考。
1 材料与方法
1.1 现场调查跟踪与样品采集
2020年6~10月, 本研究于山东省东营市三角洲养殖繁育有限公司进行凡纳滨对虾养殖实验, 虾池(118°9′E, 37°5′N), 面积约1 000 m2, 实际养殖水体面积约为800 m2, 池底自外向内逐渐凹陷, 中心深度约为1.5 m, 池水体积约为1 000 m3。于6月29日投入健康的凡纳滨对虾苗50 000尾(体长约1.6 cm, 湿重约0.035 g)合计约2.4 kg, 即养殖密度约50尾/m3, 养殖过程中每日投喂固体饵料, 于8月29日至9月20日额外投喂活体饵料(大卤虫), 持续培养至10月17日收获。
本研究对整个培养周期内对虾养殖池塘的各项水质指标进行了持续检测, 每日在现场使用便携式多功能水质仪(EXO, 美国YSI公司)测定水体的温度()、盐度()、溶氧(DO)、pH值、叶绿素浓度等水质参数; 每日定点采集10 L表层水样, 装于聚乙烯桶中, 立即取部分水样使用鲁哥试剂固定, 于0.1 mL计数框在显微镜下对粒径为2~5 μm的微微藻进行计数。
纤毛虫样品的采样和分析按照《Zooplankton Methodology Manual》(Harris, 2000)进行, 即采集100 mL水样装入塑料样品瓶中, 用1 mL鲁哥试剂固定, 于0.1 mL计数框在显微镜下对纤毛虫进行计数; 每隔4~5日采集用于进行18S rDNA测序的样品(在纤毛虫密度剧烈波动时加采一次), 水样先经过200 μm的无菌筛绢过滤后, 经0.22 μm孔径的聚碳酸酯膜过滤, 样品富集于滤膜上, 将过滤后的滤膜置于无菌冻存管中, 立即放入液氮中速冻, 保存于-80 °C冰箱中, 后续将用于分析纤毛虫的群落结构。将滤膜送至公司(基迪奥, 广州), 经提取和纯化样品膜上的环境样品DNA后, 使用1%琼脂糖凝胶电泳检测提取DNA的质量。待DNA样品合格后进行检测, 18S rDNA使用通用引物528F(5′-GCGGTAATTCCAGC TCCAA-3′)和706R(5′-AATCCRAGAATTTCACCTC T-3′)进行目的基因扩增, 分别构建测序文库, 使用MiSeq 测序仪(PE250, 美国Illumina公司)测序, 分析用数据库为SILVA, 聚类方式为USEARCH, 依据OUT值分析测序结果。参照相关分类学文献(Kofoid, 1929; 宋微波等, 1997; 林晓凤, 2005; 徐大鹏, 2007; 伊珍珍, 2009; 高珊, 2011; 张武昌等, 2012; 刘安, 2014; 张武昌等, 2016; 张雪等, 2017; 黄平平等, 2017; 邵晨等, 2020)对纤毛虫进行种类鉴定。
1.2 纤毛虫防控实验
1.2.1 实验材料 天然粘土为高岭土, 取自江苏吴县。本研究所使用的聚合氯化铝改性粘土(MC I)(俞志明等, 1994)、硫酸铝改性粘土(MC II)(Liu,2016)、高岭土与六水合氯化铁混合粘土(MC V) (质量比为高岭土︰六水合氯化铁=5︰1)三种改性粘土依次分别是用聚合氯化铝(PACs)、硫酸铝及三氯化铁改性天然粘土制成。氧化复合改性粘土为将单过硫酸氢钾(纯度98%,萨恩化学技术有限公司)作为第三组分搭配使用的改性粘土。
1.2.2 现场实验 针对虾池水质较差(透明度较低、浊度较高、富营养化)、赤潮暴发(叶绿素保持较高水平)、纤毛虫密度较高等情况,本研究将于虾池喷洒改性粘土,作业方式为将粘土同海水制成混浆后使用高压喷枪在虾池内均匀喷洒。粘土用量参照4~ 10 t/km2(俞志明等,1994), 基于上述用量开展的毒理实验显示改性粘土对对虾的运动、存活均无影响。在喷洒前及喷洒后24 h时定点采集水样,后续处理方式同1.1。
1.2.3 室内纤毛虫去除实验 (1) 考察了高岭土、MC I、MC II及MC V四种粘土在不同用量下对纤毛虫的去除作用。去除实验在100 mL比色管中进行, 实验用纤毛虫(密度约4 000 cells/mL)取自对虾养殖池塘表层水, 将海水混匀后分别加入比色管, 粘土浓度梯度设定为: 0.2、0.3、0.5、0.8 g/L, 按照相应用量加入改性粘土后颠倒混匀三次, 设置空白对照, 且每组均设两个平行。在改性粘土添加后3 h处取样观察, 记录纤毛虫密度, 并参照以下公式计算纤毛虫去除率:

(2) 基于(1)实验结果, 探究单过硫酸氢钾改性对MC II及MC V改性粘土去除纤毛虫的影响。纤毛虫来源同上, 实验在100 mL比色管中进行, 将水样混匀后分别加入比色管。设定粘土用量为0.3 g/L, 单过硫酸氢钾浓度梯度设定为: 0、1、5、10 mg/L, 按照相应用量加入改性粘土后颠倒混匀三次, 设置阴性对照及空白对照, 且每组均设二个平行。在改性粘土添加后3 h处取样观察, 去除率计算方法同(1)。
1.3 数据统计与分析
使用Excel及Origin 2019作图, 各指标以平均值±标准差(mean ± SD)表示; 数据统计分析使用IBM SPSS Statistics 19中的one-way ANOVA及独立样本检验进行, 其中显著性水平设置为0.05,<0.05即认为差异显著,<0.01认为差异极显著; 数据相关性分析使用IBM SPSS Statistics 19中的双变量相关性分析, 采用Pearson系数进行计算, ||=0~0.2认为两者无相关性, ||=0.2~0.4认为两者存在弱相关性, ||=0.4~0.6认为两者中等程度相关, ||=0.6~0.认为两者存在强相关性, ||=0.8~1认为两者存在极强相关性。
2 结果
2.1 纤毛虫的动态变化与影响因素
2.1.1 对虾养殖池塘中纤毛虫的群落结构 纤毛虫的种群动态变化基于18S rDNA测序分析结果, 图1为对虾养殖过程中, 8月4日至10月17日纤毛虫的种类组成及密度的动态变化。8月份对虾养殖池塘中的纤毛虫密度较低, 8月4日主要以旋唇纲(Spirotrichea)纤毛虫为主, 其中环毛目(Choreotrichida)纤毛虫占比较高, 砂壳目(Tintinnida)的开孔真铃虫(Eutintinnus apertus)初时占比较高, 之后逐渐减少; 8月4~18日, 线口纲(Litostomatea)栉毛科(Didiniidae)的纤毛虫占比由2.63%升至70.34%, 逐渐取代旋唇纲成为优势种; 8月28~29日纤毛虫种类变化显著, 栉毛科占比升至57.61%, 取代拟盗虫科(Strombidinopsidae)成为优势种; 自9月起纤毛虫密度显著升高, 种类组成则变得单一, 栉毛科纤毛虫及两种膜袋虫[银灰膜袋虫()、海洋膜袋虫()]先后被淘汰, 两种拟盗虫[沈氏拟拟盗虫()和最小拟拟盗虫()]分别在9月9日及9月11日成为优势种; 银灰膜袋虫的占比在9月9~13日逐渐攀升, 由3.72%升至61.31%, 成为优势种, 9月14日纤毛虫密度骤降至800 cells/mL, 直至9月中旬(14、17、18日)虾池中主要以沈氏拟拟盗虫为主; 自9月17日开始至10月17日纤毛虫种类多样性较高, 而密度较低, 9月24日缩颈桥柱虫()成为优势种, 9月27日主要由尾丝虫属()、游仆虫属()、拟拟盗虫属()以及砂壳目(Tintinnida)纤毛虫为主; 9月27日至10月13日沈氏拟拟盗虫占比逐渐提高并最终成为优势种, 海洋膜袋虫()在此期间始终保有一定的种群密度, 10月17日其占比近50%。
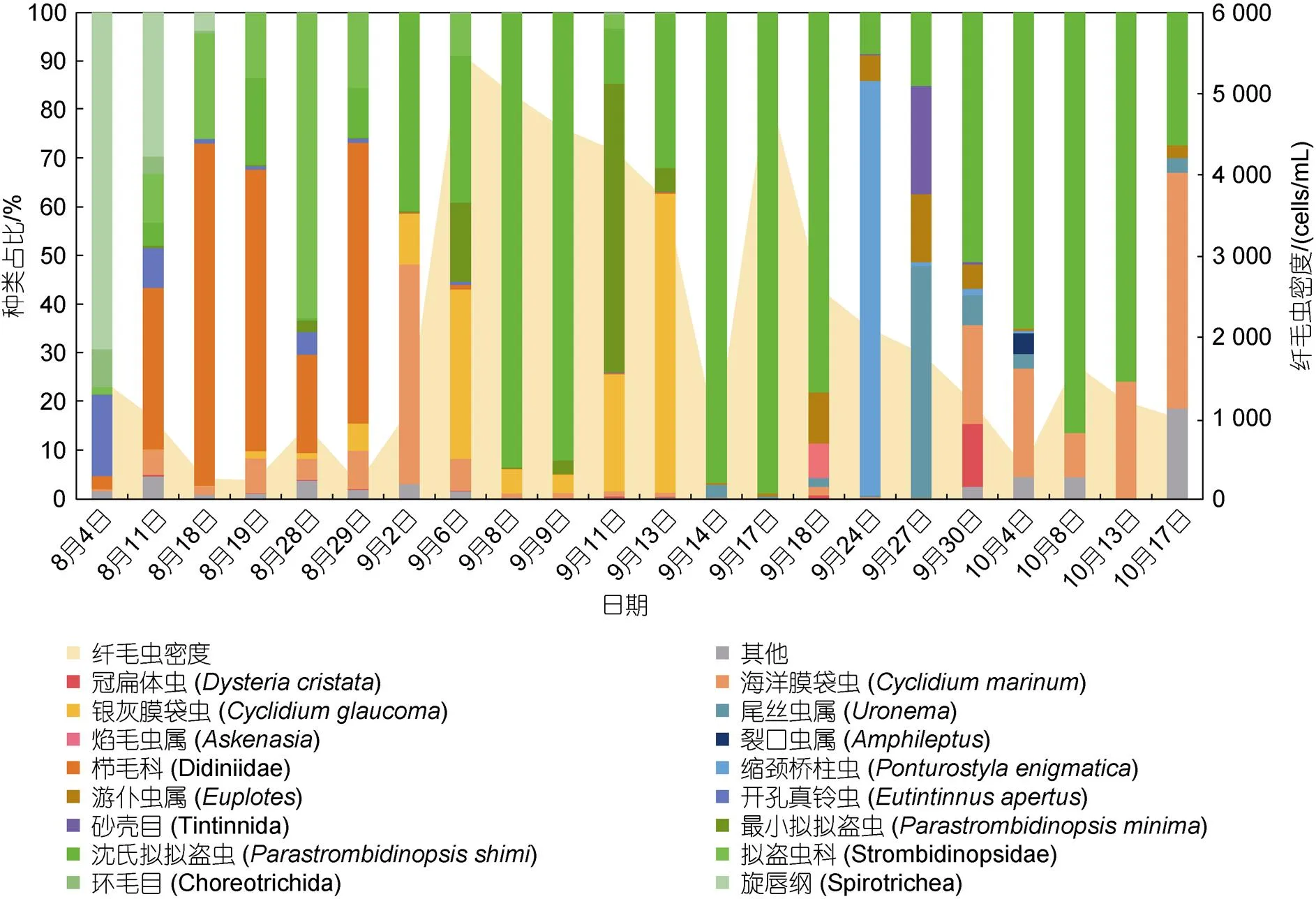
图1 对虾养殖池塘中纤毛虫的种类组成及密度变化
2.1.2 环境因素对纤毛虫动态变化的影响 自7月31日首次监测到纤毛虫以来, 对虾养殖池塘中的纤毛虫的密度呈现出先升高后降低的变化趋势, 本研究依据虾池中纤毛虫的密度水平, 将其动态变化划分为三个时期: 初期(7月31日至8月29日)、中期(8月30日至9月19日)及后期(9月20日至10月17日)。
纤毛虫食性复杂, 海洋浮游纤毛虫可以摄食较小的纤毛虫、硅藻、甲藻、聚球藻、原绿球藻和细菌等(张武昌等, 2016)。浮游微藻是对虾养殖池塘生态系的重要组成部分, 对维持对虾的健康成长有重要意义; 虾池中粒径约2~5 µm的微藻是同纤毛虫共现的重要类群, 其以绿藻、甲藻为主且正处于纤毛虫的滤食偏好范围内(0.2~20 μm微藻), 故其密度可对纤毛虫的动态变化产生一定的影响。另外, 温度、盐度、扰动等环境条件的改变会影响纤毛虫的摄食活动, 进而影响其动态变化(张武昌等, 2016)。本研究将就虾池的跟踪监测结果来阐释多种环境因素对纤毛虫动态变化的影响(图2)。
虾池中2~5 µm的微藻与纤毛虫的密度变化如图2a所示。初期较低的微藻密度, 使得纤毛虫密度水平一直保持在较低水平; 前、中期当纤毛虫密度保持在较高水平时, 微藻密度降低; 纤毛虫密度呈下降趋势时, 微藻密度又开始回升, 以上现象具有一定的滞后性, 纤毛虫密度低谷同微藻密度高峰往往间隔1~2日; 9月下旬纤毛虫密度骤降后, 后期微微藻对纤毛虫的上行控制使得纤毛虫密度同微藻密度呈强正相关关系(=0.634)(图2a)。综上所述, 纤毛虫及微微藻具有一定的捕食与被捕食关系。
自8月29日开始(中期)可以观察到纤毛虫密度的显著升高, 且其密度较其他两个时期均维持较高水平, 该期间投喂的活体饵料(大卤虫)应该引发该现象的因素之一, 监测结果显示中期时纤毛虫密度与投喂量呈正相关关系; 9月20日停止投喂后, 纤毛虫密度显著降低, 且之后也未产生密度高峰。
温度也是重要的环境因素(图2b), 初期水温较高(25~31 °C), 纤毛虫密度水平较低, 期间8月19~20日由于连续降雨导致水温骤降, 其后于8月22日纤毛虫密度达到顶峰; 中期水温在20~25 °C之间, 此时纤毛虫密度显著升高, 且长期保持较高水平; 后期纤毛虫密度显著降低, 9月底水温显著降低, 其中10月5~17日水温(13~16 °C)经历了一个先升高后降低的过程, 纤毛虫的密度虽略有波动但仍同水温变化趋势相符(=0.507); 即对虾养殖池塘中的纤毛虫偏好较高的水温, 且20~25 °C的水温较适宜其生长。
虾池的盐度先降低后升高, 在28~37之间波动(图2c)。前期纤毛虫密度较低, 水体盐度逐渐降低, 其中8月11~12日、8月15~16日、8月19~20日、8月26~28日由降雨等因素引发的盐度“V”字型波动,其后均可观察到纤毛虫的密度峰值, 二者的变化趋势呈现强负相关性(=-0.607); 中期纤毛虫密度较高, 该时期盐度较低约28~32; 后期9月25日以后盐度(32~35)的上升幅度较大, 纤毛虫保持较低的密度水平。
2.2 改性粘土对纤毛虫的控制作用
在对虾养殖过程中, 由于测序定种较慢、镜检鉴定难度较高等现实原因, 无法较为准确地实时监测纤毛虫种类, 且若观察到对虾染病往往为时已晚, 故养殖户一般会通过投加药品来降低纤毛虫总密度从而预防、减少对虾病害(宫春光等, 2007; 袁进洪, 2019; 杜明磊, 2020)。本研究基于上述情况, 尝试使用改性粘土对水体中的纤毛虫进行调控, 并跟踪检测了纤毛虫的密度变化趋势(图3), 发现改性粘土可有效抑制纤毛虫的生长, 前期在8月3、28日两个密度高峰喷洒的改性粘土均显著降低了纤毛虫密度; 中期适宜的环境条件使得纤毛虫密度急剧升高, 其增长曲线近“S”型, 该时期单日喷洒改性粘土(9月8日; 9月17日)亦可抑制纤毛虫的生长, 且本研究于8月31日至9月1日; 9月11~13日进行的连续喷洒, 可使纤毛虫密度骤降; 后期于9月27日及10月3日喷洒的两次改性粘土均有效遏制了纤毛虫密度的上升趋势, 在之后的1~2日内呈现出较强的抑制效果。
为检验改性粘土对纤毛虫的控制效用, 本研究在实验室内进行了纤毛虫去除实验。本研究选用天然粘土、MC I、MC II及MC V不同改性粘土对采自虾池的纤毛虫进行去除实验。结果表明, MC II及MC V两种改性粘土的纤毛虫去除能力均显著强于天然粘土; 除天然粘土外, 三种改性粘土在用量为0.8 g/L时对纤毛虫的去除率均可达到50%以上, 其中MC V可达80%左右; 用量为0.3 g/L时, MC II及MC V的去除率也可达50%左右(图4)。四种材料对纤毛虫的去除作用从强到弱依次为MC V、MC II、MC I、天然粘土。
为进一步提升改性粘土对纤毛虫的抑制作用, 本研究选用单过硫酸氢钾作为第三组分, 探究了氧化复合改性粘土对纤毛虫的去除效果。参照前期实验结果, 本研究使用去除效果较好的MC II和MC V, 设定粘土用量为0.3 g/L, 单过硫酸氢钾浓度梯度为0、1、5、10 mg/L, 结果如图5所示。单过硫酸氢钾作为一种消毒剂, 低浓度时对纤毛虫灭杀作用较弱, 5 mg/L 时去除率仅为47%, 高浓度时(10 mg/L)可达95%左右。经氧化复合改性后, 两种改性粘土对纤毛虫的去除率均显著提高: 单过硫酸氢钾浓度为1 mg/L时, 可使MC II去除率达66%, MC V较弱但效率也在50%左右; 当单过硫酸氢钾浓度为5 mg/L时, 两种改性粘土的去除率均提升至70%以上。综上, 单过硫酸氢钾可显著提升改性粘土对纤毛虫的灭杀效果。

图2 对虾养殖期内纤毛虫动态变化与微微藻密度(a)、温度(b)及盐度(c)的相关性
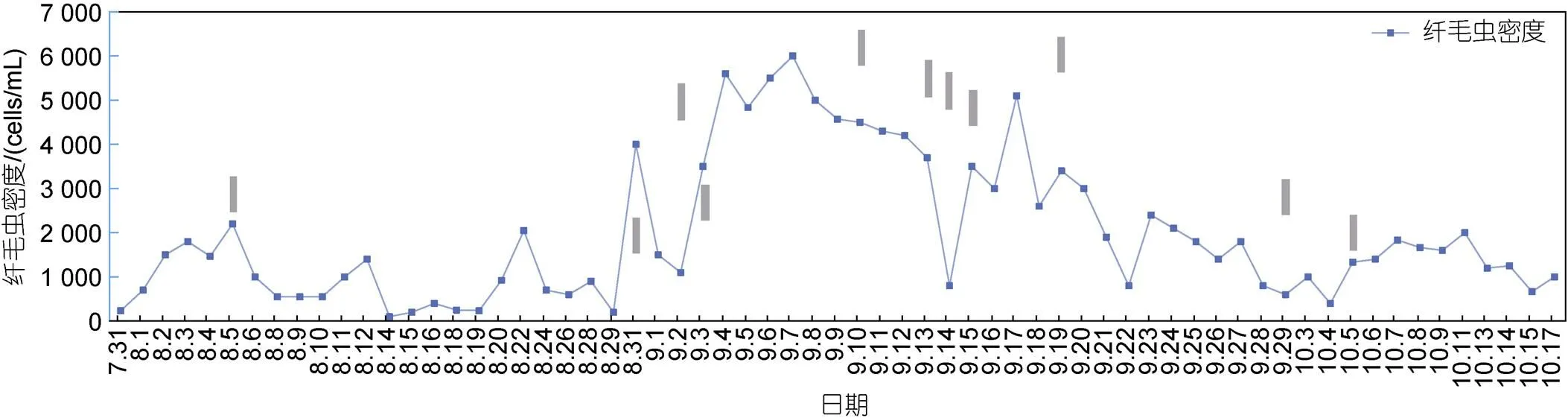
图3 对虾养殖池内改性粘土喷洒的主要时间点
注: 粘土喷洒工作由灰色加粗线条标出
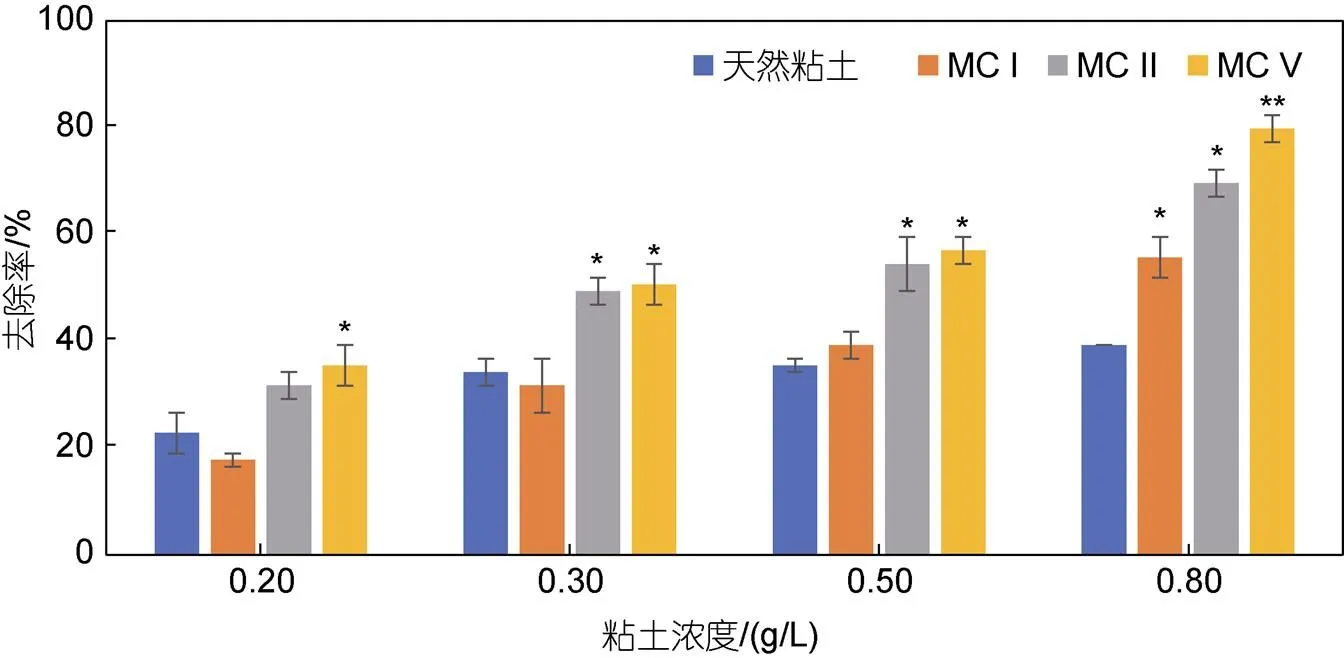
图4 四种粘土对纤毛虫的去除作用
注: *表示差异显著(<0.05), **表示差异极显著(<0.01)
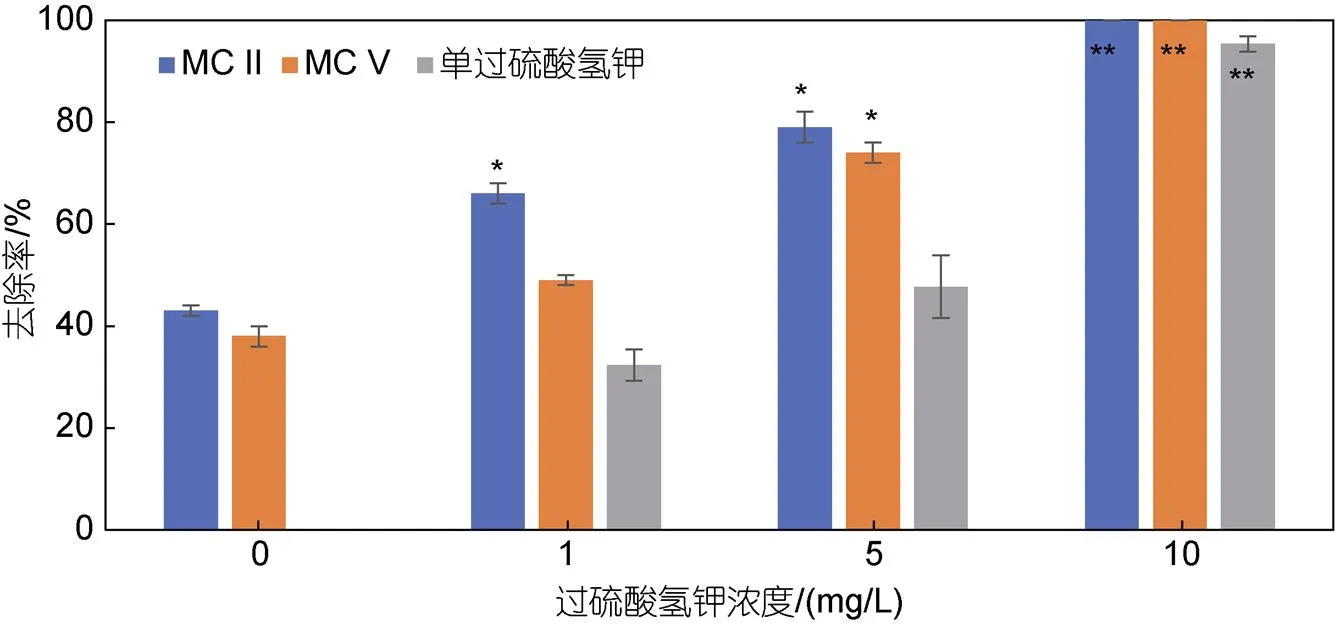
图5 单过硫酸氢钾改性的MC II及MC V对纤毛虫的去除作用
3 讨论
3.1 纤毛虫的动态变化特点
本研究依据在时间尺度上划分的三个时期, 跟踪监测了对虾养殖过程中纤毛虫的种类组成的动态变化, 并阐释了多种环境因素对纤毛虫动态变化的影响, 本研究亦对其中的主要环境因素的作用机制进行了初步探讨。
虾池中粒径约2~5 µm的微藻是同纤毛虫共享栖息环境的浮游生物, 且其正处于纤毛虫的滤食偏好范围内(0.2~20 μm微藻), 二者呈现一定的捕食与被捕食关系, 微微藻作为饵料可通过上行控制来影响纤毛虫的动态变化。
研究发现, 纤毛虫的摄食能力随温度梯度升高而增强(Rassoulzadegan, 1982); 且较高的温度可以有效缩短纤毛虫的世代时间, 提高其种群增长率(李承春等, 2010; 潘莹等, 2010); 故在耐受限度以内, 较高的温度有助于提高纤毛虫的有效积温速率, 加速其增殖(沈国英等, 2010)。结合本研究的监测结果, 即纤毛虫偏好较高的水温(20~25 °C)。
纤毛虫作为无细胞壁保护的原生动物, 其在高盐度水体中为维持自身渗透压平衡势必会消耗一部分能量, 从而减少用于增殖的能量; 且研究表明低盐度水体中, 蓝藻与绿藻易成为微微藻优势种, 硅藻则偏好高盐度(吴斌等, 2008; 陈辉煌, 2013); 纤毛虫的摄食手段主要为胞吞作用, 携带硅质外壳的硅藻较其他微微藻更难摄食, 故纤毛虫理应偏好较低的盐度环境。大规模降雨可显著影响水体的温度、盐度变化, 使其呈“V”字型波动, 引发水体环境的显著改变, 进而显著影响纤毛虫动态变化。通过本研究的跟踪监测, 发现在虾池水体的盐度在28~37之间波动, 且总体而言纤毛虫密度和盐度的变化趋势呈负相关关系。
综上所述, 虾池中纤毛虫的动态变化特点如下(图6): 初期虾池内的高盐度(32~37)水体、较高的水温(25~31 °C)以及较低的微微藻密度对纤毛虫产生持续性的胁迫, 其中几次连续大规模降水(8月11~12日、8月18~19日)导致水体温度、盐度骤降, 使得纤毛虫密度在几日内略有升高, 但总体而言初期纤毛虫密度较低。纤毛虫在适应环境的同时其群落内部也存在一定的演替过程, 该时期主要以旋唇纲(Spirotrichea)及线口纲(Litostomate)纤毛虫为主, 其下的两种纤毛虫(拟盗虫科(Strombidinopsidae)和栉毛科(Didiniidae), 与纲一一对应)持续竞争优势种, 开孔真铃虫()随日期占比递减的原因可能是其偏好前期较高的盐度, 且真铃虫和硅藻(偏高盐度)存在一定的互利共生关系(Gómez, 2007)。8月28日的粘土喷洒不仅显著降低了纤毛虫密度, 还使得栉毛科重新成为优势种群。
中期水体的温度(20~25 °C)、盐度(29~32)较前期温和, 微微藻密度逐渐攀升并维持较高密度水平, 且虾池每日额外投喂的活体饵料带来较高的营养物质外源输入, 使得纤毛虫密度的变化曲线近“S”型(图6中橙色曲线), 并持续保持较高的密度水平。本研究在该时期多次施用改性粘土, 有效地抑制了纤毛虫密度, 其中8月31日至9月1日及9月11至13日的两次连续性喷洒均显著灭杀了纤毛虫。中期纤毛虫种类组成较为单一, 两种拟盗虫科纤毛虫占比较高, 尤其是沈氏拟拟盗虫()对中期环境适应性较强, 其先后淘汰两种膜袋虫, 并于在9月8、9、14、17、18日成为优势种, 9月8、17日的喷洒结果显示改性粘土对其的控制作用较强。
后期纤毛虫密度骤降, 该时期于9月20日停止投喂活饵, 同时逐渐降低的水温(13~21 °C)及缓慢回升的盐度(32~35)持续抑制纤毛虫, 急剧降低的水温(最低约5 °C)使得纤毛虫在食物充足的情况下保持较低的密度水平。后期纤毛虫多样性提高, 缩颈桥柱虫()在9月24日成为优势种; 9月27日则以尾丝虫()为主, 尾丝虫属盾纤亚纲(Scuticociliatia)嗜污目(Philasterida)是一类在水产养殖中危害较大的致病纤毛虫(麻丽丹等, 2012; Du, 2019), 经改性粘土喷洒后, 在9月30日观察到其密度骤降, 且在后续观测中其种类占比均未超过5%; 10月4日水温骤降至15.19 °C, 此时首次观测到侧口目(Pleurostomatida)的裂口虫(), 这也同林晓凤(2005)描述的五种裂口虫生境温度(15~18 °C)相符; 直至10月17日停止观测, 海洋膜袋虫()逐渐取代沈氏拟拟盗虫()成为优势种。

图6 虾池中纤毛虫密度动态变化特点
3.2 改性粘土对纤毛虫控制作用的机制探讨
改性粘土絮凝法广泛应用于近海的有害赤潮治理(Yu, 2017), 纤毛虫的暴发性增殖或聚集本身也是一种“赤潮现象”。作为原生动物, 纤毛虫无细胞壁结构, 这使得其较大多数浮游微藻更易被灭杀; 虾池中的纤毛虫大多个体较小, 且表膜脆弱易破(张翠霞, 2011), 使其较相似粒径的多细胞浮游动物对环境胁迫的抵抗力较差(Twagilimana, 1998; Yan, 2007); 纤毛虫体表附生的纤毛易于攀附粘土颗粒, 其中砂壳类纤毛虫甚至会黏附水中颗粒物形成包覆自身的甲壳(张武昌等, 2012), 而较弱的运动能力(孙军等, 2001)也使其更易被粘土絮凝沉降。
高岭土是一类1︰1型主体呈层状结构的硅酸盐矿物, 其结构单元层由Al-O(OH)八面体和Si-O四面体组成, 表面呈弱电负性。微生物或粘土颗粒在含有电解质的水中其周围会形成双电层(马青山等, 1988), 溶液中离子强度越大, 越能够压缩双电层, 使得颗粒之间的排斥能降低, 增加有效碰撞几率, 促进颗粒絮凝(常青等, 1993; 邹华等, 2005)。改性剂(如无机铝盐、铁盐)一般为带正电荷或水解产物带正电荷的物质, 使粘土经改性处理后表面带正电, 从而增加粘土颗粒与微生物之间的静电作用、桥连作用和网捕作用, 提升粘土絮凝作用的效率(Yu, 2017; Metaxas, 2018)。MCII是经硫酸铝改性的高岭土(Liu, 2016), 在海水中粘土表面带正电, 硫酸铝水解消耗水体中的OH–降低水体pH的同时, 会产生絮凝作用较强的水解产物Al(OH)3及Al(OH)4-, 从而抑制水体中的纤毛虫; 而氯化铁的作用方式同硫酸铝类似, 其在改变粘土电负性的同时会水解产生絮凝能力较强的羟基铁离子(常青等, 1985; 王燕等, 2006; 常青, 2003), 协助粘土絮凝沉降水体中的纤毛虫。
去除实验结果表明氧化复合改性可显著提升改性粘土对纤毛虫的去除能力。单过硫酸氢钾是一种强氧化性的无机消毒剂(张文昭, 2001), 可用于饮用水消毒(李豪杰, 2017), 目前也广泛应用于养殖水域(王兵等, 2008)。单过硫酸氢钾可在水中经链式反应释放一系列能量、活性均较高的自由基等过氧化氢衍生物(Paetzold, 2011; 宋海鹏, 2012)。故单过硫酸氢钾可直接氧化灭杀微生物(Demple, 1983; Anipsitakis, 2008), 或通过其水解释放的活性物质间接损伤微生物(Waites, 1976; Dukan, 1996; Prütz, 1996; Ding, 2016)。
由此推测, 单过硫酸氢钾与MC II复合对纤毛虫的去除存在两方面的共同作用, 一方面可能是通过静电作用及桥连作用网捕水体中的纤毛虫, 改性剂(硫酸铝)水解产生絮凝作用较强的Al(OH)3及Al(OH)4-黏附在纤毛虫表面, 并携其向水体底部沉降; 另外, 单过硫酸氢钾直接氧化损伤纤毛虫的同时其水解产物作用于纤毛虫的细胞膜及胞内物质, 从而灭杀水体中的纤毛虫, 故单过硫酸氢钾与MC II复合后对纤毛虫去除效果的提升较为显著。
4 结论
(1) 在对虾养殖过程中, 纤毛虫的种群动态变化受多种因素影响: 20~25 °C是适宜纤毛虫生长的温度区间; 在纤毛虫与微微藻之间存在一定的捕食-被捕食关系, 后者可通过食物丰歉的形式上行控制纤毛虫; 大规模降水引发的温度、盐度等因素的改变会显著影响纤毛虫的动态变化。
(2) 改性粘土可以控制纤毛虫的密度, 且连续多日施用可有效抑制较高密度的纤毛虫; 在实验测试的四种改性粘土中, MC II表现出良好的纤毛虫抑制效果, 且氧化复合改性可显著提升MC II的去除能力。
致谢 感谢池连宝、姜文彬、丁玉、王中石等同学在实验工作中给予的帮助。特别感谢张武昌研究员在论文撰写过程中的指导。
马青山, 贾瑟, 孙丽珉, 1988. 絮凝化学和絮凝剂[M]. 北京: 中国环境科学出版社.
王印庚, 荣小军, 张春云, 等, 2005. 养殖海参主要疾病及防治技术[J]. 海洋科学, 29(3): 1-7.
王兵, 艾红学, 李菠, 等, 2008. 单过硫酸氢钾对常见水产养殖生物致病菌的抑制与杀灭效果[J]. 中国消毒学杂志, 25(5): 501-502.
王孟华, 2012. 牙鲆幼鱼盾纤毛虫病药物防治初步试验[J]. 水产养殖, 33(2): 49-51.
王娅宁, 施心路, 刘桂杰, 等, 2009. 纤毛原生动物研究的经济意义[J]. 生物学杂志, 26(6): 72-75.
王燕, 高宝玉, 岳钦艳, 等, 2006. 铁盐类无机有机复合絮凝剂的水解特性及脱色效能[J]. 环境化学, 25(6): 730-734.
邓楠楠, 2018. 常州市主要水产养殖病害及防治方法[J]. 科学养鱼(12): 59-61.
伊珍珍, 2009. 旋唇纲、寡膜纲和前口纲纤毛虫原生动物研究——系统发育中的亲缘关系探讨[D]. 青岛: 中国海洋大学.
刘安, 2014. 钩刺及前口类纤毛虫部分类群的分子系统学初探[D]. 青岛: 中国海洋大学.
刘志玲, 唐启胜, 2014. 对虾养殖过程中常见疾病防治[J]. 科学养鱼(5): 89.
孙军, 史屹峰, 2001. 单细胞原生动物的生存策略[J]. 生物学通报, 36(9): 20-22.
杜明磊, 2020. 三种抗生素对两种纤毛虫的毒性效应研究[D]. 哈尔滨: 哈尔滨师范大学.
李承春, 徐奎栋, 类彦立, 2010. 食物和温度对海洋底栖纤毛虫——叶状突口虫种群增长的影响[J]. 应用与环境生物学报, 16(4): 545-549.
李豪杰, 2017. 单过硫酸氢钾复合粉用于饮用水消毒的效果研究[D]. 北京: 清华大学.
吴淑波, 2009. 斑节对虾纤毛虫病综合防控[J]. 海洋与渔业·水产前沿(5): 37.
吴斌, 廖思明, 2008. 广西北海凡纳滨对虾养殖池塘中微型藻类组成调查[J]. 广西科学, 15(4): 452-455.
邱彦涛, 2003. 对虾养殖水体中浮游纤毛虫原生动物的生态学及三种药物对纤毛虫的毒杀作用研究[D]. 青岛: 中国海洋大学.
邹华, 潘纲, 陈灏, 2005. 离子强度对粘土和改性粘土絮凝去除水华铜绿微囊藻的影响[J]. 环境科学, 26(2): 148-151.
沈国英, 黄凌风, 郭丰, 等, 2010. 海洋生态学[M]. 3版. 北京: 科学出版社.
宋海鹏, 2012. 过一硫酸氢钾复合盐的制备方法: CN102311100A[P]. 2012-01-11.
宋微波, 王梅, 1993. 海水养殖水体中的病害纤毛虫[J]. 海洋科学(4): 41-47.
宋微波, 赵元莙, 徐奎栋, 等, 2003. 海水养殖中的危害性原生动物[M]. 北京: 科学出版社.
宋微波, 胡晓钟, 魏军, 1997. 海洋赤潮纤毛虫─中缢虫(spp.)的形态学及种间比较[J]. 应用与环境生物学报, 3(2): 163-167.
张文昭, 2001. 过一硫酸氢钾复盐的制备及应用前景[J]. 甘肃化工, 15(3): 101-103.
张庆起, 王兴强, 曹梅, 等, 2017. 对虾营养需求及饲料投喂技术[J]. 养殖与饲料(12): 50-55.
张武昌, 丰美萍, 于莹, 等, 2012. 砂壳纤毛虫图谱[M]. 北京: 科学出版社.
张武昌, 陈雪, 李海波, 等, 2016. 海洋浮游纤毛虫摄食研究综述[J]. 海洋与湖沼, 47(1): 276-289.
张雪, 王玉蕊, 樊阳波, 等, 2017. 小腔游仆虫形态学、个体发育与分子系统学研究[J]. 生物多样性, 25(5): 549-560.
张翠霞, 2011. 我国海区浮游纤毛虫的生态学研究[D]. 青岛: 中国科学院研究生院(海洋研究所).
陈建国, 黄荣静, 2007. 危害鱼类的几种常见纤毛虫[J]. 河南水产, 71(2): 29-30.
陈辉煌, 2013. 凡纳滨对虾低盐综合养殖池塘浮游生物群落结构的研究[D]. 宁波: 宁波大学.
邵晨, 陈旭淼, 姜佳枚, 2020. 中国腹毛亚纲纤毛虫[M]. 北京: 科学出版社.
林晓凤, 2005. 山东沿海的侧口目纤毛虫[D]. 青岛: 中国海洋大学.
俞志明, 邹景忠, 马锡年, 1994. 一种提高粘土矿物去除赤潮生物能力的新方法[J]. 海洋与湖沼, 25(2): 226-232.
宫春光, 李凤晨, 2007. 牙鲆盾纤毛虫病的药物防治试验[J]. 水产科学, 26(9): 509-511.
袁进洪, 2019. 一种用于治疗蟹纤毛虫病的中药组合物: CN109512954A[P]. 2019-03-26.
俸成荣, 2017. 水产养殖病害的发生及防治措施[J]. 农民致富之友(15): 82.
徐力文, 刘广锋, 陈毕生, 2005. 鲍类寄生性病害研究进展[J]. 海洋环境科学, 24(4): 71-76.
徐大鹏, 2007. 青岛沿海寡毛类纤毛虫的分类学研究[D]. 青岛: 中国海洋大学.
高珊, 2011. 寡毛类等5个重要纤毛虫类群的分子系统学研究[D]. 青岛: 中国海洋大学.
黄平平, 赵峰, 徐奎栋, 2017. 基于形态学与核糖体DNA及其cDNA高通量测序的海洋沉积物中纤毛虫多样性比较[J]. 海洋与湖沼, 48(2): 285-296.
常青, 汤鸿霄, 1985. 聚合铁的形态特征和凝聚-絮凝机理[J]. 环境科学学报, 5(2): 185-194.
常青, 傅金镒, 郦兆龙, 1993. 絮凝原理[M]. 兰州: 兰州大学出版社: 109-110.
常青, 2003. 水处理絮凝学[M]. 北京: 化学工业出版社,234.
麻丽丹, 王殿夫, 于晓婕, 等, 2012. 养殖河豚鱼的海洋尾丝虫病病例[J]. 中国兽医杂志, 48(3): 69-70.
潘莹, 姜勇, 张伟, 等, 2010. 不同温度对3种海洋纤毛虫种群增长的影响[J]. 应用与环境生物学报, 16(6): 807-811.
ANIPSITAKIS G P, TUFANO T P, DIONYSIOU D D, 2008. Chemical and microbial decontamination of pool water using activated potassium peroxymonosulfate [J]. Water Research, 42(12): 2899-2910.
AZAM F, FENCHEL T, FIELD J G,, 1983. The ecological role of water-column microbes in the sea [J]. Marine Ecology-Progress Series, 10: 257-263.
DEMPLE B, HALBROOK J, LINN S, 1983.mutants are hypersensitive to hydrogen peroxide [J]. Journal of Bacteriology, 153(2): 1079-1082.
DING T, XUAN X T, LI J,, 2016. Disinfection efficacy and mechanism of slightly acidic electrolyzed water onin pure culture [J]. Food Control, 60: 505-510.
DU G X, QU L Y, SHANG K,, 2019. Ciliateis the causative agent of scuticociliatosis in farm raised turbot[J]. Journal of Oceanology and Limnology, 37(5): 1726-1735.
DUKAN S, TOUATI D, 1996. Hypochlorous acid stress in Escherichia coli: resistance, DNA damage, and comparison with hydrogen peroxide stress [J]. Journal of Bacteriology, 178(21): 6145-6150.
GÓMEZ F, 2007. On the consortium of the tintinnidand the diatomin the Pacific Ocean [J]. Marine Biology, 151(5): 1899-1906.
HARRIS R P, WIEBE P H, LENZ J,, 2000. ICES Zooplankton Methodology Manual [J]. London, UK: Academic Press.
KOFOID C A, CAMPBELL A S, 1929. A Conspectus of the Marine and Freshwater Ciliata Belonging to the Suborder Tintinnoinea, with Descriptions of New Species Principally from the Agassiz Expedition to the Eastern Tropical Pacific, 1904-1905 [M]. Los Angeles: University of California, Publications in Zoology: 1-403.
LIU Y, CAO X H, YU Z M,, 2016. Controlling harmful algae blooms using aluminum-modified clay [J]. Marine Pollution Bulletin, 103(1/2): 211-219.
LU X, LUAN S, LUO K,, 2016. Genetic analysis of the Pacific white shrimp (): heterosis and heritability for harvest body weight [J]. Aquaculture Research, 47(11): 3365-3375.
METAXAS A, WILKINSON N, RAETHKE E,, 2018.polymer flocculation and growth in Taylor-Couette flows [J]. Soft Matter, 14(42): 8627-8635.
PAETZOLD S C, DAVIDSON J, 2011. Aquaculture fouling: efficacy of potassium monopersulphonate triple salt based disinfectant (Virkon® Aquatic) against[J]. Biofouling, 27(6): 655-665.
PRÜTZ W A, 1996. Hypochlorous acid interactions with thiols, nucleotides, DNA, and other biological substrates [J]. Archives of Biochemistry and Biophysics, 332(1): 110-120.
RASSOULZADEGAN F, 1982. Dependence of grazing rate, gross growth efficiency and food size range on temperature in a pelagic oligotrichous ciliate Lohmanniella spiralis Leeg. fed on naturally occurring particulate matter [J]. Ann. Inst. Oceanogr. Paris, 58: 177-184.
TWAGILIMANA L, BOHATIER J, GROLIERE C A,, 1998. A new low-cost microbiotest with the protozoan: culture conditions and assessment of sensitivity of the ciliate to 14 pure chemicals [J]. Ecotoxicology and Environmental Safety, 41(3): 231-244.
WAITES W M, WYATT L R, KING N R,, 1976. Changes in spores ofcaused by treatment with hydrogen peroxide and cations [J]. Journal of General Microbiology, 93(2): 388-396.
YAN Q Y, YU Y H, FENG W S,, 2007. Genetic diversity of plankton community as depicted by PCR-DGGE fingerprinting and its relation to morphological composition and environmental factors in Lake Donghu [J]. Microbial Ecology, 54(2): 290-297.
YU Z M, SONG X X, CAO X H,, 2017. Mitigation of harmful algal blooms using modified clays: theory, mechanisms, and applications [J]. Harmful Algae, 69: 48-64.
DYNAMIC CHANGES OF CILIATES COMMUNITIES IN SHRIMP POND CULTURE AND THE CONTROL WITH MODIFIED CLAY
LIU Zheng-Yu1, 2, 3, 4, YU Zhi-Ming1, 2, 3, 4, SONG Xiu-Xian1, 2, 3, 4, CAO Xi-Hua1, 2, 3, 4
(1. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Laboratory of Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China; 4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China)
Ciliates are a kind of single-celled protozoa, which is one of the main pathogenic organisms in shrimp pond culture. We monitored the dynamic changes of ciliates during the culture ofin summer 2020, and investigated the effects of various environmental factors. Through field experiments, we found that modified clay has a certain control effect on ciliates; then combined with laboratory experiments, we explored the removal effect and mechanism of modified clay on ciliates. Results show that changes in the density of ciliates and 2~5 μm microalgae in the ponds reflected a certain predation-predation relationship, and the latter could control the dynamics of ciliates through food enrichment. Higher water temperature (20~25 °C) and lower salinity were conducive to ciliates. In addition, modified clay was applied to the shrimp culture pond in laboratory experiments, showing that modified clay could inhibit ciliates and reduce its density, and especially, oxidized compound modified aluminum sulfate modified clay (MC II) could effectively remove ciliates. This study provided a reference for prevention and control of ciliate-induced diseases of shrimp in the pond culture.
shrimp culture; environmental factors; dynamic changes of ciliates; modified clay; prevention and control methods
Q958.8
10.11693/hyhz20211200317
*山东省重大科技创新工程项目, 2019JZZY010808号; 2019年度“泰山学者攀登计划”, 泰山学者工程专项经费资助。刘正宇, 博士研究生, E-mail: 953292005@qq.com
俞志明, 博士生导师, 研究员, E-mail: zyu@qdio.ac.cn
2021-12-09,
2022-02-18
