高选择性、高灵敏的咔唑衍生物F-荧光增强型探针
2022-09-20马立军徐玮劭卢娉婷许金松冯锐鸿
马立军, 徐玮劭, 刘 欣, 卢娉婷, 许金松, 冯锐鸿
(华南师范大学化学学院, 广州 510006)
氟元素广泛存在于自然界中,是生物代谢过程中必需的微量元素之一[1-2]。适当摄入氟元素对预防蛀牙和治疗骨质疏松症至关重要,也有利于神经系统的传导和酶系统的正常活动[3]。人体内氟元素的最佳水平通常是通过牙膏、饮用水、食物和其他氟化物补充剂来维持的。然而,摄入过量的氟元素,会导致代谢紊乱、骨骼疾病、牙齿斑点、肾结石等[4-5]。因此,开发能够选择性识别F-的方法是非常必要的。
荧光探针因操作简单、选择性高、灵敏度高,而被应用于环境监测、化学分析、医学诊断等各个领域,是一种很有前景的检测方法[6-7]。近年来,一些F-荧光探针被相继报道。但由于F-的富电性使其具有很强的亲核能力,水合能强,所以在含水体系中检测F-具有很大的挑战性,这也是目前F-探针领域所面临的共性难题[8-10]。F-探针的设计思路主要包括基于氢键的去质子化、氟硼络合和化学剂量计法等,其中,化学剂量计法是基于特定的阴离子诱导反应而设计的,通常涉及共价键的断裂和形成,属于反应型探针。F-具有触发Si—O键断裂而发生脱硅化反应的能力,一些基于F-促进Si—O键断裂的荧光探针已经被报道[11-13]。但此类探针分子设计具有一定的难度,一方面要考虑识别检测环境能否满足脱硅化反应所需的基本条件;另一方面还需考虑探针分子上具有其他一些F-的结合位点,以便增强探针与F-的结合进而产生化学剂量计法。
咔唑作为一种重要的含氮杂环化合物,它的芳香环结构和刚性平面结构使其具有较大的π电子共轭程度,荧光效率高,在许多领域都有广泛的应用[14]。本文选用咔唑作为荧光基团获得了一种基于脱硅化反应的化学剂量计法F-荧光探针。采用4-羟基咔唑与叔丁基二甲基氯硅烷反应获得了一种含Si—O键的F-荧光探针(HCTC),F-的存在能够促使分子中Si—O键断裂,从而增强了分子内电荷转移(ICT)的强度,导致咔唑基团的荧光开启现象[15-16]。HCTC对F-具有高选择性、高灵敏度,以及响应速度快、荧光强度稳定、抗干扰能力强等优点,同时还可以被制备成试纸用于水体系中F-的荧光检测,这为检测F-提供了一种有效的手段。
1 实验部分
1.1 实验仪器和试剂
主要仪器:荧光分光光度计(F-4600,日本岛津)、紫外-可见分光光谱仪(UV-2700,日本岛津)、核磁共振波谱仪(NMR Systems 600 MHz,美国瓦里安)、高分辨质谱仪(solanX 70 FT-MS,德国布鲁克)。
主要试剂:4-羟基咔唑(百灵威公司)、叔丁基二甲基氯硅烷(百灵威公司)、咪唑、二氯甲烷、乙腈、二甲基亚砜等,均为分析纯,市售。
1.2 HCTC的合成与表征
本实验利用4-羟基咔唑和叔丁基二甲基氯硅烷合成HCTC,其合成路线如图1 所示[17-18]。
将4-羟基咔唑(0.184 g,约1.0 mmol)和咪唑(0.225 g,约2.0 mmol)分别溶于4.0 mL二氯甲烷后置于圆底烧瓶中,然后缓慢滴加溶解后的叔丁基二甲基氯硅烷(0.226 1 g,约1.5 mmol),随即出现大量白色悬浊物,将混合物于室温下搅拌约5 h。用适量去离子水洗涤反应混合物3次后用真空泵抽滤,收集滤液中的有机层,加入无水 MgSO4干燥,再用真空干燥法除去溶液中的有机溶剂,所得的粗产物用洗脱剂(石油醚与二氯甲烷体积比为1∶1 )经柱层析进一步纯化后置于真空干燥箱中烘干,得到白色粉末0.114 2 g,产率38.4%。HCTC的1H NMR(600 MHz,acetonitrile-d3)的化学位移(δ)分别为:9.26 (d,J= 48.8 Hz, 1H),8.27~8.25(m,1H),7.47~7.45(m,1H),7.36(ddd,J=8.2,7.2,1.2 Hz,1H),7.24(t,J=7.9 Hz,1H),7.17(td,J=7.6,1.0 Hz,1H),7.11~7.09(m,1H),6.67(dd,J=7.8,0.6 Hz,1H),1.08~1.07(m,9H),0.36~0.35(m,6H)。HCTC的高分辨质谱ESI-MS(m/z)测量结果为297.154 0,而理论计算C18H23NOSi的相对分子质量为297.154 9。以上实验结果均表明,所获得的产物为目标分子。
2 结果与讨论
2.1 HCTC对F-的荧光识别
在365 nm激发波长下,向20.0 μmol/L探针HCTC的乙腈待测液中加入不同浓度的F-(0.0~180.0 μmol/L)。如图2所示,随着F-浓度的增大,HCTC在波长433 nm处出现了1个新的荧光发射峰并不断增强。在365 nm波长紫外灯下照射下,加入F-后的溶液显示出很强的蓝紫色荧光(图2插图下),这可能是由于氧硅键的断裂导致氧负离子裸露,导致ICT效应增强[15]。此外,HCTC在波长433 nm处的荧光强度与F-的浓度呈现较好的线性关系(图2插图上)。
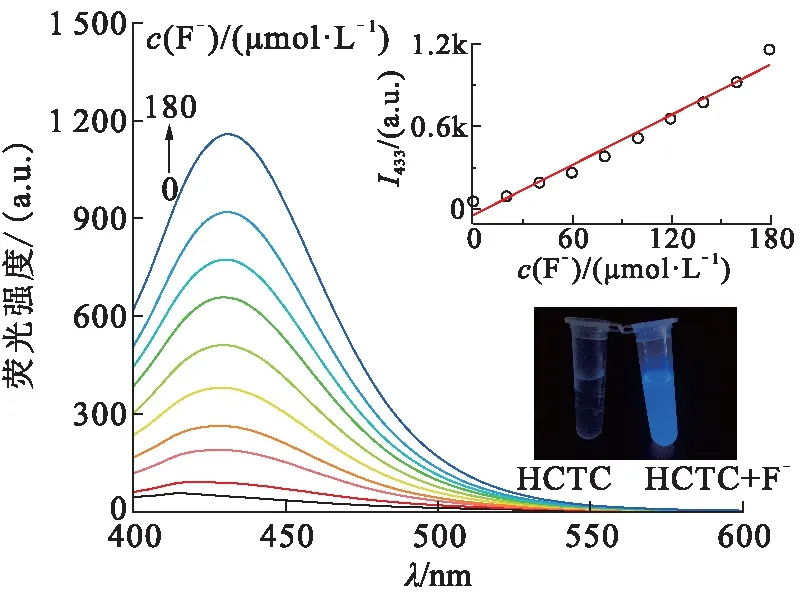
图2 HCTC对F-的荧光响应特性
分别测试了HCTC测试液(20.0 μmol/L)以及其加入140.0 μmol/L 的F-后在波长433 nm位置的荧光发射强度与随时间变化的强度-时间曲线(图3)。加入F-前,空白探针的荧光强度很低,且基本不随时间变化。而加入F-后,HCTC的荧光变化趋势表现为先快速增长后开始下降,9 min后荧光强度基本趋于稳定,该探针在设定的测试条件下响应速度相对较快[19-20],荧光稳定性较好。基于该实验结果,在测定HCTC对离子的荧光响应时,配置好溶液并放置9 min后进行测量。
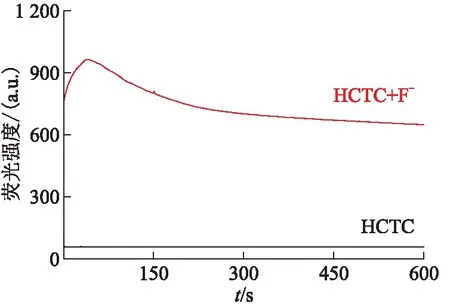
图3 HCTC溶液中加入140.0 μmol/L F-前后的荧光强度扫描曲线
2.2 HCTC识别F-的选择性和抗干扰性能

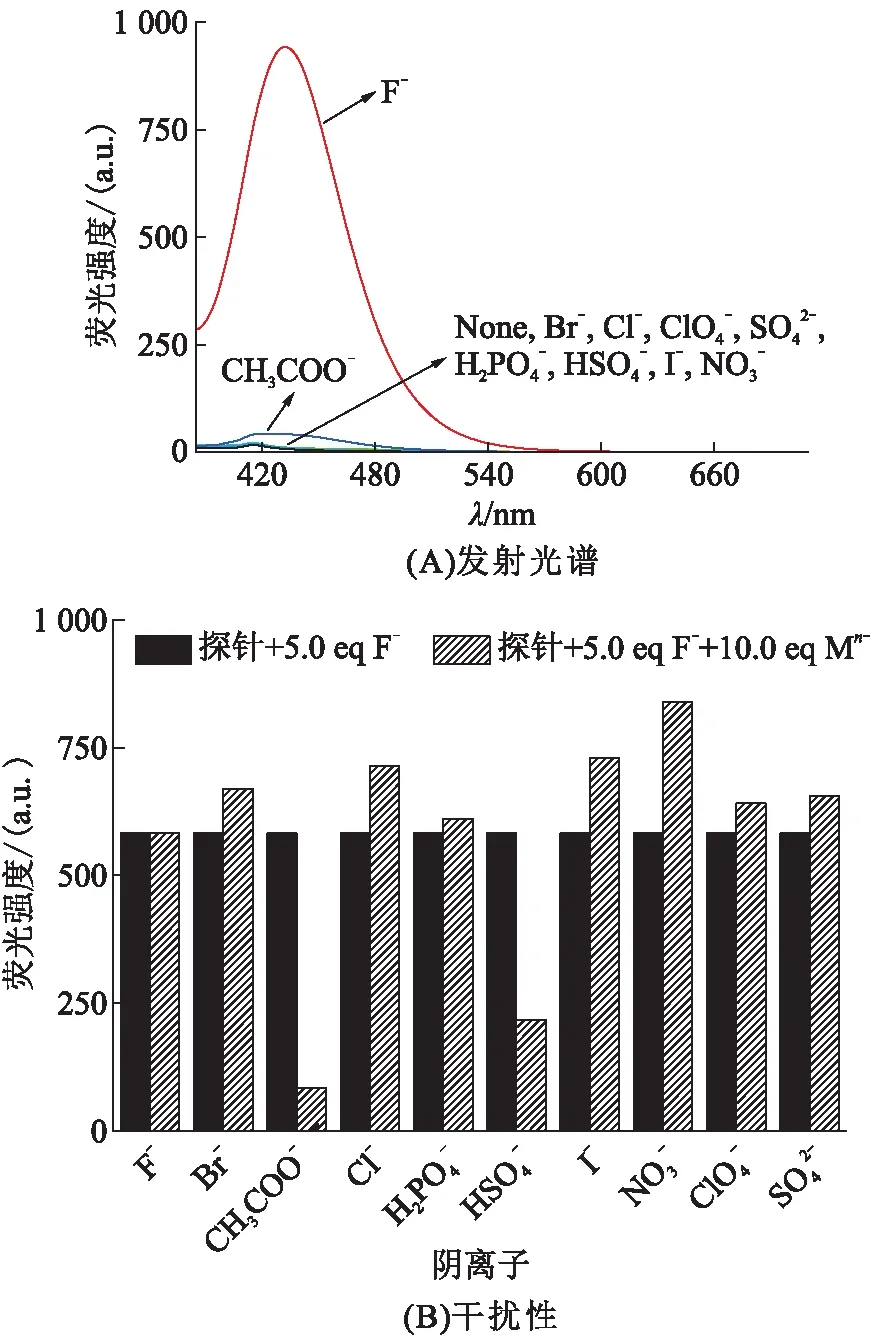
图4 不同阴离子对HCTC荧光探针的干扰性
2.3 HCTC与F-的结合比和结合常数
为了探究HCTC与F-的结合模式,通过Job’s plot曲线法[21]来确定探针与F-之间的结合比(图5)。固定HCTC与F-的总浓度为20.0 μmol/L,不断改变两者的浓度比例并测试其荧光强度,对F-所占浓度比例[c(F-)/c(F-+探针)]作图,得到其工作曲线。从图中可以看出,F-的浓度为总浓度的0.5倍时,荧光强度变化值达到最大,因此确定HCTC识别F-的最佳结合比为1∶1。

图5 不同浓度比对HCTC荧光发射峰强度的影响
根据Benesi-Hildebrand方程[22],结合荧光滴定光谱(图2)和图5的工作曲线,计算结合常数Kobs,计算公式如下:
其中,I0表示溶液中空白探针HCTC(20.0 μmol/L)的荧光强度,I表示向探针溶液中加入F-后的荧光强度,Imax表示向探针溶液中加入F-后的最大荧光强度,结合常数Kobs通过1/(I-I0)与F-浓度倒数作图的斜率来确定。如图6所示,拟合相关系数R2为0.997,表明HCTC与F-的结合较好地符合1∶1的模式,这与Job’s plot曲线法的结果一致。因此, HCTC与F-的结合比可确定为1∶1(物质的量之比)。通过公式拟合得到结合常数Kobs约2.780×103L/mol,表明HCTC与F-的结合能力较强[23]。
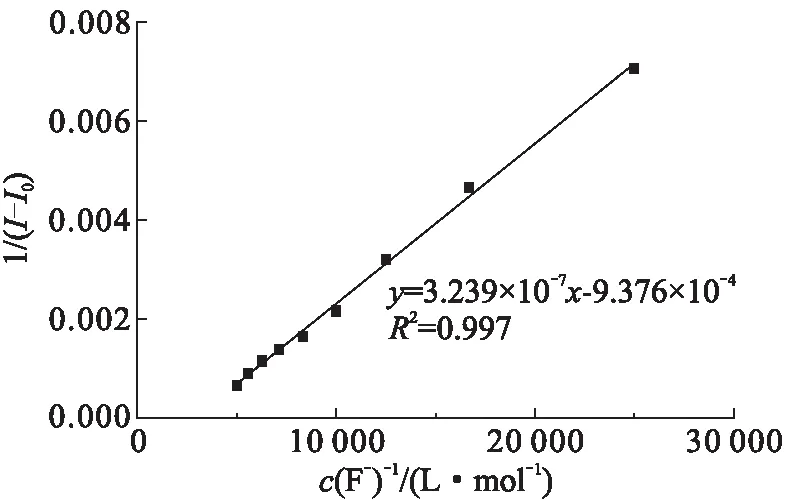
图6 在1∶1的结合模式下的拟合图
2.4 HCTC识别F-的检测限和紫外吸收光谱
检测限是体现荧光探针灵敏度的一个重要指标,查阅文献[24]可知检测限计算公式为:
Limit=3S/K,
其中,S表示空白探针溶液(20.0 μmol/L)在波长433 nm处的荧光强度的标准偏差,K表示F-浓度与最大荧光发射峰强度拟合曲线的斜率。通过测试6组空白探针的荧光强度得到S=0.418 6。拟合曲线结果如图7所示,拟合得到Kobs=5.98,通过计算得到HCTC检测F-的检测限为0.21 μmol/L,低于一些已报道的探针[1,4,12,23],具有一定的实际应用前景。
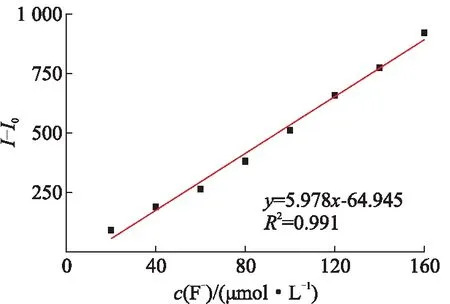
图7 HCTC的荧光强度与F-浓度变化的线性拟合图
测试HCTC随F-浓度变化的紫外-吸收光谱如图8所示,20.0 μmol/L HCTC的乙腈待测液的紫外-可见吸收光谱在波长333 nm处的吸收峰为咔唑的特征吸收峰。向HCTC溶液中加入F-(0.0~200.0 μmol/L),随F-浓度的增加,溶液在350 nm处的紫外吸收峰强度明显增强,表明HCTC与F-发生了明显的相互作用。
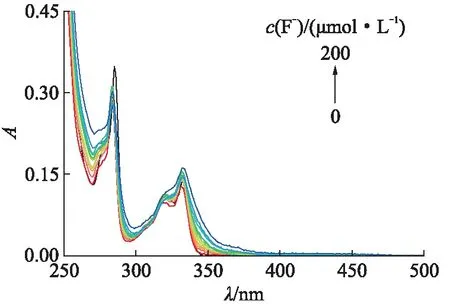
图8 HCTC随F-浓度变化的紫外-吸收光谱
2.5 HCTC识别F-的机理分析
针对HCTC识别F-提出的机理如图9所示,由于Si—O键的断裂,受体裸露出氧负离子,p-π共轭作用使得受体电荷密度增加,分子处于富电子体系,从而增强了ICT效应[17-18],使基团发生较强的荧光开启现象并伴有轻微的红移现象。
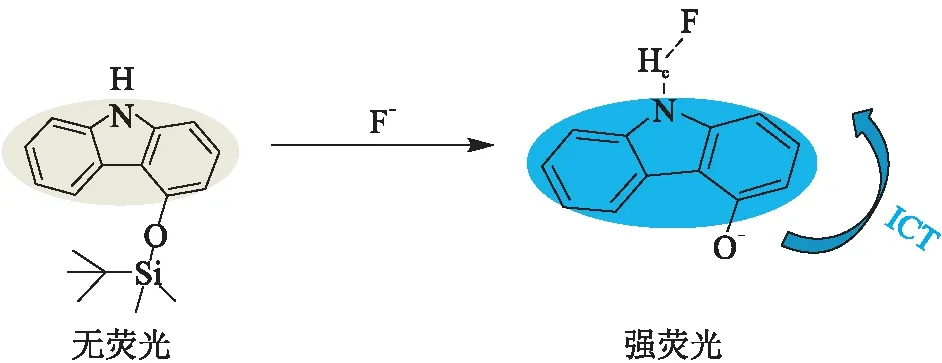
图9 HCTC与F-作用时的结构转变机理图
对HCTC识别F-进行了核磁滴定实验(图10)。先将HCTC溶于氘代乙腈溶液,测试其1H NMR谱,然后测试加入F-后的1H NMR图谱。加入F-前,在δ=9.315、1.085 和0.364 位置分别有3个质子峰,对应归属为酰胺键质子Hc、叔丁基Ha和二甲基上的质子Hb。加入1 eq的F-后,由于F-对硅的强亲核性,可切断受体中的Si—O键,生成叔丁基二甲基氟硅烷,该分子脱离苯环后,甲基上质子的屏蔽效应减弱,故Ha与Hb都向高场移动。同时,由于酰胺键质子Hc受到F-的强吸电子作用形成氢键,导致其质子峰强度减弱并向低场移动。

图10 HCTC加入F-前后的1H NMR谱
2.6 HCTC荧光试纸的制备和应用
将HCTC制成荧光试纸,探究其检测F-的实用性。首先,将定性滤纸剪成1.5 cm×2.5 cm的滤纸条,并将它们浸泡在HCTC的乙腈溶液中,5 min后取出晾干得到吸附了HCTC探针的试纸。然后,将它们分别浸入NaF的水/乙腈溶液(体积比9∶1)和四丁基氟化铵乙腈溶液中,1 min后取出晾干。在波长为365 nm的紫外灯光照射下进行荧光成像(图11),只吸附了HCTC的试纸几乎没有明显的发光现象,而浸入NaF的水/乙腈溶液和四丁基氟化铵的乙腈溶液的试纸均显示了明亮的蓝色荧光。以上实验结果显示,通过将探针HCTC制备成荧光试纸,一定程度上能够实现含水体系中F-的检测,改善了探针的检测环境,同时实现了F-的快速便捷检测。通过将探针HCTC与一些近些年已报道的F-荧光探针进行对比(表1,图12),可以发现本文中的探针HCTC在灵敏度以及应用性能上具有自身的特色。值得注意的是,本文报道的HCTC探针通过制备成荧光试纸能够实现水体系中F-的检测,这是表1中其他文献所不能实现的。

图11 HCTC荧光试纸检测F-的荧光颜色变化

表1 检测F-荧光探针的性能比较
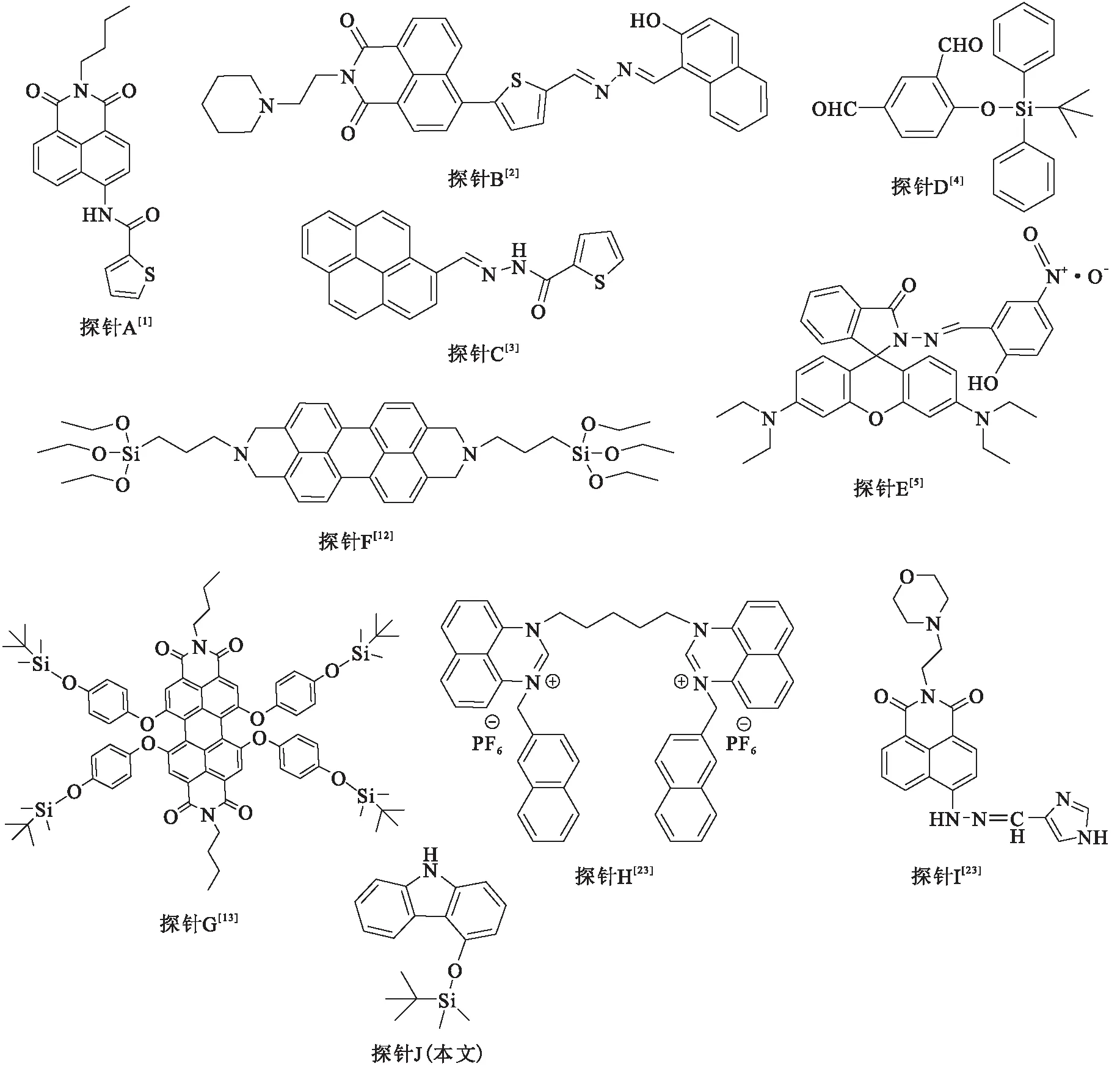
图12 各类探针的分子结构
3 结论
合成了一种以4-羟基咔唑作为荧光基团的高选择性反应型F-探针HCTC。HCTC能够对F-表现出荧光开启识别现象,即F-能够引起HCTC溶液的荧光光谱在波长433 nm处产生一个新的发射峰,且能够对不同浓度F-产生荧光响应。HCTC还具有响应速度快、荧光强度稳定以及较好的抗干扰能力等优点。此外,HCTC荧光识别F-还具有高灵敏度,检测限低至0.21 μmol/L,同时它还能够被制备成试纸用于水溶液中F-的荧光检测,显示了一定的应用潜力。
