哺乳动物线粒体DNA转录调控机制的研究进展
2022-09-18刘如爱张本斯
熊 伟,刘如爱,李 彬,张本斯,姜 北,余 敏
(1.大理大学基础医学院,云南大理 671000;2.云南省高校临床生物化学检验重点实验室,云南大理 671000;3.云南省滇西抗病原植物资源筛选研究重点实验室,云南大理 671000;4.云南大学生命科学学院,昆明 650091)
由于线粒体在人类健康和疾病中发挥着重要作用,近年来对线粒体DNA(mitochondrial DNA,mtDNA)的转录过程及调控机制的研究取得了许多重要的进展。目前,mtDNA体内和体外转录系统的基本组成部分已经基本确定,主要包括线粒体RNA聚合酶(mitochondrial RNA polymerase,POLRMT)、线粒体转录因子A(mitochondrial transcription factor A,TFAM)、线粒体转录因子B1(mitochondrial transcription factor B1,TFB1M)、线粒体转录因子B2(mitochondrial transcription factor B2,TFB2M)、线粒体转录延长因子(mitochondrial transcription elongation factor,TEFM)、线粒体单链结合蛋白(mitochondrial single-stranded binding protein,mtSSBP)和线粒体转录终止因子(mitochondrial transcription termination factors,mTERFs)家族〔1〕。此外,39 S线粒体核糖体蛋白L12(mitochondrial ribosomal protein L12,MRPL12)作为与POLRMT和TEFM结合的复合物,是转录延伸阶段持续合成和防止在保守序列块(conserved sequence block,CSB)2处转录终止所必需的〔2〕。在mtDNA的转录过程中,除了转录系统的基本组成部分发挥转录调控作用外,一些核转录因子也可以通过直接或间接的方式对mtDNA转录调控进行调节。本文主要从mtDNA的结构、转录过程及调控机制等方面进行综述,重点介绍各种转录因子以及调控转录的其他重要因素在mtDNA的转录起始、延伸和终止过程中发挥的作用。
1 线粒体DNA的结构
线粒体基因组于1960年首次被描述〔3〕,并于1981年由Anderson等人完成测序〔4〕。鉴于其共生细菌的起源,线粒体基因组与细菌DNA的结构极其相似。细菌基因组被压缩为其体积的10-4以形成类核,线粒体基因组以类似的方式将DNA组织压缩形成离散的蛋白质-DNA复合物,分布于整个线粒体基质中〔5〕。每个线粒体类核中包含2~10个拷贝的mtDNA,可以被认为是线粒体中一个独立的遗传单位。哺乳动物mtDNA基因序列中几乎没有内含子,且mtDNA没有组蛋白结合。存在类核中的蛋白质(例如TFAM等),实现了mtDNA的紧密包装〔6〕。在大多数哺乳动物细胞中,mtDNA占总DNA的0.1%~2.0%。人类mtDNA是环状的,全长16 569 bp,遗传方式为母系遗传。它编码2种rRNA、22种tRNA和13种蛋白质,都参与氧化磷酸化过程〔7〕。根据mtDNA两条链转录RNA在变性氯化铯(CsCl)密度梯度离心的不同,可将其分为重链(H链)和轻链(L链)〔8〕。其中,H链包含大部分的线粒体编码基因,L链仅编码MT-ND6蛋白和8个tRNA。
2 mtDNA的转录
与核基因组的转录机制完全不同,mtDNA转录的基本酶促机制由少数蛋白质组成:POLRMT是一种具有启动子识别功能的单亚基聚合酶,它包含一个催化性C端结构域(C-terminal domain,CTD)和1个N端结构域(N-terminal domain,NTD)。但是,POLRMT不能单独启动依赖于启动子的转录,因为它需要2个额外的转录因子:TFAM和TFB2M的协助。在非编码的D环区,线粒体的转录受到一系列顺式作用元件的调节,包括:重链启动子(heavy strand promoter,HSP)1和HSP2、轻链启动子1(light strand promoter 1,LSP1)、转录终止相关序列(termination related sequence,TAS)1和TAS2,以及保守序列块(conservative sequence block,CSB)1、CSB2和CSB3。见图1。在L链的转录过程中,LSP1是一个独特的转录起始位点,其转录可以在CSB1处终止,但大多数的转录在启动子下游200 bp处的CSB2处终止〔9〕。CSB2是1个富含G的保守序列,其功能是终止用于mtDNA复制的7 S RNA引物的转录,在调节mtDNA复制和转录之间的转换中发挥重要作用〔9-10〕。在对H链转录的研究过程中,研究者们曾提出过H链双启动子系统来解释2种rRNA的高丰度,其中HSP1转录产生包含tRNAPhe、tRNAVal和2个rRNA(12 S和16 S)的转录本,而HSP2产生的转录本几乎跨越整个基因组。然而,最近的动物模型〔11〕和体外实验〔12〕表明,H链的转录可能仅仅受单个启动子的控制,rRNA表达丰度的差异可能是不同转录本周转的结果。HSP2存在与否及其功能意义仍然是有待解决的问题。
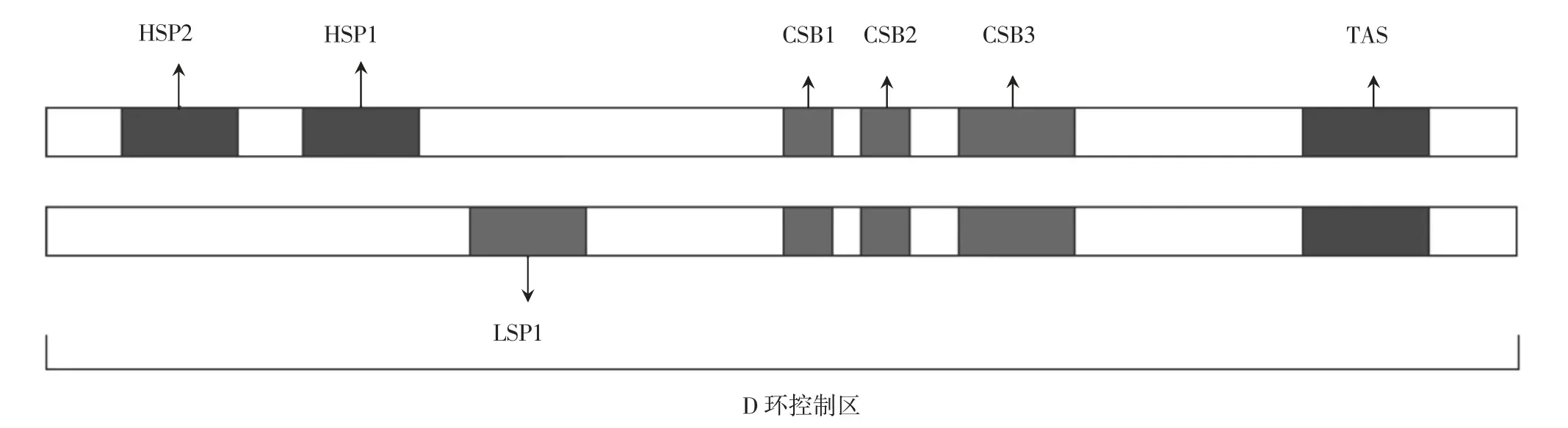
图1 线粒体DNA的D环控制区结构示意图
mtDNA的转录由TFAM与转录起始位点-15~-10 bp处的高亲和力位点结合而启动,然后产生稳定的U形转弯〔13〕,此时POLRMT就可以直接将蛋白质募集到启动子的TFAM处结合。POLRMT可以在DNA中大约-60~-50 bp的位置滑动,直到TFB2M与复合物TFAM-POLRMT结合并且完全组装成起始复合物包围启动子,才可以启动该过程。值得注意的是,TFB2M、TEFM与POLRMT之间的结合并不兼容,在线粒体转录起始阶段,TEFM无法与POLRMT结合。一旦POLRMT切换到延伸模式,转录起始因子被释放,TEFM才能与POLRMT的CTD相互作用,促进转录形成较长的RNA片段,并在体内外均能提高mtDNA转录延伸的效率和活性。研究已经证明,TFAM的水平直接控制mtDNA的拷贝数〔14〕。除了转录激活作用外,它还将DNA包裹在类核中。在所有参与mtDNA转录调控的基因中,TFAM是一种已被证明突变会导致人类疾病的基因。TFAM基因突变与常染色体隐性遗传病有关,婴儿发病时伴有进行性肝功能衰竭。此外,有研究者在小鼠模型中发现高水平的TFAM会导致小鼠出生后死亡率升高和线粒体功能障碍,抑制哺乳动物mtDNA的转录〔15〕。TEFM可以刺激POLRMT与DNA∶RNA模板的相互作用,并绕过具有二级结构(如tRNA)的区域。最近的研究〔16〕证明,TEFM能够通过减少POLRMT停顿的频率和缩短其持续时间来增强mtDNA的转录延长,并有助于跨越CSB2序列以继续转录成完整的多顺反子RNA。
线粒体转录终止的过程仍不清楚。虽然MTERF1转录终止的原始模型提出它负责终止HSP2驱动的转录以促进rRNA的合成,但这些模型没有任何体内证据支持。还有研究〔11〕表明,敲除小鼠的MTERF1基因对小鼠的表型以及rRNA和mRNA的水平没有任何显著影响,然而,生化研究表明MTERF1仅部分终止H链转录,而L链转录几乎完全被阻断。MTERF1似乎在LSP终止之外发挥作用,它已被证明可以通过POLRMT介导更普遍的RNA转录终止以及mtDNA的复制终止〔12,17〕。虽然MTERF1可能导致LSP终止,但HSP转录终止似乎与MTERF1无关,可能涉及其他蛋白质,这仍然是一个有待阐明的问题。
3 直接结合的蛋白质对mtDNA转录的调控
除了上述这些线粒体转录因子外,多项研究表明,许多不同的蛋白质如激素、核转录因子和染色质重塑酶,它们可以通过与mtDNA和RNA/DNA修饰酶发生相互作用来参与mtDNA转录的调节。
3.1 激素 最早发现参与mtDNA转录调控的蛋白质之一是甲状腺激素(thyroid hormone,TH)。TH调节的基因表达由结合甲状腺激素受体(thyroid hormone receptor,TR)与甲状腺激素反应元件(thyroid hormone response element,TRE)来介导,它能通过直接结合mtDNA基因来促进mtDNA的转录〔18〕。最近观察到甲状腺激素能够结合于12 S rRNA基因和D环区域中的TR〔19-20〕。研究还发现cAMP反应元件结合蛋 白(cAMP response element binding protein,CREB)能够特异性结合天然形式或回文结构的TRE。此外,该蛋白质可以与位于线粒体基因组D环中的同向重复序列-2特异性结合。有研究发现,在心肌细胞的线粒体中存在雌激素受体(estrogen receptor,ER),因此推测E2(17β-雌二醇)和ERβ介导的心脏保护作用依赖于有mtDNA转录编码的线粒体呼吸链活性维持。研究还证明E2可以增加ERβ的mtDNA结合活性,然后增加呼吸链复合体V编码基因的表达〔21〕。还有研究表明〔22〕,糖皮质激素(glucocorticoid,GC)存在于线粒体中,可以与位于线粒体内膜中的糖皮质激素受体(glucocorticoid receptor,GR)结合。Psarra等〔23〕首次鉴定出GR和雌激素反应元件具有部分序列同源性,提出类固醇受体在mtDNA转录调控中具有潜在的作用。但目前尚不清楚GR是否与线粒体转录起始因子(TFAM、TFB2M或POLRMT)或其他已知的线粒体转录调节因子(如MTERF蛋白)相互作用。褪黑激素(melatonin,MT)是一种发挥重要抗肿瘤作用的松果体激素,线粒体是MT的已知靶标。在胶质母细胞瘤的研究中发现,TFAM的蛋白质水平与胶质瘤的恶性程度正相关,而MT影响TFAM的表达,MT能够在mRNA和蛋白质水平上降低TFAM以及其他蛋白质的表达(如TFB1M和TFB2M),从而干扰mtDNA转录〔24〕。见表1。

表1 调控mtDNA转录的激素
3.2 核转录因子 线粒体有自身的环状基因组DNA,有线粒体特异性转录和复制系统以及相应的调节蛋白。这些蛋白质都在核基因组编码,翻译后输入线粒体。Marinov等〔25〕通过对7种不同的人类细胞系进行染色质免疫沉淀(ChIP)测序证明存在多种与mtDNA结合的核转录因子。结果表明,含量最丰富的是CEBPb、c-Jun、JunD、MafF、MafK、Max、NFE2和Rfx5,且它们中的大多数和预期一样在D环区域中富集,但也能发现一些能够在氧化磷酸化(oxidative phosphorylation,OXPHOS)亚基附近结合的序列,且在不同的细胞系之间存在差异。其中的一些转录因子已被证实在调节mtDNA转录方面的功能。
核转录因子c-Jun可以与其他涉及类视黄醇X受体(retinoid X receptor,RXR)途径的酶协同减少mtDNA的转录〔26〕。活化T细胞的核转录因子(nuclear factor of activated T-cells,cytoplasmic 1,NFATc1)参与人骨髓间充质干细胞在成骨细胞中的分化。该蛋白质位于线粒体中并与D环区域相互作用,从而抑制一些关键基因的转录,例如细胞色素b(cytochrome b,Cyt b)和NADH-泛醌氧化还原酶链1(NADH-ubiquinone oxidoreductase chain 1,ND1)。研究表明〔27〕,NFATc1在钙化过程中充当mtDNA转录的负调节因子。
3.3 染色质重塑酶 在真核生物中,核DNA(5mCpG)中CpG序列处的胞嘧啶甲基化和组蛋白修饰是影响基因转录的两大因素。但是,mtDNA缺乏核小体染色质和组蛋白,这些CpG岛在线粒体中的甲基化机制仍然未知。
TFAM是一种含量丰富且高度保守的高迁移率族(high-mobility-group box,HMG box)蛋白。类似于组蛋白对核DNA或细菌中组蛋白样蛋白质的作用,TFAM是mtDNA类核中唯一明确的发挥结构作用的转录因子,且与mtDNA永久相关。这种蛋白质可能是造成mtDNA紧密包装的主要因素,因此它在mtDNA的拓扑异构中发挥作用〔27〕。研究表明,TFAM可以将DNA扭曲形成U形转弯,这种U形转弯与LSP的转录起始有关〔28〕。TFAM可以结合mtDNA的双螺旋结构,但由于其浓度对于整个mtDNA的覆盖来说太低,因此TFAM主要在mtDNA的中心区域充当包装蛋白。据估计,一分子TFAM可以20 bp的固定间隔与mtDNA结合,但由于蛋白质作为同源二聚体,两分子TFAM可以35~40 bp的间隔与mtDNA结合。尽管有研究认为TFAM与mtDNA的结合缺乏序列特异性,但一些研究提出了mtDNA结合的位点偏好,尤其是在体外倾向于结合G-四链体结构(G-quadruplex,GQP)〔29〕。
由于TFAM对mtDNA的紧密覆盖以及相互作用的非序列特异性,该蛋白质必须与mtDNA中的许多CpG岛相互作用。越来越多的证据表明,类似于细胞核中发生的情况,一些CpG岛中可能发生甲基化从而影响mtDNA的转录修饰。Rebelo-Guiomar等〔30〕提出,5mCpG的出现有可能影响哺乳动物细胞中的TFAM-mtDNA识别。研究证实,HSP中CpG序列的甲基化可以增加TFAM在这些位点诱导TFAM多聚化的结合活性,但不会改变DNA的压实。此外,研究表明HSP1启动子中的CpG甲基化强烈增加了从该位点开始的转录。最近有人提出,结构化的成人染色质样mtDNA组织是在哺乳动物胚胎发育过程中逐渐形成的,实现了mtDNA的动态覆盖。事实上,在mtDNA中不仅可以发现CpG序列的甲基化,还可以发现不同的染色质重塑酶。
组蛋白乙酰转移酶MOF(males absent on the first,MOF),也被命名为MYST1或KAT8,是主要的赖氨酸乙酰转移酶(lysine acetyl transferase,KAT),负责果蝇和哺乳动物体内H4K16ac的沉积,是通过表观遗传学修饰连接核基因组以及线粒体基因组的双重转录调节剂。MOF可以控制mtDNA的转录,而这种作用依赖于KANSL3〔31〕。当MOF/KANSL3缺失时,线粒体转录被显著下调,严重影响细胞代谢和呼吸功能。相反,信号转导及转录激活因子3(signal transduction and activator of transcription protein 3,STAT3)能够结合mtDNA和TFAM,从而调节mtDNA的转录。已经证明,角质细胞中STAT3的缺失会导致线粒体编码的基因转录物增加〔31〕。NAD依赖性蛋白脱乙酰酶Sirtuin-1(NADdependent protein deacetylase sirtuin-1,SIRT1)作为游离蛋白质存在于线粒体中,可以作为TFAM的调节因子并与之形成稳定的复合物。SIRT1可能影响其脱乙酰化和mtDNA的活性,从而调控mtDNA的转录〔32〕。DNA甲基转移酶1(DNA methyltransferase 1,Dnmt1)是一种通常与基因沉默相关的甲基转移酶。研究发现,Dnmt1在用高浓度葡萄糖处理的视网膜内皮细胞的线粒体中累积,D环区域的甲基化水平显著增加,抑制mtDNA转录,导致线粒体功能障碍和细胞凋亡加速〔33〕。见表2。

表2 调控mtDNA转录的染色质重塑酶
3.4 线粒体微小RNA从细胞核转移到线粒体的微小RNA(microRNA,miRNA)称为线粒体miRNA(mitomiR),miRNA已经被证明是一类能够通过干扰翻译过程来调节基因表达的小RNA。研究发现了一类特定的mitomiR在线粒体附近和这些细胞器内富集来控制线粒体的行为。但目前尚不清楚mitomiRs是如何进入细胞器的,同时存在于基质和线粒体膜间隙中的一种核糖核酸酶——多核苷酸磷酸化酶(polynucleotide phosphorylase,PNPase)似乎是发挥此作用的主要蛋白质。有研究已经将mtDNA确定为mitomiRs的来源和靶标〔34-35〕。除了它们在翻译抑制中的主要功能外,miRNA还涉及在特定条件下增强或抑制mtDNA转录。有研究已经证明了mitomiR-2392可以调节舌鳞状细胞癌中mtDNA的基因表达。这种miRNA在线粒体中的存在能够逆转这些肿瘤细胞的化疗抗性,通过与Argonaut2直接结合到mtDNA H链的特定序列,部分阻断多顺反子mtDNA的转录,导致OXPHOS复合物的活性降低〔36〕。Zhang等〔37〕研究发现,miR-1是一种在肌生成过程中特异性诱导的miRNA,它能有效地进入线粒体,直接增强肌肉分化过程中特定线粒体基因组编码转录物的翻译。
4 间接调控mtDNA转录的核转录因子
许多因素涉及线粒体转录调控和细胞核之间的联系。核转录因子在间接控制mtDNA转录和线粒体功能中发挥着核心作用。目前研究最多的影响mtDNA转录的核蛋白是核呼吸因子(nuclear respiratory factor,NRF)NRF-1和NRF-2、转录阻遏蛋白阴阳1(ying-yang 1,YY1)、p53和过氧化物酶体增殖物激活受体γ共激活因子-1(peroxisome proliferator-activated receptor γ coactivator-1,PGC-1)等。见表3。

表3 直接调控和间接调控mtDNA转录的核转录因子
NRF-1和NRF-2控制的调节网络从呼吸链亚基延伸到控制mtDNA转录和复制的组分,对mtDNA转录的关键酶的表达也有重要作用〔38〕。已有研究证明,它们能够增强哺乳动物运动过程中线粒体生物发生基因的转录及对多种压力的应激反应〔39-40〕。TFAM和mtRNA加工酶是NRF-1的靶基因。最近研究证明,TFB1M和TFB2M也是NRF-1的靶基因,两者可以共同增强mtDNA的转录〔40〕。PGC-1和PGC-1相关共激活因子(PGC-1-related coactivator,PRC)的激活需要相同的NRF识别位点,这些PGC-1家族成员和PRC也是控制代谢、分化和细胞生长的生理信号转导和整合以及mtDNA转录的重要因素〔41〕。PGC-1α是一种共转录调节因子,通过激活不同的转录因子(包括NRF-1和NRF-2)来调控mtDNA的转录〔42〕。YY1是PGC-1α的靶标之一,它与哺乳动物雷帕霉素靶标(mammalian target of rapamycin,mTOR)蛋白一起可以调节mtDNA的转录。PGC-1β与PGC-1α具有相似的分子结构和功能,可以调控核受体结合和转录激活〔43〕。与前两个PGC-1家族成员一样,PRC也能结合参与线粒体基因表达的核转录因子。此外,PRC可能显著提高早期胚胎发生期间的线粒体基因转录效率〔42〕。线粒体呼吸链基因是PGC-1α和mTOR的共同靶标〔44〕。mTOR是一种激酶,是细胞中营养感应和能量通路的基本组成成分〔45〕。mTOR还有助于控制线粒体氧化活性,mTOR蛋白的抑制会导致骨骼肌细胞中的PGC-1α和NRFs的表达丧失,导致mtDNA表达减少和OXPHOS损伤。研究表明,这种功能是由YY1介导的,YY1是mTOR营养感应的重要组成部分。YY1基因沉默可以抑制mtDNA的表达和线粒体的呼吸功能〔44〕。
肿瘤抑制因子p53是一种关键的转录激活蛋白,被证明参与控制mtDNA的拷贝数。p53通过其核转录因子的活性来调节线粒体功能,增强细胞凋亡并抑制mtDNA突变。在原代小鼠和人类成纤维细胞中敲除p53导致mtDNA的消耗和TFAM的减少,从而间接影响mtDNA的转录、蛋白质合成和线粒体数量〔46〕。此外,p53可以抑制NF-κB家族成员RelA向线粒体的转运。在没有p53的情况下,RelA被转运并被招募到线粒体基因组中,抑制mtDNA的表达、耗氧量和细胞ATP水平,这种功能是通过与线粒体转录因子的相互作用实现的〔47〕。
缺氧诱导因子-1α(hypoxia inducible factor-1,HIF-1α)是细胞对缺氧反应的关键转录因子,是调节线粒体功能的另一个关键因素。研究表明,HIF-1α减少了活性氧的产生并保持了线粒体对抗氧化应激的功能,HIF-1α在诱导人体细胞氧化应激后能够在线粒体内易位。线粒体靶向形式的HIF-1α的过表达有助于减弱细胞凋亡并促进mtDNA编码的mRNA的表达,而线粒体HIF-1α的异位表达下调了基质中mtDNA编码的mRNA水平但不影响线粒体数量〔48〕。
线粒体基因转录的调控是非常独特的,因为其受到mtDNA和核基因组的双重调节。因此,调控线粒体基因表达更高级的机制是线粒体基因和编码呼吸链复合蛋白质的核基因的共表达。两种遗传系统都可以根据细胞的能量需求来增强或减少转录。研究表明,存在于细胞核和线粒体中的5种OXPHOS复合体均存在基因的共表达机制。尽管确定了OXPHOS基因表达的相关模式,但在编码OXPHOS复合物的基因核心启动子内,仍没有检测到转录因子结合位点的特异性排列〔49〕。
5 总结与展望
综上所述,随着对哺乳动物mtDNA的转录及调控研究的不断深入,人们对线粒体的转录调控机制有了更深入的认识,但仍然有许多具体的调控细节并不是非常清楚。长期以来,人们一致认为线粒体在细胞能量代谢中起着核心作用,但线粒体疾病发生发展的复杂机制尚有待进一步研究。通过对哺乳动物mtDNA的转录过程及调控机制的研究,将为阐明临床上各种线粒体疾病的发病机制提供更多的理论依据,也为寻找线粒体基因诊断和基因治疗提供新的方法和思路。
