C-藻蓝蛋白对宫颈癌HeLa细胞增殖与迁移的作用
2022-09-17韩晶晶董晓雷杨方浩刘国祥杨丽娜李冰
韩晶晶,董晓雷,杨方浩,刘国祥,杨丽娜,李冰
(青岛大学基础医学院遗传学与细胞生物学系,山东 青岛 266071)
宫颈癌是女性最常见的癌症[1]。尽管近年来宫颈癌病人早期诊出率和治疗存活率都明显增高,但晚期宫颈癌病人的预后和治疗效果仍然不甚理想。确诊和死亡病人中超过 85%发生在包括中国在内的发展中国家,宫颈癌的晚期转移是导致病人死亡的主要原因。人宫颈癌HeLa细胞相比于其他癌细胞,增殖与转移异常迅速[2]。研究表明,转化生长因子β(TGF-β)在癌症晚期可以诱导癌细胞增殖和迁移等众多反应[3]。C-藻蓝蛋白(C-PC)是从螺旋藻中分离出的天然蛋白[4],具有抗肿瘤[5]、抗炎症[6]和增进机体免疫力等作用。WANG等[7]通过构建C-PC/CMC-CD59sp 纳米颗粒,将C-PC高效转运至癌细胞内发挥杀伤作用。本研究以TGF-β1诱导的HeLa细胞作为研究对象,探讨C-PC抑制宫颈癌HeLa细胞增殖迁移活性的作用机制,为C-PC在临床上的应用提供理论依据。
1 材料与方法
1.1 实验材料
人宫颈癌HeLa细胞株受赠于青岛大学附属医院。试剂级C-PC粉末购于中国台州宾美生物技术有限公司;胎牛血清(FBS)购于以色列BI生物科技公司;DMEM高糖培养液购于美国Hyclone公司;青链霉素混合液购于苏州新赛美生物科技有限公司;PBS购于山东思科捷生物技术有限公司;重组人TGF-β1购于美国Peprotech有限公司;1 g/L结晶紫购于索莱宝公司;CCK-8试剂盒、BCA试剂盒及反转录试剂盒购自Biosharp白鲨生物科技公司;抗人E-cadherin、N-cadherin、Vimentin一抗购自美国Cell Signaling Technology公司;HRP标记的二抗购自南京巴傲德生物科技有限公司;ECL试剂盒购自上海雅酶生物科技有限公司;RNA提取试剂盒购自山东思科捷生物技术有限公司;PCR引物购自上海生工生物工程有限公司;qPCR试剂盒购自赛维尔生物科技有限公司。
1.2 实验方法
1.2.1细胞培养及分组 HeLa细胞加入含体积分数0.10胎牛血清及体积分数0.01青链霉素混合液的DMEM高糖培养液,恒温培养箱中培养,培养箱内温度为37 ℃、含体积分数0.05 CO2、95%的相对饱和湿度。当细胞培养至融合度达到80%~90%时进行细胞传代,传至2~3代时,取处于对数生长期且生长状态良好的细胞进行实验。实验分为4组,每组设置3个复孔。以DMEM高糖培养液培养的HeLa细胞作为对照组,10 μg/L TGF-β1处理的HeLa细胞作为TGF-β1处理组,200 mg/L C-PC处理的HeLa细胞作为C-PC处理组,以10 μg/L TGF-β1和200 mg/L C-PC处理HeLa细胞作为TGF-β1+C-PC共同处理组。
1.2.2CCK-8法测定C-PC对HeLa细胞增殖能力的影响 取处于对数生长期的HeLa细胞,胰蛋白酶消化制成细胞悬液,调整细胞密度为1×105/L,加入96孔板中。在5个孔中加入无细胞培养液作为空白组,每孔100 μL,置于培养箱中孵育过夜;应用不同浓度的C-PC溶液(终浓度分别为0、50、100、200、400、800、1 600 mg/L)处理细胞,每个浓度设置5个复孔,分别培养24、48 h后,将溶液换为PBS并加CCK-8工作液,置于培养箱中反应4 h。用酶标仪检测450 nm波长处光密度(D)值,并计算每组细胞存活率。细胞存活率=(C-PC处理组D值-空白组D值)/(0 mg/L组D值-空白组D值)×100%。计算半抑制浓度(IC50)值并选取整数浓度作为后续实验浓度。
1.2.3细胞平板克隆形成实验检测HeLa细胞克隆形成能力 将HeLa细胞制成单细胞悬液,以每孔1 000个细胞接种到6孔板中,按照1.2.1方法分组处理,将培养液补齐至3 mL,晃动培养板,使细胞均匀分布在孔内,置于培养箱中培养8~16 d,每3 d换液1次;当6孔板中出现肉眼可见的克隆斑时,终止培养。弃培养液,用PBS洗2~3次后,每孔加入40 g/L多聚甲醛1 mL固定细胞克隆20 min。弃固定液,加入适量结晶紫染色15 min,流水清洗,室温下干燥,观察并拍照,对克隆集落进行计数。
1.2.4Transwell实验检测HeLa细胞迁移能力使用无血清培养液预处理8.0 μm孔径的Transwell小室,将饥饿处理12 h的HeLa细胞消化离心后,用无血清培养液重悬计数,取200 μL细胞悬液(1×108/L)离心后,按1.2.1方法分组并加入相应药物200 μL重悬,接种于上室;下室加入600 μL含体积分数0.20胎牛血清的培养液,置培养箱中培养48 h后取出小室,弃上清,PBS洗2次并用棉签擦拭内室,细胞固定液固定30 min,结晶紫染色15 min,PBS洗2次,晾干。荧光显微镜下随机选取5个视野拍照并进行细胞计数,计算每孔平均细胞数。
1.2.5荧光定量PCR(qPCR)方法检测迁移相关因子Slug、Snail、Zeb1、TwistmRNA的表达 将HeLa细胞按照1.2.1方法分组铺入6孔板,加药处理48 h后以PBS洗3次,胰蛋白酶消化,收集细胞,使用RNA提取试剂盒提取细胞总RNA,用核酸蛋白检测仪测定浓度并鉴定纯度。在以下反应条件下将总RNA反转录合成cDNA:25 ℃、5 min,42 ℃、30 min,85 ℃、5 min。用荧光定量PCR仪使用三步法行qPCR扩增及检测,反应条件:95 ℃预变性30 s,95 ℃、15 s,60 ℃、10 s,72 ℃、30 s,共进行40个循环。采用2-△△CT法计算迁移相关因子mRNA相对表达水平。qPCR反应引物及其序列见表1。

表1 qPCR引物及其序列
1.2.6Western blot方法检测HeLa细胞迁移相关蛋白表达 将HeLa细胞培养液换为无血清培养液饥饿处理12 h后,按照1.2.1方法分组处理48 h后,用PBS冲洗,加入含体积分数0.01蛋白酶抑制剂(PMSF)的RIPA裂解液,将细胞刮下后转移至EP管中,置于冰上裂解30 min,在预冷的4 ℃离心机中12 000 r/min离心15 min,将上清转移至新EP管中,BCA法测定蛋白浓度。取蛋白样品按1∶4比例加入SDS-PAGE Loading Buffer后恒温变性10 min,每孔吸取30 μg蛋白上样,以溴酚蓝作为指示剂,浓缩胶层恒压80 V电泳,至分离胶层时电压调至120 V继续恒压电泳,待测样品电泳至分离胶底部时,停止电泳。恒流300 mA湿转80 min转至PVDF膜上,置于摇床上室温封闭20 min,TBST洗3次。加入一抗4 ℃孵育过夜,TBST洗3次;加入HRP标记的山羊抗兔二抗室温孵育2 h,TBST洗3次。在暗室使用凝胶成像仪和ECL试剂盒对膜进行发光成像,应用Image J软件将各条带灰度值量化,分析HeLa细胞迁移相关蛋白E-cadherin、 N-cadherin和Vimentin表达。
所有实验均重复3次。
1.3 统计学处理
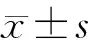
2 结 果
2.1 C-PC对TGF-β1诱导的HeLa细胞增殖活力的影响
CCK-8检测显示,C-PC处理HeLa细胞24、48 h,细胞增殖活力均受到明显抑制,且呈浓度依赖性(F=189.300、127.400,P<0.05),处理24、48 h的IC50值分别为255.4、387.0 mg/L,设置实验C-PC的工作浓度为200 mg/L。细胞平板克隆实验结果显示,培养15 d时,对照组、TGF-β1处理组、C-PC处理组、TGF-β1+C-PC共同处理组HeLa细胞集落形成数分别为405.0±14.7、620.0±37.2、364.3±20.3、140.3±13.0,TGF-β1处理组细胞的集落数较对照组明显增多,TGF-β1+C-PC共同处理组细胞集落数量则较TGF-β1处理组明显下降,C-PC单独处理组较对照组形成集落数量明显减少(FTGF-β1=176.718,P<0.001;FC-PC=248.265,P<0.001;FTGF-β1×C-PC=0.047,P=0.792)。见图1。

A、B:不同浓度C-PC处理24、48 h对HeLa细胞增殖的影响(A:与0 mg/L浓度C-PC比较,***F=189.300,P<0.05;B:与0 mg/L浓度C-PC比较,***F=127.400,P<0.05)。C:细胞平板克隆法检测各组HeLa细胞集落形成能力。
2.2 C-PC对TGF-β1诱导的HeLa细胞迁移影响
Transwell实验结果显示,对照组、TGF-β1处理组、C-PC处理组、TGF-β1+C-PC共同处理组细胞迁移数分别为94.2±9.1、129.4±14.8、57.8±7.5、89.2±6.4,TGF-β1处理组细胞迁移能力较对照组显著增强,TGF-β1+C-PC共同处理组细胞迁移能力较TGF-β1处理组明显减弱,C-PC单独处理组与对照组相比细胞迁移能力明显受抑制(FTGF-β1=44.543,FC-PC=58.923,P<0.001;FTGF-β1×C-PC=0.145,P=0.708)。见图2。

荧光显微镜下观察各组HeLa细胞迁移情况(结晶紫染色,20倍)。
2.3 各组HeLa细胞中迁移相关基因转录因子的mRNA表达比较
qPCR检测结果显示,加药处理48 h后,TGF-β1处理组HeLa细胞内迁移相关因子Slug、Snail、Zeb1、Twist的mRNA表达显著高于对照组,TGF-β1+C-PC共同处理组相关转录因子mRNA表达较TGF-β1处理组明显下降,而C-PC单独处理组与对照组相比相关转录因子mRNA表达水平显著降低(Zeb1:FTGF-β1=34.906,FC-PC=20.194,P<0.01;FTGF-β1×C-PC=4.301,P=0.077。Slug:FTGF-β1=47.541,FC-PC=47.504,P<0.01;FTGF-β1×C-PC=3.682,P=0.091。Snail:FTGF-β1=25.335,FC-PC=16.115,P<0.01;FTGF-β1×C-PC=1.849,P=0.223。Twist:FTGF-β1=21.407,FC-PC=36.926,P<0.01;FTGF-β1×C-PC=3.062,P=0.118)。见表2。

表2 各组HeLa细胞中迁移相关因子基因表达比较
2.4 各组HeLa细胞迁移相关蛋白表达比较
Western blot结果显示,TGF-β1处理组HeLa细胞内Vimentin、N-cadherin蛋白表达水平显著高于对照组,TGF-β1+C-PC共同处理组较TGF-β1处理组明显降低,而C-PC单独处理组则显著低于对照组,差异均具有显著意义(Vimentin:FTGF-β1=75.186,FC-PC=94.592,FTGF-β1×C-PC=5.581,P<0.05;N-cadherin:FTGF-β1=570.129,FC-PC=1 071.323,FTGF-β1×C-PC=87.994,P<0.01)。TGF-β1处理组细胞内E-cadherin的表达水平较对照组显著降低,TGF-β1+C-PC共同处理组较TGF-β1处理组明显升高,而C-PC单独处理组与对照组相比显著升高,差异有显著性(FTGF-β1=470.038,FC-PC=286.287,FTGF-β1×C-PC=41.870,P<0.01)。见图3、表3。

图3 各组HeLa细胞迁移相关蛋白表达Western blot检测

表3 各组HeLa细胞中细胞迁移相关蛋白表达的比较
3 讨 论
宫颈癌是女性中第四大常见癌症,并且是世界上一些贫穷国家癌症死亡的主要原因[8]。大多数宫颈癌病人被诊断时已经是晚期且已发生转移,治愈难度高。因此,一直以来,寻找特异性高、副作用小的天然抗癌药物是国内外研究的热点。
癌症晚期病人癌细胞易发生浸润迁移,转移癌比原发癌的治愈难度更大,病死率更高。TGF-β在人类癌症发展过程中的作用具有二重性,在癌前细胞中,TGF-β主要起抑癌作用;而在癌症晚期,TGF-β信号转导发挥促进肿瘤细胞迁移的作用[9]。因此,抑制TGF-β的促细胞迁移作用能够有效抑制晚期肿瘤的发展。
C-PC能够抑制多种癌细胞的增殖和迁移,促进其凋亡。JIANG等[10]研究发现,C-PC能够抑制三阴性乳癌MDA-MB-231细胞增殖、迁移,同时能够激活p38 MAPK和JNK信号通路,抑制ERK通路,诱导细胞凋亡。LIU等[11]研究发现,C-PC抗肝癌的作用机制包括肿瘤发生早期的血细胞损伤、线粒体介导的凋亡及自噬抑制,为肿瘤的治疗提供了相对安全的途径。JI等[12]研究表明,C-PC可逆转TGF-β1诱导的宫颈癌细胞上皮向间充质转化,下调TGF-β/samd信号通路诱导的肿瘤细胞周期G0/G1阻滞。HAO等[13]首次提出C-PC通过下调非小细胞肺癌细胞的RIPK1/NF-κB活性发挥抗增殖和抗迁移功能。LIU等[14]构建能够靶向作用于HeLa细胞C-PC/CMC-CD55sp纳米微球,提高了C-PC抑制癌细胞增殖并诱导凋亡的效率。但有关C-PC对于转移性宫颈癌的作用及机制研究的报道较少。本文研究通过TGF-β1诱导宫颈癌HeLa细胞转移,探讨C-PC对宫颈癌细胞转移的作用及其机制。研究结果显示,C-PC能够明显抑制TGF-β1诱导的HeLa细胞增殖和迁移。
大部分癌细胞的增殖迁移能力较强,癌变细胞钙黏蛋白表达的变化表现为E-cadherin表达减少和N-cadherin表达增加。已有研究发现,E-cadhe-rin蛋白表达的丧失与晚期肿瘤细胞运动性增加、转移能力增强密切相关[15]。NAVARRO等[16]研究结果表明,诱导增加缺乏E-cadherin的癌细胞中E-cadherin的表达量可以阻止肿瘤的进展和侵袭,因此E-cadherin成为经典的肿瘤抑制因子。与E-cadherin对肿瘤细胞的进展和侵袭抑制作用相反,N-cadherin赋予肿瘤细胞更强的迁移和侵袭能力,该作用与E-cadherin的表达无关[17-18]。研究显示,N-cadherin的异常表达与恶性肿瘤的转化、黏附、凋亡、血管生成、侵袭转移等多方面密切相关,N-cadherin可能成为肿瘤侵袭转移的治疗靶点[19]。Vimentin是中间丝蛋白质的一种,对细胞的活动性有重要的作用,Vimentin能够促进癌细胞迁移,在运动细胞和侵袭细胞中的表达水平较高[20]。本研究结果显示,TGF-β1诱导HeLa细胞内N-cadherin、Vimentin高表达,E-cadherin低表达,C-PC则能逆转HeLa细胞内的这种变化。本实验还检测了TGF-β1和C-PC对迁移相关标志性因子Twist、Zeb1、Slug、Snail表达的影响,结果显示,TGF-β1诱导HeLa细胞内Twist、Zeb1、Slug、Snail表达水平升高,C-PC与TGF-β1共处理则降低了这些因子的表达水平。Twist表达的增加与肿瘤的侵袭和转移直接相关,并介导E-cadherin的丢失,Slug是Twist诱发的癌细胞转移的重要递质[21],Snail在E-cadherin启动子上发挥阻遏活性[22],Snail和Twist协同作用控制Zeb1的表达量[23]。
综上所述,TGF-β1可以诱导宫颈癌HeLa细胞的增殖、迁移,而C-PC能够明显逆转TGF-β1诱导的HeLa细胞增殖和迁移,其机制主要与C-PC降低迁移相关因子的表达及调节E-cadherin、Vimen-tin和N-cadherin的蛋白表达水平有关。而C-PC是如何作用于癌细胞实现这一功能的是我们接下来研究的重点。本文研究结果为宫颈癌的晚期临床治疗提供了新思路。
