芒果MiNAC1基因的功能研究
2022-09-16杨小州周少丽何新华余海霞陆婷婷
杨小州,周少丽,何新华,刘 源,余海霞,陆婷婷,王 卓,罗 聪
芒果基因的功能研究
杨小州*,周少丽*,何新华**,刘 源,余海霞,陆婷婷,王 卓,罗 聪**
亚热带农业生物资源保护与利用国家重点实验室/植物科学国家级实验教学示范中心/广西大学农学院,广西南宁 530004
NAC转录因子在植物非生物逆境胁迫应答中发挥重要作用,研究芒果基因的功能为芒果的抗逆性育种提供基因资源。干旱、盐和低温等非生物胁迫严重影响芒果的生长发育。前期研究中,课题组从芒果逆境胁迫转录组中获得了一个基因,表达模式分析发现其与芒果的逆境胁迫应答有关。本研究对芒果基因的功能进行了验证。将芒果基因构建到pBI121-MiNAC1超量表达载体中,并利用农杆菌介导的花序浸染法转化野生型拟南芥,对获得的T3代纯合株系进行表型观察分析和逆境胁迫处理。结果显示,转芒果基因与野生型拟南芥的表型类似,转基因不影响拟南芥的莲座叶数量、抽薹时间、开花时间以及开花时的植株高度。逆境胁迫处理:分别用0、200、300、400 mmol/L甘露醇进行干旱胁迫;用0、100、150、200 mmol/L NaCl进行盐胁迫;4℃低温胁迫处理转基因与对照拟南芥植株。结果显示:随着甘露醇处理浓度的增加,转基因株系与对照组拟南芥的根系生长发育均受到抑制,但转基因株系受到抑制的影响显著小于对照组拟南芥,比如在300 mmol/L甘露醇处理时,转基因株系的根长显著增长,OE9的根长是WT的1.51倍,侧根数量显著增加,OE7的侧根数是WT的5倍,另外根冠比分析显示,转基因植株的根冠比显著高于对照植株,OE2的根冠比是WT的1.53倍。盐胁迫和低温胁迫也取得了类似的结果。以上结果表明转芒果基因可以通过增加转基因植株的根长和侧根数量提高其对干旱胁迫、盐胁迫和低温胁迫的抗性。本研究初步揭示了基因的功能,为深入研究基因参与调控芒果逆境胁迫调控网络奠定基础。
芒果;转录因子;;非生物胁迫;功能分析
NAC(NAM、ATAF1/2、CUC1/2)是植物特有的一类转录因子家族,广泛存在于陆生植物中[1]。NAC转录因子的C末端为高度变异的转录调控区,N端为高度保守的5个亚结构域[2]。NAC转录因子结构的多样性使得NAC转录因子功能多样化[3],植物NAC转录因子参与植物根、茎、叶等组织的生长发育以及调控次生代谢产物的合成,而且逆境胁迫方面功能显著,尤其是非生物逆境胁迫。植物NAC转录因子在调控植物侧根的生长发育上发挥着重要作用,掌叶大黄基因在一年生植株的根中表达量最高[4]。花生在不同器官中的表达量分析显示在侧根中最高[5],过量表达基因使拟南芥侧根数增多[6]。同时玉米在胚芽鞘中大量表达,促进茎尖分生组织的形成[7],说明植物NAC转录因子在植物茎的生长发育中起一定作用。植物NAC转录因子还对调控叶片衰老发挥着重要作用,拟南芥过表达基因可提高脱落酸合成基因的表达,积累脱落酸促进拟南芥叶片衰老[8]。过量表达甜瓜基因的拟南芥植株叶片衰老也明显加速[9]。烟草基因的过表达导致拟南芥叶片提前衰老[10]。植物NAC转录因子在调控次生代谢产物合成中也发挥着重要作用。番木瓜的果实成熟过程中,番木瓜转录因子能够促进类胡萝卜素的生物合成[11]。在菠萝的成熟过程中基因对果实的形成和发育有促进作用而且参与到逆境胁迫响应[12]。植物NAC转录因子在非生物逆境方面功能明显,一直是现在研究的热点。在高盐处理下,火龙果的上调表达[13],水稻通过促进根系发育提高过表达转基因棉花的耐旱耐盐性[14];油茶基因的表达模式与其抗旱性有关[15]。在模拟干旱和高盐胁迫处理下,梭梭表达量均显著上调[16]。大麦基因的过表达使其在干旱胁迫下气孔阻力增加,通过保证充足的光合作用提高抗旱性[17]。在低温环境下甘薯NAC转录因子有25个NAC基因差异表达[18],苹果基因负调控苹果的抗冷能力[19]。
芒果(L.)属于漆树科芒果属乔木,芒果营养丰富深受消费者的青睐,素有“热带水果之王”美称[20]。非生物胁迫影响芒果的生长发育、产量以及果实品质。前期研究中,本课题组从‘四季蜜芒’中分离获得了1个基因,表达模式分析显示其在低温、干旱和盐胁迫诱导其表达,推测其可能在芒果逆境胁迫应答中发挥作用[21]。本研究构建了基因的过量表达载体,并转化到模式植物哥伦比亚野生型拟南芥中,采用干旱胁迫、盐胁迫和低温胁迫以验证过量表达基因的功能。
1 材料与方法
1.1 材料
逆境胁迫材料种植于广西大学农学院标本园,拟南芥为哥伦比亚型拟南芥(wild type, WT)保存于本实验室。
1.2 方法
1.2.1 拟南芥转化、筛选和鉴定 将前期课题组已经构建好的过量表达载体pBI121-MiNAC1,通过花期侵染法转化野生型拟南芥[22]。收取种子后,播种在1/2 MS(50 mg/L Kan)培养基上,筛选出阳性植株。待长至4片真叶时,移栽到基质中在长日照条件下进行培育。提取阳性苗DNA进行PCR检测,检测引物为载体公用引物35SFu和基因特异引物MiNAC1d,对于检测为阳性的植株进行继续培育,直到获得T3代纯合植株。
转基因植株半定量检测:利用HiPure HP Plant RNA Mini Kit试剂盒提取T3代拟南芥叶片的总RNA,逆转录为cDNA,稀释cDNA浓度为100 ng/µL。以拟南芥为内参基因,芒果以qNAC1u(上游引物)和qNAC1d(下游引物)为特异引物,参考WANG等[23]的方法进行半定量检测,检测芒果基因在转基因拟南芥中的表达水平。引物序列见表1。
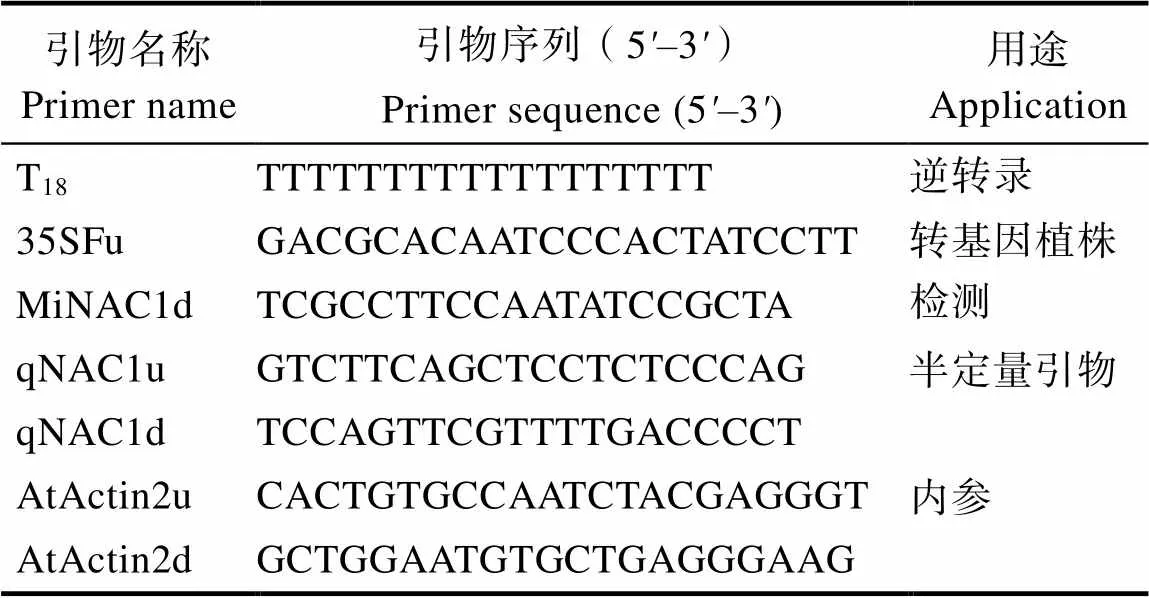
表1 本研究所用引物序列
1.2.2 过量表达拟南芥株系的表型分析 在长日照条件下以WT为对照,观察转入芒果基因对拟南芥生长发育的影响。
1.2.3 过量表达拟南芥株系的逆境处理 逆境胁迫处理,将播种6 d的幼苗(WT、OE2、OE7、OE9)分别移栽到经过不同逆境胁迫处理的1/2 MS培养基上。干旱胁迫:0、200、300、400 mmol/L的甘露醇处理;盐胁迫:0、100、150、200 mmol/L的NaCl处理。干旱胁迫和盐胁迫苗在22℃培养箱中垂直培养。低温胁迫:将苗置于22℃(常温)和4℃(低温)条件下进行处理。参考张辰明等[24]的方法,每个处理重复3次,处理10 d后对拟南芥主根长、侧根数(长于5 mm的根)及根冠比进行测量并拍照记录。根冠比=根鲜重÷鲜叶重。
1.3 数据处理
采用Microsoft Excel 2010和SPSS 22.0软件对数据进行整理、统计分析。
2 结果与分析
2.1 拟南芥转化与检测
通过PCR检测阳性植株是否转入目标基因,结果见图1A,转基因阳性植株均可以扩增出目标大小的条带,说明转化成功。提取转基因和对照拟南芥的叶片总RNA,逆转录为cDNA检测基因的表达量,结果见图1B,结果表明基因在转基因株系OE2、OE7和OE9植株中可以正常表达,而在WT和转空载体植株中不表达。

A:转MiNAC1拟南芥阳性植株PCR检测;B:对照和转MiNAC1拟南芥的半定量检测;C:过量表达MiNAC1拟南芥的表型分析。
2.2 过量表达的MiNAC1对拟南芥生长发育的影响
对T3代纯合株系的莲座叶、抽薹时间和开花时间以及开花时的植株高度与对照植株进行比较观察,发现转芒果基因对拟南芥的叶片形态、开花时间等表型没有明显的影响(图1C)。
2.3 过量表达的MiNAC1对拟南芥干旱胁迫的影响
本研究采用不同浓度甘露醇处理过量表达的株系(OE2、OE7、OE9)并测其根长、侧根数与根冠比。在0 mmol/L甘露醇的培养下过量表达的株系与WT之间的根长没有明显差异。随着甘露醇浓度的增大,WT与过量表达的株系的生长发育均受到抑制,叶片发黄变小,叶柄狭长,根长渐短,侧根增多。但过表达株系受到的抑制相对于WT较小(图2A~图2D)。在200、300、400 mmol/L浓度的甘露醇处理时,过量表达株系的根长比WT显著增长(图2E),侧根数显著增多(图2F),根冠比显著增大(图2G)。结果表明,转芒果基因可以显著提高转基因拟南芥对干旱的抗性。
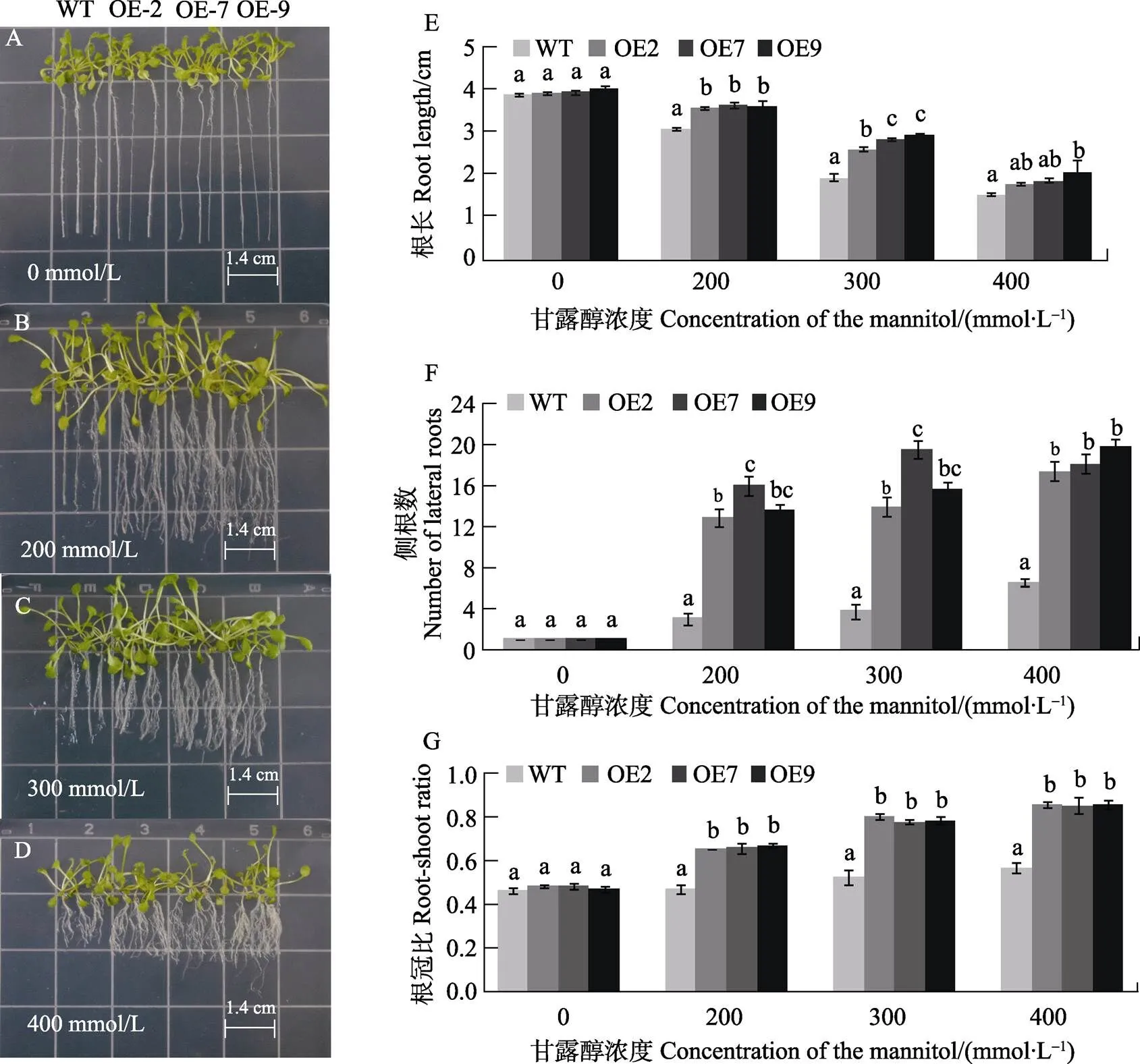
不同小写字母表示处理间差异显著(P<0.05)。
2.4 过量表达的MiNAC1对拟南芥盐胁迫的影响
本研究采用不同浓度NaCl处理WT与过量表达的株系(OE2、OE7和OE9)并测其根长、侧根数与根冠比。在0 mmol/L NaCl的处理下过量表达的株系与WT之间的根长,侧根数与根冠比没有明显差异,随着NaCl浓度的增大,WT与过量表达的株系的生长发育均受到抑制,表现出叶片发黄变白,根长渐短,侧根增多的现象。但过量表达的的生长发育受到的抑制不明显(图3A~图3D)。在100、150、200 mmol/L浓度的NaCl的处理下,过量表达的的根长比WT的显著增长(图3E),侧根数显著增多(图3F),根冠比显著增大(图3G)。结果表明,转芒果株系可以显著提高拟南芥对盐胁迫的抗性。
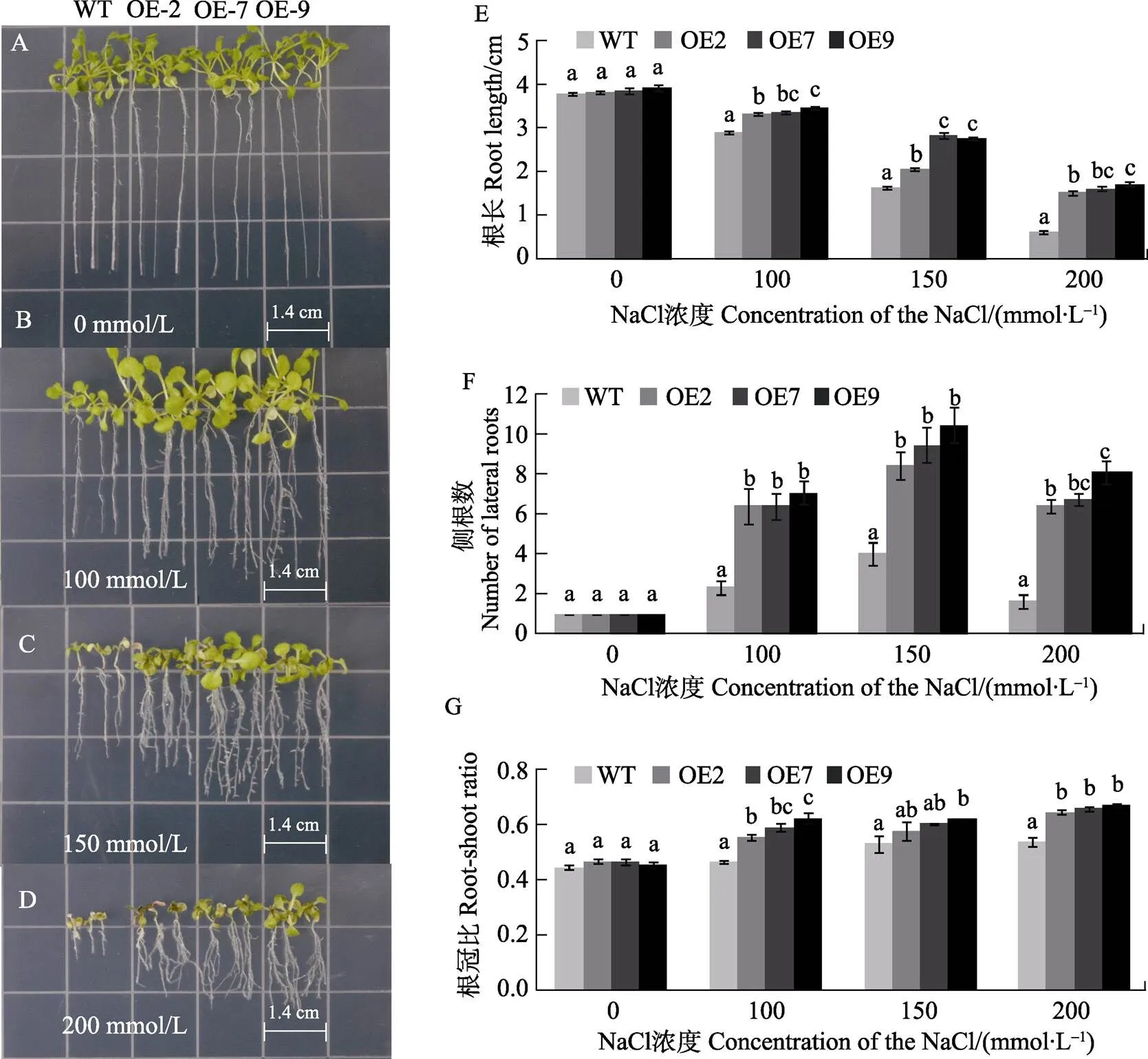
不同小写字母表示处理间差异显著(P<0.05)。
2.5 过量表达的MiNAC1对拟南芥低温胁迫的影响
本研究采用常温22℃和低温4℃处理WT与过量表达的株系(OE2、OE7、OE9)并测其根长、侧根数与根冠比。在常温22℃培养中,过量表达的株系和WT的生长发育均受到影响,在低温4℃处理下,过量表达的株系和WT表现出叶片小而厚,叶茎发红,植株生长弱小的现象,但是过量表达的株系受低温抑制的不明显(图4A、图4B、图4C)。在4℃的培养下,过量表达的株系的根长较WT的显著增长(图4C),侧根数显著增加(图4F),根冠比显著增加(图4G)。结果表明,转芒果株系可以显著提高转基因拟南芥对低温的抗性。
3 讨论
植物的生长发育受到非生物胁迫的影响,严重降低农作物的产量和品质。干旱胁迫、盐胁迫和低温胁迫是造成农作物损失最严重的非生物胁迫[25-26]。植物遭到胁迫后打破正常的生理代谢状态,以适应胁迫下的环境[27],比如沙芥幼苗根系的主根长、主根体积和根冠比随着干旱胁迫天数的延长不断增加[28]。转细叶百合基因的烟草幼苗在盐胁迫下其根长、鲜重和长势显著好于对照[29]。NAC转录因子对植物的生长发育和逆境胁迫应答等方面发挥着重要的调控作用[30]。植物NAC转录因子是一个大的基因家族,在应对逆境胁迫的功能方面一直被广泛关注。在前期研究中,课题组从芒果中分离克隆了一个基因,表达模式分析显示,低温、盐胁迫和干旱胁迫均影响其表达,说明基因与芒果的逆境胁迫应答有关[21]。
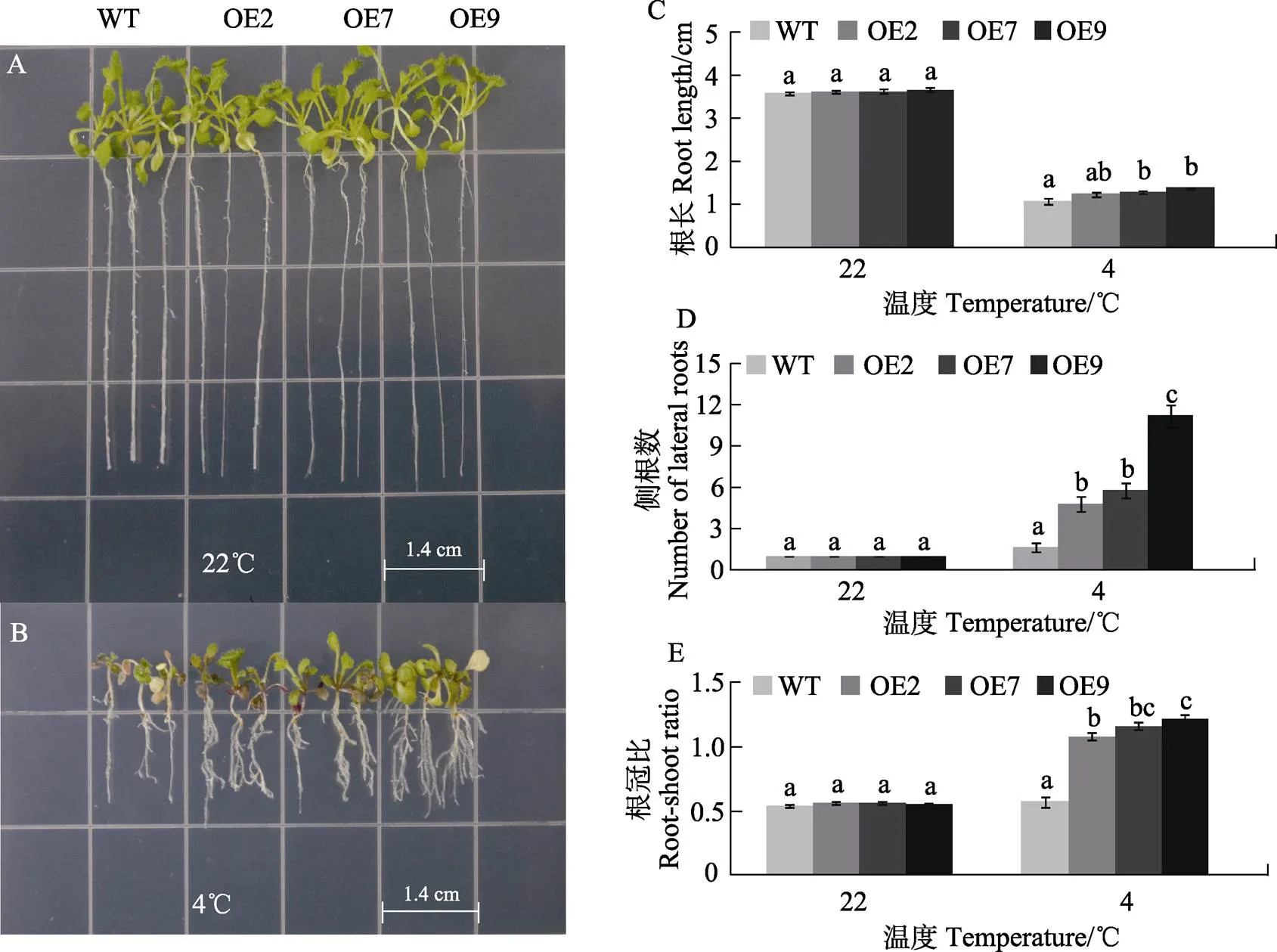
不同小写字母表示处理间差异显著(P<0.05)。
不同物种的基因均可以使其转基因植株提高对逆境胁迫的抗性,比如将水稻O基因转入棉花,过量表达的棉花在干旱和高盐胁迫下蒸腾速率下降,根系发育增强,提高了过量表达棉花的耐旱和耐盐性[14]。在干旱和盐胁迫培养下,过量表达的水仙基因可以提高烟草对干旱和盐胁迫的抗性[31]。番茄的表达模式分析显示其不但受干旱胁迫、盐胁迫和细菌病原体的诱导,与烟草空载相比在干旱和盐胁迫下过表达株系还表现出更多侧根数量和更长的根长[32]。说明植物在遭受逆境胁迫时通过增加主根的长度和须根的数量来应对逆境胁迫[33],本研究中,将芒果基因转入模式植物拟南芥中,在干旱胁迫、盐胁迫和低温胁迫下,转基因拟南芥和对照拟南芥的根系生长均受到抑制,但转基因拟南芥植株受到的抑制效应显著小于WT植株,而侧根数和根冠比也都大于WT,说明转芒果基因可以提高转基因拟南芥植株对干旱胁迫、盐胁迫和低温胁迫的抗性。
本研究中过表达拟南芥的主根增长,侧根数目显著增加,提高了株系的生物产量,且根冠比增大。说明芒果基因可以参与干旱胁迫、盐胁迫和低温胁迫的应答,具有提高芒果抗逆性的运用潜能。
[1] 荣 欢, 任师杰, 汪梓坪, 王 飞, 周 勇. 植物NAC转录因子的结构及功能研究进展[J]. 江苏农业科学, 2020, 48(18): 44-53.
RONG H, REN S J, WANG Z P, WANG F, ZHOU Y. Research progress on structure and function of plant NAC transcription factors[J]. Jiangsu Agricultural Sciences, 2020, 48(18): 44-53. (in Chinese)
[2] MOHANTA T K, YADAV D, KHAN A, HASHEM A, TABUSSUM B, KHAN A L, ABD A E F, AL H A. Genomics, molecular and evolutionary perspective of NAC transcription factors[J]. PLoS One, 2020, 15(4): e0231425.
[3] DIAO P, CHEN C, ZHANG Y, MENG Q W, LV W, MA N N. The role of NAC transcription factor in plant cold response[J]. Plant Signaling & Behavior, 2020, 15(9): 1785668.
[4] 梁小燕, 李元敏, 李依民, 李 慧, 杜 鹃, 张明英, 高 静, 彭 亮, 张 岗. 掌叶大黄基因的克隆、亚细胞定位及表达分析[J]. 中草药, 2021, 52(23): 7302-7308.
LIANG X Y, LI Y M, LI Y M, LI H, DU J, ZHANG M Y, GAO J, PENG L, ZHANG G. Cloning, subcellular localization, and expression analysis offrom[J]. Chinese Herbal Medicines, 2021, 52(23): 7302-7308. (in Chinese)
[5] 李鹏祥. 花生NAC转录因子在干旱响应中的作用[D]. 济南: 山东师范大学, 2021.
LI P X. The roles of NAC transcription factors in responses to drought stress in peanut[D]. Jinan: Shandong Normal University, 2021. (in Chinese)
[6] SINGH S, KOYAMA H, BHATI K K, ALOK A. The biotechnological importance of the plantspecific NAC transcription factor family in crop improvement[J]. Journal of Plant Research, 2021, 134(3): 475-495.
[7] ZIMMERMANN R, WERR W. Pattern formation in the monocot embryo as revealed by NAM and CUC3 orthologues fromL[J]. Plant Molecular Biology, 2005, 58(5): 669-685.
[8] RENT,WANG J,ZHAO M,GONG X S G,ZHOU C. Involvement of NAC transcription factor SiNAC1 in a positive feedback loop via ABA biosynthesis and leaf senescence in foxtail millet[J]. Planta, 2018, 247(1): 53-68.
[9] CAO S X, ZHANG Z B, WANG C H, GUO C, YANG L, GUO Y. Identification of a novel melon transcription factor CmNAC60 as a potential regulator of leaf senescence[J]. Genes, 2019, 10(8): 584.
[10] LI W, LI X X, CHAO J T, ZHANG Z L, WANG W F, GUO Y F. NAC family transcription factors in tobacco and their potential role in regulating leaf senescence[J]. Front Plant Science, 2018, 9: 1900
[11] FU C C, HAN Y C, FAN Z Q, CHEN J Y, CHEN W X, LU W J, KUANG J F. The papaya transcription factormodulates carotenoid biosynthesis through activating phytoene desaturase genesduring fruit ripening[J]. Journal of Agricultural and Food Chemistry, 2016, 64(27): 5454-5463.
[12] 谭秦亮, 蔡元保, 杨祥燕, 李 穆, 李季东, 黄思婕, 程 琴, 庞新华, 朱鹏锦, 周全光. 菠萝NAC转录因子基因生物信息学及表达分析[J]. 热带作物学报, 2021, 42(2): 310-316.
TAN Q L, CAI Y B, YANG X Y, LI M, LI J D, HUANG S J, CHENG Q, PANG X H, ZHU P J, ZHOU Q G. Bioinformatics and expression analysis of a NAC transcription factor genein[J]. Chinese Journal of Tropical Crops, 2021, 42(2): 310-316. (in Chinese)
[13] 余欢欢, 杨 鵾, 沈天娇, 侯黔东, 文晓鹏. 火龙果miR164b-NAC调控关系在非生物胁迫下的应答作用[J]. 生物技术, 2021, 31(3): 209-216.
YU H H, YANG K, SHEN T J, HOU Q D, WEN X P. hpo-miR164b involved in pitaya () responses to abiotic stresses by regulating HpNAC expression[J]. Biotechnology, 2021, 31(3): 209-216. (in Chinese)
[14] LIU G Z, LI X L, JIN S X, LIU X Y, ZHU L F, NIE Y C, ZHANG X L. Overexpression of rice NAC geneimproves drought and salt tolerance by enhancing root development and reducing transpiration rate in transgenic cotton[J]. PLoS One, 2014, 9(1): e86895.
[15] 曹瑞兰, 李知青, 欧阳雯婷, 胡冬南, 周增亮, 苏文娟, 陈 霞, 刘 娟. 油茶NAC基因鉴定及对干旱胁迫响应分析[J]. 江西农业大学学报, 2021, 43(6): 1357-1370.
CAO R L, LI Z Q, OUYANG W T, HU D N, ZHOU Z L, SU W J, CHEN X, LIU J. Identification of NAC gene in camellia oleifera and analysisand of its response to drought stress[J]. Acta Agriculturae Universitatis Jiangxiensis, 2021, 43(6): 1357-1370. (in Chinese)
[16] 周亮第, 姚正培, 杨文艳, 刘 豪, 张振清, 王 波, 任燕萍, 张 桦. 梭梭基因克隆及特性分析[J]. 西北农业学报, 2021, 30(10): 1556-1564.
ZHOU L D, YAO Z P, YANG W Y, LIU H, ZHANG Z Q, WANG B, REN Y P, ZHANG H. Cloning and characteristic offrom(C.A.Mey.) Bunge ex Fenzl[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2021, 30(10): 1556-1564. (in Chinese)
[17] ABDALLAT A M A, AYAD J Y, ABU ELENEIN J M, AJLOUNI Z AL, HARWOOD W A. Overexpression of the transcription factor HvSNAC1 improves drought tolerance in barley (L.)[J]. Mol Breeding, 2014, 33(2): 401-414
[18] 黄小芳, 毕楚韵, 王和寿, 陈其俊, 胡韵卓, 陈选阳, 林世强. 甘薯NAC转录因子家族的全基因组鉴定与分析[J]. 热带作物学报, 2021, 42(7): 1831-1840.
HUANG X F, BI C Y, WANG H S, CHEN Q J, HU Y Z, CHEN X Y, LIN S Q. Genome-wide identification and analysis of NAC transcription factor family of[J]. Chinese Journal of Tropical Crops, 2021, 42(7): 1831-1840. (in Chinese).
[19] AN J P, RUI L, QU F J, WANG X F, HAO Y J. An apple NAC transcription factor negatively regulates cold tolerance via CBF dependent pathway[J]. Journal of Plant Physiology, 2018, 221: 74-80.
[20] 李日旺, 黄国弟, 苏美花, 周俊岸, 陈永森. 我国芒果产业现状与发展策略[J]. 南方农业学报, 2013, 44(5): 875-878.
LI R W, HUANG G D, SU M H, ZHOU J A, CHEN Y S. Status and developmental strategies of mango industry in China[J]. Journal of Southern Agriculture, 2013, 44(5): 875-878. (in Chinese)
[21] 余海霞, 罗 聪, 徐 趁, 何新华. 芒果转录因子NAC 的克隆与表达模式分析[J]. 分子植物育种, 2016, 14(1): 38-44.
YU H X, LUO C, XU C, HE X H. Molecular cloning and expression analysis of a NAC transcription factor from mango[J]. Molecular Plant Breeding, 2016, 14(1): 38-44. (in Chinese)
[22] BENT A. Arabidopsis thaliana floral dip transformation method[J]. Methods in Molecular Biology, 2006, 343: 87- 103.
[23] WANG Y H, HE X H, YU H X, MO X, FAN Y, FAN Z Y, LIU Y, LUO C. Overexpression of four MiTFL1 genes from mango delays the flowering time in transgenic[J]. BMC Plant Biology, 2021, 21: 407.
[24] 张辰明, 徐烨红, 赵海娟, 图尔迪, 沈其荣, 张亚丽. 不同氮形态对水稻苗期氮素吸收和根系生长的影响[J]. 南京农业大学学报, 2011, 34(3): 72-76.
ZHANG C M, XU Y H, ZHAO H J, TU E D, SHEN Q R, ZHANG Y L. Effects of different nitrogen forms on nitrogen uptake and root growth of rice at the seedling stage[J]. Journal of Nanjing Agricultural University, 2011, 34(3): 72-76. (in Chinese)
[25] 李瑞雪, 周 荣, 苏雪强, 汪泰初. 干旱对植物的影响及植物干旱适应性反应研究进展——以桑树为例[J]. 广西蚕业, 2021, 58(4): 29-37.
LI R X, ZHOU R, SU X Q, WANG T C. Effects of drought on plants and adaptive response of plant drought-Take mulberry as an example[J]. Guangxi Sericulture, 2021, 58(4): 29-37. (in Chinese)
[26] 孟繁昊, 王 聪, 徐寿军. 盐胁迫对植物的影响及植物耐盐机理研究进展[J]. 内蒙古民族大学学报(自然科学版), 2014, 29(3): 315-318, 373.
MENG F H, WANG C, XU S J. Advances in research on effects of salt stress on plant and the mechanism of plant salt tolerance[J]. Journal of Innner Mongolia University for Nationalities, 2014, 29(3): 315-318, 373. (in Chinese)
[27] 田富蓉. 浅谈植物抗旱生理研究进展与育种[J]. 种子科技, 2021, 39(20): 135-136.
TIAN F R. Research progress and breeding of plant drought resistance[J]. Seed Science & Technology, 2021, 39(20): 135-136. (in Chinese)
[28] 张希吏, 王 萍, 石 磊, 杨 静. 干旱胁迫对沙芥幼苗根系形态及抗氧化酶活性的影响[J]. 干旱地区农业研究, 2016, 34(3): 160-164.
ZHANG X L, WANG P, SHI L, YANG J. Root morphology and antioxidant enzyme activity of(L.) gaertn under drought stress[J]. Agricultural Research in the Arid Areas, 2016, 34(3): 160-164. (in Chinese)
[29] 崔 颖. 细叶百合基因的克隆与抗盐功能分析[D]. 哈尔滨: 东北林业大学, 2021.
CUI Y. Cloning and salt-resistant functional analysis ofgene from[D]. Ha’erbin: Northeast Forestry University, 2021. (in Chinese)
[30] 彭筱娜, 易自力, 蒋建雄. 植物抗寒性研究进展[J]. 生物技术通报, 2007(4): 15-18.
PANG X N, YI Z L, JIANG J X. Progress in the study of cold resistance in plant[J]. Biotechnology Bulletin, 2007 (4): 15-18. (in Chinese)
[31] 肖瑶宇, 李 琳, 李全超, 刘 洋, 陈晓静. ‘云香’水仙基因的克隆及功能分析[J]. 热带作物学报, 2019, 40(5): 913-921.
XIAO Y Y, LI L, LI Q C, LIU Y, CHEN X J. Cloning and functional analysis ofgene in‘YunXiang’[J]. Chinese Journal of Tropical Crops, 2019, 40(5): 913-921. (in Chinese)
[32] WANG G D, ZHANG S, MA X C, WANG Y, KONG F Y, MENG Q W. A stress-associated NAC transcription factor () from tomato plays a positive role in biotic and abiotic stresses[J]. Physiolgia Plantarum, 2016, 158(1): 45-64 .
[33] 毛 爽, 周万里, 杨 帆, 狄小琳, 蔺吉祥, 杨青杰. 植物根系应答盐碱胁迫机理研究进展[J]. 浙江农业学报, 2021, 33(10): 1991-2000. (in Chinese)
MAO S, ZHOU W L, YANG F, DI X L, LIN J X, YANG Q J. Research progress on mechanism of plant roots response to salt-alkali stress[J]. Acta Agriculturae Zhejiangensis, 2021, 33(10): 1991-2000. (in Chinese)
Functional Analysis of aGene in Mango
YANG Xiaozhou*, ZHOU Shaoli*, HE Xinhua**, LIU Yuan, YU Haixia, LU Tingting, WANG Zhuo,LUO Cong**
State Key Laboratory for Conservation and Utilization of Subtropical Agro-Bioresources / National Demonstration Center for Experimental Plant Science Education / College of Agriculture, Guangxi University, Nanning, Guangxi 530004, China
NAC transcription factors play important roles in the response to abiotic stress in plants. Studying the function of the mangogene may provide genetic resources for mango stress tolerance breeding. Abiotic stresses such as drought, salt and low temperature affect the growth and development of mango. In a previous study, agene was obtained from the transcriptome of mango stress samples, and the expression pattern analysis showed that it was related to the stress response of mango. In this study, the function of the mangogene was verified. The pBI121-MiNAC1 overexpression vector was constructed and transferred into the model plant. The T3 homozygous lines were used for phenotypic observation and stress treatment. The results showed that the phenotypes of the transgenic mangogene and WT wild-typewere similar with each other. The transgenic mangogene did not affect the number of rosette leaves, bolting time, flowering time and plant height at flowering. Transgenic and WTwere treated with Mannitol (0, 200, 300, 400 mmol/L), salt (0, 100, 150, 200 mmol/L) and low temperature stress at 4℃, respectively. Stress treatment was performed by comparing the changes in root length, lateral root number and root crown ratio with the transgenic and control plants. Under drought stress treatment, the root length of WT and transgenic plants was obviously inhibited with the concentration increase of mannitol treatment, but the degree of inhibition was significantly lower in transgenic lines than that of WT plants. The lateral root number increased, but the transgenic plants were significantly higher than that of WT plants. In addition, the root crown ratio of transgenic plants was also significantly higher than that of control plants. For example, under 300 mmol/L mannitol treatments, the root length increased significantly, with OE9 was 1.51 times longer than that of WT. The number of lateral roots increased significantly, with OE7 having 5 times more lateral roots than that of WT. The root crown ratio was significantly higher in transgenic plants than that in control plants, and that in OE2 was 1.53-fold higher than that of WT. Similar results were obtained under salt stress and low temperature stress. These results indicated that transgenic mangogene could improve the resistance of transgenic plants to drought stress, salt stress and low temperature stress by increasing root length and lateral root number. This study initially revealed the function ofgene, and laid a foundation for further study ofgene involved in regulating the regulatory network of mango stress.
mango; transcription factor;; abiotic stress; functional analysis
S667.7
A
10.3969/j.issn.1000-2561.2022.08.001
2022-01-25;
2022-03-04
国家现代农业产业技术体系广西芒果创新团队栽培与病虫害防治岗位项目(No. nycytxgxcxtd-2021-06-2);广西自然科学基金项目(No. 2014GXNSFBA118102);科技先锋队‘强农富农’‘六个一’专项行动(No. 202204)。
杨小州(1991—),男,硕士研究生,研究方向:果树分子生物学;*同等贡献作者:周少丽(1997—),女,本科生,研究方向:果树分子生物学。**通信作者(Corresponding author):何新华(HE Xinhua),E-mail:honest66222@163.com;罗 聪(LUO Cong),E-mall:22003luocong@163.com。
