虎奶菇菌丝体抗菌肽提取工艺优化及活性研究
2022-09-15张书会孙雪言马爱民
张书会 罗 璐 孙雪言 马爱民
(华中农业大学食品科学技术学院,湖北 武汉 430070)
抗菌肽(Antimicrobial peptides, AMPs)是含有100个以内氨基酸残基的多肽抗菌物质,具有广谱抑菌效果,对细菌、真菌、病毒以及寄生虫等均有抑制作用[1],被广泛应用于生物医药、食品及动物饲料加工领域。抗菌肽能够通过破坏微生物的细胞膜或靶向细胞内成分产生抑菌作用[2]。截至2022年5月,已有3 000多种抗菌肽被收录至抗菌肽数据库(https://aps.unmc.edu)中。然而这些抗菌肽主要来源于动物、植物和细菌,抗菌肽数据库中真菌来源的抗菌肽<1%。
虎奶菇(Pleurotustuber-regium)是一种既能形成菌核又能形成子实体的高温食用菌,广泛分布于热带和亚热带地区[3]。然而虎奶菇菌核和子实体的生长周期长,生物转化率低,因此常用液体深层发酵培养的菌丝体作为试验材料[4]。近年来,有关虎奶菇生物活性的研究主要集中于抗氧化活性[5]、抗肿瘤活性[6]、免疫调节活性[7]、抗炎活性[8]、抑菌活性[9]以及降血糖和降血脂活性[10]等方面。虎奶菇菌丝体中含有丰富的蛋白质和氨基酸[11],是天然抗菌肽的优质来源。但目前尚未见从虎奶菇菌丝体中提取抗菌肽的相关报道。
常见的抗菌肽制备方法主要包括酶解法、基因工程法、化学合成法以及微生物发酵法[12]。由于专一性强、反应条件温和以及过程易于控制等优点,酶解法成为目前制备抗菌肽最常用的方法[13]。因此,研究拟以虎奶菇菌丝体为原料,通过酶解法提取抗菌肽。在单因素试验的基础上结合响应面试验优化提取工艺,并对其抑菌活性进行研究,以期提高虎奶菇菌丝体抗菌肽的提取率和抑菌率,从而为虎奶菇菌丝体抗菌肽的进一步开发与利用提供依据。
1 材料与方法
1.1 供试菌株与主要试剂
虎奶菇菌株、金黄色葡萄球菌(ATCC25923)菌株、大肠杆菌(ATCC25922)菌株:华中农业大学食品科学技术学院食品微生物实验室;
木瓜蛋白酶、中性蛋白酶、碱性蛋白酶、风味蛋白酶、复合蛋白酶:上海源叶生物科技有限公司;
胰蛋白酶、牛血清白蛋白:德国Biofroxx公司;
福林酚:北京索莱宝科技有限公司;
乙醇、氢氧化钠、盐酸、四水合酒石酸钾钠:分析纯,国药集团化学试剂有限公司。
1.2 主要仪器与设备
真空冷冻干燥机:Beta2-8LD型,德国Christ公司;
台式电热干燥箱:202-00AB型,天津市泰斯特仪器有限公司;
数显恒温水浴锅:HH-4型,上海力辰邦西仪器科技有限公司;
台式pH计:ST 2100型,美国奥豪斯仪器有限公司;
超速冷冻离心机:Avanti J-E型,美国Beckman公司;
超净工作台:VD-1320型,北京东联哈尔仪器制造有限公司;
恒温培养摇床:KYC-1102C型,金坛市盛蓝仪器制造有限公司;
全自动酶标仪:Multiskan Skyhigh型,美国Thermo公司。
1.3 培养基
(1) PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂粉15 g,加蒸馏水至1 L,121 ℃高压灭菌20 min。
(2) 发酵培养基:葡萄糖20 g,酵母提取物5 g,磷酸二氢钾1 g,无水硫酸镁0.5 g,加蒸馏水至1 L,121 ℃高压灭菌20 min。
(3) LB培养基:胰蛋白胨10 g,NaCl 10 g、酵母提取物5 g,加蒸馏水至1 L,121 ℃高压灭菌20 min。
1.4 试验方法
1.4.1 液体深层发酵培养虎奶菇菌丝体 用孔径为0.5 cm的打孔器将PDA培养基上生长的虎奶菇菌丝体打孔后,用灭菌的镊子取8个菌丝块接种至100 mL液体发酵培养基中,32 ℃、120 r/min培养8 d。培养结束后,将其作为液体菌种,用灭菌的玻璃匀浆器磨匀,以5%的接种量接种至新的发酵培养基中。相同条件下培养8 d,过滤洗涤,收集菌丝体,并冷冻干燥,获得干燥的虎奶菇菌丝体。
1.4.2 样品脱脂 将冻干后的虎奶菇菌丝体研磨成粉末,于索氏提取器中用无水乙醇浸提6 h脱脂。脱脂后的菌丝于50 ℃烘干,粉碎过筛,即得到脱脂虎奶菇菌丝体粉末。
1.4.3 酶解法制备虎奶菇菌丝体抗菌肽 参照文献[14-15]并修改。称取1 g脱脂菌粉,以料液比(m菌粉∶V水)为1∶20 (g/mL)溶解后,添加蛋白酶于最适pH及温度下酶解3 h,加酶量为8 000 U/g。每隔1 h使用1 mol/L NaOH和1 mol/L HCl溶液维持体系中的pH恒定。反应结束,将虎奶菇菌丝体酶解液于沸水中水浴10 min,11 000 r/min离心30 min,收集上清液。
1.4.4 虎奶菇菌丝体抗菌肽的初步分离 根据文献[15-16]并修改。向酶解上清液中加入4倍体积的无水乙醇,使乙醇体积分数为80%,以除去酶解上清液中的多糖。混合液于4 ℃静置24 h,8 000 r/min离心15 min。将上清液旋转蒸发去除乙醇,加入一定体积的蒸馏水,-20 ℃放置过夜,真空冷冻干燥,获得虎奶菇菌丝体多肽粉末。
1.4.5 最适蛋白酶的筛选 分别用木瓜蛋白酶、中性蛋白酶、碱性蛋白酶、风味蛋白酶、复合蛋白酶和胰蛋白酶于其最适pH及温度下酶解制备虎奶菇菌丝体多肽(表1)。将各蛋白酶酶解制备的虎奶菇菌丝体多肽粉末于干燥皿中贮藏用于后续多肽得率及抑菌率的测定。

表1 不同蛋白酶的理论最适酶活条件Table 1 Theoretical optimal conditions for enzyme activity of different proteases
1.4.6 单因素试验 在蛋白酶筛选的基础上,根据其最适蛋白酶的理论最适酶活范围,分别考察酶解温度(30,35,40,45,50 ℃)、酶添加量(6 000,8 000,10 000,12 000,14 000 U/g)、pH(9.5,10.0,10.5,11.0,11.5)、酶解时间(1,2,3,4,5 h)和料液比(V水∶m菌粉)[1∶10,1∶15,1∶20,1∶25,1∶30 (g/mL)]对抗菌肽抑菌活性及得率的影响。
1.4.7 响应面试验 在单因素试验的基础上,确定响应面试验的三因素和三水平。并根据Design-Expert 10.0.7软件中的Box-Behnken中心组合设计原理设计响应面试验,优化虎奶菇菌丝体抗菌肽的最佳酶解条件。
1.4.8 多肽得率测定 参照文献[15]并修改。以牛血清白蛋白标准品浓度为横坐标,吸光度值OD500 nm为纵坐标绘制标准曲线,得线性回归方程y=0.769x+0.053 2(R2=0.998 2)。将多肽粉末加蒸馏水复溶,经50倍稀释后取100 μL于1.5 mL离心管中,加入500 μL碱性铜试液,25 ℃反应10 min,随后加入50 μL福林酚试剂混匀后继续反应30 min,用酶标仪测定500 nm 处吸光值。空白组用超纯水代替多肽溶液,按式(1)计算多肽得率。
(1)
式中:
R1——虎奶菇菌丝体多肽得率,%;
C——稀释后多肽溶液的质量浓度,mg/mL;
n——多肽的稀释倍数;
V——虎奶菇菌丝体酶解后获得上清液的体积,mL;
m——脱脂菌粉样品的质量,mg。
1.4.9 总糖含量测定 采用苯酚—硫酸法[17]。以葡萄糖含量为横坐标,OD490 nm为纵坐标,绘制总糖含量测定的标准曲线为y=7.007 4x+0.067 8(R2=0.999 7)。并按式(2)计算总糖含量。
(2)
式中:
R2——总糖含量,%;
C——稀释后酶解液中糖质量浓度,mg/mL;
n——酶解液的稀释倍数;
V——酶解液体积,mL;
m——脱脂菌粉样品的质量,mg。
1.4.10 抑菌活性测定 参照文献[18]的方法,按式(3)计算抑菌率。
(3)
式中:
Y——抗菌肽抑菌率,%;
A0——培养12 h后对照组混合液在OD600 nm处的吸光度;
A1——培养12 h后样品组混合液在OD600 nm处的吸光度。
1.4.11 最小抑菌浓度(MIC)测定 采用微量稀释法[19]。
1.4.12 数据处理 每组试验重复3次,采用Origin 2021软件绘制图形,Design Expert 10.0.7软件对响应面试验结果进行分析。
2 结果与分析
2.1 虎奶菇菌丝体抗菌肽的初步分离
由图1可知,醇沉法脱糖后酶解液中总糖含量仅为2.95%,远低于多肽含量,从而保证了多肽作为酶解液中抑菌的主要活性成分。此外,脱糖处理对酶解液中多肽含量的影响较小,脱糖处理前后酶解液中多肽含量分别为21.55%和20.43%,损失量较低。
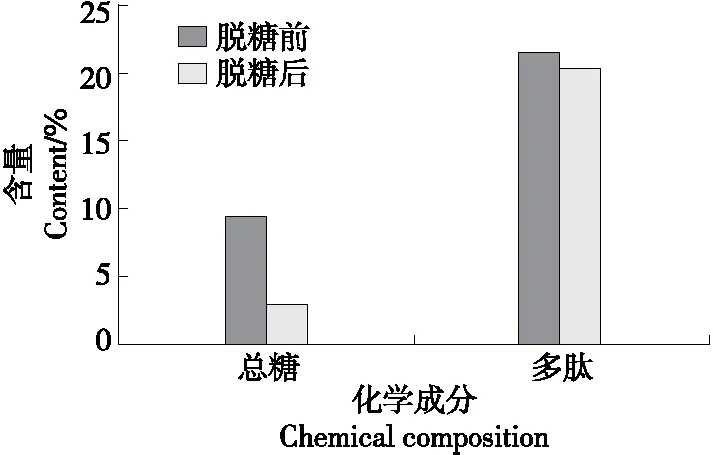
图1 脱糖前后酶解液中多肽及总糖含量变化Figure 1 Changes of polypeptide and total sugar contents in enzymatic hydrolysate before and after desugarization
2.2 最适蛋白酶的筛选
由图2可知,相比于其他蛋白酶,风味蛋白酶酶解制备的多肽得率最高,为18.59%。推测是因为风味蛋白酶是经复配而成的一种复合型蛋白酶,含有内切蛋白酶和外切肽酶,具有广泛的作用位点,水解更彻底,因此多肽得率较高[20]。其次对虎奶菇菌丝体多肽得率影响较大的是碱性蛋白酶(17.05%),是因为碱性蛋白酶主要作用于C-端的某些疏水性氨基酸残基,导致蛋白质结构疏松,能够获得较多的多肽[21]。林冰洁等[22]研究发现,相比于中性、复合和风味蛋白酶,碱性蛋白酶酶解制备的抗菌肽得率最高为88.88%,与试验结果相似。
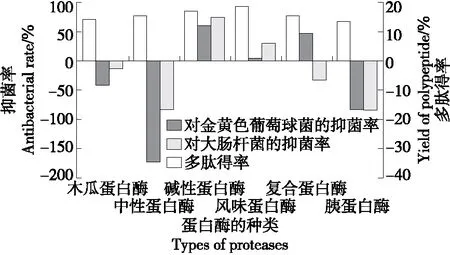
图2 不同蛋白酶对虎奶菇菌丝体多肽得率及 抑菌率的影响Figure 2 Effects of different proteases on the yield and antibacterial rate of PTRM-AMPs
碱性蛋白酶酶解产生的多肽对金黄色葡萄球菌和大肠杆菌均具有抑制作用,且抑菌活性最强,分别为61.10% 和75.30%,与马尚玄等[23]的结论类似。利用木瓜蛋白酶、中性蛋白酶和胰蛋白酶制备的多肽对金黄色葡萄球菌和大肠杆菌的生长存在不同程度的促进作用,可能是这些蛋白酶制备的多肽粉末中存在的含碳物质和含氮物质能够促进金黄色葡萄球菌和大肠杆菌的进一步生长发育[18-19]。宋伟光[24]研究发现,碱性蛋白酶酶解产物中分子量<1 kD的多肽比例最高,为86.5%。而木瓜蛋白酶和中性蛋白酶中分子量<1 kD的多肽比例相对较低,分别为73.1%和72.4%。林贺等[25]发现<1 kD的多肽组分对大肠杆菌和金黄色葡萄球菌的抑菌作用最显著。
综上,以多肽得率及多肽对金黄色葡萄球菌和大肠杆菌的抑菌率为评价指标,与其他5种蛋白酶相比,碱性蛋白酶酶解虎奶菇菌丝体得到的多肽不仅得率较高,其抑菌活性也最强。因此,选取碱性蛋白酶用于制备虎奶菇菌丝体抗菌肽。
2.3 单因素试验
2.3.1 酶解温度 由图3可知,当酶解温度为30~50 ℃时,抗菌肽得率和抑菌率呈先增加后降低的趋势,并在40 ℃时达最高,是因为过低的温度不利于蛋白酶与底物的结合,酶促反应延缓,因此得到的抗菌肽片段也相对较少,抑菌活性降低。随着酶解温度的增加,蛋白酶分子与底物分子之间自由碰撞概率增加,酶的催化效率也随之增加,能够促使底物产生更多的抗菌肽。酶解温度过高,蛋白酶的结构可能被破坏,酶活性降低,甚至失活,不利于抗菌肽的生成。因此选择40 ℃为最佳酶解温度。
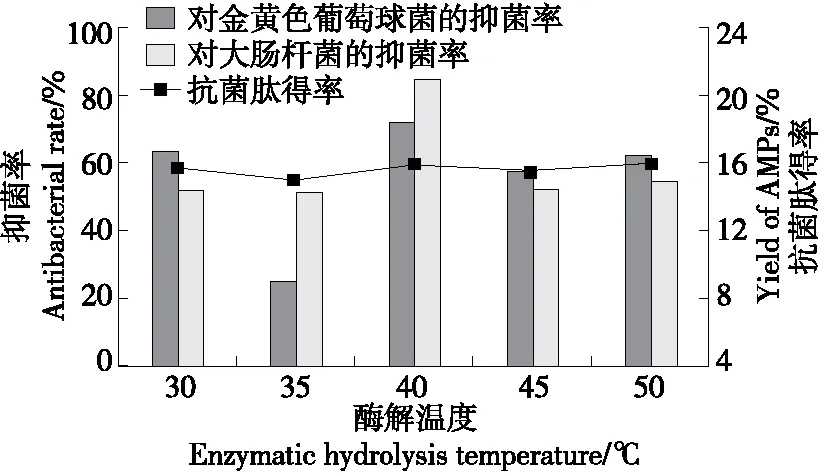
图3 酶解温度对虎奶菇菌丝体抗菌肽抑菌率及 得率的影响Figure 3 Effects of enzymatic hydrolysis temperature on antibacterial rate and yield of PTRM-AMPs
2.3.2 酶解时间 由图4可知,当酶解时间为1~3 h时,虎奶菇菌丝体抗菌肽对金黄色葡萄球菌的抑菌率逐渐增加,在3~5 h酶解范围内变化趋势平缓。抗菌肽得率及对大肠杆菌的抑菌率在酶解1~5 h时先上升后下降,且在酶解3 h时达最大值,分别为17.67%和84.75%。继续增加酶解时间,抗菌肽得率和抑菌率反而降低。这可能是因为更长的酶解时间使得具有抑菌活性的多肽被继续降解为氨基酸,进而导致抗菌肽减少,抑菌率下降。故选择3 h为最佳酶解时间。
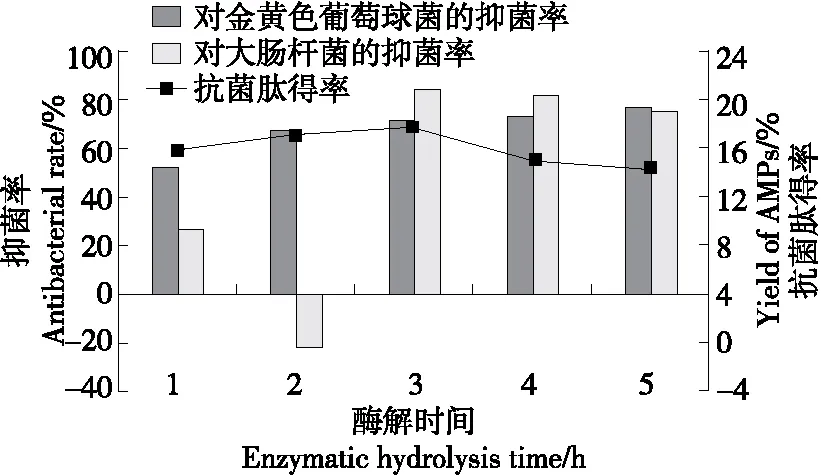
图4 酶解时间对虎奶菇菌丝抗菌肽抑菌率及 得率的影响Figure 4 Effects of enzymatic hydrolysis time on antibacterial rate and yield of PTRM-AMPs
2.3.3 pH 由图5可知,当pH为9.5~10.5时,抗菌肽得率无明显变化,继续增大pH,抗菌肽得率变大。这是因为碱性蛋白酶在碱性较高的环境下能够发挥更好的作用,从而促进抗菌肽的生成。当pH为9.5~11.0时,抗菌肽对金黄色葡萄球菌的抑菌率随pH的增大逐渐增加,并在pH为11.0时达最大值(74.03%),继续增大pH,抑菌率反而下降,是因为过高的pH易导致蛋白酶活性降低,甚至失活。虎奶菇菌丝体抗菌肽对大肠杆菌抑菌率在pH为9.5~10.5时随pH的增加逐渐增强,当pH为10.5,11.0时,抑菌率差异不显著,分别为84.75%和84.54%。当pH>11.0时,抑菌率下降。因此选择11.0为最佳酶解pH。

图5 pH对虎奶菇菌丝体抗菌肽抑菌率及得率的影响Figure 5 Effects of pH on antibacterial rate and yield of PTRM-AMPs
2.3.4 料液比 由图6可知,当料液比为1∶10~1∶20 (g/mL)时,虎奶菇菌丝体抗菌肽得率逐渐增加,抗菌肽对金黄色葡萄球菌和大肠杆菌的抑菌率也呈上升趋势。这是因为料液比较低时,底物黏稠,不能充分接触蛋白酶,不利于抗菌肽的提取。在一定水分含量范围内,随着料液比的增加,溶剂完全浸润样品,底物与蛋白酶充分接触,产生更多具有抗菌活性的多肽片段[26]。当料液比从1∶20 (g/mL)继续增加至1∶30 (g/mL)时,抗菌肽得率虽有所增加,但抑菌率降低,可能是随着料液比的进一步增加,样品中其他水溶性物质溶解度增加,抗菌肽抑菌率下降,甚至促进大肠杆菌的生长。因此,综合考虑,选择1∶20 (g/mL)为最佳料液比。
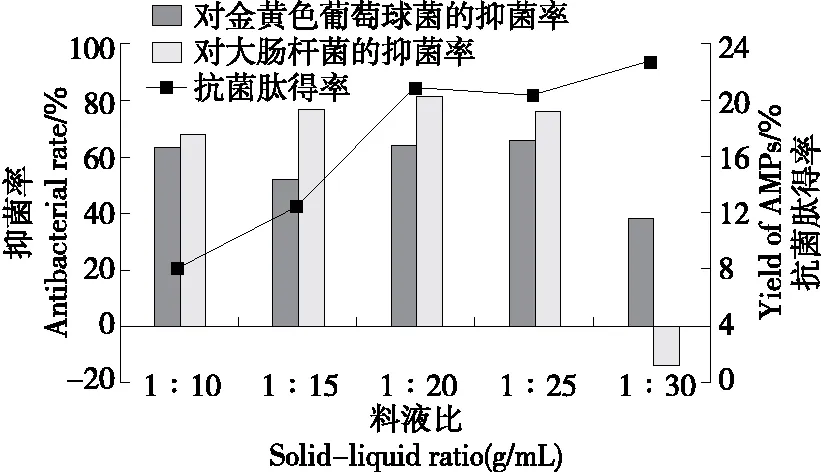
图6 料液比对虎奶菇菌丝体抗菌肽抑菌率及 得率的影响Figure 6 Effects of solid-liquid ratio on antibacterial rate and yield of PTRM-AMPs
2.3.5 酶添加量 由图7可知,抗菌肽对金黄色葡萄球菌的抑菌率在加酶量为6 000~8 000 U/g范围内平缓增加,在8 000~14 000 U/g范围内呈下降趋势。而抗菌肽得率和对大肠杆菌的抑菌率在加酶量为6 000~14 000 U/g时持续下降,是因为蛋白酶和底物的比例达到平衡时,能够生成较多的抗菌肽。蛋白酶添加量继续增加,底物质量保持不变,则会使得生成的抗菌肽进一步水解成活性较低的小分子肽或者无活性的氨基酸,抗菌肽含量及抑菌率下降。为节约成本,选择6 000 U/g为最佳酶添加量。
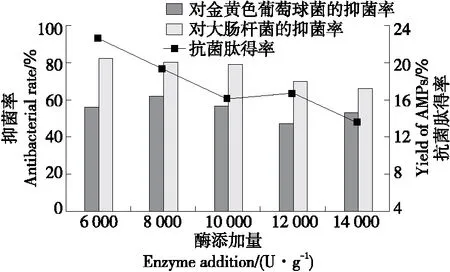
图7 酶添加量对虎奶菇菌丝体抗菌肽抑菌率及 得率的影响Figure 7 Effects of enzyme addition on antibacterial rate and yield of PTRM-AMPs
2.4 响应面优化
2.4.1 响应面试验设计与结果 根据单因素试验结果,固定料液比为1∶20 (g/mL),酶添加量为6 000 U/g,以酶解时间、pH和酶解温度为自变量,以抗菌肽对金黄色葡萄球菌和大肠杆菌的抑菌率为响应值,根据Design-Expert 10.0.7软件中的Box-Behnken中心组合设计原理进行响应面设计,因素水平见表2,试验设计及结果见表3。
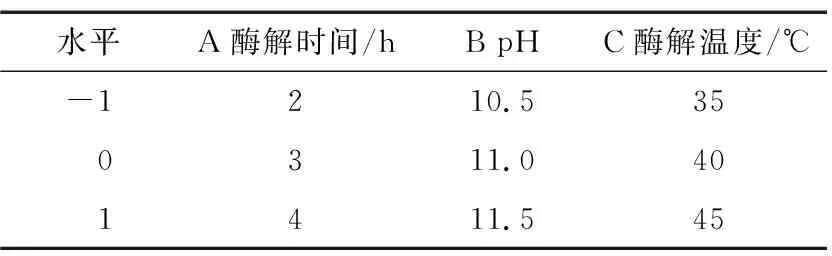
表2 响应面试验的因素和水平Table 2 Factors and levels of response surface test
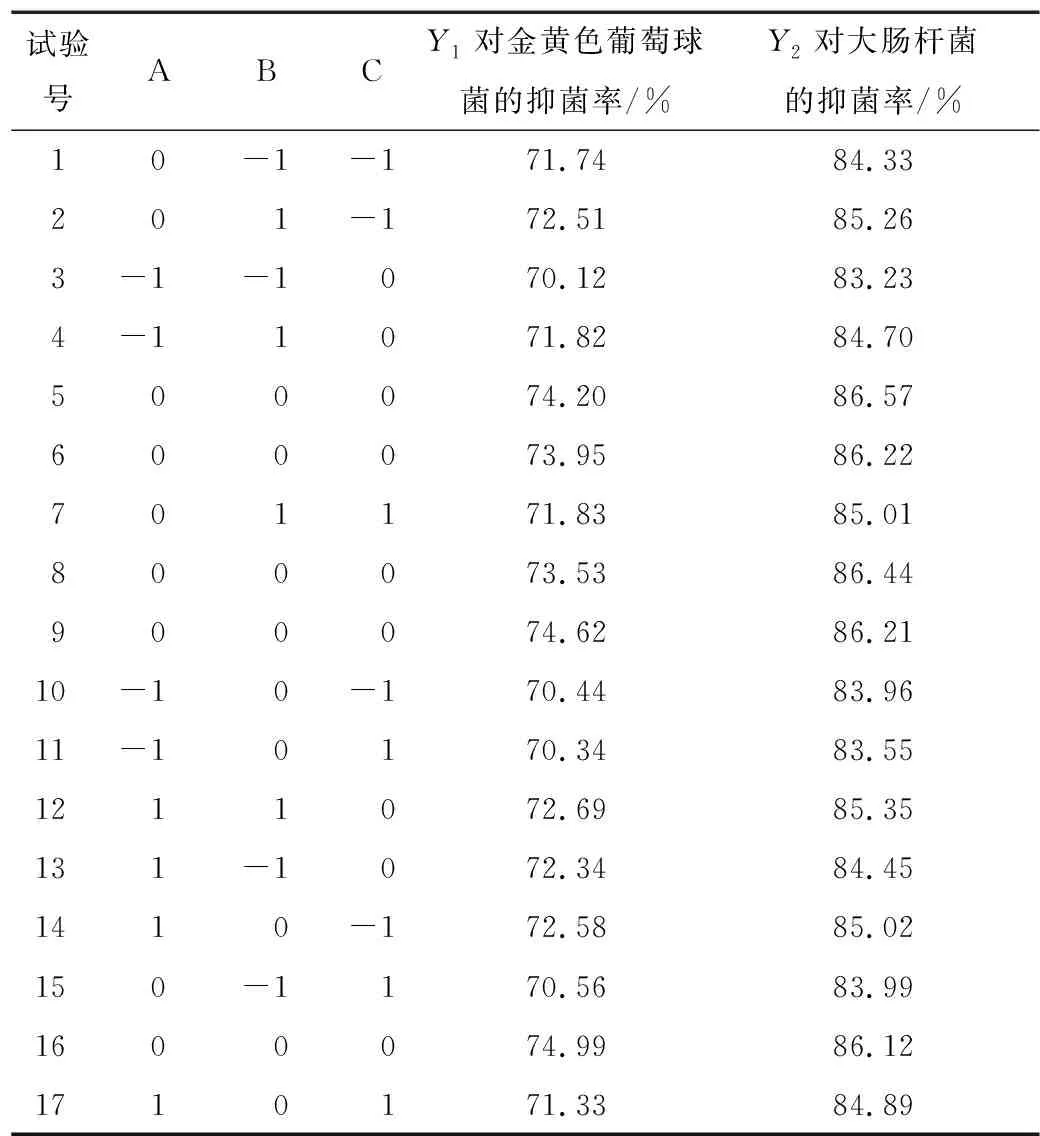
表3 响应面试验设计及结果Table 3 Experimental design and results for response surface methodology
2.4.2 响应面模型的建立及方差分析 通过Design-Expert 10.0.7软件对试验结果进行多元回归拟合,得回归模型方程:
Y1=74.26+0.78A+0.51B-0.40C-0.34AB-
0.29AC+0.12BC-1.50A2-1.01B2-1.58C2,
(3)
Y2=86.31+0.53A+0.54B-0.14C-0.14AB+0.07AC+0.023BC-1.09A2-0.79B2-0.87C2。
(4)


表4 回归模型方差分析(Y1)†Table 4 Variance analysis of regression model (Y1)
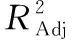
2.4.3 响应面交互作用分析 由图8、图9可知,酶解时间和pH的交互作用对虎奶菇菌丝体抗菌肽抑菌率的影响最显著,酶解时间、pH和酶解温度3个因素中任意两个因素之间的交互作用均不明显,与表4、表5中方差分析结果相吻合。
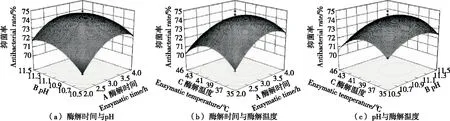
图8 各因素交互作用对虎奶菇菌丝体抗菌肽抑菌率的影响(金黄色葡萄球菌)Figure 8 Effects of the interaction of various factors on antibacterial rate of PTRM-AMPs (Against S.aureus)

图9 各因素交互作用对虎奶菇菌丝体抗菌肽抑菌率的影响(大肠杆菌)Figure 9 Effects of the interaction of various factors on antibacterial rate of PTRM-AMPs (Against E.coli)

表5 回归模型方差分析 (Y2)†Table 5 Variance analysis of regression model (Y2)
2.4.4 双指数最优提取条件的确定及验证 根据模型分析结果及试验操作的可行性,将最佳酶解条件确定为酶解时间3.2 h、pH值11.1、酶解温度39.5 ℃,此时虎奶菇菌丝体抗菌肽对金黄色葡萄球菌和大肠杆菌抑菌率的预测值分别为74.43%和86.46%。为了验证该模型的有效性,连续进行3组重复实验,测得该条件下制备的虎奶菇菌丝体抗菌肽对金黄色葡萄球菌和大肠杆菌的抑菌率平均值分别为74.17%和86.22%,与模型预测结果接近。因此,此模型准确可行。此时,抗菌肽得率为22.67%,比优化前提高了5.62%。
2.5 最小抑菌浓度(MIC)
由图10可知,抗菌肽对金黄色葡萄球菌和大肠杆菌的MIC值分别为5.0,2.5 mg/mL。马尚玄等[23]采用碱性蛋白酶酶解制备的澳洲坚果多肽MNP-8对金黄色葡萄球球菌和大肠杆菌的MIC分别为4.0,4.5 mg/mL,与试验结论相似。因此天然虎奶菇菌丝体抗菌肽具有广谱抑菌活性,且抑菌作用较强,有望成为抗生素和食品防腐剂的替代品。
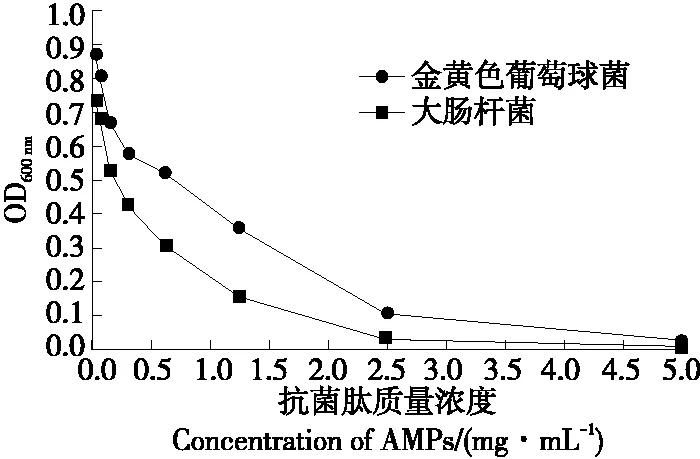
图10 虎奶菇菌丝体抗菌肽的最小抑菌浓度Figure 10 Minimum inhibitory concentration of PTRM-AMPs
3 结论
碱性蛋白酶酶解制备虎奶菇菌丝体抗菌肽的最佳工艺条件为酶解时间3.2 h、酶解温度39.5 ℃、pH值11.1,此时虎奶菇菌丝体抗菌肽对金黄色葡萄球菌和大肠杆菌的抑菌率分别为74.17%和86.22%,抗菌肽得率为22.67%。抗菌肽对金黄色葡萄球菌和大肠杆菌的最低抑菌浓度分别为5.0,2.5 mg/mL。后续可对虎奶菇菌丝体抗菌肽进行分离纯化,并研究其作为抗生素及食品防腐剂的潜在可能,从而提高虎奶菇菌丝体抗菌肽的利用价值。
