外周血ADAM19 DNA甲基化生物标记物对慢性阻塞性肺疾病的诊断价值
2022-09-09王霞,侯嘉
王 霞,侯 嘉
(1.宁夏医科大学临床医学院,银川 750004;2.宁夏医科大学总医院呼吸与危重症医学科,银川 750004)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是以持续性气流受限为特征的疾病,其发生与气道和肺组织暴露于香烟等有害气体或颗粒所致的异常炎性反应有关[1]。目前已为全球第三大疾病死因[2-3]。我国成人COPD患病率为7.8%,估算我国有近1亿例COPD患者[4]。该疾病早期诊断和有效治疗刻不容缓,但临床缺乏能够早期诊断和评价疾病活动度的标记分子。COPD的发病机制与遗传易感性和环境暴露有关,而表观遗传与二者关系紧密[5-6]。表观遗传学包括DNA甲基化、组蛋白修饰、非编码RNA等,其中DNA启动子甲基化与COPD的关系研究较多,但Body区甲基化的相关研究较少[7]。通常DNA启动子甲基化导致基因沉默,去甲基化导致基因活化,而发生在Body区作用相反[7-8]。本研究通过筛查COPD患者外周血Illumina 850K芯片全基因组甲基化测序结果,选出甲基化差异位点及靶标基因,经Agena质谱法进行验证,同时扩大样本量利用RT-PCR法验证基因表达,通过分析靶标基因与不同临床特征指标的相关性,以期寻找能够早期用于诊断COPD和评估疾病进展的生物标记物。
1 材料与方法
1.1 材料
甲基化扩增引物由美国Sequenom公司设计合成;ADAM19基因引物由生工生物工程(上海)股份有限公司合成;外周血提取RNA试剂盒购自天根生华科技(北京)有限公司;RNA逆转录和荧光定量PCR试剂盒购自日本TaKaRa公司;DNA提取试剂盒购自德国Qiagen公司;DNA甲基化试剂盒、亚硫酸盐试剂盒、碱性磷酸酶(SAP)处理试剂盒、体外转录(IVT)酶切试剂盒、质谱试剂均购自美国Sequenom公司。
MassARRAY Nanodispenser RS1000点样仪、SpectroCHIP 384格式芯片、EpiTYPER软件均为美国Sequenom公司生产;荧光定量PCR仪器为罗氏480。
1.2 研究对象
选择2020年10月至2021年4月在宁夏医科大学总医院呼吸与危重症医学科住院的COPD患者102名(COPD组)和同期在本院行健康体检者61例(对照组)作为研究对象。COPD按照2019版GOLD指南标准诊断[9],并根据肺功能GOLD分组为GOLD 1(轻度)、GOLD 2(中度)、GOLD 3(重度)、GOLD 4(极重度)。本研究经宁夏医科大学总医院科研伦理委员会批准,并获得所有研究对象的知情同意。
1.3 方法
1.3.1 基本临床资料 收集两组研究对象的一般资料(包括性别、年龄、吸烟史);血气指标:pH、PCO2、PO2,肺功能指标:FEV(1第1秒用力呼气容积)、FVC(用力肺活量)、FEV1/FVC(一秒钟用力呼气容积与用力肺活量的比值)、FEV1%预计值(第1秒用力呼气的容积占预计值的百分比)。COPD组患者依据PCO2、PO2分组,无呼吸衰竭组(N组):PO2≥60 mmHg,PCO2≤50 mmHg;Ⅰ型呼吸衰竭组(Ⅰ型组):PO2<60 mmHg,PCO2正常或轻度下降;Ⅱ型呼吸衰竭组(Ⅱ型组):PO2<60 mmHg,PCO2>50 mmHg。
1.3.2 筛选Illumina 850 K芯片数据 随机抽取两组中各8例研究对象,抽取外周静脉血5 mL,分析外周血的DNA甲基化Illumina 850K芯片数据,筛选差异甲基化位点cg07557896,位点靶标基因ADAM19。
1.3.3 Agena质谱法验证外周血DNA甲基化 取若干离心管标记置于冰上,分别吸取20 μL蛋白酶至离心管底部,加入200 μL待测全血;离心管加入200 μL Butter AL,涡旋震荡15 s混匀,56 °C孵育10 min,4 °C快速离心;分别加入200 μL的无水乙醇,涡旋振荡15 s混匀,4 °C快速离心;混合物转移至离心柱中,8 000 r·min-1离心1 min;离心柱转移至2 mL收集管中,加入500 μL Buffer AW1,8 000 r·min-1离心1 min;弃滤液,加入500 μL Buffer AW2,14 000 r·min-1离心3 min;离心柱转移到新1.5 mL收集管,加入50 μL洗脱液,室温孵育1 min,8 000 r·min-1离心1 min,获取全基因组DNA。使用EZ-96 DNA甲基化试剂盒对每个样品中共1 mg的基因组DNA进行处理。处理产物进行PCR扩增,扩增片段为200~600 bp,正向引物5′端加入10mer tag平衡PCR反应条件;反向引物5′端加入T7-Promoter序列用于后续体外转录(IVT),cg07575896位点正向引物5′aggaagagagTTTTTTGAGTTTTGAGTTT TT GAG3′;反向引物5′cagtaatacgactcactatagggagaaggctTCCACCATTTCTACAT CTACCCT AA3'。扩增体系总共5 μL,其中无酶水1.37 μL、10×Hot-Star Taq buffer 0.50 μL、dNTP mix 0.04 μL、Hot-Star Taq 0.09 μL、Primer Mix 2.00 μL、DNA模板1.00 μL。PCR程序:94℃,10 min;(94℃,45 s;62℃,48 s;72℃,1 min)共10个循环;(94℃,45 s;57℃,48 s;72℃,1 min)共35个循环;72℃,3 min。扩增产物进入碱性磷酸酶(SAP)处理:SAP体系总共5.6 μL,其中无酶水1.36 μL、碱性磷酸酶0.24 μL、PCR产物4.00 μL。PCR程序:37 °C,20 min;85°C,5 min。SAP产物进入体外转录(IVT)和RNase酶切环节,体系共7 μL,其中无酶水3.15 μL、5×T7 polymerase buffer 0.89 μL、T Cleavage Mix 0.24 μL、DTT 0.22 μL、T7 DNA Polymerase 0.44 μL、RNAse A 0.06 μL、SAP处理PCR产物2.00 μL。程序:37 °C,3 h。IVT和酶切结束进入纯化,使用点样仪将纯化后产物点至SpectroCHIP 384芯片上,将点制好的芯片放入MassARRAY系统进行检测。使用MALDI-TOF(matrix-assisted laser desorption/ionization-time of flight)基质辅助激光解吸附电离飞行时间质谱分析技术检测数据,最后通过EpiTYPER软件分析并输出结果。
1.3.4 RT-PCR检测外周血ADAM19 mRNA相对表达水平 抽取COPD患者和健康者外周血5 mL,离心柱法提取总RNA,反转录为cDNA,RT-PCR检测相关基因相对表达量。总反应体系20 μL:cDNA 2 μL,上、下游引物各0.8 μL,TB Green Premix EXTaqⅡ10 μL,ddH2O 6.4 μL。反应条件(95℃,30 s;95℃,5 s;60℃,30 s;70℃,30 s)共40个循环;65℃,1 min结束。ADAM19上游引物:5′-GGCTCTTCAGTTTACACAACAG-3′,下游引物5′-AAAGCTCCACATACTTCATGGA-3′;GAPDH上游引物:5′-CAGG AGGCATTGCTGATGAT-3′,下游引物:5′-GAAGG CTGGGGCTCATTT-3′。GAPDH为内参,用2-ΔΔct计算mRNA相对表达量。
1.4 统计学方法
数据采用GraphPad Prism 7.0、SPSS 25.0软件进行分析。计量资料以均数±标准差(±s)表示,对于大样本符合正态分布的两组数据使用t检验;多组间比较进行方差齐性检验,方差不齐采用韦尔齐法,两两比较采用非参数检验Tamhane T2法统计,计数资料采用χ2检验。差异甲基化位点的结果用R软件IMA 3.1.2进行分析,采用limma中的empirical Bayes statistics方法。同时针对多重假设检验问题,降低假阳性率,计算错误发现率(FDR)校正的P值。P≤0.05为差异有统计学意义。
2 结果
2.1 筛选Illumina 850K芯片甲基化测序结果
应用GenomeStudio软件进行分析,采用Illumina官方Methylation Analysis Algorithms进行芯片原始数据的提取、质量控制分析、校正。每个CpG位点的甲基化程度用β值表示,范围为0~1,Δβ代表COPD组与对照组CpG位点的差异甲基化程度,Δβ>0为高甲基化,Δβ<0为低甲基化。Δβ绝对值越大,其差异甲基化程度越高。根据差异位点的P值和β值筛选差异甲基化位点cg07557896。与对照组相比,在COPD组发现差异甲基化位点cg07557896发生高甲基化,位于Body区(起始密码子ATG和终止密码子之间的区域)(Δβ=0.08,P<0.05),对应基因为ADAM19,位于5号染色体。与对照组相比,COPD组中ADAM19 DNA发生最大差异甲基化区域(DMR)(P<0.05),见图1。

图1 DNA最大差异甲基化区域(DMR)图
2.2 研究对象基本资料
两组在年龄,性别,吸烟史方面差异均无统计学意义(P均>0.05)。COPD组肺功能指标FEV1/FVC和FEV1%预计值均低于对照组(P均<0.001),见表1。

表1 COPD组和对照组的不同临床特征比较
2.3 两组甲基化位点cg07575896中CpG4甲基化水平比较
Agena质谱法检测两组甲基化位点cg07575896中CpG4甲基化水平结果显示,COPD组CpG4位点的甲基化水平高于对照组(P<0.05),见图2。

图2 两组cg07575896_CpG4位点甲基化程度比较
2.4 两组外周血中ADAM19 mRNA相对表达水平比较
RT-PCR检测外周血中ADAM19 mRNA的相对表达量,结果显示,与对照组相比,COPD组ADAM19 mRNA表达上调(P<0.05),见图3。

图3 两组外周血中ADAM19 mRNA相对表达水平比较
2.5 外周血中ADAM19基因对COPD的预测价值
ROC曲线分析外周血中ADAM19基因对COPD的预测价值:曲线下面积(AUC)为0.78,截断值为1.19,约登指数为0.45,灵敏度为62.1%,特异度为82.9%,95%CI:0.71~0.85,P<0.001,见图4。

图4 ADAM19在COPD疾病中诊断ROC曲线
2.6 COPD患者不同GOLD分级肺功能与ADAM19 mRNA相对表达量的关系
COPD患者依据肺功能GOLD分级分为GOLD1、GOLD2、GOLD3、GOLD4组。FEV1、FVC、FEV1%预计值在GOLD2、GOLD3、GOLD4组均低于GOLD1组(P均<0.05);GOLD3、GOLD4组的FEV1/FVC比值低于GOLD1组(P均<0.05);与GOLD2组相比,FEV1/FVC、FEV1%预计值在GOLD3、GOLD4组均降低(P均<0.05),GOLD4组FEV1低于GOLD2(P<0.05)。COPD组患者外周血中ADAM19mRNA相对表达GOLD4组均高于GOLD1、GOLD2、GOLD3组(P均<0.05),见表2、图5。
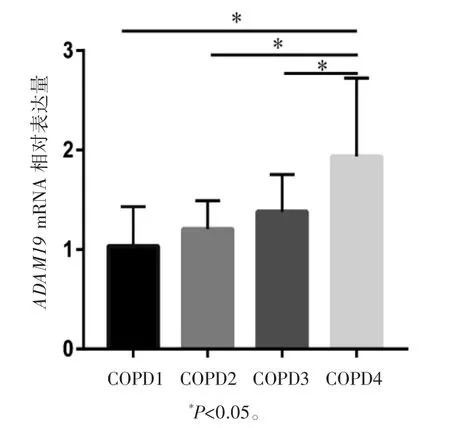
图5 ADAM19 mRNA相对表达量与COPD患者肺功能GOLD不同分级的关系

表2 COPD患者不同GOLD分级肺功能指标比较
2.7 COPD患者不同呼吸衰竭类型与ADAM19 mRNA相对表达量的关系
与N组比较,Ⅰ型、Ⅱ型组COPD患者PO2、SO2降低,Ⅱ型组PCO2升高(P均<0.05);与N组比较,ADAM19的mRNA表达量在Ⅱ组中增加(P<0.05),见表3、图6。

图6 不同呼吸衰竭类型ADAM19 mRNA相对表达量比较

表3 COPD患者不同呼吸衰竭类型PO2、PCO2、SO2的比较
3 讨论
DNA甲基化是表观遗传学的重要方式,不改变NDA序列,调节靶基因异常表达[10]。COPD是一种受遗传和环境因素影响的慢性疾病。长期暴露于环境污染,如香烟烟雾等,可引起DNA甲基化改变,参与COPD的发生、发展[11-12]。
本研究在COPD患者外周血中发现ADAM19表达升高,可能受cg07575896位点高甲基化调控导致。相关研究[13-15]显示,ADAM19是细胞表面的糖蛋白,在信号通路、蛋白水解活性、细胞活性和形态发生等方面有广泛作用。ADAM19基因表达改变会导致疾病的发生,在肺纤维化中TGF-α上调ADAM19从而促进细胞外基质沉积和肺瘢痕形成[16]。Melenhorst等[17]发现ADAM19在肾脏恶性肿瘤中表达升高,可能参与促肾脏纤维化和促炎发生。实验研究发现,ADAM19表达随着COPD患者肺功能GOLD分级升高而上调,提示外周血ADAM19的表达与COPD患者肺功能损伤程度呈一致性。同样地,COPD患者呼吸衰竭程度与ADAM19的表达量也存在相关性。ADAM19可能涉及COPD的发病机制,和炎症、神经肌肉、肺的发育等有关。
本研究发现,外周血高甲基化位点cg07575896及高表达ADAM19可作为COPD疾病早期诊断和病情活动度评价的指标,未来还需大样本、多中心、前瞻性研究加以验证。此外,ADAM19参与COPD发病的具体机制尚需进一步研究阐明。
