右美托咪定预处理对脓毒症急性肾损伤大鼠肾功能的影响
2022-09-09周文杰杨海荣刘勤富马希刚
周文杰,杨海荣,张 楠,刘勤富,马希刚
(1.宁夏医科大学总医院重症医学科,银川750004;2.宁夏医科大学附属自治区人民医院,银川750021;
3.宁夏医科大学总医院手术室,银川 750004)
脓毒症是引发脓毒症休克和多器官功能障碍综合征的重要因素[1]。脓毒症相关急性肾损伤(acute kidney injury,AKI)具有病情危重、死亡率高、预后差、易发展为慢性肾脏病等特点[2-3],对患者和社会是沉重的负担。脓毒症相关AKI是一种涉及炎症、肾毒性、缺血性损伤等多因素的综合征,致病机制复杂,目前尚无有效的预防或干预药物[4]。因此,寻求有效减轻脓毒症相关AKI的治疗药物对于改善预后尤为重要。右美托咪定(dexmedetomidine,DEX)是一种新型α2肾上腺素受体激动剂,具有镇静镇痛、抗焦虑、抗氧化应激、抗炎等作用[5-6]。但DEX预处理是否对脓毒症AKI具有保护作用尚不清楚。本研究通过盲肠结扎穿孔(CLP)法制备大鼠脓毒症AKI模型,探讨DEX预处理对脓毒症AKI的保护作用,为临床治疗脓毒症AKI患者提供理论依据。
1 材料与方法
1.1 实验动物与分组
健康雄性SD大鼠60只,体质量(250±20)g,购于宁夏医科大学实验动物中心,动物合格证号:SCXK(宁)2015-0001。按照随机数表法分为4组:假手术(Sham)组、DEX对照组、盲肠结扎穿孔(CLP)组、DEX干预组,每组15只。
1.2 大鼠脓毒症模型制备
采用CLP法制备大鼠脓毒症AKI模型。即称重后腹腔注射10%水合氯醛0.35 mL/100 g充分麻醉大鼠,于腹部行1.5 cm切口,开腹分离出盲肠,在盲肠根部用3.0丝线结扎,避免结扎回盲瓣,在盲肠被结扎段避开血管,用直径2.6 mm的三棱针穿刺3孔,挤出少量粪便后回纳腹腔,分层关腹。Sham组和DEX对照组仅开关腹,不结扎,不穿孔。术后皮下注射复方氯化钠3 mL/100 g补液,保暖复温后放回鼠笼,自由进食水。各组分别于术后6、12和24 h处死5只大鼠取材待测。本实验中所有动物处理方法符合动物伦理学标准,并通过宁夏医科大学总医院医学科研伦理审查委员会批准(审批号:2019-228)。
1.3 DEX干预措施
采用预处理的方法进行干预。1)DEX对照组和DEX干预组:制模前1 h经尾静脉持续泵入右美托咪定(江苏恩华,批号:H20110085),速率为5 μg·(kg·h)-1,泵注时间为1 h;2)Sham组和CLP组:制模前1 h经尾静脉泵入等体积生理盐水。
1.4 标本收集
各组术后6、12和24 h分别取5只大鼠,沿腹中线打开腹腔,经腹主动脉采血3~5 mL,以3 000 r·min-1速度、4℃离心15 min分离血清,存于-80℃冰箱备用。打开后腹膜,分离左侧肾脏,去除包膜,沿肾横轴切取厚约3 mm组织置于4%多聚甲醛中固定,待行病理形态学观察。同时在左肾皮髓质交界区切取大小为1 mm×1 mm×2 mm组织置于2%戊二醛中固定,待行电镜观察超微结构。
1.5 检测指标
1.5.1 肾组织病理形态学检测 将肾组织于4%多聚甲醛中浸泡固定24 h,二次取材后置于包埋盒中,流水冲洗3 h,70%乙醇过夜,经梯度乙醇脱水,二甲苯透明,石蜡包埋后切片,厚度4 μm,进行苏木素-伊红(HE)染色。切片置于光镜下观察肾组织病理形态,并参照文献[7]对肾小管损伤程度进行评价。据损伤程度按以下标准进行半定量评分:无损伤为0分;≤25%为1分;26%~50%为2分;51%~75%为3分;>75%为4分。
1.5.2 肾组织超微结构观察 将肾组织置于2%戊二醛中固定2 h,0.1 mol·L-1二甲胂酸钠缓冲液冲洗,每2 h更换一次,1%锇酸浸泡2 h,每15 min更换一次缓冲液,共冲洗2次,30%~100%乙醇依次脱水,环氧丙烷渗透,包埋组织,制作切片,在透射电镜下观察肾组织超微结构。
1.5.3 血清肌酐(Cr)和尿素氮(BUN)检测 腹主动脉采血后离心分离血清,采用全自动生化分析仪(日立7180型)检测血清Cr和BUN水平。
1.5.4 血清中性粒细胞明胶酶相关脂质运载蛋白(NGAL)和肾损伤分子-1(KIM-1)的检测 采用酶联免疫吸附试验(ELISA)法测定血清NGAL和KIM-1水平。各组大鼠腹主动脉采血制备血清,标准孔加标准品50 μL,样品孔加样品稀释液40 μL及待测样品10 μL,37℃温育1 h,洗涤5次后避光显色15 min,终止反应,在450 nm波长测量各孔的吸光度(OD)值。根据ELISA试剂盒中提供标准品做出标准曲线,测出每个样品吸光度OD值,代入标准曲线中,计算得出样本浓度值。
1.6 统计学方法
采用SPSS 20.0统计学软件进行数据分析。计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,组间两两比较采用SNK-q
检验。P≤0.05为差异有统计学意义。
2 结果
2.1 肾组织病理形态学观察
光镜下可见Sham组和DEX对照组各时间点肾组织结构完整,未见明显病理学改变。CLP组可见肾小球水肿瘀血,有核细胞数增多;肾小管上皮细胞空泡变性,部分刷状缘丢失,肾小管扩张,部分有管型,肾间质水肿、灶性出血;CLP术后6 h损伤程度最轻,随术后时间延长,损伤呈加重趋势,至24 h最为显著。DEX干预组各时间点肾损伤程度较CLP组均减轻,见图1。
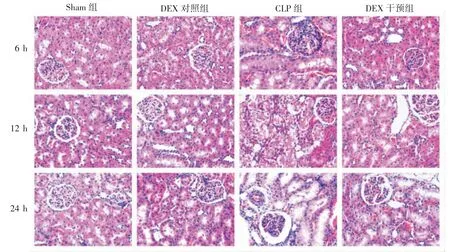
图1 各组大鼠肾组织病理形态学改变(HE×400)
2.2 各组大鼠术后不同时间肾小管损伤评分比较
各组大鼠术后不同时间肾小管损伤评分,Sham组和DEX对照组间差异无统计学意义(P>0.05);CLP组术后各时间点肾小管损伤评分均高于Sham组(P均<0.01),DEX干预组各时间点肾小管损伤评分均较CLP组降低(P均<0.01),见表1。
表1各组大鼠术后不同时间肾小管损伤评分(±s,分)

表1各组大鼠术后不同时间肾小管损伤评分(±s,分)
与Sham组比较aP<0.01;与CLP组比较bP<0.01。
组别 12 h 24 h Sham组 0.39±0.18 0.42±0.20 DEX对照组 0.38±0.16 0.39±0.24 CLP组 2.62±0.34a 3.52±0.34a DEX干预组 1.34±0.26ab 2.08±0.38ab n 15 15 15 15 6 h 0.36±0.25 0.34±0.24 1.98±0.37a 0.66±0.27ab
2.3 各组大鼠术后不同时间肾组织超微结构观察
透射电镜下显示,Sham组和DEX对照组肾小球结构正常,足细胞结构正常,细胞器完整,足突排列整齐、无倒伏或融合、裂孔清晰,基底膜厚薄均匀。近曲小管结构正常,上皮细胞核膜清晰,线粒体数目丰富、形状规则、嵴清晰。CLP组可见肾小球结构局部损伤,肾小管损伤较肾小球更明显。6 h见足细胞结构尚正常,足突肿胀呈矮柱状,有轻微融合,基底膜厚薄不均;近曲小管上皮可见空泡变性,线粒体肿胀,界限不清,部分嵴溶解。12 h损伤进一步加重,足突局灶性倒伏、融合,基底膜厚薄不均;近曲小管上皮细胞可见较多大空泡,线粒体数量减少、嵴溶解加重。24 h足细胞细胞器轮廓不清,足突倒伏、融合程度加重,裂孔模糊不清,基底膜厚薄不均;近曲小管上皮核固缩,线粒体损伤加重,部分空泡化。DEX干预组6 h肾小球及肾小管结构基本正常,12 h肾小球可见足突有轻微融合,肾小管线粒体肿胀,部分嵴溶解。24 h可见足突局灶融合,基底膜基本均匀;肾小管核膜清晰,线粒体致密、嵴溶解,见图2。

图2 透射电镜下各组大鼠肾小球和肾小管超微结构改变(肾小球×5 000,肾小管×100 000)
2.4 各组大鼠术后不同时间血清Cr和BUN水平的变化
血清Cr和BUN水平在6 h各组间差异均无统计学意义(P均>0.05)。CLP组于12 h、24 h的血清Cr和BUN水平均高于Sham组(P均<0.01);DEX干预组12 h和24 h的Cr及BUN水平均低于CLP组(P均<0.01)。Sham组与DEX对照组各时间点Cr和BUN水平差异均无统计学意义(P均>0.05),见表2。

表2各组大鼠术后不同时间血清Cr和BUN水平的变化
2.5 各组大鼠术后不同时间血清NGAL和KIM-1水平的变化
CLP组大鼠血清NGAL和KIM-1水平在6、12和24 h均高于Sham组(P均<0.01);DEX干预组大鼠血清NGAL水平在6 h和12 h,KIM-1在6、12和24 h均高于Sham组(P均<0.01);DEX干预组大鼠血清NGAL和KIM-1水平在6、12和24 h均低于CLP组(P均<0.01)。Sham组与DEX对照组各时间点NGAL和KIM-1水平差异均无统计学意义(P均>0.05),见表3。

表3各组大鼠术后不同时间血清NGAL和KIM-1水平的变化
3 讨论
CLP法制模大鼠术后精神萎靡,少食懒动,寒颤、蜷缩、竖毛,眼角及鼻腔可见淡血性分泌物,腹胀腹泻,上述表现随术后时间延长而逐渐加重,处死大鼠开腹可闻及恶臭,有较多淡血性浑浊腹腔积液,结扎段盲肠扩张坏死明显,呈紫黑色,与周围组织粘连严重,表明脓毒症模型复制成功。同时,Sham组和DEX对照组探查膀胱充盈、尿液清亮,CLP组大鼠膀胱挛缩无尿,且部分膀胱内可见白色结晶,而DEX干预组膀胱充盈欠佳、尿色深,大鼠尿量的变化符合临床脓毒症AKI的特点。同时检测脓毒症组大鼠血清NGAL和KIM-1在肾损伤早期已明显升高,血清Cr和BUN反映早期肾损伤有较大的局限性,但随时间延长出现持续上升趋势。并且CLP组出现肾损伤的病理改变,且肾小管损伤评分升高。综合尿量、肾损伤标记物及肾脏病理学改变的情况,证实脓毒症诱发了AKI[8]。
脓毒症患者中AKI发病率高,同时与患者病死率增加独立相关[9]。肾小管上皮细胞凋亡已被认为是脓毒症AKI的显著特征,与患者肾功能恶化及死亡率增加密切相关[10]。氧化应激、炎性反应、缺血等均可造成细胞凋亡[11-12]。本研究在光镜下观察到CLP组大鼠肾组织水肿、间质灶性出血,可以明显见到肾小管的损伤,诸如空泡变性、刷状缘丢失、肾小管扩张、管型形成等改变,同时在电镜下证实了小管上皮细胞中有线粒体的损伤,同时出现核固缩、上皮细胞凋亡现象。足细胞是维持肾小球滤过屏障的重要结构,本研究在透射电镜下还观察到了肾小球的损害,主要以足突局灶性倒伏融合为主,其形态改变会增加滤过屏障的通透性,导致肾功能恶化[13],说明脓毒症发生时,以炎性反应为关键环节,同时伴随氧化应激、局部缺血损害、能量代谢障碍等过程,不仅破坏肾小管上皮细胞的正常结构,诱发细胞凋亡,同时还损害肾小球滤过屏障的正常结构,最终导致急性肾损伤。在给予DEX预处理后,大鼠肾小管及肾小球的病理改变均明显减轻,血清Cr、BUN和NGAL、KIM-1的水平也有所下降,说明对脓毒症AKI具有一定的保护作用。
DEX激动α2肾上腺素能受体具有高选择性和特异性,不仅应用于镇痛镇静领域,近年来,其器官保护作用也成为研究热点。有研究[14-15]显示,DEX具有抑制炎性反应、抗氧化应激、免疫调节等作用,对脑、心脏、肺、肾、肠等器官具有保护作用,但其具体机制仍在进一步研究中。在脓毒症诱发的急性肺损伤小鼠模型中,DEX能通过上调TIPE2并抑制NF-κB和JNK信号通路的激活,减轻肺组织炎性反应和细胞凋亡,从而对急性肺损伤起到保护作用[16]。本实验中给予DEX预处理后各时间点大鼠肾损伤程度均减轻,肾功能得到改善,提示DEX对脓毒症大鼠AKI有一定的保护作用,其保护机制可能与抑制炎性反应及细胞凋亡,降低肾小球屏障的通透性有关。
综上所述,DEX预处理可以减轻脓毒症AKI大鼠肾功能,有望成为临床治疗脓毒症AKI的有效药物,其具体机制仍需进一步研究。
