补铁剂及多肽铁复合物的研究进展
2022-09-08钟丽雯鲁迎瑞张卫兵郭兆斌张金亮文鹏程
钟丽雯,鲁迎瑞,张卫兵,郭兆斌,张金亮,文鹏程,*
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.武威高原生物制品有限责任公司,甘肃 武威 733000)
铁元素是人体必需的微量元素之一[1],正常成年人体内铁含量高达0.004%[2],存在于多个组织器官中,主要参与人体氧的运输和贮存以及一些生理生化反应等[3]。机体内缺铁时,红细胞生成减少导致缺铁性贫血,是贫血中最常见的一种[4]。据世界卫生组织调查显示,全球有20%左右的人群患有缺铁性贫血,特别在儿童及孕妇等主要贫血人群中发病率高于50%[5],因此治疗和预防显得尤为重要。缺铁性贫血的治疗主要分为病因治疗及补铁治疗,其中补铁治疗又分为口服补铁及静脉注射补铁,目前大多以口服补铁剂为主,静脉注射补铁虽然效果好但其安全性尚有待确证[6]。随着营养与健康需求的变化和安全意识的增强,人们致力于补铁效果好、吸收好、副作用小、安全性更高的口服补铁剂的研发。
本文针对缺铁性贫血的治疗,阐述补铁剂的发展历程,同时重点介绍多肽铁复合物,讨论以牦牛乳酪蛋白为原料制作的蛋白琥珀酸铁的原料来源、结构、机理、制备、消化吸收机制等的研究进展及其目前在食品领域的应用,并对多肽铁复合物和蛋白琥珀酸铁的发展前景进行展望,以期为补铁剂的研究与发展提供理论依据。
1 补铁剂的发展历程
1.1 第1代补铁剂
自首次用硫酸亚铁治疗“萎黄病”以来,多年来经过科研工作者的研究开发[7],出现了以硫酸亚铁为代表的第1代无机亚铁盐类补铁剂。该类补铁剂虽然铁含量较高,价格便宜,但性质不稳定,具有很大的铁锈味,生物利用度差[8]。赖四海等[9]的临床实验表明,患者服用1~2 周后,血红蛋白回升效果较好,但硫酸亚铁释放出的亚铁离子对胃肠道刺激明显,引起恶心、呕吐等不良反应。据研究显示,硫酸亚铁与黏蛋白配合使用,可有效缓解铁离子在胃肠道的释放速率,从而降低不良反应[10-11],进一步说明硫酸亚铁刺激作用明显,不适用于消化道有炎症或疾病的人群,使用范围受限。
1.2 第2代补铁剂
20世纪中期,出现了以乳酸亚铁为代表的第2代小分子有机酸盐类补铁剂。此类补铁剂优势在于剌激作用减小,有机酸酸根通过离子作用和配位作用与铁离子结合,形成能在胃内酸性环境中缓慢释放铁离子的螯合物,有效防止了高浓度铁离子对人体消化道的刺激,降低了胃肠道损伤[12]。安森亮[13]比较无机盐类和有机酸盐类的补铁疗效,表明有机酸盐类效果好,生物利用率高,吸收好,不良反应率更低,但它同第1代补铁剂仍属于亚铁盐类,性质不稳定,不易贮存,且易产生挥发性气体。这2 代补铁剂均是以离子形式吸收,易受到其他成分的干扰,而且游离的亚铁离子会产生内源性自由基,造成细胞膜损伤[14]。
1.3 第3代补铁剂
20世纪末以来,出现了血红素铁、多糖铁、富铁酵母、多肽铁复合物等大分子复合物补铁剂[15],有效弥补了第1、2代补铁剂的缺点。血红素铁不受植酸根等因素影响,直接以卟啉铁的形式被肠道吸收,因而生物利用度比一般铁剂高,但补铁周期长,起效缓慢[16]。多糖铁复合物性质稳定,可利用多糖表面的羰基、羟基等给电子基团作为配基与铁离子络合,不含游离铁,可被人体以分子形式整体吸收[17]。富铁酵母是用硫酸亚铁或富马酸亚铁培养的特定酿酒酵母菌,使铁离子结合在细胞的有机组分内[18],其存在状态与人体内接近,生物利用度高[19]。因此,一种理想的补铁剂需要具备安全性好、补铁效果好、性质稳定、对肠道副作用小等特性。
1.4 新型补铁剂
最新研究发现,一类纳米材料口服补铁剂可基本符合人们对补铁剂的需求,其特殊之处在于纳米颗粒可被整体吸收,最终通过溶酶体或核内体将铁释放出来,有效减少了非转铁蛋白结合铁[20-21]。Wang Tongtong等[22]采用酶解和固定化金属亲和层析技术从南极磷虾中分离出铁结合肽,铁离子与南极磷虾肽(Antarctic krill peptides,AKP)的羧基结合形成纳米级球形粒子的AKP-铁配合物,通过模拟胃肠道消化后,与硫酸亚铁类补铁剂相比表现出显著的铁转运活性,具有改善铁吸收的能力。Helman等[23]研究一种新型纳米补铁剂氢氧化铁己二酸酒石酸盐(iron hydroxide adipate tartrate,IHAT)的安全性和有效性,该化合物由5 个直径10 nm的氢氧化铁水分散粒子组成,用己二酸和酒石酸进行化学修饰,模拟了膳食非血红素铁和铁蛋白核心的自然消化产物。结果表明,IHAT和硫酸亚铁对妊娠小鼠补铁有同等效果,且均未见氧化应激标志物水平改变,但最终在喂养硫酸亚铁小鼠的胎盘中氧化应激物血红素加氧酶1水平显著升高。该实验证明,IHAT是一种有效的亚硫酸盐类口服补铁剂的代替品,并且在治疗人类妊娠缺铁方面具有很大的潜力,但目前研究以小鼠为生物模型,缺乏临床实验数据,其安全性尚不明确,另外其消化吸收机制是否与膳食铁蛋白的吸收机制相似,还有待研究[24]。
目前阶段,多肽铁复合物由于具有生物利用度好、吸附性强、稳定性好、安全性高等优点,且其消化吸收机制、功能特性以及安全性研究较新型补铁剂全面,成为了除新型补铁剂之外的另一研究热点。
2 多肽铁复合物
自Newey等[25]提出肽可在肠道被整体吸收的理论后,更多人发现了生物利用率更高的多肽铁复合物,其为从一系列食源性动植物中提取的肽与铁离子通过配位作用结合形成的产物,而肽结合铁的能力取决于其含有的特定氨基酸。多项研究表明,His的咪唑基团以及Asp、Glu的羧基有助于铁的结合和吸收[26],且不损害小肠黏膜,生物利用率高,多肽铁复合物是十分理想的补铁剂[27]。
多肽铁复合物较第1、2代补铁剂性质稳定,副作用小;较新型纳米补铁剂安全性较好,补铁效果研究全面,而其相较于同期出现的补铁剂,原料来源丰富,除具有其他补铁剂的特性外,有些还具备抗氧化、清除自由基等功能。楼钰航[28]提取牛骨中多肽,研究发现氨基酸残基中Cys、Tyr、Met及Trp抗氧化作用较为突出,其结构中的巯基、吲哚基、酚羟基和巯甲基可作为电子的供体清除自由基。Palika等[29]通过层析和纯化蛋清中的多肽,建立Caco-2细胞单层模型,发现多肽与铁螯合后肠道对铁元素的吸收率大大提升,比无机铁盐类高约2 倍,且对肠道副作用极低[30]。纪晓雯[31]对牛乳酪蛋白进行酶解、分离纯化后得到具有特定结构的酪蛋白磷酸肽,并研究了其氨基酸序列、螯合位点和生物利用度,指出酪蛋白磷酸肽螯合能力是酪蛋白的3 倍,推测羧基是螯合铁离子的主要基团且铁蛋白生成量显著高于氯化亚铁、葡萄糖酸亚铁等。早在1987年,意大利药厂研制出一种酪蛋白铁络合物(蛋白琥珀酸铁)[32],它不同于酪蛋白磷酸肽,是酪蛋白经酰化后与铁离子络合而得,对肠道无刺激作用,适用范围广泛,得到了很高的认可。Cancelo-Hidalgo等[33]通过文献检索统计了111 项研究中不同口服补铁剂的不良反应,结果显示,蛋白琥珀酸铁的不良反应显著低于其他制剂,因此蛋白琥珀酸铁作为一类多肽复合物更具安全性和应用前景。
2.1 蛋白琥珀酸铁
蛋白琥珀酸铁是一种有机铁化合物,是酪蛋白经丁二酸酐酰化后与三氯化铁络合制得的产物,在溶液中铁不游离,呈络合状态[34]。
2.1.1 原料来源
牦牛主要分布在青海、甘肃等地,以天然放牧为主,自然、纯净的环境造就了牦牛乳中基本氨基酸含量、维生素、微量元素等均较普通牛乳高,被广泛称为“天然浓缩乳”[35]。其中,酪蛋白是主要蛋白成分,占牦牛乳总蛋白含量的80%,具有溶解性、乳化性、热及酸稳定性等功能特性,通常经过酸沉淀法得到,应用较为广泛。目前,对牦牛乳的开发利用还处于研究阶段,多数采用传统的加工方式生产曲拉、酸乳、干酪等,商业化程度不高,因此,对牦牛乳的开发利用具有重要意义[36]。
蛋白琥珀酸铁采用牦牛乳酪蛋白为主要原料,将其作为一种生物活性肽进行加工和应用,提高了酪蛋白的利用率,得到了生物利用度好、营养价值高的补铁剂。
2.1.2 理化性质及结构
蛋白琥珀酸铁为红棕色粉末,无刺激性气味,分子质量为5 000 kDa,在250~300 ℃时灼烧粉末会炭化变黑,其在碱性条件下可溶解,在酸性条件下析出,在水、0.1 mol/L盐酸、乙醇、丙酮、氯仿中不溶[37]。
蛋白琥珀酸铁结构如图1~2所示[38],其中铁离子通过配位作用与酰化位点结合,络合在酪蛋白分子结构中。
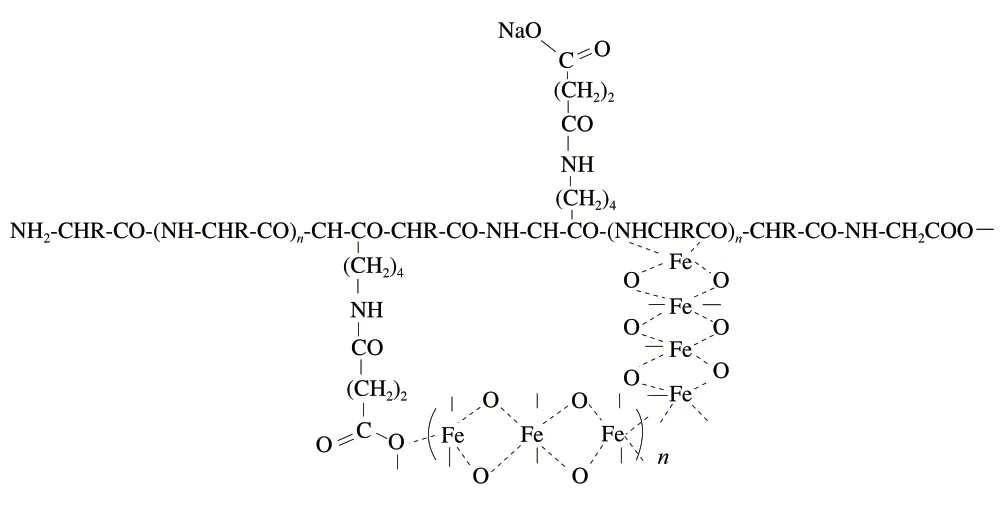
图1 碱性条件下蛋白琥珀酸铁结构Fig. 1 Structure of protein iron succinate under alkaline conditions
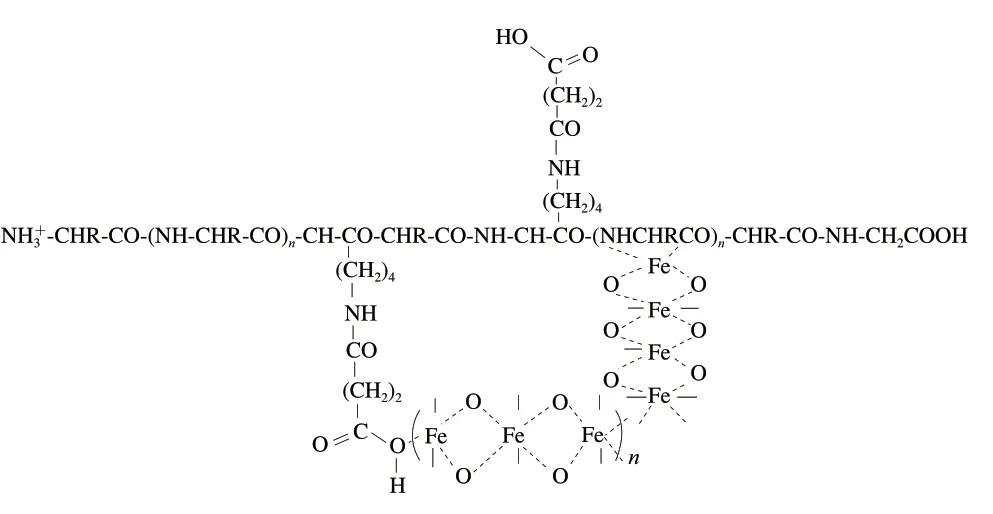
图2 酸性条件下蛋白琥珀酸铁结构Fig. 2 Structure of protein iron succinate under acidic conditions
2.1.3 反应机理
酪蛋白是一种复合蛋白,由4 种不同的结构(αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白)组成[39],因为其分子中各基团之间依靠氢键和其他次价键连接,且有大量亲水基团和疏水基团以及电离化基团的存在[40],所以酪蛋白分子的柔顺性和滑动性比较差[41],导致酪蛋白功能性质较差。因此,常用蛋白质化学结构修饰来改善,最具代表性的为酰化修饰,是指酰化试剂(如琥珀酸酐、琥珀酸)与蛋白质分子的亲核基团(如氨基或羟基)反应,在蛋白质分子中导入新功能基团的过程(图3)[42]。
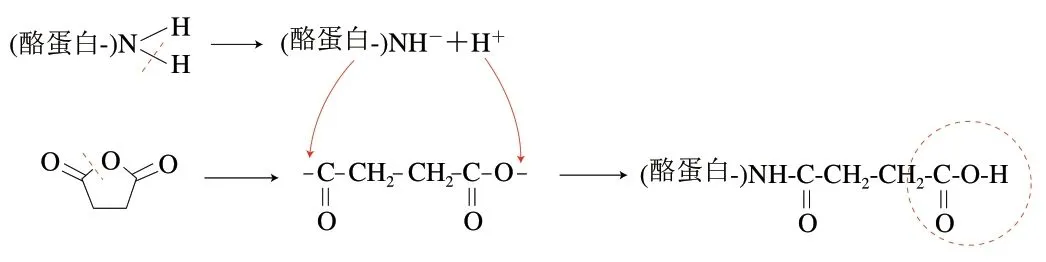
图3 酪蛋白酰化反应机制Fig. 3 Mechanism of casein acylation reaction
杨敏等[43-44]研究牦牛乳酪蛋白酰化修饰前后空间结构及其理化性质的改变,结果表明,酪蛋白经酰化修饰后游离氨基转化为丁二酰胺基,其所带负电荷增加了氨基酸侧链之间静电斥力,促使α-螺旋结构形成,从而改变了牦牛乳酪蛋白的二级结构,主要以β-转角、β-折叠和无规卷曲结构为主,并且发现经过酰化修饰后的酪蛋白溶解度增大,稳定性增强,色泽变白。据研究[45],不同的空间和构象约束会影响琥珀酰化过程中游离氨基的可用性,由于牦牛乳和荷斯坦牛乳酪蛋白中氨基的数量和反应性质不同,所以牦牛乳酪蛋白的琥珀酰化程度高于荷斯坦牛乳酪蛋白。在修饰过程中,琥珀酰化促进蛋白质展开,减少蛋白质聚集,增加四级结构亚基的解离,使等电点降低到较低值,中极性基团数量增加,影响了酪蛋白的构象,并暴露了之前埋藏的氨基,增加了酰化蛋白的结合位点[46],而Shilpashree等[47]也证明了琥珀酰化后的酪蛋白铁结合能力显著增强且稳定性较高。周陶鸿[48]研究表明,铁离子存在状态受很多因素影响,当溶液pH<2时,随着pH值升高,Fe2+氧化为氢氧化铁后,其氧化性急剧增强。Fe2+自氧化速率与氢氧根浓度平方成正比,即碱性越强,氧化速率越快。当pH>6时,Fe2+被迅速氧化成Fe3+而沉淀,因此在蛋白琥珀酸铁补铁剂中,为保证铁离子的稳定性和吸收率,选择3 价铁与酰化蛋白络合。Shilpashree等[49]对琥珀酰化后酪蛋白离子结合能力增强的原因进行了阐述,在酰化过程中,羧基会增加酰化蛋白的电负性,随着pH值的变化,其沉淀和增溶能力会随之改变,羧基提供了大量能与铁形成配位键的结合位点。Cremonesi等[50]的研究也证实了这一点,羧基在琥珀酰化过程中增加了蛋白质分子的净负电荷和单一酪蛋白胶束单体间的静电斥力,从而使蛋白质在pH值大于6.5的水中溶解度增大。该研究还表明,除了酪蛋白的天然结合位点外,蛋白质分子中增加的净负电荷也参与了铁结合过程,并与氨基和羧基通过共价键形成稳定的五元环、六元环螯合物。
2.1.4 制备工艺
蛋白琥珀酸铁是以酪蛋白为主要原料,经过酰化、络合反应等一系列工序制成,工艺流程如图4所示。
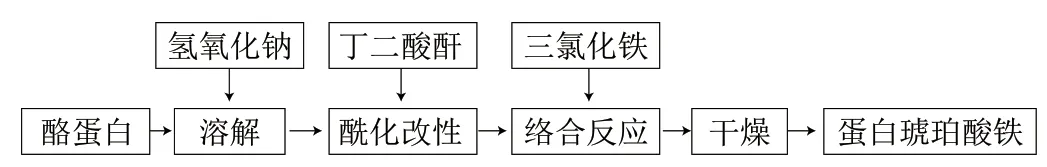
图4 蛋白琥珀酸铁制备工艺流程Fig. 4 Flow chart for the preparation process of iron protein succinate
为达到更好的效果,在此基础上可以对原料或加工过程作不同程度的改进。研究表明,酪蛋白本身含有一些苦味氨基酸和寡肽,可以通过水解、添加氨肽酶或羧肽酶用等电点沉淀法去除,可有效提高酪蛋白利用率,控制铁的络合量和释放量[51]。于长青等[52]利用响应面分析法得到微胶囊补铁剂的最佳制备工艺参数,而蛋白琥珀酸铁或多肽铁复合物是否能利用同样的技术手段,将其做成微胶囊[53],以提高其利用率和贮藏性能还有待研究。
2.1.5 消化吸收机制
铁的存在形式决定其生物利用率,如血红素铁、有机铁、2 价铁等更易被吸收,但由于2 价铁在肠道内容易发生氧化还原循环产生活性氧[54],对胃肠道刺激作用显著,导致2 价铁消化吸收率降低。3 价铁离子氧化还原反应速率较慢,但是在肠道pH值条件下不溶,发生水解反应生成聚氧-氢氧化物沉淀被析出[55]。因而使得铁离子穿过细胞膜,就需要一种特定的载体分子将它包被,形成一种有机的脂溶性表面,不易被破坏[56]。廉雯蕾[57]指出,人体十二指肠和空肠上段是铁被吸收的主要场所,而3 价铁离子需要经肠黏膜被十二指肠细胞色素b还原后[58],经小肠上皮细胞吸收,再由基底侧细胞膜上的转铁蛋白释放进入循环系统[59],在此过程中铁离子必须与相关的内源性或外源性配位体结合成一种螯合物,经过易化扩散后才能被机体消化、吸收与利用[60],如图5所示。

图5 蛋白琥珀酸铁在胃肠道内消化吸收示意图Fig. 5 Schematic diagram of digestion and absorption of iron protein succinate in the gastrointestinal tract
蛋白琥珀酸铁将3 价铁离子络合在酪蛋白分子结构中形成螯合物,其特有的结构使其在胃内不被胃蛋白酶酶解,同时其中的铁离子被蛋白膜包裹,有效保护了胃黏膜;因其保持了酪蛋白对pH值敏感的特性,使其具有了肠靶向性[61],当进入肠道后蛋白膜才能被胰蛋白酶水解,铁离子被释放,有利于机体的生理吸收,但不会形成吸收高峰,呈现一种平稳的吸收趋势,逐步在人体的各个部位达到吸收与贮存的最佳动态平衡状态[62],因此肠胃的耐受性较强,利用价值较高。
2.1.6 应用
鉴于蛋白琥珀酸铁的消化吸收特性,现如今被广泛应用于孕妇妊娠期贫血和小儿缺铁性贫血的治疗。曹三群等[63]探讨蛋白琥珀酸铁在妊娠期缺铁性贫血患者中的应用效果,通过对比发现,蛋白琥珀酸铁口服液治疗的总有效率为95.08%,显著高于其他组,不良反应显著低于其他组,治疗妊娠期缺铁性贫血具有显著的临床应用价值。漆腾飞[64]研究蛋白琥珀酸铁口服溶液治疗小儿缺铁性贫血的临床疗效及其安全性,临床结果显示,蛋白琥珀酸铁的总疗效高于其他组,可有效改善患儿贫血症状,不良反应发生率低,并可及时补充体内铁含量,且安全性较高。
2.2 其他
利用蛋白酶水解剂或微生物方法将蛋白质分解成小片段,有效提高了其功能和产生生物活性肽的能力,在适宜条件下,产生具有一定功能的水解蛋白和肽[65]。原料通常来源于动物和植物,包括一些副产品,如乳清、鱼皮、鱼骨、动物血液、谷物麸皮等,增加了产品利用价值,减少浪费。
酪蛋白是牛乳中的主要蛋白质,其初级结构中的丝氨酸残基簇易被磷酸化。经胰蛋白酶或糜蛋白酶处理的酪蛋白会释放酪蛋白磷酸肽(casein phosphopeptides,CPPs),CPPs结合钙、铁和锌的能力较强[66]。因此,CPPs在这些矿物质的吸收和生物利用度方面发挥着重要作用,而CPPs不同的螯合能力主要取决于它们是否由αs1-、αs2-或β-酪蛋白亚基释放。研究[67]发现,抑制肠道磷酸酶可显著增加β-CPPs-铁的摄取和吸收,但对αs1-CPPs-铁没有影响,这种差异可能与肽的化学结构有关。
鱼的许多副产物(鱼皮、鱼骨、鱼鳞等)的水解蛋白表现出金属螯合能力,其中明胶和胶原蛋白是衍生螯合肽的常见来源。研究[68]表明,从养殖巨型鲶鱼的皮肤中提取的明胶胰蛋白酶水解物螯合铁能力(9.93 mmol乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)/g蛋白)优于未消化的明胶(5.43 mmol EDTA/g蛋白),并且其在0.5 mg/mL质量浓度下铁螯合率高达90%。与乳CPPs一样,鱼皮和鱼骨水解蛋白中的许多肽都含有磷酸盐残基,这可以解释其良好的螯合能力。
谷物是人类营养中重要的能量来源,其本身和加工过程中产生的副产物可被用于产生功能蛋白和生物活性肽。据研究,由碱性蛋白酶和风味蛋白酶组合处理的米糠蛋白质的铁螯合能力高达83%[69],大豆蛋白经中性蛋白酶处理后,具有0.1~0.7 mg EDTA当量/g的铁螯合活性,其中分子质量大于10 kDa的部分具有更强的铁螯合活性[70]。一些其他具有铁螯合特性的食源性物质和处理所使用的酶及其多肽序列见表1。
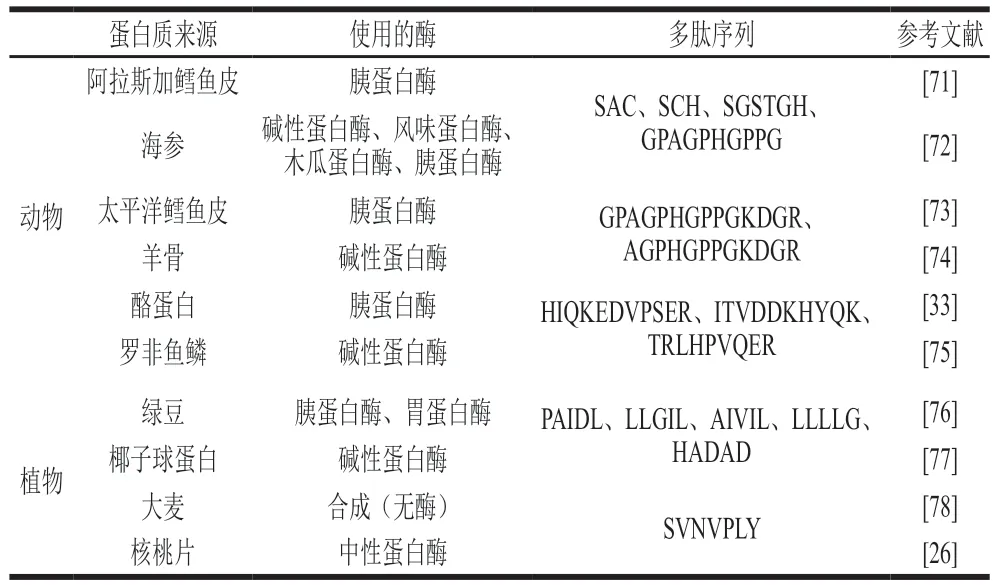
表1 具有铁螯合特性的食源性物质Table 1 Food-derived substances with iron-chelating properties
3 结 语
随着补铁剂的研究深入开展,大多新型补铁剂表现出良好的生物利用率和顺应性,但目前都还处于研究实验阶段,没有达到生产规模。我国对高质量、低副作用补铁剂的使用主要依赖进口,因此价格比较昂贵。为了使生物利用度好、稳定性好、价格低的补铁剂得到普及,对补铁剂进行了大量研究。其中,鉴于补铁剂中添加多肽物质对人体健康的重要性,应该探索更多不同蛋白质来源的多肽物质。此外,多肽铁复合物的构效关系尚不明确,如肽链上结合位点的定位、立体化学结构和动态过程等还有待进一步研究,复合物构成形式的多样性也有待探索。蛋白琥珀酸铁因其补铁效果显著、副作用小、消化吸收好等特点,具有良好的发展前景并且被广泛研究,目前蛋白琥珀酸铁的理化性质、反应机理等有较为明确的报道,相关制备工艺有具体的专利报道[79],但在小试、中试或小批量试生产中还需进一步研究。另外,蛋白琥珀酸铁在体内外对铁的吸收和转运机制对生物利用度和稳定性有重要意义,有必要对其进行更深层次的研究,为我国蛋白琥珀酸铁投入市场以及其他新型补铁剂提供科学依据和参考。
