CXC趋化因子配体8促进结直肠癌微环境中M2型巨噬细胞趋化及浸润
2022-09-07高书华柴欣悦刘杭丰成敏蓉郑锦秀
高书华, 柴欣悦, 刘杭丰, 成敏蓉, 郑锦秀,4), 邵 莹, 杨 涛,4)*
(1)山西医科大学基础医学院生物化学与分子生物学教研室,太原 030001;2)山西医科大学基础医学院药理学教研室,太原 030001;3)山西医科大学基础医学院病理生理学教研室,太原 030001;4)山西医科大学细胞生理学教育部重点实验室,太原 030001)
趋化因子(chemokines)是一类参与白细胞向炎症部位趋化的小分子蛋白质,它是肿瘤微环境(tumor microenvironment,TME)中的重要组分,可通过靶向肿瘤微环境中的非免疫细胞,包括肿瘤细胞和血管内皮细胞,进而调节肿瘤细胞增殖、肿瘤干细胞样细胞特性、肿瘤侵袭与转移,直接或间接地参与抗肿瘤免疫应答,并影响癌症进展、患者治疗及预后[1-3]。
CXC趋化因子配体8(CXC chemokine ligand 8,CXCL8)又称白细胞介素8(interleukin 8,IL-8),由单核细胞、肺泡巨噬细胞、内皮细胞和上皮细胞等分泌[4-7],主要通过与G蛋白偶联受体C-X-C趋化因子受体1型(CXCR1)和C-X-C趋化因子受体2型(CXCR2)高亲和力结合并发挥生物学作用[8]。研究证实,CXCL8在多种肿瘤中表达上调,通过CXCL8-CXCR1/2信号通路调控肿瘤血管生成、免疫细胞浸润、细胞运动及调节局部抗肿瘤免疫反应,从而介导肿瘤的恶性进展[9-11]。已有部分研究表明,高浓度的CXCL8与结直肠癌患者TNM分期和远处转移相关[12, 13],然而,CXCL8对结直肠癌(colorectal cancer,CRC)免疫微环境有何影响尚不清楚。
肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)作为TME中主要的肿瘤侵袭性免疫细胞群,能够促进肿瘤免疫逃逸、血管生成、肿瘤生长和转移。大量研究表明,TME中大量的趋化因子(CCL1、CCL2、CCL3、CCL4、CCLC、CXCL1、CXCL2、CXCL4、CX3CL1)能够招募巨噬细胞进入微环境[14]。进入微环境后巨噬细胞主要被极化为M2型,促进肿瘤的生长和转移,与肿瘤不良预后相关[9, 10, 15, 16]。目前,已经明确CRC中有大量的TAMs浸润,并且与CRC转移和脉管形成相关[17, 18]。但CXCL8作为一种趋化因子能否招募和趋化巨噬细胞仍未可知。因此,研究CXCL8是否能调节TAMs极化与浸润对抑制结直肠癌恶性进展具有重要意义。本文工作旨在探讨CXCL8与结直肠癌微环境中M2型巨噬细胞浸润之间的联系。
1 材料与方法
1.1 材料
人结直肠癌细胞株HCT116、LoVo、CL34、SW620、SW480、人急性单核细胞白血病细胞株THP-1均购自中国科学院典型培养物保藏委员会细胞库。收集2013年1月4日至2014年7月29日期间,于山西省肿瘤医院手术后制备的结直肠癌及癌旁石蜡包埋组织102对,并制备组织芯片。本研究获得山西医科大学伦理委员会批准,患者或其家属均签署知情同意书。RPMI1640培养基购自Hyclone公司;MCCOY′s 5A培养基、青链霉素混合液(P1400)、胰蛋白酶-EDTA消化液(No.T1300)均购自北京Solarbio公司;L-15培养基、胎牛血清购自Gibco公司;Phorbol 12-myristate 13-acetate(PMA)(HY18739)购自MCE公司;蛋白质裂解液RIPA(P0013B)购自Beyotime Biotechnology公司;二辛可宁酸(bicinchonininc acid, BCA, WB6501)试剂盒购自New Cell &Molecular Biotechnology;超敏化学发光(enhanced chemiluminescent, ECL)(SW134-01)检测试剂盒购自北京赛文创新生物科技有限公司;小鼠抗人CXCL8抗体(ab18672)、兔抗人CD163抗体(ab182422)购自Abcam公司;兔抗人CXCL8抗体(AHC0881)购自ThermoFisher公司;鼠抗肌动蛋白(actin)(HC201)购自全式金公司;辣根过氧化物酶(horseradish peroxidase, HRP)标记的山羊抗鼠IgG(7076S)购自Cell signaling Technology,所用抗体均保存至-20 ℃;HRP标记的山羊抗小鼠/兔IgG聚合物及二氨基联苯(diaminobenzidine, DAB)显色试剂盒均购自北京中杉金桥生物技术有限公司;RNA提取试剂盒(CW0581S)、反转录酶试剂(CW2020M)均购自中国康为世纪公司;QuantiNova SYBR Green PCR kit(No.208054)购自QIAGEN公司。
1.2 TCGA数据库
使用临床生信之家在线工具对癌症基因组图谱(TCGA)数据库来源结直肠癌及正常组织样本中CXCL8表达数据进行分析,ssGSEA算法分析TCGA数据库CRC样本的免疫细胞浸润情况。
1.3 芯片制备及IHC染色
制作带有阵列孔的受体蜡块,根据HE染色,穿取供体结直肠癌及其癌旁石蜡包埋组织蜡块上具有代表性的区域,将其嵌入制备好的蜡块阵列孔中,制备成组织芯片蜡块。切片经常规脱蜡水化,抗原修复后晾至室温。加入300 ml/L过氧化氢溶液阻断内源性过氧化物酶,并用5%牛血清白蛋白(bovine serum albumin, BSA)进行封闭;滴加兔抗人CXCL8多克隆抗体(1∶400)兔抗人CD163单克隆抗体(1∶500),4℃过夜孵育;PBS振荡清洗3次,每次2 min,加入HRP标记的山羊抗小鼠/兔IgG聚合物,室温孵育30 min;PBS洗涤,DAB进行显色;苏木素复染,脱水,常规封片。按照“染色阳性率评分(阴性0分,1分<25%,25%≤2分≤50%,3分>50%)”与“染色强度评分(阴性0分,弱阳性1分,中阳性2分,强阳性3分)”的乘积作为总评分进行分组。根据患者所得评分中位值分为低表达组与高表达组,不染色或零星染色则定义为阴性。IHC染色结果均由两位病理医师经双盲法独立评分。
1.4 细胞培养
使用RPMI1640培养基培养THP-1细胞、CL34细胞、LoVo细胞,MCCOY′5A培养基培养HCT116细胞,L-15培养基培养SW480、SW620细胞。培养基均含100 ml/L胎牛血清和100 IU/mL青霉素、100 μg/mL链霉素。其中,THP-1、CL34、LoVo、HCT116细胞置于50 mL/L CO2的37℃细胞培养箱内培养,SW480、SW620细胞则置于37℃正常空气的细胞培养箱内培养。THP-1细胞收集、传代采用离心方式;CL34、LoVo、HCT116、SW480、SW620细胞收集、传代均采用2.5 g/L胰蛋白酶消化方式。
1.5 qRT-PCR检测
使用TRIzol法提取细胞总RNA并逆转录成cDNA。根据QuantiNova SYBR Green PCR Kit试剂盒说明书配置反应体系。反应总体积为20 μL/管,包括cDNA 50 ng、引物为0.7 μmol/L、SYBR Green PCR Master Mix为10 μL/管,参比染料罗丹明X(rhodamine X, ROX)为2 μL/管,ddH2O补齐反应体系。反应条件为:95 ℃预变性2 min;95 ℃ 5 s,60 ℃ 10 s,重复40个循环。每个反应设置3个复孔,以2-△△Ct值作为相对表达量,以GAPDH为内参,其引物序列如Table 1所示。

Table 1 Sequences of the primers
1.6 Western 印迹检测
Western 印迹检测CXCL8蛋白表达。收集各组细胞沉淀,RIPA裂解细胞提取总蛋白质,BCA试剂盒进行蛋白质定量。配置聚丙烯酰胺凝胶,上样30 μg总蛋白质/孔,电泳2 h,转膜1.5 h,封闭1 h。加小鼠抗人β-肌动蛋白(β-actin)单克隆抗体(1∶4 000)、小鼠抗人CXCL8单克隆抗体(1∶500),4 ℃孵育过夜;TBST洗涤,HRP标记山羊抗小鼠IgG(1∶5 000),室温孵育1 h;ECL发光液,显影。
1.7 慢病毒感染
慢病毒包装CXCL8过表达质粒由上海吉凯基因科技有限公司完成,以慢病毒包装空载质粒为对照组。感染前1 d,于6孔板中接种细胞8×104个/孔,37 ℃培养至细胞汇合度为20%~30%时,按照感染系数MOI=20感染HCT116细胞,12 h后更换新鲜培养基。感染过程中观察感染效率,加入嘌呤霉素Polybrene筛选稳定感染细胞。
1.8 M2型巨噬细胞的诱导
以100 ng/mL的PMA刺激THP-1细胞(5×105个/mL)24 h,贴壁后更换培养基,加入40 ng/mL IL-4,培养48 h,细胞相差显微镜下拍照。收集细胞沉淀,qRT-PCR检测M2型巨噬细胞特异性标志物CD163的mRNA表达水平。
1.9 Transwell趋化分析
Transwell小室置入24孔板,上室加入3×104个THP-1细胞,再加入100 ng/mL PMA作用24 h,待THP-1转变为贴壁细胞,更换上室培养基,加入40 ng/mL IL-4作用48 h,再次更换培养基,于下室分别加入2×104个HCT116、过表达CXCL8的HCT116细胞或IL-1β刺激HCT116后的条件培养基共培养24 h。同样在SW480细胞对应各组中进行重复。取出上室,PBS清洗3次,甲醇固定30 min,PBS再次清洗,1%结晶紫溶液染色15 min,PBS洗涤3次,用棉签轻轻拭去上室内部细胞,显微镜下随机选取5个视野观察并拍照,计数各组穿出细胞数。每组设置3个复孔,实验单独重复3次。
1.10 统计学分析
2 结果
2.1 CXC趋化因子配体8在结直肠癌患者癌组织中高表达
对TCGA数据库的CRC患者癌组织及正常组织样本表达数据进行分析。结果正如Fig.1A所示,CRC患者肿瘤组织CXCL8的mRNA水平显著高于正常组织(P<0.01)。为进一步明确CXCL8在结直肠癌组织中的表达情况,本文通过IHC染色检测102对结直肠癌组织及配对的癌旁组织中CXCL8的表达。结果显示,CRC组织中CXCL8表达水平显著高于癌旁组织(Fig.1B)。
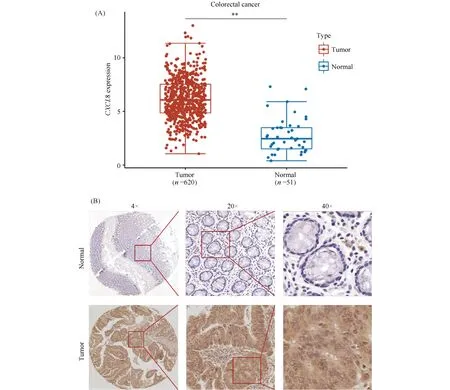
Fig.1 CXCL8 was highly expressed in cancer tissues of CRC patients (A)The expression level of CXCL8 in CRC cancer tissues was higher than that in normal tissues.Tumor(n=620), Normal(n=51).(B)The expression of CXCL8 in cancer tissues of CRC patients was higher than the paired adjacent tissues.n=102
2.2 CXC趋化因子配体8高于表达结直肠癌组织浸润更多的M2型巨噬细胞
使用ssGSEA算法分析TCGA数据库CRC样本的免疫细胞浸润情况。结果正如Fig.2A所示,高表达CXCL8的CRC组织中巨噬细胞浸润程度高于低表达CXCL8的CRC组织(P<0.05)。已有研究表明,肿瘤微环境中存在大量肿瘤相关巨噬细胞,其表型大部分表现为M2型[9, 10]。随后,本研究依据CXCL8表达中位值,将102例CRC组织分为低表达组与高表达组,并检测样本中CD163表达水平。结果显示,相较于CXCL8低表达组,CXCL8高表达的CRC肿瘤组织中CD163表达水平更高,表明有更多的M2型巨噬细胞浸润(Fig.2B)。
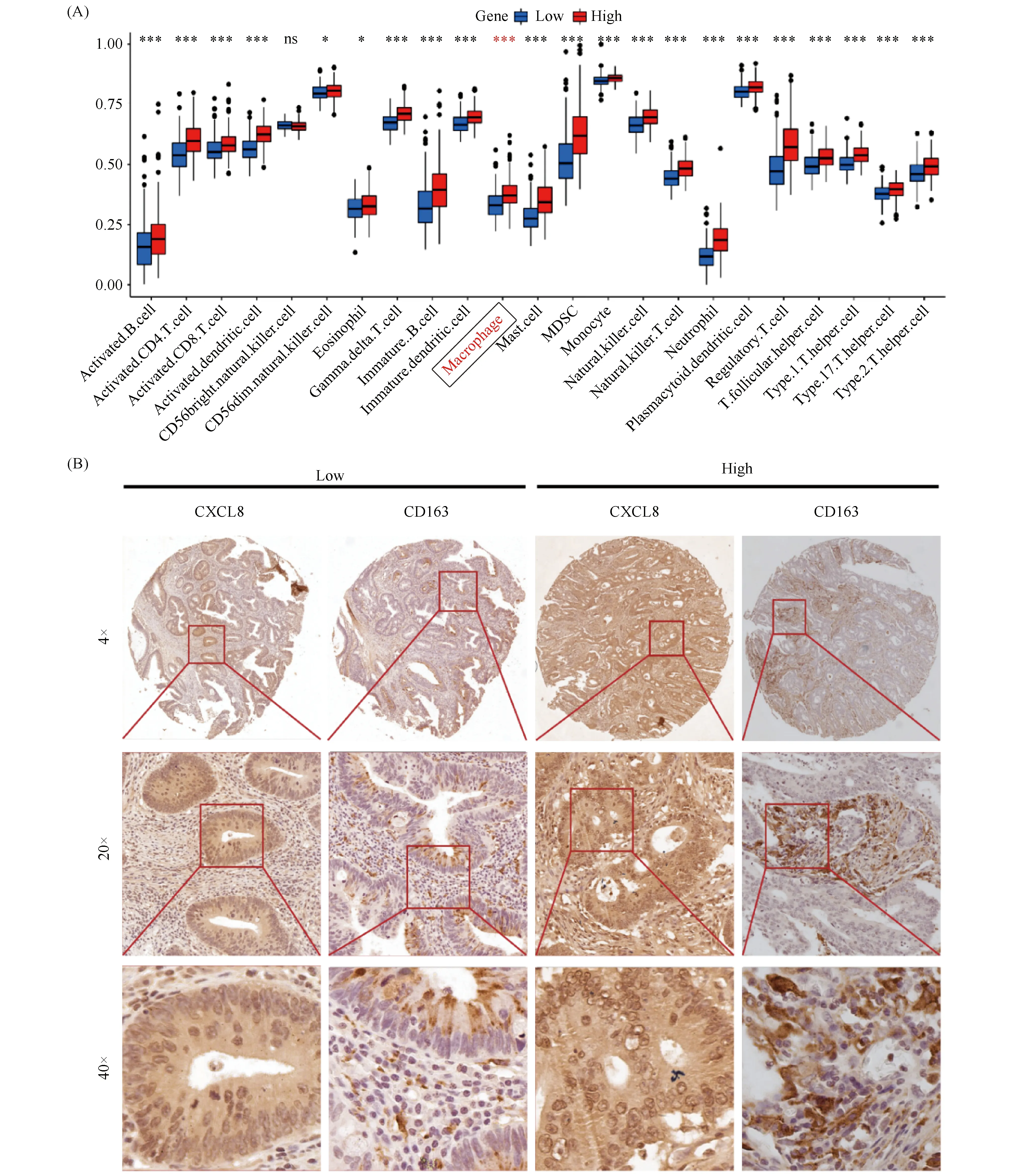
Fig.2 CRC tissues with high CXCL8 expression were infiltrated more M2 macrophages (A)Bioinformatic results showed that macrophage infiltration in the CXCL8 high-expression group was higher than the low-expression group in CRC tissues.(B)There are more M2 macrophages infiltrated in tumor tissues with high expression of CXCL8.n=102
2.3 结直肠癌细胞中CXC趋化因子配体8高表达促进M2型巨噬细胞趋化
Western 印迹和qRT-PCR检测5种CRC细胞HCT116、LoVo、CL34、SW480和SW620中CXCL8表达水平。结果如Fig.3A所示,相较于HCT116细胞,SW480细胞中CXCL8的mRNA及蛋白质表达水平相对更高(P<0.05),选取在CXCL8差异表达的HCT116细胞及SW480细胞中过表达CXCL8。检测SW480及HCT116细胞中CXCL8主要配体CXCR1与CXCR2表达情况。结果见Fig.3B所示,CXCR2在SW480中表达较高,CXCR1在2株细胞中表达差异不明显。Western 印迹、qRT-PCR检测CXCL8过表达效率,结果正如Fig.3C所示,CXCL8蛋白及mRNA水平均显著上调(P<0.05)。
qRT-PCR结果显示,经PMA及IL-4作用后,CD163表达水平明显上调(P<0.05),表明THP-1被成功诱导为M2型巨噬细胞(Fig.3D)。THP-1细胞本身为圆形或类圆形悬浮状态,细胞边缘整齐;经PMA诱导后,细胞由悬浮转为贴壁状态;再经IL-4诱导后,THP-1从胞体伸出伪足,形态不规则,表现为多边形(Fig.3E)。将M2型巨噬细胞分别与HCT116或SW480及CXCL8/HCT116或CXCL8/SW480共培养。Transwell结果显示,M2型巨噬细胞趋化数目随CXCL8表达水平的升高而增加(Fig.3F)(P<0.05)。以上结果提示,肿瘤细胞高表达CXCL8促进M2型巨噬细胞趋化。
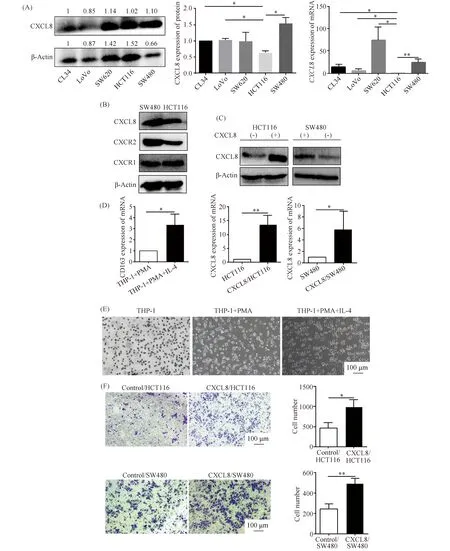
Fig.3 High expression of CXCL8 in CRC cells can promote the chemotaxis of M2 macrophages (A)The mRNA and protein expression of CXCL8 were detected in CL34, LoVo, SW620, HCT116 and SW480 cells.(B)The protein expression of CXCL8,CXCR1,CXCR2 in HCT116 cells and SW480 cells were detected by Western blotting.(C)The efficiency of CXCL8 overexpression was detected by Western blotting and qRT-PCR.(D)qRT-PCR was used to verify the polarization efficiency of M2 macrophages.(E)Detection of morphological changes during the induction of THP-1 into M2 macrophages.(F)The chemotactic number of M2 macrophages was more in the CXCL8/HCT116 or CXCL8/SW480 group than that in the HCT116 or SW480 group.N=3, *P<0.05,** P<0.01
2.4 IL-1β诱导HCT116、SW480中CXC趋化因子配体8表达进一步促进其对M2型巨噬细胞的趋化
有文献报道,IL-1β能刺激CXCL8表达上调[19-21]。据此,本文将终浓度为20 ng/mL和100 ng/mL的IL-1β分别处理HCT116细胞株48 h,终浓度为1 ng/mL和50 ng/mL的IL-1β分别处理SW480细胞株48 h。发现CXCL8蛋白及mRNA表达水平均显著上调(Fig.4A,B)(P<0.05)。
为进一步明确CXCL8对M2型巨噬细胞的趋化作用,将不同浓度IL-1β处理过HCT116与SW480的条件培养基与M2型巨噬细胞共培养。结果显示,M2型巨噬细胞趋化数目明显多于未经IL-1β处理HCT116及SW480的培养基(Fig.4C,D)(P<0.05)。
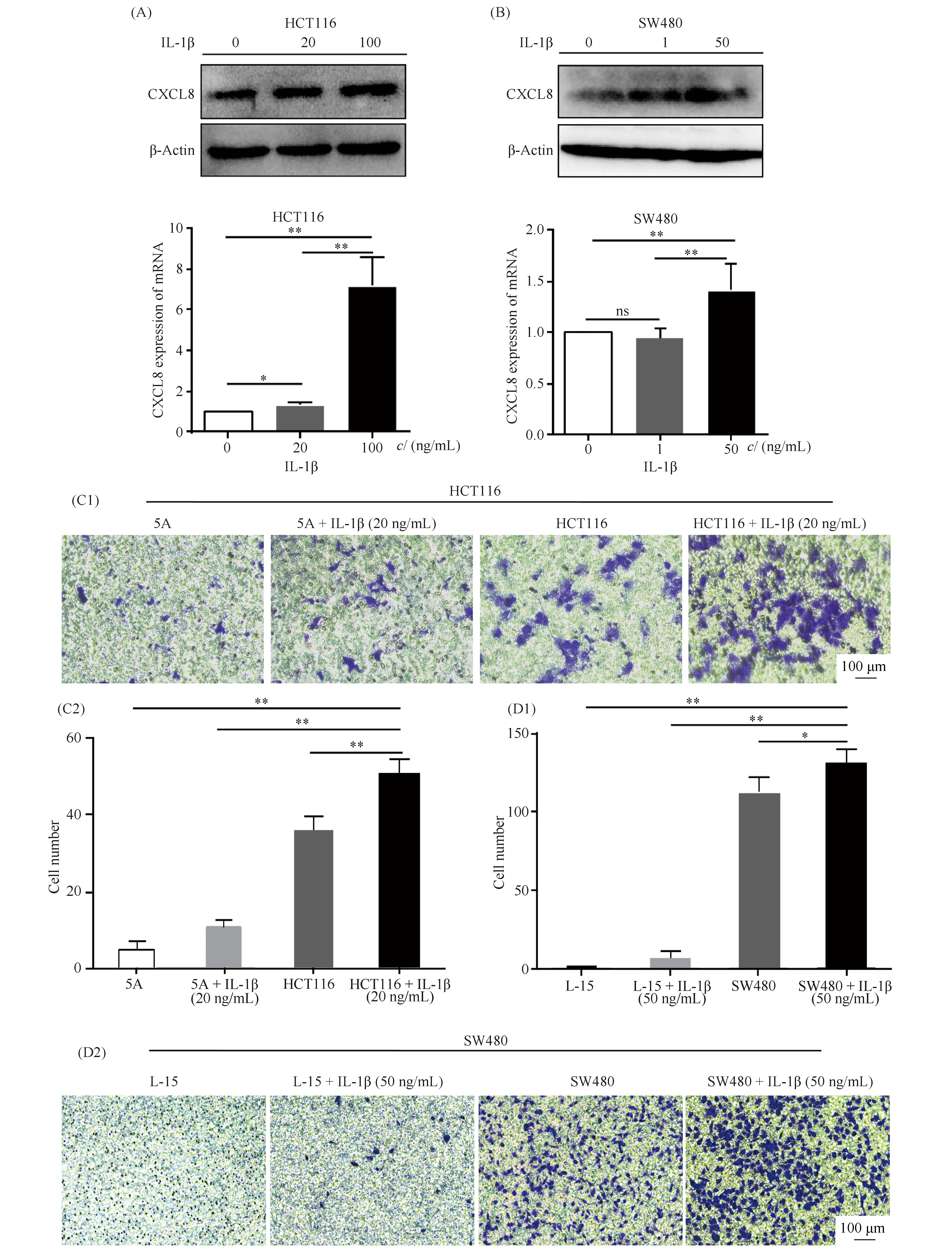
Fig.4 The expression of CXCL8 in HCT116 and SW480 can induced by IL-1β, which can further promote the chemotaxis number of M2 macrophages (A)CXCL8 expression in HCT116 cells was upregulated via IL-1β treatment(20,100 ng/mL).(B)CXCL8 expression in SW480 cells was upregulated via IL-1β treatment(1,50 ng/mL).(C)The chemotaxis number of M2 macrophages increased significantly in the conditioned medium of HCT116 with IL-1β.(D)The chemotaxis number of M2 macrophages increased significantly in the conditioned medium of SW480 with IL-1β.n=3,*P<0.05,** P<0.01
3 讨论
趋化因子CXCL8,在未受刺激的细胞中几乎无法检测到,其表达可受多种细胞因子(IL-1、IL-6、CXCL12和TNF-α)、缺氧、活性氧(ROS)、细菌颗粒和其他环境应激的刺激调控[22-24]。CXCL8可能在炎症期间和稳态期间控制白细胞运输,主要通过与趋化受体CXCR1、CXCR2[25]相互作用,这也解释了炎症与肿瘤发生发展之间的联系。以往的研究仅揭示,CXCL8能够促进CRC细胞的增殖、迁移,能通过诱导血管生成和上皮间充质转换(EMT),从而促进肿瘤转移[26],而CXCL8对CRC微环境甚至是免疫细胞浸润的调节作用知之甚少。因此,揭示结直肠癌中CXCL8对肿瘤微环境的调节机制有助于探索结直肠癌恶性进展的机制。
肿瘤微环境是一个复杂的生态环境,主要由肿瘤细胞、基质细胞、细胞因子和趋化因子等组成。其中,基质细胞又包括肿瘤细胞、巨噬细胞、成纤维细胞、内皮细胞、T淋巴细胞和B淋巴细胞等[11, 27, 28]。肿瘤相关巨噬细胞作为肿瘤微环境中的重要组成部分,绝大部分均表现为M2表型,发挥促瘤作用[29, 30]。在巨噬细胞与肿瘤细胞的相互作用过程中,肿瘤细胞受到某些刺激能够分泌大量的活性物质。其中,就包括大量趋化因子,通过调控肿瘤微环境的变化,来进一步募集M2型巨噬细胞或诱导巨噬细胞转化为M2型,进而促进肿瘤的生长、侵袭和转移等生物学活动。目前,CRC中大量TAMs浸润的机制尚未明确,趋化因子CXCL8是否调控CRC微环境、参与招募M2型巨噬细胞仍未得到研究。
本研究通过生物信息分析和临床样本检测,发现CRC组织CXCL8的表达水平高于癌旁组织。在CXCL8高表达的CRC样本中,有更多M2型巨噬细胞浸润,提示M2型巨噬细胞浸润可能与CXCL8高表达相关。将体外诱导的M2型巨噬细胞与不同CXCL8表达水平的HCT116细胞共培养。结果显示,随着CXCL8表达水平升高,M2型巨噬细胞趋化数目增加,提示CXCL8能够趋化M2型巨噬细胞,这也进一步验证了生物信息学及患者组织中得到的结果。
IL-1β作为肿瘤微环境中另一种高度富集的趋化因子,参与肿瘤恶性进程,与肿瘤进展相关[31]。有大量研究表明,IL-1β能够促进CXCL8表达增加[19-21]。其中,在三阴性乳腺癌中,IL-1β通过诱导CXCL8表达进一步促进肿瘤进展[32]。但在CRC微环境中,IL-1β能否诱导CXCL8表达仍未得到验证。本研究结果证实,IL-1β可诱导CRC细胞中CXCL8的表达,并进一步加强了CRC细胞对M2型巨噬细胞的趋化作用。这提示CRC组织中,CXCL8高表达可能是由肿瘤微环境中高浓度IL-1β介导。但IL-1β的分泌及调控机制仍需进一步研究。
综上所述,CRC细胞中CXCL8可由IL-1β诱导产生,CXCL8表达增加能够促进M2型巨噬细胞的趋化,CRC微环境中M2型巨噬细胞大量浸润可能与CXCL8表达升高有关。但是,CXCL8促进M2型巨噬细胞浸润具体机制仍未阐明。因此,课题组将进一步探究CXCL8调控TAMs浸润的具体分子机制,以期为结直肠癌的肿瘤免疫治疗策略提供一些思路。
