粪产碱杆菌矿化土壤中重金属离子的研究及应用
2022-09-02杨晋炜辛东帅
程 瑜 胡 建 刘 强 杨晋炜 王 钜 辛东帅 郝 宁
(1.江苏省有色金属华东地质勘查局地球化学勘查与海洋地质调查研究院,江苏 南京 210007;2.南京工业大学生物与制药工程学院,江苏 南京 210000)
在我国部分有色金属矿区,因早期无序开发导致矿区土壤及周边耕地受到不同程度的重金属污染,从而严重影响矿区的生态安全。研究表明,重金属离子可通过多种途径进入土壤,并通过作物的食物链循环进入人体,进而危害人体健康[1]。目前,修复重金属污染土壤的方法主要有物理化学法和生物法:物理化学法可有效去除土壤中的重金属,但存在成本高、易破坏土壤结构及造成二次污染等问题;生物法因土壤微生物绿色无害且能够有效地固化重金属从而成为一种有着广阔应用前景的土壤修复方法[2-3]。近年来,国内外开展了大量关于微生物固化及矿化修复土壤的机理研究。李驰等[4]研究发现,利用微生物矿化技术可使分散性土壤变得密实紧结从而解决土壤过于分散难以种植等问题;滕应等[5]总结发现硫还原菌可通过自身呼吸作用将硫酸盐还原成硫化物,还可以在同化作用过程中利用硫酸盐合成氨基酸,如胱氨酸和蛋氨酸,再通过脱硫作用使S2-分泌于体外,并与重金属形成硫化物沉淀从而达到矿化重金属的目的;FUJITA、刘睿等[6-8]基于生物矿化原理,利用细菌分解尿素等底物产生CO32-,使重金属离子矿化从而达到修复污染土壤的目的。
本研究利用从福建某铅锌矿区周边土壤中筛选出的优势矿化菌种—粪产碱杆菌[9-11],针对配制的不同浓度的Pb2+、Cd2+和Zn2+溶液,在实验室条件下进行尿素浓度、矿化时间、溶液pH值对重金属离子矿化效果影响的研究,从而确定最优的矿化条件和最佳微生物,并将该微生物用于实际土壤进行矿化效果验证,为后期矿区土壤治理提供依据。
1 菌种采集与分析
试验所用矿化菌种来自矿区内有机质含量高的农田、菜地等位置的土壤中,通过细菌富集与分离、纯化、鉴定、BLAST比对分析后得到8种可能的矿化菌种,分别与粪产碱杆菌1、粪产碱杆菌2、奇异变形杆菌1、奇异变形杆菌2、普通变形杆菌1、普通变形杆菌2、溶藻弧菌1、溶藻弧菌2的同源性分别达到98.7%、97.5%、96.8%、98.9%、97.8%、99.2%、97.8%、98.2%。 8种菌分别用编号 BF1、BF2、BQ1、BQ2、BP1、BP2、BR1、BR2 表示,其形态见图1所示,培养基配方如表1。

图1 8种矿化细菌形态图Fig.1 Morphology of eight mineralized bacteria

表1 微生物培养基配方Table 1 Formula of microbial medium
2 试验原理及试验方法
2.1 试验原理
碳酸盐矿化细菌在其生长繁殖过程中产生特定脲酶(脲酶,系统命名为酰胺水解酶,是人类首次获得晶体并发现含有镍离子的金属酶),脲酶可以催化产生CO32-来固结土壤中 Pb2+、Cd2+、Zn2+等重金属离子,使其由离子可迁移态转变为较稳定的碳酸盐矿化态,从而达到矿化的目的。重金属离子矿化过程可用如下方程式近似表示:

2.2 试验方法
2.2.1 微生物菌种培养、脲酶活度测定
将从矿区分离得到的 BF1、BF2、BQ1、BQ2、BP1、BP2、BR1、BR2菌株在特定条件下培养后,取少量菌液用分光光度计测定其光密度值(optical density,简写为OD),以确定培养的菌液浓度。将培养的菌液离心后弃上清液,按提取比例加入提取液,超声破碎细胞4℃条件下离心弃上清液,置冰上待测。将菌液加入试剂盒中行酶促反应并测量其吸光度值A用以测量氨量,并使用标准条件下测定的回归方程y=0.091 5x+0.037 3,测定菌液浓度计算细菌酶活性,其中x为标准品浓度(μg/mL),y为吸光值A,最后以UE表示酶活力,单位的定义为每1万个细菌或细胞每分钟产生1μg NH3-N,定义为一个酶活力单位。
2.2.2 细菌矿化影响因素试验
通过细菌脲酶活度检测,选定两种活度最高的细菌进行试验研究。首先在实验室条件下进行单一重金属离子矿化试验,将不同类型重金属离子溶液分别在不同尿素浓度、重金属离子浓度、重金属离子的加入时间、矿化反应时间时进行矿化反应,从而确定2种细菌在进行矿化反应时最佳的条件,并在此基础上进行混合重金属离子试验,以此筛选出该矿区最优的矿化菌种。
2.2.3 原土与田间试验
利用确定的最优矿化菌种进行原土试验,通过考察重金属离子矿化效果找出原土试验与溶液试验之间的差距,并为最终在田间进行试验提供依据。
3 试验结果与讨论
3.1 矿化微生物菌种选定
选用0.5%的标准葡萄糖乳糖肉汤(LB)培养基,在自然 pH 值条件下,将得到的 BF1、BF2、BQ1、BQ2、BP1、BP2、BR1、BR2 菌株按照每 100 mL培养基接种纯菌株1环,在37℃恒温培养箱中以170 r/min培养24 h,待培养基浑浊取出菌液。取3 mL细菌液于1 cm内径比色皿,利用细菌液中细胞浓度与其浑浊度成正比,与透光度成反比,用分光光度计测定其OD值表示相应菌液浓度。标准LB培养基配方组成为:蛋白胨1%、酵母粉0.5%、氯化钠1%。
矿化细菌脲酶活度测定方法为将培养后细菌收集,离心后弃上清液,按提取比例加入提取液,超声破碎细胞(冰浴,功率200 W,超声3 s,间隔10 s,重复30次)4℃条件下离心弃上清液,置冰上待测。测定步骤如下:①分光光度计或酶标仪预热30min以上,调节波长至578 nm,用蒸馏水将设备调零。②酶促反应:按照试剂盒加入尿素。混匀,放入37℃水浴1 h后,10 000 r/min、25℃离心10 min,取上清液。③将上清液稀释10倍(取0.1 mL上清液,加入0.9 mL蒸馏水)。④测氨量(在微量石英比色皿96孔板中加入试剂,充分混匀),室温放置20 min。 混匀,于578 nm处,蒸馏水调零,读吸光值A,计算A-A,测定管-A对照管,每个测定管设置一个对照管。⑤活力计算,标准条件下测定的回归方程为y=0.091 5x+0.037 3;x为标准品浓度(μg/mL),y为吸光值A。
应用上述方法对选取的8种细菌的脲酶活性进行检测,测定的脲酶活性数据见表2。

表2 脲酶活性比较Table 2 Comparison of urease activity
由表2可知,BF1(粪产碱杆菌1)和BF2(粪产碱杆菌2)的脲酶活性较高,故将采用BF1和BF2作为矿化菌种进行试验。
3.2 不同尿素浓度对矿化效果的影响
取37℃、170 r/min培养24 h的BF1和BF2的菌液各5支,每支1 mL,分别添加1 mL不同浓度的尿素溶液(20、60、100、140、180 g/L),充分振荡混匀,催化底物尿素2 h后,加1 mL配制好的重金属离子溶液(Pb2+浓度1 g/L、Cd2+浓度 0.01 g/L、Zn2+浓度1 g/L)充分混匀,放置24 h后,经离心测定上清液中离子的含量,3种重金属离子的矿化率变化趋势如图2和图3所示。

图2 不同尿素浓度掺量下重金属离子矿化率(BF1)Fig.2 Mineralization rates of heavy metal ions with different concentrations of urea(BF1)
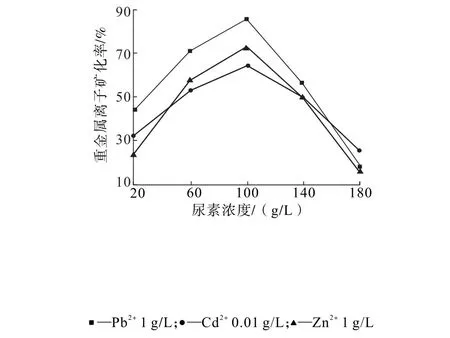
图3 不同尿素浓度掺量下重金属离子矿化率(BF2)Fig.3 Mineralization rates of heavy metal ions with different concentrations of urea(BF2)
由图2、图3可知,当尿素浓度为100 g/L时,BF1和BF2对重金属离子具有最佳的矿化效果。当尿素浓度较低时,菌株催化底物尿素产生的CO32-量不足,浓度过高时,尿素溶液pH值较高,抑制脲酶的活性,从而影响重金属离子的矿化。因此,选择尿素浓度为100 g/L。
3.3 不同重金属离子浓度对矿化效果的影响
因重金属离子浓度过高会对菌株产生毒害作用,故开展了不同重金属离子浓度的矿化试验。取37℃、170 r/min培养24 h的 BF1、BF2各 15支,每支1 mL,分别添加100 g/L的尿素溶液1 mL,充分振荡混匀,催化底物尿素2 h后,分别加入1 mL配置好的不同浓度的 Pb2+、Cd2+、Zn2+溶液,充分混匀放置24 h后,离心测上清液中重金属离子的含量并计算矿化率,结果见图4。

图4 不同重金属离子不同浓度下的矿化率Fig.4 Mineralization rates of different heavy metal ions at different concentrations
由图4可知,当Pb2+浓度在0.01~1 g/L之间时,2种菌种矿化率随Pb2+浓度增加均呈现波动提高趋势,在试验区间内浓度最大时矿化率最高,其中添加BF1时矿化率最高达90.7%;当Cd2+在0.001~0.01 g/L之间时,BF1对Cd2+的矿化率在65%~69%之间,随着离子浓度降低矿化率呈现上升趋势,BF2对Cd2+的矿化率在60%~64%,矿化率随离子浓度变化不明显;当Zn2+浓度在0.01~1 g/L之间时,BF1对Zn2+的矿化率随着浓度增加呈现先增加后减少的趋势,最高矿化率为81.1%,BF2对Zn2+的矿化率随离子浓度增加而增大,最高为76.8%。综合对比上述数据发现,BF1和BF2两种微生物在相应的重金属离子浓度区间内矿化率较为稳定,说明上述区间内重金属对菌株的毒性较小,总体而言BF1对Pb2+、Cd2+和Zn2+的矿化效果要好于BF2。
3.4 脲酶催化时间对矿化效果的影响
因菌株产脲酶至脲酶催化底物尿素需要反应时间,为获得脲酶催化底物尿素的最佳反应时间,进行了不同反应时间的试验研究。取37℃、170 r/min培养24 h的BF1、BF2各5批,每批各3支,分别添加浓度为100 g/L尿素1 mL,充分振荡混匀,在加入尿素1、2、3、4、5 h后,分别加入1mL配置好的重金属离子溶液充分混匀,放置24 h后,离心测上清液中重金属离子的含量并计算矿化率。脲酶催化尿素不同反应时间时重金属离子的矿化率见图5和图6。

图5 脲酶催化尿素不同反应时间重金属离子的矿化率(BF1)Fig.5 Mineralization rates of heavy metal ions in urea catalyzed by urease at different reaction times(BF1)
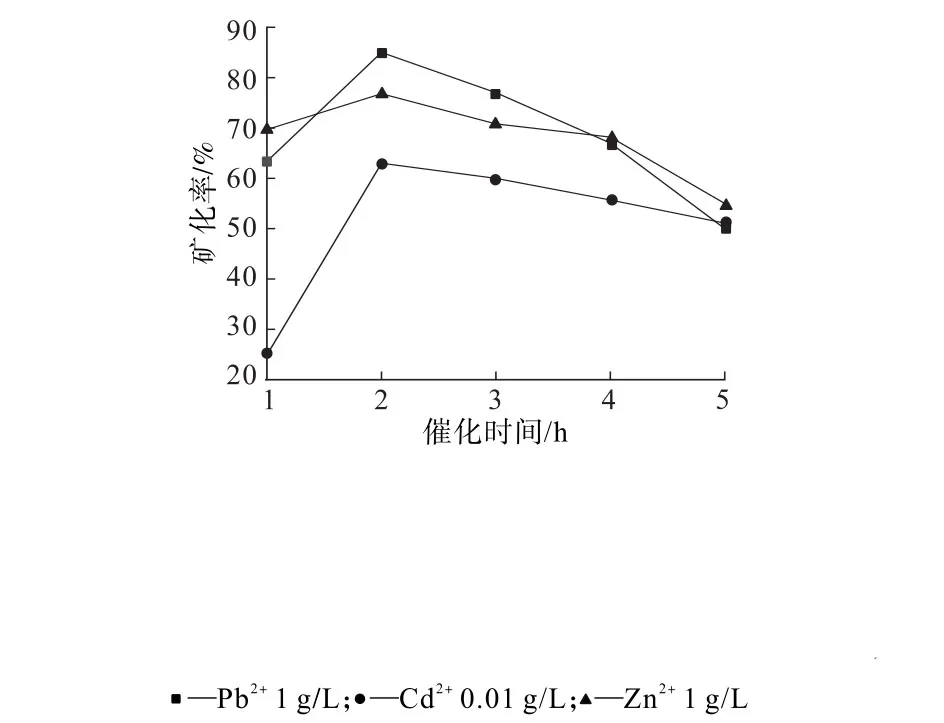
图6 脲酶催化尿素不同反应时间重金属离子的矿化率(BF2)Fig.6 Mineralization rates of heavy metal ions in urea catalyzed by urease at different reaction times(BF2)
由图5、图6可知,BF1和BF2在添加尿素2 h后加入重金属离子进行反应时矿化效果最好。加入时间过早,脲酶不能完全催化底物尿素分解为CO32-;加入时间过晚,酶易分解,进而影响脲酶催化底物尿素分解产生碳酸根,因而重金属离子的最佳添加时间为加入尿素后的2 h左右。
3.5 矿化反应时间对矿化效果的影响
通过矿化反应时间对重金属矿化率的影响试验,得到不同矿化时间下重金属离子的矿化率,试验结果见图7、图8。 取37℃、170 r/min培养24 h后的BF1、BF2的菌液各5批,每批各3只,分别添加浓度100 g/L的尿素1 mL,充分振荡混匀,催化底物尿素2 h后,加入1 mL配制好的重金属离子溶液,充分混匀,放入37℃、170 r/min的摇床中,每隔12 h每种菌分别取3支,共取5次,离心分析上清液中重金属离子的含量并计算矿化率。

图7 不同矿化时间下重金属离子的矿化率(BF1)Fig.7 Mineralization rates of heavy metal ions at different mineralization times(BF1)

图8 不同矿化时间下重金属离子的矿化率(BF2)Fig.8 Mineralization rates of heavy metal ions at different mineralization times(BF2)
由图7、图8可知,矿化时间越长,重金属离子的矿化率越好,但是从48 h后,矿化率增长缓慢并趋于平缓,故最佳的矿化时间应控制在48 h左右。
3.6 混合重金属离子矿化效果试验
在确定了各因素对重金属离子矿化率的影响及最佳掺量后,模拟真实土壤在溶液环境下开展混合重金属离子矿化试验。取37℃、170 r/min培养24 h后的BF1、BF2的菌液共8支,每支1mL,分别添加浓度100 g/L的尿素1mL,充分振荡混匀,催化底物尿素2 h后,加入1 mL配置好的混合重金属离子溶液,充分混匀,放置24 h后,离心测上清液中重金属离子的含量并计算矿化率,试验结果见图9(其中,A组试验Pb2+浓度 0.01 g/L,Cd2+浓度 0.001 g/L,Zn2+浓度0.01 g/L;B组试验Pb2+浓度 1 g/L,Cd2+浓度 0.01 g/L,Zn2+浓度 1 g/L;C组试验Pb2+浓度0.04 g/L,Cd2+浓度 0.02 g/L,Zn2+浓度 0.02 g/L;D组试验Pb2+浓度 0.1 g/L,Cd2+浓度0.01 g/L,Zn2+浓度0.1 g/L)。

图9 混合重金属离子矿化率Fig.9 Mineralization rates of mixed heavy metal ions
由图9可知,用BF1、BF2进行混合重金属离子矿化试验时,在不同重金属浓度配比条件下,Pb2+的矿化率大于80%,Cd2+的矿化率大于62%,Zn2+的矿化率均在77%以上。对比前述单因素条件试验可知,混合离子的矿化效果和单元素离子试验的矿化效果相当,由此说明BF1、BF2对混合重金属离子的矿化效果均较为理想。在混合体系中,BF1细菌的矿化效果均好于BF2菌。
3.7 菌种pH耐受性试验
对菌株的pH耐受性进行试验,取37℃、170 r/min培养24 h后的BF1、BF2的菌液各5 mL,采用HCl、NaOH 调节 pH 为 4、5、6、7、8、9 进行细菌的活性试验。测得细菌的活性值见图10。

图10 不同pH条件下菌株的脲酶活性Fig.10 Urease activity of strains under different pH conditions
由图10可知,BF1的脲酶活性耐受能力比BF2要强,在pH=4.0时脲酶活性最低,pH=8.0时脲酶活性最高,pH=9.0时脲酶活性略有降低,BF1最佳的pH适用范围是pH=6~8,由此也说明在强酸或者强碱条件下,细菌活性受到抑制,对于如何使细菌在该范围内保持活性,正是国际和国内攻坚克难的重点。
综合上述试验可知,BF1菌无论是脲酶活性还是对重金属离子的矿化率都好于BF2菌,后续将使用BF1菌开展重金属污染土壤的修复试验。
3.8 实验室土壤修复试验
3.8.1 试验样品
试验土壤样品采自福建某铅锌矿区,依据土壤污染状况调查结果,挑选出污染程度不同的两种土壤:重污染土壤(简称S1)、中度污染土壤(简称S2)。土壤样品采取时遵循NYT 1121.1-2006《土壤检测第1部分:土壤样品的采集、处理和贮存》[12]去除杂物后封装运输,其中S1样品30 kg、S2 样品 20 kg。
将取回的土壤样品按四分法,缩分至2 kg左右自然风干,研磨,过0.2 mm筛,分别保存用于分析和试验,两种土壤重金属Pb、Cd、Zn总量和各形态分析结果见表3、表4,土壤形态分析采用Tesier顺序提取法。

表3 S1土壤总量及各形态含量Table 3 Total and morphological contents of S1 soil mg/kg

表4 S2土壤总量及各形态含量Table 4 Total and morphological contents of S2 soil mg/kg
由表3可知,S1土壤中Pb、Cd、Zn总量高,其中Cd主要以离子态和碳酸盐结合态形式存在,而Pb、Zn大部分以铁锰结合态和残渣态形式存在,以离子态存在的含量仅占总量的0.69%和0.38%。表4显示S2土壤中Pb、Cd、Zn总量高,但离子态含量与土壤S1类似,Pb、Zn离子态含量很低,Cd离子态含量较高。依据福建省地方标准《农产品产地土壤重金属污染程度的分级》[13]中的农产品产地土壤重金属有效态(离子态)限制值标准(Pb2+含量<35 mg/kg、Cd2+含量<0.3 mg/kg、Zn2+含量<60 mg/kg)可判断,2种土壤3种重金属中仅有Cd2+超过限制值,会对农产品造成危害。
3.8.2 结果分析
使用培养后的BF1菌液对试验土壤进行矿化试验研究。取S1、S2各20 g于小碗中(碗底平铺四层纱布),将1.2 mL、37℃、170 r/min培养24 h后的BF1菌液和3 mL浓度100 g/L的尿素溶液混合2 h后,加入上述土壤充分混匀,静置48 h后,应用Tesier顺序提取法分析重金属离子的含量并与原土对比,反应后结果见图11,结果见表5、表6。

图11 不同土壤矿化效果Fig.11 Different soil mineralization effects
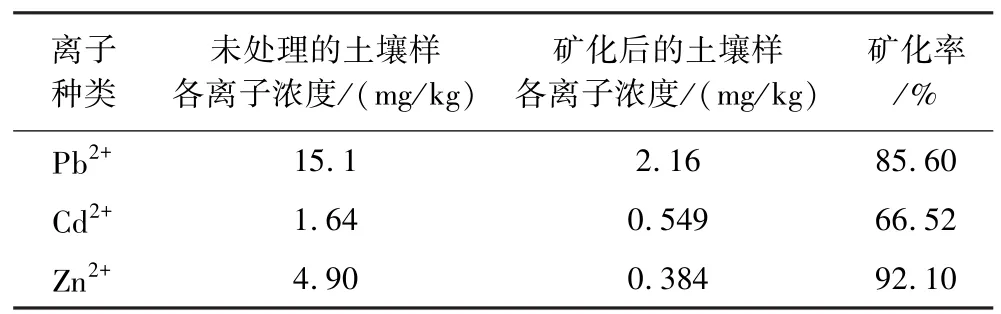
表5 S1土壤样重金属离子矿化效果Table 5 Mineralization effect of heavy metal ions in S1 soil samples
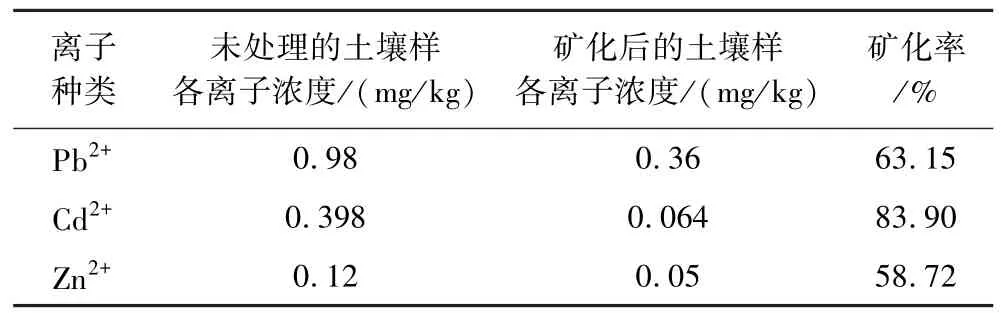
表6 S2土壤样重金属离子矿化效果Table 6 Mineralization effect of heavy metal ions in S1 soil sample
由表5、表6数据可知,在与离子溶液条件基本相同的情况下,BF1菌对S1、S2两种土壤中 Pb2+、Zn2+矿化率均到达83%以上,Cd2+的矿化率在60%左右,且矿化后土壤中所有重金属离子浓度均达到《农产品产地土壤重金属污染程度的分级》(DB35/T 859-2016)指标中的限制值标准,可作为耕地继续使用。同时,与前述混合离子溶液试验结果对比可知,BF1菌在真实土壤中的矿化效果略差于溶液中,其主要原因可能是土壤成分复杂,对菌株生长、细菌脲酶活性均有一定影响,可考虑向矿化菌中添加甘油作为保护剂,以阻止部分导致酶失活的物质接近活性中心,从而提高了酶的稳定性。
3.9 田间试验
为进一步验证BF1菌在实际土壤环境中矿化重金属离子的效果,在该铅锌矿区内选择一处因重金属Cd污染而荒废的农田进行田间试验,田块面积约800 m2,翻耕深度300 mm,将600 L OD=7的高浓度BF1菌液,在-4℃条件下运至矿区试验田进行试验。先加尿素底物稀释10倍后,分多次均匀喷洒在田内,每次喷洒后翻动并混合土壤,喷洒完成后覆盖薄膜72 h同时保持土壤湿度80%以上,在不同时间段检测微生物矿化后土壤中重金属离子变化情况,结果见表7。

表7 田间试验重金属Cd2+离子矿化效果Table 7 Field experiment on mineralization effect of heavy metal Cd2+ion
由表7可知,在自然条件下的田间试验中,未矿化前Cd2+超过《农产品产地土壤重金属污染程度的分级》(DB35/T 859-2016)中限制值标准,属于限制使用的农用地,矿化修复后Cd2+小于限制值标准,属于可利用农用地;同时土壤中Cd2+在微生物矿化处理后1年内变化不明显,说明使用该微生物进行矿化修复后可在一定时期内使重金属离子浓度保持稳定。
4 结 论
(1)试验菌取自福建某铅锌矿区内有机质含量高的农田、菜地、小树林等土壤中,筛选分离得到BF1、BF2、BQ1、BQ2、BP1、BP2、BR1、BR2 共8 种可产生脲酶的矿化菌种,选取活性较高的BF1、BF2进行试验。最终试验的土壤样品S1、S2取自矿区特定区域。
(2)研究发现在重金属离子浓度区间为Pb2+0.01~1 g/L,Cd2+0.001~0.01 g/L,Zn2+0.01~1 g/L时,对BF1、BF2菌株生长基本没有影响。
(3)在上述重金属离子浓度区间内,细菌矿化重金属离子的最佳试验条件为尿素浓度100 g/L、加尿素反应2 h后加入重金属离子溶液、矿化时间48 h以上且pH范围6-8。通过混合重金属离子矿化试验,表明 BF1、BF2 对 Pb2+、Cd2+、Zn2+的矿化率在 80%、62%、77%以上,且BF1 细菌对Pb2+、Cd2+、Zn2+的矿化效果均好于BF2菌。
(4)通过实际土壤修复试验发现,BF1菌对S1、S2两种土壤中Pb2+、Zn2+的矿化率均到达83%以上,Cd2+的矿化率在60%左右。真实土壤中重金属离子矿化效果与溶液中试验结果相比要差,其主要原因可能是土壤成分复杂,导致菌株生长和酶活性受到影响。田间试验结果显示,使用BF1菌修复镉污染农田,一年后矿化效果依旧理想。
(5)试验所选取的BF1、BF2菌种,在生长繁殖过程作用下产生酶,通过酶的催化作用分解尿素产生碳酸根并与重金属离子结合形成碳酸盐沉淀。这种生物矿物修复重金属污染土壤方法工艺简单,实用价值高,环境友好,具有大面积推广使用的可能性。
