铁死亡抑癌机制及其在消化系统肿瘤中的研究进展
2022-08-31李佳佳夏宣平吴利敏史宇宁张徐弨夏豫珊卢光荣
0 引言
癌症是第二大死亡原因,是严重威胁人类生命健康的主要疾病之一,2020年全球估计有1930万新发癌症病例,近1000万人死于癌症
.我国癌症中心公布的数据显示,恶性肿瘤死亡占居民全部死因的23.91%,而其中肝癌、胃癌等起源消化系统的癌症仍是我国主要的恶性肿瘤,严重危害国民健康,带来巨大的经济负担
.铁死亡(Ferroptosis)2012年首次由Brent R.Stockwell提出,以细胞内还原铁蓄积和脂质过氧化物蓄积为特点,是不同于凋亡、自噬的新型细胞程序性死亡(regulated cell death,RCD)方式
.研究表明
,铁死亡参与神经病变、缺血再灌注损伤、急性肾功能不全和恶性肿瘤等多种疾病的发生发展,但其确切的调控机制和生物学功能尚不明确,现就铁死亡的抑癌机制作一综述,探讨铁死亡在恶性肿瘤尤其是消化系统肿瘤治疗中的潜力.
1 铁死亡概述
1.1 铁死亡的特点 铁死亡的主要特点是细胞内Fe
与过氧化物发生芬顿反应(Fenton chemistry)生成羟基自由基或烷氧基自由基等活性氧(reactive oxygen species,ROS),ROS在细胞内蓄积与不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)发生反应形成脂质过氧化物,而脂质过氧化物又能够在Fe
催化下生成脂质自由基,最终导致细胞膜损伤从而诱发细胞死亡.不同于凋亡、自噬等坏死模式铁死亡具有其独特的表现,在形态学方面可以观察到线粒体萎缩,线粒体膜皱缩、破裂,细胞核正常但缺乏染色质凝集;细胞代谢方面表现为细胞内亚铁离子和ROS聚集,发生显著的磷脂过氧化(phospholipid peroxidation,pLPO)、脂质过氧化物修复功能受损
.
1.2 铁死亡的调控机制

1.2.2 NADH-FSP1-CoQ10通路:Conrad团队和Olzmann团队分别通过基因抑制剂和CRISPR-Cas9技术筛选出线粒体相关凋亡诱导因子2(apoptosis-inducing factor mitochondria-associated 2,
)基因,鉴定为非GPX4依赖的内源性铁死亡抑制因子,并将其重命名为铁死亡抑制蛋白1(ferroptosis suppressor protein 1,FSP1)
.AIFM2最初描述为促凋亡基因,研究发现FSP1具有NADH依赖的泛醌氧化还原酶活性,能够利用NADH将泛醌(CoQ
)还原为二氢泛醌(CoQ
-H2),而CoQ
-H2是一种亲脂氧自由基清除剂
,进而终止脂质过氧化反应,在GPX4缺失的情况下抑制铁死亡
.
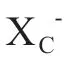
1.2.4 DHOD H-Co Q H2通路:二氢乳清酸脱氢酶(dihydroorotate dehydrogenase,DHODH)是线粒体内膜上的黄素依赖性酶,参与催化二氢乳清酸氧化为乳清酸.Mao等人发现
,抑制DHODH能够在GPX4低表达的细胞系中诱发线粒体脂质过氧化和铁死亡,深入研究发现,DHODH能够催化线粒体膜上的CoQ
还原为抗氧化剂CoQH2,进而抑制铁死亡.因此,将DHODH鉴定为独立于GXP4的另一个铁死亡防御因子.
1.3 铁死亡的诱导剂及抑制剂
那高中学生怎么利用元认知策略来提高英语能力和成绩呢?教师可以运用元认知策略理论的具体操作方法,教育学生了解自己认知的能力、特点和基础,激发学生对学习英语的热情;其次,培养学生熟悉认知活动任务,规划好长期学习英语的目的、方向,以及短期学习任务的难度、性质、所需时间长短和难易程度等;再次,为了实现长期学习目的和短期任务,引导学生通过对时间的科学认知和有效管理来提高学习的成效,提高英语学习的成绩;最后,对照规划和目标,要求学生进行认知活动的事后评估、改进和提高。本文主要探讨和研究高中学生学习英语可以采取的一种有效元认知策略—GTD时间管理方式。
1.2.3 GCH1-BH4-DHFR通路:Kraft等人
通过基因技术筛选出鸟苷三磷酸环水解酶1(GTP cyclohydrolase-1,GCH1),发现过表达GCH1的细胞株能够抵御GPX4缺失所诱发的铁死亡,鉴定为独立于GXP4的铁死亡负调控因子.进一步研究发现作为四氢生物蝶呤(tetrahydrobiopterin,BH4)合成的限速酶,GCH1过表达能够促进内源性BH4的合成,而BH4本身是一种强效的亲脂氧自由基清除剂,同时还参与CoQ
前体的合成,可以促进可以抑制细胞内脂质过氧化,进而阻止铁死亡发生.另一团队研究发现
,除GCH1外二氢叶酸还原酶(dihydrofolate reductase,DHFR)作为二氢叶酸(dihydrofolate,BH2)合成BH4的关键酶,能够使氧化的BH4再生,同样是重要的铁死亡负调控因子.
本篇包含了5个章节,分别是自动控制的基本概念、热工对象的数学模型、控制器的动态特性、单回路控制系统、复杂回路控制系统。按照知识点的内在联系,可以把内容分成3类进行绘制。即将热工对象的数学模型加入自动控制的基本概念章节中。复杂控制系统则与单回路控制系统合并。然后选定核心词进行绘制,使内容层次清晰,便于理解和记忆。由于种类众多且没有统一的模型可以包含,故也使用思维导图加超链接的模式。自动控制基本概念思维导图如图1所示。
2 铁死亡抑制肿瘤的机制研究进展
3.3 胃癌 胃癌是全球最常见的癌症之一,在东亚、东欧和南美洲胃癌的发病率最高,手术是唯一有可能根治胃癌的方式,而基于5-氟尿嘧啶(5-FU)或顺铂的化疗是晚期胃癌的患者最有效的治疗方式,但化疗毒性,肿瘤耐药性等因素限制了最终疗效
.
青蒿素是从青蒿中提取的天然化合物,是一种耐受性良好的抗疟疾药物,近年来青蒿素及其衍生物在肿瘤治疗方面的应用受到广泛关注,并被证实对多种肿瘤细胞均具有细胞毒性作用
.Ooko等人
报道青蒿素衍生物能够在非小细胞肺癌、白血病等多种肿瘤中诱导细胞死亡,而铁死亡抑制剂能够显著降低青蒿素衍生物的细胞毒性.青蒿琥酯(artesunate,ART)是青蒿素的半合成衍生物,有文献报道青蒿琥酯处理后卵巢癌HEY1和HEY2细胞增殖受到抑制,细胞中ROS水平明显升高,而铁死亡抑制剂能够降低青蒿琥酯介导的细胞毒性
.Markowitsch和Wang团队
则分别证实ART能够通过诱导铁死亡抑制舒尼替尼耐药的肾细胞癌细胞和Burkitt淋巴瘤细胞的生长,双氢青蒿素 (dihydroartemisinin,DHA)作为青蒿素衍生物同样被证实能够在胶质瘤细胞中诱导铁死亡依赖的细胞死亡
.
转录激活因子-4(activating transcription factor 4,ATF4)在氨基酸消耗、氧化应激等因素刺激下表达增加,研究发现ATF4在肿瘤组织中高表达,并且能够改善肿瘤细胞在缺氧和营养缺乏的肿瘤微环境中的生存
.Chen等人
发现在胶质瘤细胞中ATF4高表达促进细胞增殖,而诱导铁死亡可以减弱ATF4促进增殖的效果,进一步研究发现,在过表达ATF4的胶质瘤细胞中通过siRNA技术沉默xCT可以抑制细胞增殖,在敲低ATF的胶质瘤细胞中过表达xCT则能够有效促进细胞增殖,推测ATF4正是通过靶向调控xCT进而抑制铁死亡从而达到促进胶质瘤细胞的增殖的作用.Bai等人
报道MicroRNA-214-3p能够靶向抑制ATF4表达,进而诱导肝癌细胞发生铁死亡依赖的细胞死亡.除此之外,Alvarez等
证实缺氧环境能够上调铁硫簇生物合成酶(NFS1)的表达,而NFS1能够保护细胞免于氧化损伤所诱发的铁死亡,帮助肺腺癌细胞在低氧环境下存活.上述研究展示了铁死亡在药物、基因调控肿瘤细胞死亡中的作用,进一步阐释铁死亡调控细胞死亡的机制,对于研发新的抗癌药物有重大意义.
新媒体主要包括门户网站、电子邮件、搜索引擎、虚拟社区、在线游戏、博客、播客、微信、手机短信、手机电视、互联网电视,数字电视,手机报,网络杂志等类型。其中,一些属于新媒体形式,一些属于新媒体软件,另一些属于新媒体硬件和新媒体服务。
2.2 铁死亡与肿瘤化学治疗 化疗药物是无法手术的肿瘤病人的主要治疗方式之一,为改善病人预后做出巨大贡献,然而在化学治疗过程中肿瘤细胞会对化疗药物产生抵抗性,这种现象被称为肿瘤的多药耐药性(multidrug resistance,MDR)
.MDR的形成可以大致分为两种情况:(1)肿瘤在接受化学治疗之前对该种化疗药物就具有抵抗性,称为固有抵抗;(2)在有效的化学治疗后,肿瘤对化疗药物产生了抵抗,称为获得性抵抗
.MDR的发生使得化疗的临床疗效十分受限,因此研究肿瘤耐药性的产生机制,寻求减弱药物耐药的方法对提高化疗疗效具有重要意义.
三磷酸腺苷结合基因(ATP-binding cassette subfamily B member 1,
)基因可以编码多种转运蛋白和通道蛋白,将细胞内的底物主动泵出至细胞外,从而降低细胞内药物的蓄积
,研究表明ABCB1的过表达可以减少细胞内化疗药物的积累,并导致蒽环类(阿霉素),长春花生物碱(长春碱)等多种常用化疗药物产生耐药性
.Zhou
等人发现ABCB1的过表达导致卵巢癌对多烯紫杉醇产生耐药性,而Erastin能够抑制ABCB1的药物外排活性增强过表达ABCB1的卵巢癌细胞对多烯紫杉醇的敏感性.另外,研究表明作为铁死亡的关键分子谷胱甘肽(GSH)能够与顺铂的结合形成Pt(GS)2偶联物,并通过多药耐药相关蛋白(multidrug-resistant-associated proteins,MRPs)转运至细胞外,降低细胞内顺铂浓度,从而使细胞获得顺铂耐药性
.在急性白血病、非小细胞肺癌等多种肿瘤中所展开的研究也证实了GSH水平升高是产生顺铂耐药的主要因素
.Roh团队
和Zhang团队
通过体内和体外实验同样证实Erastin、柳氮磺吡啶等铁死亡诱导剂或基因敲除xCT能有效诱导细胞发生铁死亡,增强耐药头颈癌细胞系和舌鳞状细胞癌对顺铂的敏感性,进一步证实铁死亡与肿瘤耐药之间的潜在联系.
调节细胞内ROS水平也是逆转药物MDR的策略之一
,Gentric等人
通过蛋白质组学、代谢组学和生物遗传分析等技术将高度浆液性卵巢癌(High-grade serous ovarian cancer,HGSOC)分为高氧化磷酸化(high-OXPHOS)和低氧化磷酸化(low-OXPHOS)两个亚群,并报道high-OXPHOS亚群能够通过增加细胞内ROS和Fe
水平,促进脂质过氧化,增强细胞对卡铂和紫杉醇敏感性,提示铁死亡可能起到关键作用.针对多形性胶质母细胞瘤(glioblastoma multiforme,GBM)的研究表明过表达xCT能够调节细胞氧化还原反应,降低细胞内ROS水平,从而使GBM细胞对替莫唑胺敏感性下降
,而通过铁死亡诱导剂Erastin或基因敲除抑制xCT表达均能够促进细胞ROS生成和谷胱甘肽(GSH)消耗,从而增强GBM细胞对替莫唑胺的敏感性
,提示增强铁死亡是克服肿瘤MDR的潜在机制.
2.3 铁死亡与肿瘤放射治疗 放射治疗是癌症治疗的重要方式之一,广泛应用于肺癌、食管癌、鼻咽癌等多种实体肿瘤的治疗
,辐射造成的DNA损伤被认为是放疗的主要作用机制,而DNA损伤程度和修复速度被认为是决定受辐射细胞死亡的关键因素2,因此过往放疗抗性的研究主要涉及DNA修复激活和细胞凋亡抑制
.除DNA损伤外,辐射还会引起细胞中的脂质过氧化
,随着铁死亡被人们所知,铁死亡是否介导辐射诱导的细胞死亡,能否参与放疗抗性调节也引起了广泛关注.
Pan等人
发现Erastin联合放疗能够增强放疗对放疗抗性的非小细胞肺癌细胞(non-small cell lung cancer,NSCLC)细胞的杀伤效果,而铁死亡抑制剂去铁胺(deferoxamine)可以缓解联合治疗诱导细胞死亡,而凋亡抑制剂和坏死抑制剂则没有这样的效果.Lei等人
的研究进一步揭示放射治疗可以通过上调ACSL4表达诱导非小细胞肺癌细胞发生铁死亡依赖的细胞死亡,同时也能够调控SLC7A11和GPX4表达并抑制放疗所诱导的铁死亡,进而导致放疗抵抗.而铁死亡诱导剂(Erastin和RSL3)能够提高耐辐射的癌细胞对放疗的敏感性,并在动物模型中证实铁死亡诱导剂能够有效增强非小细胞肺癌的放疗敏感性.Ling的团队
同样发现铁死亡抑制剂而不是凋亡或坏死抑制剂能够拮抗放疗诱导的细胞死亡,而铁死亡诱导剂与放疗协同治疗能够增强细胞内脂质过氧化却不增加细胞DNA损伤,并通过体外细胞模型和体内小鼠移植瘤模型证实铁死亡诱导剂能够增强肺腺癌和神经胶质瘤对放疗的敏感性.除此之外,Erastin、RSL3和柳氮磺胺吡啶等铁死亡诱导剂还被证实能够增强黑色素瘤、乳腺癌等恶性肿瘤对放疗的敏感性
,进一步揭示了铁死亡有望成增强放疗敏感性、改善放疗疗效的新方向.
Bai等人报道
,氟哌啶醇可以促进Fe2+的积累、脂质过氧化和谷胱甘肽的消耗,进而增强索拉非尼所诱导的细胞死亡,而铁死亡抑制剂(ferrostatin-1)可以阻断氟哌啶醇所增强的细胞死亡,但凋亡和坏死的抑制剂(ZVAD-FMK和necrosulfonamide)却不能,证明氟哌啶醇能够促进HCC细胞发生铁死亡,却不会促进细胞凋亡和坏死.Wen和Moss的研究团队报道
天然omega-3脂肪酸二十二碳六烯酸(LDL-DHA)重组的低密度脂蛋白纳米颗粒可选择性地杀死肝癌细胞并减少大鼠原位肝肿瘤的生长,而凋亡、自噬和坏死抑制剂都不能阻止LDLDHA介导的肝癌细胞死亡.进一步研究发现,LDH-DHA处理后的HCC细胞中可以捕捉到显著的脂质过氧化物增加、谷胱甘肽消耗和GPX4失活,提示肿瘤细胞经历了铁死亡依赖的细胞死亡
,提示诱导铁死亡是研发新的抗肝癌药物的新思路.
预算编制结果将直接影响预算执行情况。因为在进行预算编制过程中,没有从企业各个环节入手,导致预算活动参与度相对不高。并且因为预算编制自身不具备严谨性和规范性,在执行预算工作时,时常和实际情况相背离,使得预算监管存在盲区,管理人员不能发挥自身担具的监管作用,从而使得预算编制结果差强人意。
肿瘤免疫治疗可以激活肿瘤微环境的CD8
T细胞,并通过穿孔素-颗粒酶和Fas-Fas配体途径诱导细胞死亡来清除肿瘤
.Wang等人
研究表明免疫疗法激活的CD8
T细胞可以通过释放干扰素-γ(Interferon-γ,IFN-γ)下调 SLC3A2和SLC7A11表达,抑制System X
-活性并诱导肿瘤细胞发生铁死亡,而所诱导的铁死亡又能够增强CD8
T细胞对肿瘤细胞的损伤.同时,他们通过回顾性分析发现xCT表达情况与CD8
T细胞、IFN-γ水平、免疫治疗疗效等呈负相关,进一步证实免疫治疗期间CD8
T细胞促进的肿瘤铁死亡是一种抗肿瘤机制,是改善肿瘤免疫疗法的潜在靶点
.Lang等发现
放射治疗诱导的共济失调毛细血管扩张突变基因(ataxia telangiectasiamutated,ATM)及免疫治疗激活的CD8
T细胞能够协同抑制SLC7A11表达诱导铁死亡发生,而抑制铁死亡会减低放射治疗及免疫治疗的疗效,提示铁死亡诱导剂可以增强肿瘤细胞对放射治疗和免疫治疗的敏感性,同时能够作为两者协同作用的“桥梁”.
3 铁死亡在消化系统肿瘤中的研究进展
根据国际癌症研究结构公布的数据,来源消化系统的结直肠癌、肝癌、胃癌是2020年全球癌症相关死亡的主要原因,分别是位于全球癌症死亡病因的第二、第三、第四位
.而在我国,肝癌、胃癌等起源消化系统的恶性肿瘤仍是主要的恶性肿瘤
,研究消化系统肿瘤的发病机制,寻找新的治疗方案有重大意义.本文对铁死亡在消化系统肿瘤中的研究进展进行概述(表1),探讨铁死亡在消化系统肿瘤治疗中的潜力,为研发新的治疗方案提供新思路.
1.3.2 铁死亡抑制剂:常见的铁死亡抑制剂可分为以下几类:第一类以去铁胺(deferoxamine,DFO)为代表的铁螯合剂,通过与细胞内Fe2+结合,降低细胞内Fe2+水平抑制Fenton反应;第二类包括Ferrostatin-1(Fer-1)和Liproxstatins,通过抑制脂质过氧化,减少细胞内ROS生成,从而抑制铁死亡发生
.

3.1 肝癌 肝癌是世界范围内癌症相关死亡的前几位原因,由于慢性丙型肝炎病毒感染、非酒精性脂肪性肝病、饮酒等事件的增多,肝癌的发病率正在上升,虽然近年来肝动脉靶向化疗等治疗的开展为肝癌治疗带来显著的变化,但目前仍缺乏有效的肝癌治疗方案
.
肝癌的发生发展与抑癌基因失活息息相关,视网膜母细胞瘤蛋白(retinoblastoma protein,Rb)功能缺失是肝细胞癌(hepatocellular carcinoma,HCC)发生发展过程中的一个重要事件
,Louandre等人
发现索拉非尼在低表达Rb的HCC细胞表现出更强的细胞杀伤效果,同时也诱导更强的铁死亡反应,提示铁死亡或与低表达Rb的肝癌细胞对索拉非尼更敏感有关.p53是最重要的肿瘤抑制基因之一,Jennis等报道
P53密码子第47位丝氨酸(TP53S47)在非洲人中存在多样性,而S47突变可能增加非裔个体的患癌风险.与野生型P53相比S47变体表现出显著的顺铂耐药性,并增加小鼠模型患肝癌的风险,进一步研究发现S47突变会减弱P53靶向抑制SLC7A11的能力,进而抑制铁死亡.上述研究提示,铁死亡可能是Rb、P53等抑癌基因调控肝癌发生发展的潜在机制.
在本试验的4项试验指标中,单粒率是最主要的,其次是双粒率,再次是空穴率和损伤率。通过试验方案,对试验结果进行分析:
家长群的本质是一种教学和家校沟通工具的延伸,但因为群是半开放的空间,而且具有天然的社交属性,所以常常会变味儿,很多家长群事实上已成为信息过载的“负担群”。怎样在这样一个虚拟的“小社会”里构建合理的秩序呢?这又是另外一个复杂的话题。而我希望,不管是家长还是老师都能在群里多一些理解和包容——至少不要一言不合就把人家给踢了出去。
索拉非尼是一种新型多靶向性抗癌药物,能够抑制多种激酶的活性,从而发挥广泛的抗癌作用,被批准用于晚期肝细胞肝癌的治疗.Lachaier
发现索拉非尼能诱导肝癌、胰腺癌等多种癌细胞发生铁死亡且索拉非尼的细胞毒性与铁死亡呈正相关,而吉非替尼、伊马替尼等10种其他激酶抑制剂却没有显示出铁死亡诱导效应,进一步研究发现,索拉非尼可能通过抑制System X
-、促进ROS生成发挥独特的诱导铁死亡效应
.Louandre等
使用去铁胺 (deferoxamine,DFX) 消耗细胞内铁储存发现可以通过抑制氧化应激反应保护HCC 细胞免受索拉非尼的细胞毒性作用,但却不会抑制索拉非尼诱导的细胞凋亡、自噬和激酶阻断活性,由此证实索拉非尼能够诱导HCC发生铁死亡依赖的细胞死亡.金属硫蛋白(metallothionein,MT)是一类广泛表达的金属结合蛋白,近年来被证实与多种癌症的发生发展及耐药性相关,常作为肿瘤的分子标志物进行研究
.Sun团队发现
索拉非尼同样可以特异性上调MT-1G表达,而通过基因技术敲低MT-1G,可以促进HCC细胞内谷胱甘肽消耗和脂质过氧化,增强索拉非尼诱导的铁死亡,同时增强HCC细胞以及移植瘤模型对索拉非尼的敏感性.上述研究提示铁死亡有望成为改善索拉非尼疗效的潜在靶点.
2.4 铁死亡与肿瘤免疫治疗 肿瘤发展的过程中肿瘤细胞能够通过多种方式使人体免疫系统无法正常识别并清除肿瘤细胞,从而保障肿瘤的生存发展,这个过程被称为肿瘤免疫逃逸
.免疫治疗就是通过调节免疫系统关键分子,以恢复免疫系统对肿瘤的正常监视和清除功能
,而程序性细胞死亡1(programmed death 1,PD-1)/程序性死亡配体1(programmed death ligand 1,PD-L1)是最经典的免疫治疗靶点
.
3.2 胰腺癌 胰腺癌是最具侵袭性的恶性肿瘤之一,因其高侵袭性,早期转移,对放化疗反应不佳的特点,胰腺癌的5年生存率仅有5%左右.手术和以吉西他滨为主的化学治疗是目前胰腺癌的主要治疗方式,近年来虽有新的药物用于胰腺癌治疗,但均不能收获良好的临床疗效
.
硬文化是指教室内设置的英文标语、英语墙报、英语画刊等;校园里开办“英语角”,这些能够体现和强化一种英语氛围。
同样的,社区内的地租水平多元化也会影响不同人群的集聚。例如,如果地租水平整体过高,会导致高端品牌或者大量资本注入,市场会驱逐个体创意工作室的规模化形成;而地租水平过低,大量无业游民、城市底层居民会选择该区域居住,一定程度造成“不安全”的印象或者事实,导致创意人群选择搬离。因此,这要求城市在对房屋的改建中,要考虑到不同群体的需求,有计划的进行房屋改造计划,才能保证文化发展人群的差异化和多样性。
Lo等
报道xCT在胰腺癌中表达水平高于正常胰腺组织,进一步研究发现,过表达xCT的胰腺癌细胞表现出更强的吉西他滨耐药性,而xCT特异性抑制剂处理后胰腺癌细胞的生长受到显著抑制,提示xCT与胰腺癌的增殖能力和耐药性相关.Daher等
同样证实不论是通过基因技术敲低还是Erastin等抑制剂预处理来抑制xCT均可以增强胰腺癌细胞对吉西他滨和顺铂的敏感性.Zhu的团队报导
热休克蛋白家族A成员5(heat shock 70kDa protein 5,HSPA5)能够与GPX4蛋白结合并抑制其降解,从而抑制铁死亡的发生.HSPA5或GPX4敲低的PDAC细胞中,吉西他滨能够诱导更显著的细胞死亡,而铁死亡抑制剂能够抑制吉西他滨诱导的细胞死亡,而凋亡和坏死抑制剂则没有这样的效果.
矿区岩浆岩较发育,主要有加里东期形成的变辉石岩燕山晚期形成的花岗岩株(脉)(γ53)及其附近产出石英斑岩脉、花岗斑岩脉、伟晶岩脉和石英脉等。
荜拔酰胺(piperlongumine,PL)是一种天然产物,能够在胰腺癌细胞中能发挥显著的杀伤效果,且铁死亡抑制剂和铁螯合剂能够抑制PL的细胞毒性,但不受凋亡抑制剂和坏死抑制剂的影响,提示PL主要通过增强铁死亡诱导胰腺癌细胞死亡
.Cotylenin A(CN-A)是一种髓系白血病细胞分化诱导剂,在多种癌细胞中均表现出抑癌活性,Takashi等人报道CN-A联合异硫氰酸苯乙酯(PEITC)能够有效抑制胰腺癌细胞增殖,而ferrostatin-1、liproxstatin和去铁胺作为铁死亡抑制剂均能有效消除了这种协同作用,自噬抑制能够部分消除,而凋亡和坏死的抑制剂没有这种效果,提示CN-A与PEITC主要通过诱导铁死亡发挥抗胰腺癌作用
.上述研究提示,铁死亡能够在改善吉西他滨等现役药物的疗效或是研发新的抗胰腺癌药物方面作出贡献.
2.1 铁死亡与肿瘤细胞死亡 正常细胞死亡对维持机体生理平衡和预防过度细胞增殖是至关重要的,而恶性肿瘤常表现为转化细胞的不受控制地生长和增殖
,因此诱发肿瘤细胞死亡是首先被考虑的癌症治疗策略.目前临床上使用的抗癌药物大多基于凋亡通路诱导癌细胞死亡
,但在使用过程中出现的药物抗性性限制了相应药物的使用,使我们需要寻求新机制诱发癌细胞死亡.铁死亡作为新发现的细胞程序性死亡模式,近年来被证实在杀伤肿瘤细胞方面起着关键性作用.
Zhang等
报道顺铂和紫杉醇能够激活肿瘤相关成纤维细胞(cancer associated fibro-blasts,CAFs)并分泌外泌体miR-522抑制花生四烯酸脂氧合酶15(ALOX15)活性,减少细胞内脂质ROS积累,从而抑制胃癌细胞发生铁死亡,最终导致化疗敏感性下降.Wang
等发现顺铂耐药的胃癌细胞具有xCT高表达,并通过Kaplan-Meier生存分析发现xCT高表达是胃癌患者辅助化疗的不良预后因素,进一步研究发现线粒体功能障碍能够增强顺铂耐药性和促进xCT表达,而抑制xCT活性能够部分逆转胃癌细胞因线粒体功能障碍导致的顺铂耐药性,进一步证实提示铁死亡可能是胃癌获得性化疗耐药的新机制.
半胱氨酸双加氧酶1(cysteine dioxygenase 1,CDO1)是一种含铁金属酶,参与半胱氨酸向牛磺酸的转换,在结直肠癌、胃癌等多种肿瘤中发现CDO1启动子甲基化是肿瘤预后的独立危险因素,被认为是新发现的抑癌基因
.Hao
等人发现铁死亡诱导剂Erastin在胃癌细胞中能够有效触发铁死亡依赖的细胞死亡,而敲低CDO1能够有效抑制Erastin诱导的铁死亡和细胞毒性,而过表达CDO1则有相反的结果,提示CDO1介导胃癌细胞中铁死亡的调控.硬脂酰辅酶A去饱和酶1(stearoyl-CoA desaturase 1,SCD1)是一种重要的内质网相关脂肪合酶,可以促进肺癌、卵巢癌多种癌症的肿瘤发生
.Wang等
报道SCD1在胃癌中高表达,且是胃癌的独立预后危险因素,高表达 SCD1提示患者预后不佳,进一步研究发现SCD1能够促进胃癌在体内、体外的生长和能力并保护胃癌细胞免于铁死亡.上述研究提示铁死亡可能是CDO1、SCD1等分子的潜在作用机制.
3.4 结直肠癌 结直肠癌(colorectal cancer,CRC)是消化道常见肿瘤之一,根据国际癌症研究机构公布的数据,结直肠癌是2020年癌症相关死亡的第二大病因,甚至超过了肝癌和胃癌,寻找有效的治疗方案迫在眉睫.
结直肠癌常发生TP53缺失或突变
,Xie等报道
TP53缺失使CRC细胞对Erastin诱发的铁死亡更敏感,提示TP53能够抑制Erastin所诱导的铁死亡依赖的细胞死亡,进一步研究发现TP53能够通过调控SLC7A11转录表达和促进二肽基肽酶-4(dipeptidyl peptidase-4,DPP4)入核的双层机制抑制CRC发生铁死亡,提示抑癌基因TP53可能通过铁死亡参与调控结直肠癌的发生发展.
以铂为基础的化疗广泛应用于各种恶性肿瘤的治疗,但是耐药性的产生却极大限制了顺铂等药物在临床上的应用,过去的研究已经证实,细胞内GSH高水平是产生顺铂耐药的主要因素
.System X
-能够调节胱氨酸的摄取对GSH合成至关重要,抑制System X
-可以抑制细胞内GSH的合成.Sugano等人
检测了304例结直肠癌组织标本中xCT蛋白的表达水平,发现其中208例组织中xCT表达呈阳性,而这部分患者术后复发风险显著高于xCT表达阴性的患者,提示xCT表达增加是结直肠癌复发的独立预测因子.另一研究团队
同样报道了xCT高表达于结直肠癌组织,同时他们还发现柳氮磺胺吡啶(Sulfasalazine,SSZ)-xCT的有效抑制剂
,能够有效消耗CRC细胞内GSH并诱导ROS积累,但在正常结肠组织中却没有如此显著的效果.进一步研究发现,SSZ联合顺铂能够显著提高CRC细胞内铂浓度,与顺铂产生协同的细胞毒性作用.GPX4作为铁死亡的关键调节分子,同样被发现在结直肠癌等癌组织中的表达高于正常组织,并且与患者的预后呈负相关,通过RSL3抑制GPX4可以增强顺铂在体外和体内的抗癌作用
.上述研究揭示,铁死亡可能是结直肠癌耐药的潜在机制.
3.5 食管癌 食管癌是最具侵袭性的胃肠道恶性肿瘤之一,尽管目前有手术、放化疗等方式可用于食管癌治疗,但由于药物副作用等原因上述治疗方式未能收获很好的疗效,食管癌的5年总生存率仍然很低
.
萜类化合物是一类具有抗癌作用的天然化合物,Zhang等人报道
冬凌草甲素(oridonin,Ori)能够诱导食管癌细胞发生显著的细胞死亡,同时检测到细胞内Fe
、丙二醛和ROS水平升高,而铁死亡抑制剂能够干扰Ori的作用,说明Ori在食管癌细胞中诱导铁死亡依赖的细胞死亡.深入研究发现Ori能够抑制γ-谷酰胺转酞酶(gamma-glutamyl transpeptidase 1,GGT1)和谷氨酸半胱氨酸连接酶催化亚基(glutamate cysteine ligase catalytic subunit,GCLC)的活性,导致GHS合成减少,降低细胞内GSH水平,进而抑制GPX4活性,最终触发铁死亡发挥抗癌活性.异土木香内酯(Isoalantolactone)同属于萜类化合物,Lu等人
报道异土木香内酯处理后食管癌细胞可以观察到显著的细胞内ROS升高和细胞增殖受抑,而异土木香内酯对食管癌细胞的细胞毒性能够被凋亡和铁死亡抑制剂逆转.上述研究提示,萜类化合物在食管癌中发挥铁死亡依赖的杀伤效果.
异柠檬酸脱氢酶1(isocitrate dehydrogenase 1,IDH1)是三羧酸循环的关键酶,近年来在胆管癌、骨肉瘤
等多种恶性肿瘤中均有报道IDH1突变.Wang等人
发现IDH1
突变可以增强Erastin在食管癌细胞中诱导的铁死亡,进一步研究发现IDH1
突变能够通过靶向调节GPX4的蛋白质水平增强细胞对铁死亡的敏感性,提示铁死亡可能是IDH1突变的潜在作用机制.
图13-图15所示的是小曲拐应力、应变最大的节点1 703(从图7-图9可以看出3个小曲拐的发生最大应力、应变的节点编号均为1 703)的应力、应变随主轴转动一周的变化情况。由图中可以看出,3个小曲拐应力应变的变化规律基本一致,进一步说明了涡旋压缩机3个小曲拐受力情况与运动规律基本相同,符合小曲拐平面四杆机构的运动规律。由于涡旋压缩机电动机刚开始驱动,因此图中刚开始会出现一个突变状况,由图中看出3个小曲拐的最大应力约为11N/mm2,而最大应变约为7×10-5mm。由此可见,小曲拐的变形还很小的,因此选择的小曲拐符合涡旋压缩机防自转的要求,并为小曲拐的进一步优化设计提供重要的参考。
4 展望
自铁死亡被报道以来就受到了广泛的关注,并被证实与多种疾病的发生发展具有相关性,但其确切的调控机制和生物学功能尚不明确,本文通过回顾铁死亡与肿瘤相关研究,对铁死亡抑制恶性肿瘤尤其是消化系统肿瘤的机制作一综述.本如本文所述,诱导铁死亡能够通过促进肿瘤细胞死亡、增强肿瘤对放化疗敏感性、调节肿瘤对免疫治疗的反应等方式发挥抗癌作用,然而铁死亡在肿瘤侵袭性、肿瘤能量代谢、肿瘤微环境等方面中的作用还鲜为人知,有待进一步完善相关研究.在消化系统肿瘤中,铁死亡参与TP53、Rb、CDO1等癌症相关基因以及索拉非尼、顺铂、荜拔酰胺等药物调控肿瘤发生发展的过程,但是上述基因和药物调控铁死亡的具体靶点仍是未知数,有待从基因突变、表观遗传学等角度进一步研究分析.总的来说,作为新发现的细胞程序性死亡方式,铁死亡展示出强大的抗癌潜力,深入研究消化道肿瘤中铁死亡的分子机制,有助于研发新的治疗方式以改善消化道肿瘤的预后.
1 Sung H,Ferlay J,Siegel RL,Laversanne M,Soerjomataram I,Jemal A,Bray F.Global Cancer Statistics 2020:GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries.
2021;71:209-249 [PMID:33538338 DOI:10.3322/caac.21660]
2 孙可欣,郑荣寿,张思维,曾红梅,邹小农,陈茹,顾秀瑛,魏文强,赫捷.2015年中国分地区恶性肿瘤发病和死亡分析.中国肿瘤2019;28:1-11 [DOI:10.3760/cma.j.issn.0253-3766.2019.01.005]
3 Dixon SJ,Lemberg KM,Lamprecht MR,Skouta R,Zaitsev EM,Gleason CE,Patel DN,Bauer AJ,Cantley AM,Yang WS,Morrison B 3rd,Stockwell BR.Ferroptosis:an iron-dependent form of nonapoptotic cell death.
2012;149:1060-1072 [PMID:22632970 DOI:10.1016/j.cell.2012.03.042]
4 Skouta R,Dixon SJ,Wang J,Dunn DE,Orman M,Shimada K,Rosenberg PA,Lo DC,Weinberg JM,Linkermann A,Stockwell BR.Ferrostatins inhibit oxidative lipid damage and cell death in diverse disease models.
2014;136:4551-4556[PMID:24592866 DOI:10.1021/ja411006a]
5 Gao M,Monian P,Quadri N,Ramasamy R,Jiang X.Glutaminolysis and Transferrin Regulate Ferroptosis.
2015;59:298-308[PMID:26166707 DOI:10.1016/j.molcel.2015.06.011]
6 Friedmann Angeli JP,Schneider M,Proneth B,Tyurina YY,Tyurin VA,Hammond VJ,Herbach N,Aichler M,Walch A,Eggenhofer E,Basavarajappa D,Rådmark O,Kobayashi S,Seibt T,Beck H,Neff F,Esposito I,Wanke R,Förster H,Yefremova O,Heinrichmeyer M,Bornkamm GW,Geissler EK,Thomas SB,Stockwell BR,O’Donnell VB,Kagan VE,Schick JA,Conrad M.Inactivation of the ferroptosis regulator Gpx4 triggers acute renal failure in mice.
2014;16:1180-1191 [PMID:25402683 DOI:10.1038/ncb3064]
7 Yang WS,Stockwell BR.Ferroptosis:Death by Lipid Peroxidation.
2016;26:165-176 [PMID:26653790 DOI:10.1016/j.tcb.2015.10.014]
8 Sato H,Tamba M,Ishii T,Bannai S.Cloning and expression of a plasma membrane cystine/glutamate exchange transporter composed of two distinct proteins.
1999;274:11455-11458 [PMID:10206947 DOI:10.1074/jbc.274.17.11455]
9 Xie Y,Hou W,Song X,Yu Y,Huang J,Sun X,Kang R,Tang D.Ferroptosis:process and function.
2016;23:369-379 [PMID:26794443 DOI:10.1038/cdd.2015.158]
10 Yang WS,SriRamaratnam R,Welsch ME,Shimada K,Skouta R,Viswanathan VS,Cheah JH,Clemons PA,Shamji AF,Clish CB,Brown LM,Girotti AW,Cornish VW,Schreiber SL,Stockwell BR.Regulation of ferroptotic cancer cell death by GPX4.
2014;156:317-331 [PMID:24439385 DOI:10.1016/j.cell.2013.12.010]
11 Bersuker K,Hendricks JM,Li Z,Magtanong L,Ford B,Tang PH,Roberts MA,Tong B,Maimone TJ,Zoncu R,Bassik MC,Nomura DK,Dixon SJ,Olzmann JA.The CoQ oxidoreductase FSP1 acts parallel to GPX4 to inhibit ferroptosis.
2019;575:688-692 [PMID:31634900 DOI:10.1038/s41586-019-1705-2]
12 Frei B,Kim MC,Ames BN.Ubiquinol-10 is an effective lipidsoluble antioxidant at physiological concentrations.
1990;87:4879-4883 [PMID:2352956 DOI:10.1073/pnas.87.12.4879]
13 Doll S,Freitas FP,Shah R,Aldrovandi M,da Silva MC,Ingold I,Goya Grocin A,Xavier da Silva TN,Panzilius E,Scheel CH,Mourão A,Buday K,Sato M,Wanninger J,Vignane T,Mohana V,Rehberg M,Flatley A,Schepers A,Kurz A,White D,Sauer M,Sattler M,Tate EW,Schmitz W,Schulze A,O’Donnell V,Proneth B,Popowicz GM,Pratt DA,Angeli JPF,Conrad M.FSP1 is a glutathione-independent ferroptosis suppressor.
2019;575:693-698 [PMID:31634899 DOI:10.1038/s41586-019-1707-0]
14 Kraft VAN,Bezjian CT,Pfeiffer S,Ringelstetter L,Müller C,Zandkarimi F,Merl-Pham J,Bao X,Anastasov N,Kössl J,Brandner S,Daniels JD,Schmitt-Kopplin P,Hauck SM,Stockwell BR,Hadian K,Schick JA.GTP Cyclohydrolase 1/Tetrahydrobiopterin Counteract Ferroptosis through Lipid Remodeling.
2020;6:41-53 [PMID:31989025 DOI:10.1021/acscentsci.9b01063]
15 Soula M,Weber RA,Zilka O,Alwaseem H,La K,Yen F,Molina H,Garcia-Bermudez J,Pratt DA,Birsoy K.Metabolic determinants of cancer cell sensitivity to canonical ferroptosis inducers.
2020;16:1351-1360 [PMID:32778843 DOI:10.1038/s41589-020-0613-y]
16 Mao C,Liu X,Zhang Y,Lei G,Yan Y,Lee H,Koppula P,Wu S,Zhuang L,Fang B,Poyurovsky MV,Olszewski K,Gan B.DHODH-mediated ferroptosis defence is a targetable vulnerability in cancer.
2021;593:586-590 [PMID:33981038 DOI:10.1038/s41586-021-03539-7]
17 Feng H,Stockwell BR.Unsolved mysteries:How does lipid peroxidation cause ferroptosis?
2018;16:e2006203[PMID:29795546 DOI:10.1371/journal.pbio.2006203]
18 Shimada K,Skouta R,Kaplan A,Yang WS,Hayano M,Dixon SJ,Brown LM,Valenzuela CA,Wolpaw AJ,Stockwell BR.Global survey of cell death mechanisms reveals metabolic regulation of ferroptosis.
2016;12:497-503 [PMID:27159577 DOI:10.1038/nchembio.2079]
19 Roquette R,Painho M,Nunes B.Spatial epidemiology of cancer:a review of data sources,methods and risk factors.
2017;12:504 [PMID:28555468 DOI:10.4081/gh.2017.504]
20 Pistritto G,Trisciuoglio D,Ceci C,Garufi A,D’Orazi G.Apoptosis as anticancer mechanism:function and dysfunction of its modulators and targeted therapeutic strategies.
2016;8:603-619 [PMID:27019364 DOI:10.18632/aging.100934]
21 Efferth T.Willmar Schwabe Award 2006:antiplasmodial and antitumor activity of artemisinin--from bench to bedside.
2007;73:299-309 [PMID:17354163 DOI:10.1055/s-2007-967138]
22 Ooko E,Saeed ME,Kadioglu O,Sarvi S,Colak M,Elmasaoudi K,Janah R,Greten HJ,Efferth T.Artemisinin derivatives induce iron-dependent cell death (ferroptosis) in tumor cells.
2015;22:1045-1054 [PMID:26407947 DOI:10.1016/j.phymed.2015.08.002]
23 Greenshields AL,Shepherd TG,Hoskin DW.Contribution of reactive oxygen species to ovarian cancer cell growth arrest and killing by the anti-malarial drug artesunate.
2017;56:75-93 [PMID:26878598 DOI:10.1002/mc.22474]
24 Markowitsch SD,Schupp P,Lauckner J,Vakhrusheva O,Slade KS,Mager R,Efferth T,Haferkamp A,Juengel E.Artesunate Inhibits Growth of Sunitinib-Resistant Renal Cell Carcinoma Cells through Cell Cycle Arrest and Induction of Ferroptosis.
2020;12 [PMID:33121039 DOI:10.3390/cancers12113150]
25 Wang N,Zeng GZ,Yin JL,Bian ZX.Artesunate activates the ATF4-CHOP-CHAC1 pathway and affects ferroptosis in Burkitt’s Lymphoma.
2019;519:533-539 [PMID:31537387 DOI:10.1016/j.bbrc.2019.09.023]
26 Chen Y,Mi Y,Zhang X,Ma Q,Song Y,Zhang L,Wang D,Xing J,Hou B,Li H,Jin H,Du W,Zou Z.Dihydroartemisinin-induced unfolded protein response feedback attenuates ferroptosis via PERK/ATF4/HSPA5 pathway in glioma cells.
2019;38:402 [PMID:31519193 DOI:10.1186/s13046-019-1413-7]
27 Bi M,Naczki C,Koritzinsky M,Fels D,Blais J,Hu N,Harding H,Novoa I,Varia M,Raleigh J,Scheuner D,Kaufman RJ,Bell J,Ron D,Wouters BG,Koumenis C.ER stress-regulated translation increases tolerance to extreme hypoxia and promotes tumor growth.
2005;24:3470-3481 [PMID:16148948 DOI:10.1038/sj.emboj.7600777]
28 Ameri K,Lewis CE,Raida M,Sowter H,Hai T,Harris AL.Anoxic induction of ATF-4 through HIF-1-independent pathways of protein stabilization in human cancer cells.
2004;103:1876-1882 [PMID:14604972 DOI:10.1182/blood-2003-06-1859]
29 Chen D,Fan Z,Rauh M,Buchfelder M,Eyupoglu IY,Savaskan N.ATF4 promotes angiogenesis and neuronal cell death and confers ferroptosis in a xCT-dependent manner.
2017;36:5593-5608 [PMID:28553953 DOI:10.1038/onc.2017.146]
30 Bai T,Liang R,Zhu R,Wang W,Zhou L,Sun Y.MicroRNA-214-3p enhances erastin-induced ferroptosis by targeting ATF4 in hepatoma cells.
2020;235:5637-5648 [PMID:31960438 DOI:10.1002/jcp.29496]
31 Alvarez SW,Sviderskiy VO,Terzi EM,Papagiannakopoulos T,Moreira AL,Adams S,Sabatini DM,Birsoy K,Possemato R.NFS1 undergoes positive selection in lung tumours and protects cells from ferroptosis.
2017;551:639-643 [PMID:29168506 DOI:10.1038/nature24637]
32 Pérez-Tomás R.Multidrug resistance:retrospect and prospects in anti-cancer drug treatment.
2006;13:1859-1876[PMID:16842198 DOI:10.2174/092986706777585077]
33 Nikolaou M,Pavlopoulou A,Georgakilas AG,Kyrodimos E.The challenge of drug resistance in cancer treatment:a current overview.
2018;35:309-318 [PMID:29799080 DOI:10.1007/s10585-018-9903-0]
34 Nanayakkara AK,Follit CA,Chen G,Williams NS,Vogel PD,Wise JG.Targeted inhibitors of P-glycoprotein increase chemotherapeutic-induced mortality of multidrug resistant tumor cells.
2018;8:967 [PMID:29343829 DOI:10.1038/s41598-018-19325-x]
35 Schinkel AH,Jonker JW.Mammalian drug efflux transporters of the ATP binding cassette (ABC) family:an overview.
2003;55:3-29 [PMID:12535572 DOI:10.1016/s0169-409x(02)00169-2]
36 Viswanathan VS,Ryan MJ,Dhruv HD,Gill S,Eichhoff OM,Seashore-Ludlow B,Kaffenberger SD,Eaton JK,Shimada K,Aguirre AJ,Viswanathan SR,Chattopadhyay S,Tamayo P,Yang WS,Rees MG,Chen S,Boskovic ZV,Javaid S,Huang C,Wu X,Tseng YY,Roider EM,Gao D,Cleary JM,Wolpin BM,Mesirov JP,Haber DA,Engelman JA,Boehm JS,Kotz JD,Hon CS,Chen Y,Hahn WC,Levesque MP,Doench JG,Berens ME,Shamji AF,Clemons PA,Stockwell BR,Schreiber SL.Dependency of a therapy-resistant state of cancer cells on a lipid peroxidase pathway.
2017;547:453-457 [PMID:28678785 DOI:10.1038/nature23007]
37 Zhou HH,Chen X,Cai LY,Nan XW,Chen JH,Chen XX,Yang Y,Xing ZH,Wei MN,Li Y,Wang ST,Liu K,Shi Z,Yan XJ.Erastin Reverses ABCB1-Mediated Docetaxel Resistance in Ovarian Cancer.
2019;9:1398 [PMID:31921655 DOI:10.3389/fonc.2019.01398]
38 Cui Y,König J,Buchholz JK,Spring H,Leier I,Keppler D.Drug resistance and ATP-dependent conjugate transport mediated by the apical multidrug resistance protein,MRP2,permanently expressed in human and canine cells.
1999;55:929-937 [PMID:10220572]
39 Chen HH,Kuo MT.Role of glutathione in the regulation of Cisplatin resistance in cancer chemotherapy.
2010;2010 [PMID:20885916 DOI:10.1155/2010/430939]
40 Wu WJ,Zhang Y,Zeng ZL,Li XB,Hu KS,Luo HY,Yang J,Huang P,Xu RH.β-phenylethyl isothiocyanate reverses platinum resistance by a GSH-dependent mechanism in cancer cells with epithelial-mesenchymal transition phenotype.
2013;85:486-496 [PMID:23219523 DOI:10.1016/j.bcp.2012.11.017]
41 Di Pasqua AJ,Hong C,Wu MY,McCracken E,Wang X,Mi L,Chung FL.Sensitization of non-small cell lung cancer cells to cisplatin by naturally occurring isothiocyanates.
2010;23:1307-1309 [PMID:20707406 DOI:10.1021/tx100187f]
42 Dedoussis GV,Andrikopoulos NK.Glutathione depletion restores the susceptibility of cisplatin-resistant chronic myelogenous leukemia cell lines to Natural Killer cell-mediated cell death via necrosis rather than apoptosis.
2001;80:608-614 [PMID:11675936 DOI:10.1078/0171-9335-00193]
43 Roh JL,Kim EH,Jang HJ,Park JY,Shin D.Induction of ferroptotic cell death for overcoming cisplatin resistance of head and neck cancer.
2016;381:96-103 [PMID:27477897 DOI:10.1016/j.canlet.2016.07.035]
44 Zhang P,Wang W,Wei Z,Xu LI,Yang X,DU Y.xCT expression modulates cisplatin resistance in Tca8113 tongue carcinoma cells.
2016;12:307-314 [PMID:27347143 DOI:10.3892/ol.2016.4571]
45 Cui Q,Wang JQ,Assaraf YG,Ren L,Gupta P,Wei L,Ashby CR Jr,Yang DH,Chen ZS.Modulating ROS to overcome multidrug resistance in cancer.
2018;41:1-25 [PMID:30471641 DOI:10.1016/j.drup.2018.11.001]
46 Gentric G,Kieffer Y,Mieulet V,Goundiam O,Bonneau C,Nemati F,Hurbain I,Raposo G,Popova T,Stern MH,Lallemand-Breitenbach V,Müller S,Cañeque T,Rodriguez R,Vincent-Salomon A,de Thé H,Rossignol R,Mechta-Grigoriou F.PML-Regulated Mitochondrial Metabolism Enhances Chemosensitivity in Human Ovarian Cancers.
2019;29:156-173.e10 [PMID:30244973 DOI:10.1016/j.cmet.2018.09.002]
47 Polewski MD,Reveron-Thornton RF,Cherryholmes GA,Marinov GK,Cassady K,Aboody KS.Increased Expression of System xc-in Glioblastoma Confers an Altered Metabolic State and Temozolomide Resistance.
2016;14:1229-1242 [PMID:27658422 DOI:10.1158/1541-7786.MCR-16-0028]
48 Chen L,Li X,Liu L,Yu B,Xue Y,Liu Y.Erastin sensitizes glioblastoma cells to temozolomide by restraining xCT and cystathionine-γ-lyase function.
2015;33:1465-1474[PMID:25585997 DOI:10.3892/or.2015.3712]
49 Tafreshi NK,Doligalski ML,Tichacek CJ,Pandya DN,Budzevich MM,El-Haddad G,Khushalani NI,Moros EG,McLaughlin ML,Wadas TJ,Morse DL.Development of Targeted Alpha Particle Therapy for Solid Tumors.
2019;24 [PMID:31779154 DOI:10.3390/molecules24234314]
50 Goldstein M,Kastan MB.The DNA damage response:implications for tumor responses to radiation and chemotherapy.
2015;66:129-143 [PMID:25423595 DOI:10.1146/annurev-med-081313-121208]
51 Kim BM,Hong Y,Lee S,Liu P,Lim JH,Lee YH,Lee TH,Chang KT,Hong Y.Therapeutic Implications for Overcoming Radiation Resistance in Cancer Therapy.
2015;16:26880-26913[PMID:26569225 DOI:10.3390/ijms161125991]
52 Morgan MA,Lawrence TS.Molecular Pathways:Overcoming Radiation Resistance by Targeting DNA Damage Response Pathways.
2015;21:2898-2904 [PMID:26133775 DOI:10.1158/1078-0432.CCR-13-3229]
53 Waldenjr TL,Hughes HN,Prostaglandin and lipid metabolism in radiation injury,prostaglandin and lipid metabolism in radiation.
1987
54 Pan X,Lin Z,Jiang D,Yu Y,Yang D,Zhou H,Zhan D,Liu S,Peng G,Chen Z,Yu Z.Erastin decreases radioresistance of NSCLC cells partially by inducing GPX4-mediated ferroptosis.
2019;17:3001-3008 [PMID:30854078 DOI:10.3892/ol.2019.9888]
55 Lei G,Zhang Y,Koppula P,Liu X,Zhang J,Lin SH,Ajani JA,Xiao Q,Liao Z,Wang H,Gan B.The role of ferroptosis in ionizing radiation-induced cell death and tumor suppression.
2020;30:146-162 [PMID:31949285 DOI:10.1038/s41422-019-0263-3]
56 Ye LF,Chaudhary KR,Zandkarimi F,Harken AD,Kinslow CJ,Upadhyayula PS,Dovas A,Higgins DM,Tan H,Zhang Y,Buonanno M,Wang TJC,Hei TK,Bruce JN,Canoll PD,Cheng SK,Stockwell BR.Radiation-Induced Lipid Peroxidation Triggers Ferroptosis and Synergizes with Ferroptosis Inducers.
2020;15:469-484 [PMID:31899616 DOI:10.1021/acschembio.9b00939]
57 Nagane M,Kanai E,Shibata Y,Shimizu T,Yoshioka C,Maruo T,Yamashita T.Sulfasalazine,an inhibitor of the cystineglutamate antiporter,reduces DNA damage repair and enhances radiosensitivity in murine B16F10 melanoma.
2018;13:e0195151 [PMID:29649284 DOI:10.1371/journal.pone.0195151]
58 Shibata Y,Yasui H,Higashikawa K,Miyamoto N,Kuge Y.Erastin,a ferroptosis-inducing agent,sensitized cancer cells to X-ray irradiation via glutathione starvation in vitro and in vivo.
2019;14:e0225931 [PMID:31800616 DOI:10.1371/journal.pone.0225931]
59 Sleire L,Skeie BS,Netland IA,Førde HE,Dodoo E,Selheim F,Leiss L,Heggdal JI,Pedersen PH,Wang J,Enger PØ.Drug repurposing:sulfasalazine sensitizes gliomas to gamma knife radiosurgery by blocking cystine uptake through system Xc-,leading to glutathione depletion.
2015;34:5951-5959[PMID:25798841 DOI:10.1038/onc.2015.60]
60 de Visser KE,Eichten A,Coussens LM.Paradoxical roles of the immune system during cancer development.
2006;6:24-37 [PMID:16397525 DOI:10.1038/nrc1782]
61 Lin Y,Okada H.Cellular immunotherapy for malignant gliomas.
2016;16:1265-1275 [PMID:27434205 DOI:10.1080/14712598.2016.1214266]
62 Golstein P,Griffiths GM.An early history of T cell-mediated cytotoxicity.
2018;18:527-535 [PMID:29662120 DOI:10.1038/s41577-018-0009-3]
63 Khalil DN,Smith EL,Brentjens RJ,Wolchok JD.The future of cancer treatment:immunomodulation,CARs and combination immunotherapy.
2016;13:273-290 [PMID:26977780 DOI:10.1038/nrclinonc.2016.25]
64 Wang W,Green M,Choi JE,Gijón M,Kennedy PD,Johnson JK,Liao P,Lang X,Kryczek I,Sell A,Xia H,Zhou J,Li G,Li J,Li W,Wei S,Vatan L,Zhang H,Szeliga W,Gu W,Liu R,Lawrence TS,Lamb C,Tanno Y,Cieslik M,Stone E,Georgiou G,Chan TA,Chinnaiyan A,Zou W.CD8
T cells regulate tumour ferroptosis during cancer immunotherapy.
2019;569:270-274 [PMID:31043744 DOI:10.1038/s41586-019-1170-y]
65 Lang X,Green MD,Wang W,Yu J,Choi JE,Jiang L,Liao P,Zhou J,Zhang Q,Dow A,Saripalli AL,Kryczek I,Wei S,Szeliga W,Vatan L,Stone EM,Georgiou G,Cieslik M,Wahl DR,Morgan MA,Chinnaiyan AM,Lawrence TS,Zou W.Radiotherapy and Immunotherapy Promote Tumoral Lipid Oxidation and Ferroptosis via Synergistic Repression of SLC7A11.
2019;9:1673-1685 [PMID:31554642 DOI:10.1158/2159-8290.CD-19-0338]
66 Llovet JM,Kelley RK,Villanueva A,Singal AG,Pikarsky E,Roayaie S,Lencioni R,Koike K,Zucman-Rossi J,Finn RS.Hepatocellular carcinoma.
2021;7:6 [PMID:33479224 DOI:10.1038/s41572-020-00240-3]
67 Anwar SL,Krech T,Hasemeier B,Schipper E,Schweitzer N,Vogel A,Kreipe H,Lehmann U.Deregulation of RB1 expression by loss of imprinting in human hepatocellular carcinoma.
2014;233:392-401 [PMID:24838394 DOI:10.1002/path.4376]
68 Laurent-Puig P,Zucman-Rossi J.Genetics of hepatocellular tumors.
2006;25:3778-3786 [PMID:16799619 DOI:10.1038/sj.onc.1209547]
69 Louandre C,Marcq I,Bouhlal H,Lachaier E,Godin C,Saidak Z,François C,Chatelain D,Debuysscher V,Barbare JC,Chauffert B,Galmiche A.The retinoblastoma (Rb) protein regulates ferroptosis induced by sorafenib in human hepatocellular carcinoma cells.
2015;356:971-977 [PMID:25444922 DOI:10.1016/j.canlet.2014.11.014]
70 Jennis M,Kung CP,Basu S,Budina-Kolomets A,Leu JI,Khaku S,Scott JP,Cai KQ,Campbell MR,Porter DK,Wang X,Bell DA,Li X,Garlick DS,Liu Q,Hollstein M,George DL,Murphy ME.An African-specific polymorphism in the TP53 gene impairs p53 tumor suppressor function in a mouse model.
2016;30:918-930 [PMID:27034505 DOI:10.1101/gad.275891.115]
71 Lachaier E,Louandre C,Godin C,Saidak Z,Baert M,Diouf M,Chauffert B,Galmiche A.Sorafenib induces ferroptosis in human cancer cell lines originating from different solid tumors.
2014;34:6417-6422 [PMID:25368241]
72 Dixon SJ,Patel DN,Welsch M,Skouta R,Lee ED,Hayano M,Thomas AG,Gleason CE,Tatonetti NP,Slusher BS,Stockwell BR.Pharmacological inhibition of cystine-glutamate exchange induces endoplasmic reticulum stress and ferroptosis.
2014;3:e02523 [PMID:24844246 DOI:10.7554/eLife.02523]
73 Coriat R,Nicco C,Chéreau C,Mir O,Alexandre J,Ropert S,Weill B,Chaussade S,Goldwasser F,Batteux F.Sorafenib-induced hepatocellular carcinoma cell death depends on reactive oxygen species production in vitro and in vivo.
2012;11:2284-2293 [PMID:22902857 DOI:10.1158/1535-7163.MCT-12-0093]
74 Louandre C,Ezzoukhry Z,Godin C,Barbare JC,Mazière JC,Chauffert B,Galmiche A.Iron-dependent cell death of hepatocellular carcinoma cells exposed to sorafenib.
2013;133:1732-1742 [PMID:23505071 DOI:10.1002/ijc.28159]
75 Chun JH,Kim HK,Kim E,Kim IH,Kim JH,Chang HJ,Choi IJ,Lim HS,Kim IJ,Kang HC,Park JH,Bae JM,Park JG.Increased expression of metallothionein is associated with irinotecan resistance in gastric cancer.
2004;64:4703-4706 [PMID:15256434 DOI:10.1158/0008-5472.CAN-04-1063]
76 Gumulec J,Raudenska M,Adam V,Kizek R,Masarik M.Metallothionein -immunohistochemical cancer biomarker:a meta-analysis.
2014;9:e85346 [PMID:24416395 DOI:10.1371/journal.pone.0085346]
77 Sun X,Niu X,Chen R,He W,Chen D,Kang R,Tang D.Metallothionein-1G facilitates sorafenib resistance through inhibition of ferroptosis.
2016;64:488-500 [PMID:27015352 DOI:10.1002/hep.28574]
78 Bai T,Wang S,Zhao Y,Zhu R,Wang W,Sun Y.Haloperidol,a sigma receptor 1 antagonist,promotes ferroptosis in hepatocellular carcinoma cells.
2017;491:919-925 [PMID:28756230 DOI:10.1016/j.bbrc.2017.07.136]
79 Wen X,Reynolds L,Mulik RS,Kim SY,Van Treuren T,Nguyen LH,Zhu H,Corbin IR.Hepatic Arterial Infusion of Low-Density Lipoprotein Docosahexaenoic Acid Nanoparticles Selectively Disrupts Redox Balance in Hepatoma Cells and Reduces Growth of Orthotopic Liver Tumors in Rats.
2016;150:488-498 [PMID:26484708 DOI:10.1053/j.gastro.2015.10.008]
80 Moss LR,Mulik RS,Van Treuren T,Kim SY,Corbin IR.Investigation into the distinct subcellular effects of docosahexaenoic acid loaded low-density lipoprotein nanoparticles in normal and malignant murine liver cells.
2016;1860:2363-2376 [PMID:27418237 DOI:10.1016/j.bbagen.2016.07.004]
81 Ou W,Mulik RS,Anwar A,McDonald JG,He X,Corbin IR.Low-density lipoprotein docosahexaenoic acid nanoparticles induce ferroptotic cell death in hepatocellular carcinoma.
2017;112:597-607 [PMID:28893626 DOI:10.1016/j.freeradbiomed.2017.09.002]
82 Vincent A,Herman J,Schulick R,Hruban RH,Goggins M.Pancreatic cancer.
2011;378:607-620 [PMID:21620466 DOI:10.1016/S0140-6736(10)62307-0]
83 Lo M,Ling V,Wang YZ,Gout PW.The xc-cystine/glutamate antiporter:a mediator of pancreatic cancer growth with a role in drug resistance.
2008;99:464-472 [PMID:18648370 DOI:10.1038/sj.bjc.6604485]
84 Daher B,Parks SK,Durivault J,Cormerais Y,Baidarjad H,Tambutte E,Pouysségur J,Vučetić M.Genetic Ablation of the Cystine Transporter xCT in PDAC Cells Inhibits mTORC1,Growth,Survival,and Tumor Formation via Nutrient and Oxidative Stresses.
2019;79:3877-3890 [PMID:31175120 DOI:10.1158/0008-5472.CAN-18-3855]
85 Zhu S,Zhang Q,Sun X,Zeh HJ 3rd,Lotze MT,Kang R,Tang D.HSPA5 Regulates Ferroptotic Cell Death in Cancer Cells.
2017;77:2064-2077 [PMID:28130223 DOI:10.1158/0008-5472.CAN-16-1979]
86 Yamaguchi Y,Kasukabe T,Kumakura S.Piperlongumine rapidly induces the death of human pancreatic cancer cells mainly through the induction of ferroptosis.
2018;52:1011-1022 [PMID:29393418 DOI:10.3892/ijo.2018.4259]
87 Kasukabe T,Honma Y,Okabe-Kado J,Higuchi Y,Kato N,Kumakura S.Combined treatment with cotylenin A and phenethyl isothiocyanate induces strong antitumor activity mainly through the induction of ferroptotic cell death in human pancreatic cancer cells.
2016;36:968-976 [PMID:27375275 DOI:10.3892/or.2016.4867]
88 Wagner AD,Grothe W,Haerting J,Kleber G,Grothey A,Fleig WE.Chemotherapy in advanced gastric cancer:a systematic review and meta-analysis based on aggregate data.
2006;24:2903-2909 [PMID:16782930 DOI:10.1200/JCO.2005.05.0245]
89 Zhang H,Deng T,Liu R,Ning T,Yang H,Liu D,Zhang Q,Lin D,Ge S,Bai M,Wang X,Zhang L,Li H,Yang Y,Ji Z,Wang H,Ying G,Ba Y.CAF secreted miR-522 suppresses ferroptosis and promotes acquired chemo-resistance in gastric cancer.
2020;19:43 [PMID:32106859 DOI:10.1186/s12943-020-01168-8]
90 Wang SF,Chen MS,Chou YC,Ueng YF,Yin PH,Yeh TS,Lee HC.Mitochondrial dysfunction enhances cisplatin resistance in human gastric cancer cells via the ROS-activated GCN2-eIF2α-ATF4-xCT pathway.
2016;7:74132-74151 [PMID:27708226 DOI:10.18632/oncotarget.12356]
91 Brait M,Ling S,Nagpal JK,Chang X,Park HL,Lee J,Okamura J,Yamashita K,Sidransky D,Kim MS.Cysteine dioxygenase 1 is a tumor suppressor gene silenced by promoter methylation in multiple human cancers.
2012;7:e44951 [PMID:23028699 DOI:10.1371/journal.pone.0044951]
92 Yamashita K,Hosoda K,Nishizawa N,Katoh H,Watanabe M.Epigenetic biomarkers of promoter DNA methylation in the new era of cancer treatment.
2018;109:3695-3706 [PMID:30264476 DOI:10.1111/cas.13812]
93 Hao S,Yu J,He W,Huang Q,Zhao Y,Liang B,Zhang S,Wen Z,Dong S,Rao J,Liao W,Shi M.Cysteine Dioxygenase 1 Mediates Erastin-Induced Ferroptosis in Human Gastric Cancer Cells.
2017;19:1022-1032 [PMID:29144989 DOI:10.1016/j.neo.2017.10.005]
94 She K,Fang S,Du W,Fan X,He J,Pan H,Huang L,He P,Huang J.SCD1 is required for EGFR-targeting cancer therapy of lung cancer via re-activation of EGFR/PI3K/AKT signals.
2019;19:103 [PMID:31019378 DOI:10.1186/s12935-019-0809-y]
95 Tesfay L,Paul BT,Konstorum A,Deng Z,Cox AO,Lee J,Furdui CM,Hegde P,Torti FM,Torti SV.Stearoyl-CoA Desaturase 1 Protects Ovarian Cancer Cells from Ferroptotic Cell Death.
2019;79:5355-5366 [PMID:31270077 DOI:10.1158/0008-5472.CAN-19-0369]
96 Wang C,Shi M,Ji J,Cai Q,Zhao Q,Jiang J,Liu J,Zhang H,Zhu Z,Zhang J.Stearoyl-CoA desaturase 1 (SCD1) facilitates the growth and anti-ferroptosis of gastric cancer cells and predicts poor prognosis of gastric cancer.
2020;12:15374-15391 [PMID:32726752 DOI:10.18632/aging.103598]
97 Fearon ER.Molecular genetics of colorectal cancer.
2011;6:479-507 [DOI:10.1146/annurevpathol-011110-130235]
98 Xie Y,Zhu S,Song X,Sun X,Fan Y,Liu J,Zhong M,Yuan H,Zhang L,Billiar TR,Lotze MT,Zeh HJ 3rd,Kang R,Kroemer G,Tang D.The Tumor Suppressor p53 Limits Ferroptosis by Blocking DPP4 Activity.
2017;20:1692-1704 [PMID:28813679 DOI:10.1016/j.celrep.2017.07.055]
99 Sugano K,Maeda K,Ohtani H,Nagahara H,Shibutani M,Hirakawa K.Expression of xCT as a predictor of disease recurrence in patients with colorectal cancer.
2015;35:677-682 [PMID:25667445]
100 Ma MZ,Chen G,Wang P,Lu WH,Zhu CF,Song M,Yang J,Wen S,Xu RH,Hu Y,Huang P.Xc-inhibitor sulfasalazine sensitizes colorectal cancer to cisplatin by a GSH-dependent mechanism.
2015;368:88-96 [PMID:26254540 DOI:10.1016/j.canlet.2015.07.031]
101 Zhang W,Trachootham D,Liu J,Chen G,Pelicano H,Garcia-Prieto C,Lu W,Burger JA,Croce CM,Plunkett W,Keating MJ,Huang P.Stromal control of cystine metabolism promotes cancer cell survival in chronic lymphocytic leukaemia.
2012;14:276-286 [PMID:22344033 DOI:10.1038/ncb2432]
102 Doxsee DW,Gout PW,Kurita T,Lo M,Buckley AR,Wang Y,Xue H,Karp CM,Cutz JC,Cunha GR,Wang YZ.Sulfasalazineinduced cystine starvation:potential use for prostate cancer therapy.
2007;67:162-171 [PMID:17075799 DOI:10.1002/pros.20508]
103 Zhang X,Sui S,Wang L,Li H,Zhang L,Xu S,Zheng X.Inhibition of tumor propellant glutathione peroxidase 4 induces ferroptosis in cancer cells and enhances anticancer effect of cisplatin.
2020;235:3425-3437 [PMID:31556117 DOI:10.1002/jcp.29232]
104 Ohashi S,Miyamoto S,Kikuchi O,Goto T,Amanuma Y,Muto M.Recent Advances From Basic and Clinical Studies of Esophageal Squamous Cell Carcinoma.
2015;149:1700-1715[PMID:26376349 DOI:10.1053/j.gastro.2015.08.054]
105 Zhang J,Wang N,Zhou Y,Wang K,Sun Y,Yan H,Han W,Wang X,Wei B,Ke Y,Xu X.Oridonin induces ferroptosis by inhibiting gamma-glutamyl cycle in TE1 cells.
2021;35:494-503 [PMID:32869425 DOI:10.1002/ptr.6829]
106 Lu Z,Zhang G,Zhang Y,Hua P,Fang M,Wu M,Liu T.Isoalantolactone induces apoptosis through reactive oxygen species-dependent upregulation of death receptor 5 in human esophageal cancer cells.
2018;352:46-58[PMID:29800641 DOI:10.1016/j.taap.2018.05.026]
107 Wang P,Dong Q,Zhang C,Kuan PF,Liu Y,Jeck WR,Andersen JB,Jiang W,Savich GL,Tan TX,Auman JT,Hoskins JM,Misher AD,Moser CD,Yourstone SM,Kim JW,Cibulskis K,Getz G,Hunt HV,Thorgeirsson SS,Roberts LR,Ye D,Guan KL,Xiong Y,Qin LX,Chiang DY.Mutations in isocitrate dehydrogenase 1 and 2 occur frequently in intrahepatic cholangiocarcinomas and share hypermethylation targets with glioblastomas.
2013;32:3091-3100 [PMID:22824796 DOI:10.1038/onc.2012.315]
108 Amary MF,Bacsi K,Maggiani F,Damato S,Halai D,Berisha F,Pollock R,O’Donnell P,Grigoriadis A,Diss T,Eskandarpour M,Presneau N,Hogendoorn PC,Futreal A,Tirabosco R,Flanagan AM.IDH1 and IDH2 mutations are frequent events in central chondrosarcoma and central and periosteal chondromas but not in other mesenchymal tumours.
2011;224:334-343 [PMID:21598255 DOI:10.1002/path.2913]
109 Wang TX,Liang JY,Zhang C,Xiong Y,Guan KL,Yuan HX.The oncometabolite 2-hydroxyglutarate produced by mutant IDH1 sensitizes cells to ferroptosis.
2019;10:755 [PMID:31591388 DOI:10.1038/s41419-019-1984-4]
