烟草BBLc基因CRISPR/Cas 9载体构建与遗传转化
2022-08-27仆田秀南王麟麒
苏 龙, 仆田秀南, 杨 竞, 万 克, 王麟麒, 刘 洋
(贵州大学烟草学院,贵州省烟草品质研究重点实验室, 贵阳 550025)
烟草(NicotianatabacumL.)是一种嗜好性经济作物,在国民经济中具有十分重要的作用[1]。烟碱是烟叶中最重要的化学成分,是衡量烟草和卷烟质量的一项重要指标,是烟草商品价值的主要体现。烟碱含量的调控机制一直是烟草学科研究的重点之一。
目前的研究认为,烟碱合成的关键酶包括冬氨酸脱羧酶(Arginine Decarboxylase,ADC)、天鸟氨酸脱羧酶(Ornithine Decarboxylase,ODC)、腐胺甲基转移酶(Putrescine-N-methyltransferase,PMT),甲基腐胺氧化酶(N-methylputrescine Oxidase,MPO)、喹啉酸磷酸核糖基转移酶(Quinolinic acid phosphoribosyltransferase,QPT)等[2]。ADC途径在细胞生长和胁迫应答等方面必不可少,而ODC途径的重要之处在于为植物细胞正常分化、分裂和发育提供所需多胺[3]。在许多产生物碱植物中,PMT控制初级代谢产物向次级代谢产物的转化,Sato F等[4]通过转基因手段下调林烟草中PMT基因表达水平时,发现烟碱合成量大幅度降低;但同时烟草叶片的生长和开花异常,推测可能是腐胺和多胺的积累所致,或者是吡啶环合成途径中一些与生长有关的中间产物过多积累所致。Shoji等[5]采用基因沉默技术使烟草根系不表达MPO基因造成烟碱含量大幅度降低,但同时新烟碱含量增加并成为最主要的生物碱。Xie J H等[6]通过抑制QPT基因表达降低了烟碱含量,但烟叶正常生长受到显著影响。上述基因都在烟碱合成途径的上游。
小檗碱桥状酶(Berberine bridge enzyme-like,BBL)基因家族含有BBLa、BBLb、BBLc、BBLd等基因,广泛存在于细菌、真菌和植物中[7]。BBL蛋白定位在液泡,显示出FAD辅因子的双共价链,可能具有 FAD依赖型氧化还原酶功能[8],并参与了烟碱代谢过程中吡啶生物碱的合成[9]。Lewis等[7]根据BBLa、BBLc、BBLd基因的保守结构域,设计同一个RNAi载体遗传转化栽培烟草K 326的二倍体植株降低了小檗碱桥状酶的表达量,结果表明,经过RNAi技术改造的烟草烟碱含量为0.684%,而对照的烟碱含量为2.454%,烟碱含量大幅降低,同时经过RNAi技术改造的烟草生长发育未见明显变化;进一步分析认为,小檗碱桥状酶可能参与催化烟草吡啶生物碱合成的最后一步,由于该酶在烟碱生物合成途径的下游起作用,所以对烟草正常发育的影响很小。
CRISPR(Clustered Regularly-interspaced Short Palindromic Repeats)是指规律成簇的间隔短回文重复,CRISPR/Cas 9系统最初来源于细菌和古细菌中的适应性免疫系统,逐渐发展成为一种广泛使用的基因编辑技术。该技术可以在目标基因的靶位点处切开DNA双链结构,激发DNA损伤修复,从而准确编辑基因。CRISPR/Cas 9基因编辑技术具有无物种限制、靶向精确性高、使用方便、价格便宜等优点,不需要将外源基因插入到植物基因组内,就能够对植物原有的基因进行编辑,获得的基因编辑植株可以通过自交等方式获得不含有任何外源基因,且内源目标基因被编辑的纯合后代,实现对目标性状改造的精准育种,且不涉及转基因生物安全性问题,因而在作物育种上具有广泛的应用前景。
本研究利用 CRISPR/Cas 9 技术构建BBLc敲除载体并遗传转化生产上广泛使用的烤烟品种K 326,获得BBLc编辑植株7株,其烟碱含量均降低,基因编辑植株烟叶褶皱程度较野生型增大,其余农艺性状与野生型相比差别不大。本研究为培育低烟碱含量烤烟新品系并应用于生产奠定了基础。
1 材料与方法
1.1 材 料
烤烟品种 K 326种子,由贵州省烟草品质研究重点实验室保存;CRISPR/Cas 9基本载体pBWA(V)K-Cas 9 pl 购于武汉伯远生物科技有限公司;大肠杆菌DH 5 α 菌株、农杆菌LBA 440由本实验室保存。
1.2 CRISPR/Cas 9载体的构建方法
根据BBLc基因5’ 端非翻译区及其紧邻的第一个外显子序列,利用CRISPR-P v 2.0 在线软件设计针对该区域的编辑靶点,并分析潜在脱靶位点,设计获得BBLc的目标靶点为c-Y 1和c-Y 2,c-Y 1靶点(序列为:TCAAGTCGATGATCACGAACGGG),c-Y 2靶点(序列为:AACGTCACTTGCCTTGGCAATGG)。
设计出用于靶点序列合成的3对引物(表1)。参照张璠等[10]的方法构建 CRISPR/Cas 9 基因编辑载体,采用菌液PCR及Sanger 测序鉴定载体构建效果,载体命名为 pBWA(V)K-Cas 9 pl-sgRNA。菌液PCR反应体系为:ddH2O 36 μL、Buffer 5 μL、Mg2+4 μL、dNTP 2 μL、Taq2 μL、模板 1 μL、总体积50 μL。用1.5%的琼脂糖凝胶电泳,分别将97 bp、76 bp、97 bp的电泳片段切下,用总体积30 μL的水溶解回收DNA,检测无误后与载体进行连接。载体酶切体系:ddH2O 13 μL、Buffer 2 μL、Bsa I/Eco 31 I 1 μL、pBWA(V)K-Cas 9 pl 4 μL、总体积20 μL,于37 ℃恒温培养箱培养2 h。将5~10 μL连接产物转化大肠杆菌感受态,转化涂布的抗性平皿,37 ℃培养12 h,进行菌斑PCR鉴定。挑取10个菌斑同时进行1.5 mL EP管接种,并进行PCR鉴定。pBWA(V)K-Cas 9 pl(atu 6 i)鉴定引物为p 1、p 2,目标条带为200 bp左右的片段。对连接好的载体进行PCR检测,反应体系:ddH2O 15.5 μL、Buffer 2.5 μL、Mg2+2 μL、dNTP1 μL、Taq1 μL、模板 1 μL、p 1 1 μL、p 2 1 μL总体积25 μL。取1~3个阳性条带所对应的菌液,取100 μL送样测序,其余400 μL菌液接种到含有5~10 mL卡那霉素的抗性LB中,待测序结果出来后,对应测序正确的取一管质粒,用冻融法将构建成功的基因编辑载体转入农杆菌感受态细胞中。将摇菌得到的菌液加入甘油于-80 ℃冰箱保存并用于下一步实验。

表1 本实构建载体验所用引物Table 1 The primers used to construct the vector
1.3 用含BBLc基因的CRISPR/Cas 9载体遗传转化烟草K 326
培养农杆菌:用接种环分别蘸取-80 ℃冻存的含BBLc编辑载体的农杆菌在YEP固体培养基上划 Z字形平板, 28 ℃恒温培养24 h左右,直到长出合适大小的单菌落。划平皿挑取农杆菌单菌落:用高温灭菌后的牙签挑取农杆菌单菌落放入5 mL YEP液体培养基中,200 r/min 28 ℃振荡培养24 h后,用灭过菌的枪头从5 mL菌液中吸取1 mL加入到100 mL 灭过菌的三角瓶中,再加入40~50 mL YEP 液体培养基,200 r/min 28 ℃振荡培养直到OD600值为0.3~0.7(大约需8 h)。接着将菌液转移到50 mL离心管4 ℃ 5 000 r/min离心10 min,去掉上清液收集农杆菌菌体。
利用农杆菌介导法遗传转化烟草:取烟草K 326幼嫩叶片,用75%的酒精先消毒30 s 再用0.1%的升汞消毒7 min后用无菌水清洗3~5次,在超净工作台将其切成1 cm2大小的方块,置于已灭菌的培养皿中,用MS重悬液(4.432 g/L MS+30 g/L蔗糖)重悬离心收集得到的农杆菌菌体,将农杆菌重悬液倒入盛有切好的烟草叶片的培养皿中,浸泡8 min进行侵染,已侵染的叶片置于无菌滤纸上吸干残留的菌液后,将其按照叶面背面朝下的方式排布于共培培养基上,于28 ℃ 黑暗培养条件下暗培养(共培养) 2~3 d。暗培养好的叶片则转移到筛选培养基中进行筛选培养。每2周更换一次筛选培养基,筛选培养3~4周,外植体叶片将产生抗性愈伤组织继而分化出不定芽,当抗性芽长到1~2 cm时,切下芽并转接至生根培养基中,待幼苗生根后炼苗再移栽。
2) 对小尺度空间水景的构成要素和水岸景观、设施配置内容进行整体分析,刻画优美而富有特色的细节,探讨和分析营造小尺度空间水景的适宜形式、类型以及管理和维护方式;
烟草遗传转化培养基配方如下:
共培养基:4.432 g/L MS+1.0 mg/L 6-BA+0.1 mg/L NAA+30 g/L蔗糖+7 g/L琼脂,pH值为5.8~6.0。
筛选培养基:4.432 g/L MS+1.0 mg/L 6-BA+0.1 mg/L NAA+30 g/L 蔗糖+7 g/L 琼脂+100 mg/L Timentin+20 mg/L Kan,pH值为5.8~6.0。
生根培养基:2.216 g/L 1/2 MS+20 g/L蔗糖+7.5 g/L琼脂+100 mg/L Timentin+20 mg/L Kan,pH值为5.8~6.0。
1.4 抗性植株的分子鉴定及BBLc基因表达量分析
1.4.1突变株的分子鉴定
根据卡那霉素(Kanamycin Kan)的基因序列(GenBank:M 17626.1)利用Premier Premier 6.0软件设计PCR引物,Kan F:GATCTGGACGAAGAGCATCAG,Kan R:CTCGTCAAGAAGGCGATAGAAG,用CTAB法从卡那霉素抗性植株中提取基因组DNA作为PCR反应模板,进行PCR扩增。PCR反应体系为:ddH2O 12 μL、Buffer 2 μL、KanF引物0.5 μL、KanR引物0.5 μL、dNTP 2 μL、Taq酶2 μL、模板1 μL、总体积20 μL。
1.4.2BBLc基因表达量分析
利用RNA prep pure Plant Kit总RNA提取试剂盒提取突变株和野生型烟株的RNA,利用反转录试剂盒将RNA合成cDNA。利用Primer Premier 6.0软件设计引物,引物为:Bblc-F:TCATTATCCTACCAAACAGCAA,Bblc-R:ACGACACTATCAGCAGCGAC。以“L 25”基因为内参基因,扩增引物为:L 25-F:5′-CCCCTCACCACAGAGTCTGC-3′和L 25-R:5′-AAGGGTGTTGTTGTCCTCAATCTT-3′。实时荧光定量PCR反应体系为:2×Talentl qPCR PreMix 10 μL、10 μmol/L上下游引物各0.6 μL、cDNA模板1 μL、RNase-free ddH2O 7.8 μL,共20 μL。反应程序:95 ℃预变性3 min;95 ℃变性5 s、60 ℃退火15 s、39个循环。每个反应重复3次,采用2-ΔΔCt法计算BBLc基因的相对表达量。
1.5 烟碱含量的测定
采用高效液相色谱法(HPLC)测定烟草中烟碱含量,具体参考杨娟等[11]的方法。取盛花期相同部位(从下往上第9片叶)烟叶,杀青烘干备用。移取烟碱标准溶液2.0、4.0、6.0、8.0、10.0 mL用流动相定容至25 mL,每个实验点重复进样3次,在同一条件下进行色谱测定。
1.6 数据分析
采用Excel 2007软件计算平均值、标准差,采用SPSS 23.0软件、LSD法进行单变量方差分析和相关性分析,*表示在p<0.05水平下差异显著。
2 结果与分析
2.1 烟草BBLc基因的CRISPR/Cas 9载体构建
2.1.1对载体的大肠杆菌细胞进行PCR检测
对连接好的重组载体大肠杆菌细胞进行PCR检测,经过琼脂糖凝胶电泳,获得200 bp左右的目标条带,与预期一致(图1)。
2.1.2烟草BBLc基因的CRISPR/Cas 9 载体的图谱
2.2 烟草的遗传转化
利用农杆菌介导法将BBLc编辑载体遗传转化K 326烟草叶片(图3 A),经过2~4周从叶片边缘分化出愈伤组织(图3 B),再培养2~3周开始长抗性芽(图3 C),抗性芽长到1.5~3 cm时,切下完整抗性芽接至生根培养基中,2~3周后抗性芽开始生根且茎秆伸长变粗、叶片数量增多、叶片变大(图3 D)。烟苗长到5~6 cm高时,打开瓶盖炼苗24 h,再将烟苗取出,用清水洗净附着在根上的琼脂,移栽到装有营养土的花盆中。实验共获得35株抗性转化苗(图3 E)。

图1 重组载体电泳图Fig.1 The map of electrophoresi recombinant vector
2.3 转化植株筛选鉴定
2.3.1Kan抗性基因鉴定
以卡那霉素抗性基因为目标基因,利用PCR技术对35株卡那霉素抗性烟草植株进行检测,结果(图4)显示,有12株转化株扩增出300 bp左右的条带,该条带与预期产物大小一致,说明外源基因已经整合到转化植株基因组上,阳性编辑率为34.29%。

图2 CRISPR/Cas 9植物表达载体图谱Fig.2 The map of CRISPR/Cas 9 plant expression vector
2.3.2BBLc基因表达量测定
采用RT-qPCR技术对12株经PCR鉴定的转化苗进行表达量测定,通过比较植株中BBLc表达量的变化来判断是否发生突变[12]。结果表明,在BBLc基因编辑植株(CB)中,植株CB 2、CB 4、CB 5、CB 7、CB 8、CB 10、CB 11与对照植株(野生型)相比均差异显著,表达量均大幅降低,其余处理与对照相比差异不显著(图5)。实验结果表明,BBLc基因编辑植株CB 2、CB 4、CB 5、CB 7、CB 8、CB 10、CB 11中的BBLc基因敲除成功,最终获得BBLc基因编辑植株共7株,阳性突变率为58.33%。对BBLc基因编辑植株进行观察发现,突变株烟叶褶皱程度较野生型增大,其余农艺性状与野生型相比差别不大。
2.4 突变株烟碱含量的测定
采用高效液相色谱法(HPLC)对7株BBLc基因编辑植株进行烟碱含量测定,结果(图6)表明,野生型植株烟碱含量为1.41%,突变株烟碱含量平均值为1.07%,平均降低了24.2%,其中突变株CB 10烟碱含量为0.88%,降幅最大,为37.6%。
3 讨 论
本研究中突变株BBLc相对表达量明显降低,这与王伟伟[13]敲除植株中表达量明显降低的结果相同,CRISPR/Cas 9技术对BBLc的阳性编辑效率为34.29%,突变效率为58.33%,编辑效率和突变效率都略高于蒋悦等[14]的研究结果,这可能与材料不同有关。本研究所获突变株中部分突变株的烟叶褶皱程度较野生型增大,其余农艺性状与野生型相比差别不大,这与Lewis等[7]通过RNAi技术降低BBL基因家族在二倍体K 326的表达后转基因烟草株系生长发育未受影响的研究结果相似,但Lewis使用的是二倍体K 326,而本实验中使用的是四倍体K 326。金云峰等[15]推测BBL在烟碱合成的后期,很可能是最后阶段起作用;本研究所获突变株的农艺性状与野生型相比差别不大,也间接证实了金云峰的推测。Lewis通过RNAi技术获得的转基因植株烟碱含量为0.684%,比对照(2.454%)大幅降低,而本研究中基因编辑植株的烟碱含量平均降低24.2%,烟碱降低程度没有Lewis的研究结果显著,可能是测定时期不同所致,本实验中烟碱含量是在盛花期测定的,这一时期处于烟碱积累后期,变化趋于平稳[16],烟碱变化幅度较小可能与此有关。

注:A为侵染叶片放在抗性筛选培养基上诱导愈伤组织;B为侵染叶片长出愈伤组织;C为愈伤组织开始分化长芽;D为抗性苗;E为抗性苗的移栽。图3 遗传转化烟草Fig.3 Transgenic tobacco seedlings
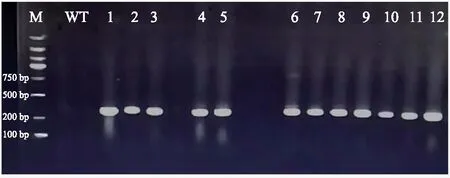
注:M表示2000 bp Marker;WT表示野生型;1~12表示转化株。图4 转基因植株的PCR鉴定电泳图(部分)Fig.4 The PCR identification electrophoresis map of transgenic plants

注:WT为野生型;CB 1~CB 12为BBLc编辑植株;“*”表示差异显著(p<0.05)。图5 BBLc基因相对表达量Fig.5 Relative expression of BBLc gene
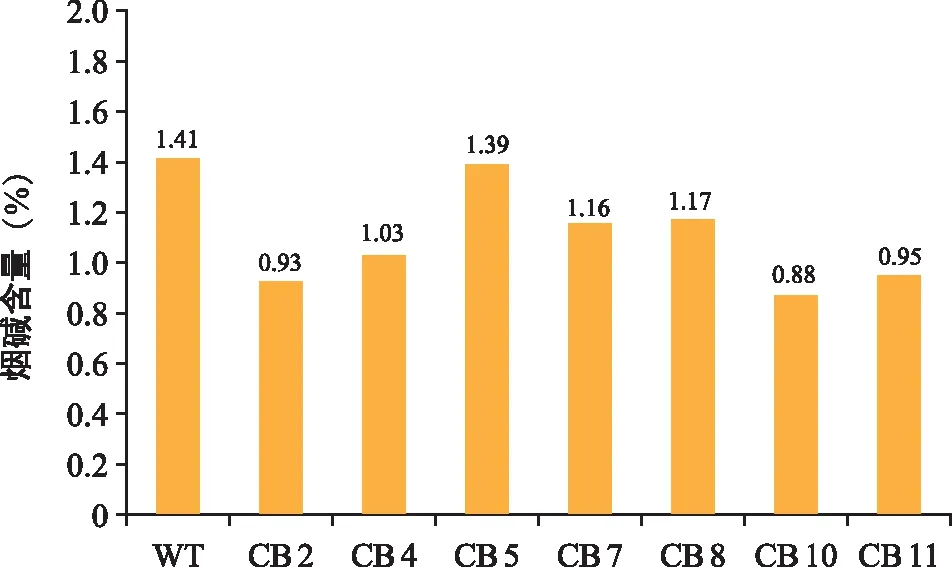
注:WT为野生型;CB 2、CB 4、CB 5、CB 7、CB 8、CB 10、CB 11为不同突变株系。图6 各株系烟碱含量Fig.6 Nicotine content of strains
