微生态制剂对儿童腹型过敏性紫癜疗效及免疫功能的影响研究*
2022-08-16符林瑜林景
符林瑜,林景
(海南省第五人民医院药剂科,海南海口 570103)
过敏性紫癜是一种自限性疾病,是儿童最常见的系统性小血管炎,多发于学龄期儿童,发病率较高,且近年来呈逐年上涨趋势[1]。目前,该病的发病机制尚未完全明确,但多数学者认为与免疫应答密切相关[2]。该病以腹痛、便血、关节痛、皮肤紫癜等为主要临床表现,根据病变部位的不同,可分为腹型、肾型、混合型等。其中,腹型最常见,即首发症状为腹痛,且大多伴有消化道出血症状。有数据显示,腹型过敏性紫癜患儿占总体的90%以上[3]。腹型过敏性紫癜尚无特异性治疗药物,主要以抗过敏、对症治疗为主,但治疗效果不理想。有研究[4]指出,腹型过敏性紫癜患儿多伴有消化道症状,肠道生态失衡,致使肠道黏膜屏障功能受到一定程度的破坏,进而导致肠道免疫紊乱,进一步加重患儿症状。微生态制剂对胃肠具有有效调节作用,可促进肠道微生态平衡,在多种胃肠疾病中均有应用[5]。虽然临床关于微生态制剂治疗儿童腹型过敏性紫癜的研究较多,但该类药物对患儿免疫功能的影响尚未明确。基于此,本研究拟探讨微生态制剂对儿童腹型过敏性紫癜疗效及免疫功能的影响,现报道如下。
1 资料与方法
1.1 一般资料
本研究为前瞻性研究,经海南省第五人民医院医学伦理委员会审查通过。选取2017年8月—2021年9月本院102 例腹型过敏性紫癜患儿为研究对象,按随机数字表法分为对照组和研究组,每组51 例。纳入标准:符合2011 版《诸福棠实用儿科学》[6]的诊断标准,且诊断为腹型;年龄<12 岁;病程≤7 d;家属知情并自愿签署知情同意书。排除标准:治疗前接受过免疫抑制剂等药物治疗;合并其他胃肠疾病;合并肝肾等重要器官功能障碍;肾型、皮肤型、混合型过敏性紫癜;合并血液系统或免疫系统疾病。
对照组男性28 例,女性23 例;年龄2~12 岁,平均(7.53±1.40)岁;病程1~7 d,平均(4.03±0.53)d;便血33 例,严重腹痛18 例。研究组男性27 例,女性24 例;年龄2~12 岁,平均(7.62±1.37)岁;病程1~7 d,平均(4.10±0.57)d;便血31 例,严重腹痛20 例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
对照组采用常规对症治疗和抗过敏治疗,限制患儿活动量,给予西咪替丁(广西天天乐药业股份有限公司,国药准字H20045965,规格:0.2 g)、消旋山莨菪碱片(杭州民生药业股份有限公司,国药准字H20023739,规格:10 mg)、维生素C 片(吉林恒星科技制药有限公司,国药准字H22022918,规格:0.1 g)等。研究组在对照组基础上加用微生态制剂治疗,即温开水送服双歧杆菌四联活菌片(杭州远大生物制药有限公司,国药准字S20060010,规格:0.5 g),3 次/d,3 片/次,重症者遵医嘱药量加倍。两组患儿均连续服药2 周。
1.3 观察指标
1.3.1 临床疗效治疗后,患儿便血、腹痛等症状消失,紫癜完全消失或残留少量色素沉着,为治愈;患儿便血、腹痛等症状明显减少,紫癜消失70%以上,为显效;患儿便血、腹痛等症状有所缓解,紫癜消失30%~70%,为有效;患儿便血、腹痛等症状无变化,紫癜未消退,为无效。
1.3.2 症状缓解时间及住院时间比较两组患儿的腹泻时间、皮疹时间、便血时间及住院时间。
1.3.3 肠道菌群于治疗前、治疗2 周后采集两组患儿新鲜粪便标本,经细菌培养后,采用全自动快速微生物鉴定智能分析仪(购自山东云唐智能科技有限公司)测定乳杆菌、双歧杆菌、肠球菌、肠杆菌水平。
1.3.4 肠道黏膜屏障功能于治疗前、治疗2 周后采集患儿晨起空腹静脉血2 mL,3 000 r/min 离心5 min,取血清-80℃保存待测。采用分光光度计测定二胺氧化酶(diamine oxidase, DAO)、D-乳酸、内毒素的吸光度值,根据回归方程(Y=a+bX)计算DAO、D-乳酸、内毒素水平(Y为浓度标准溶液的吸光度值,a 为截距,b 为回归系数,X为标准溶液的浓度或含量)。
1.3.5 免疫功能取待测血清,采用BS-350S 全自动生化分析仪(购自南京贝登医疗股份有限公司) 测定免疫球蛋白M(Immunoglobulin M, IgM)、免疫球蛋白A(Immunoglobulin A, IgA)、免疫球蛋白G(Immunoglobulin G, IgG)水平;采用全光谱流式细胞仪(购自青岛佳鼎分析仪器有限公司)测定调节性T 细胞(regulatory cells, Treg)、调节性B 细胞(regulatory B cell, Breg)、抑制性细胞(myeloidderived suppressor cells,MDSC)的百分比。
1.3.6 不良反应比较两组患儿发生恶心呕吐、皮疹、腹泻等不良反应情况。
1.4 统计学方法
数据处理采用SPSS 24.0 统计软件。符合正态分布的计量资料以均数±标准差(±s)表示,比较采用t检验;计数资料以率(%)表示,比较用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患儿疗效比较
研究组与对照组的治疗总有效率比较,差异有统计学意义(χ2=4.320,P=0.038),研究组高于对照组。见表1。
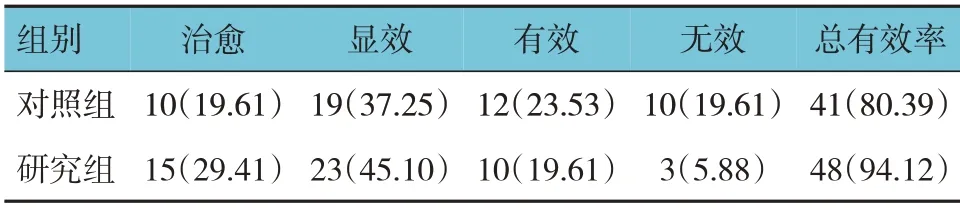
表1 两组患儿疗效比较 [n=51,例(%)]
2.2 两组患儿症状缓解时间及住院时间比较
两组患儿的腹泻时间、皮疹时间、便血时间、住院时间比较,经t检验,差异有统计学意义(P<0.05),研究组腹泻时间、皮疹时间、便血时间、住院时间均比对照组短。见表2。
表2 两组患儿症状缓解时间及住院时间比较(n=51,d,±s)
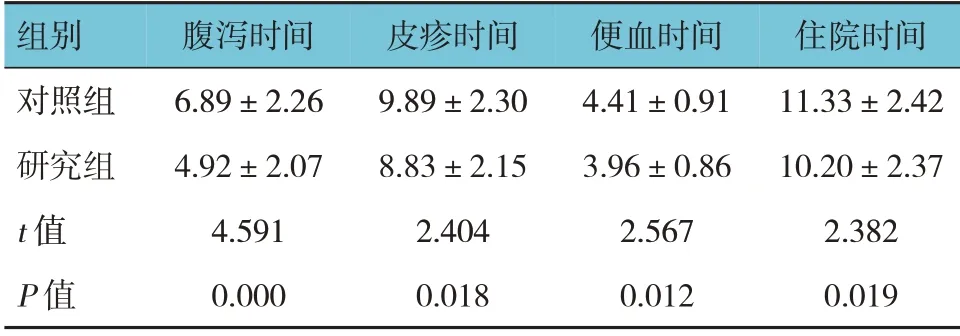
表2 两组患儿症状缓解时间及住院时间比较(n=51,d,±s)
组别对照组研究组t 值P 值腹泻时间6.89±2.26 4.92±2.07 4.591 0.000皮疹时间9.89±2.30 8.83±2.15 2.404 0.018便血时间4.41±0.91 3.96±0.86 2.567 0.012住院时间11.33±2.42 10.20±2.37 2.382 0.019
2.3 两组患儿肠道菌群比较
两组患儿乳杆菌、双歧杆菌、肠球菌、肠杆菌治疗前后差值比较,经t检验,差异有统计学意义(P<0.05),研究组治疗后乳杆菌、双歧杆菌比对照组高,肠球菌、肠杆菌比对照组低,且研究组治疗前后差值比对照组高。见表3。
表3 两组患儿治疗前后肠道菌群比较 (n=51,lgCFU/g,±s)
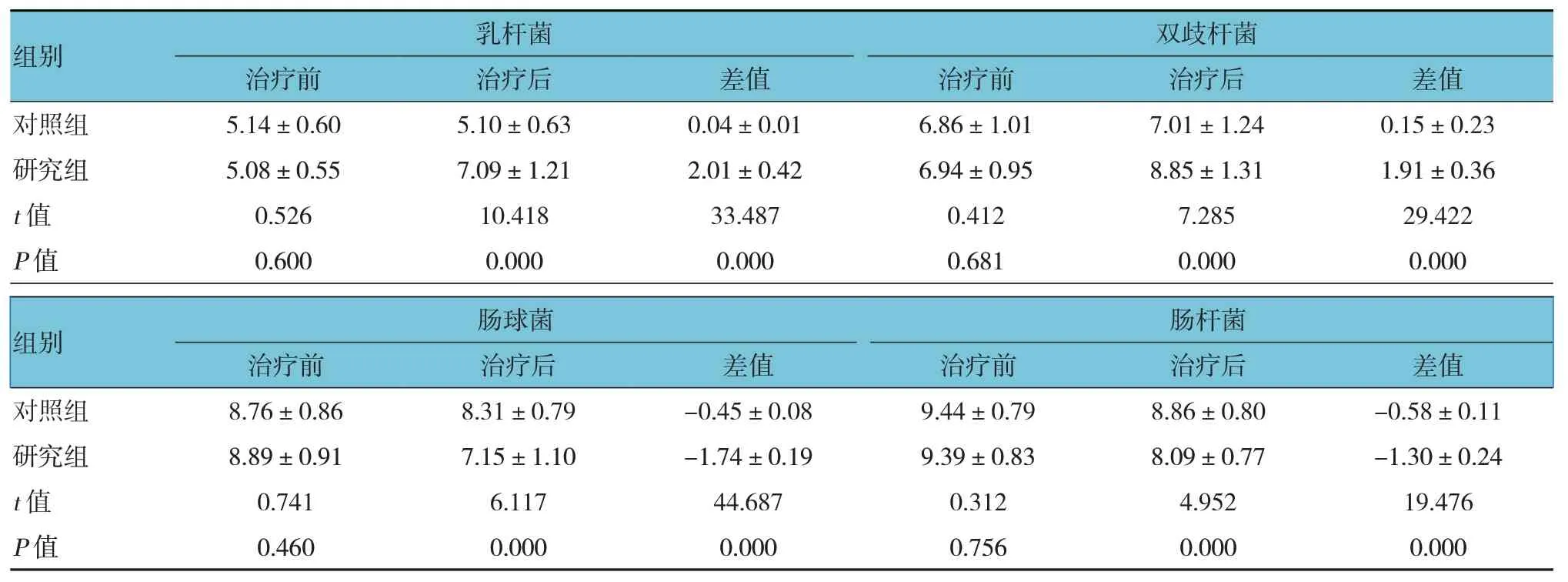
表3 两组患儿治疗前后肠道菌群比较 (n=51,lgCFU/g,±s)
组别乳杆菌双歧杆菌治疗前治疗后差值治疗前治疗后差值对照组研究组t 值P 值5.14±0.60 5.08±0.55 0.526 0.600 5.10±0.63 7.09±1.21 10.418 0.000 0.04±0.01 2.01±0.42 33.487 0.000 6.86±1.01 6.94±0.95 0.412 0.681 7.01±1.24 8.85±1.31 7.285 0.000 0.15±0.23 1.91±0.36 29.422 0.000组别对照组研究组t 值P 值肠球菌肠杆菌治疗前8.76±0.86 8.89±0.91 0.741 0.460治疗后8.31±0.79 7.15±1.10 6.117 0.000差值-0.45±0.08-1.74±0.19 44.687 0.000治疗前9.44±0.79 9.39±0.83 0.312 0.756治疗后8.86±0.80 8.09±0.77 4.952 0.000差值-0.58±0.11-1.30±0.24 19.476 0.000
2.4 两组患儿肠道黏膜屏障功能比较
两组患儿DAO、D-乳酸、内毒素水平治疗前后差值比较,经t检验,差异有统计学意义(P<0.05),研究组治疗后DAO、D-乳酸、内毒素水平均比对照组低,研究组DAO、D-乳酸、内毒素水平治疗前后差值比对照组高。见表4。
表4 两组患儿治疗前后肠道黏膜屏障功能比较 (n=51,±s)
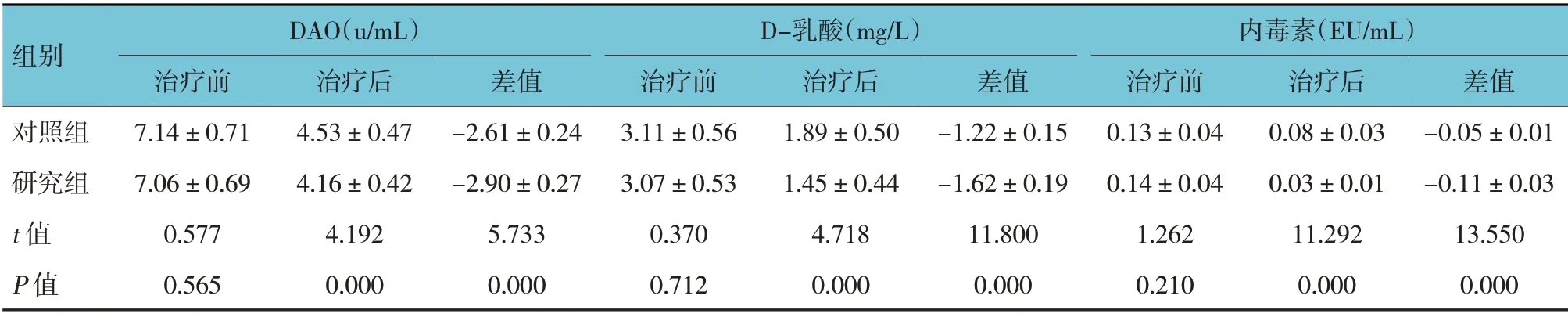
表4 两组患儿治疗前后肠道黏膜屏障功能比较 (n=51,±s)
组别DAO(u/mL)D-乳酸(mg/L)内毒素(EU/mL)治疗后4.53±0.47 4.16±0.42 4.192 0.000治疗前7.14±0.71 7.06±0.69 0.577 0.565对照组研究组t 值P 值差值-2.61±0.24-2.90±0.27 5.733 0.000治疗前3.11±0.56 3.07±0.53 0.370 0.712治疗后1.89±0.50 1.45±0.44 4.718 0.000差值-1.22±0.15-1.62±0.19 11.800 0.000治疗前0.13±0.04 0.14±0.04 1.262 0.210治疗后0.08±0.03 0.03±0.01 11.292 0.000差值-0.05±0.01-0.11±0.03 13.550 0.000
2.5 两组患儿免疫功能比较
两组患儿IgM、IgA、IgG 水平治疗前后差值比较,经t检验,差异有统计学意义(P<0.05),研究组治疗后IgM、IgA、IgG 水平均比对照组低,研究组IgM、IgA、IgG 水平治疗前后差值比对照组高(见表5)。两组Treg、Breg、MDSC 治疗前后差值比较,经t检验,差异有统计学意义(P<0.05),研究组治疗后Treg、Breg、MDSC 均比对照组低,研究组Treg、Breg、MDSC 治疗前后差值比对照组高(见表6)。
表5 两组患儿治疗前后免疫功能比较 (n=51,g/L,±s)
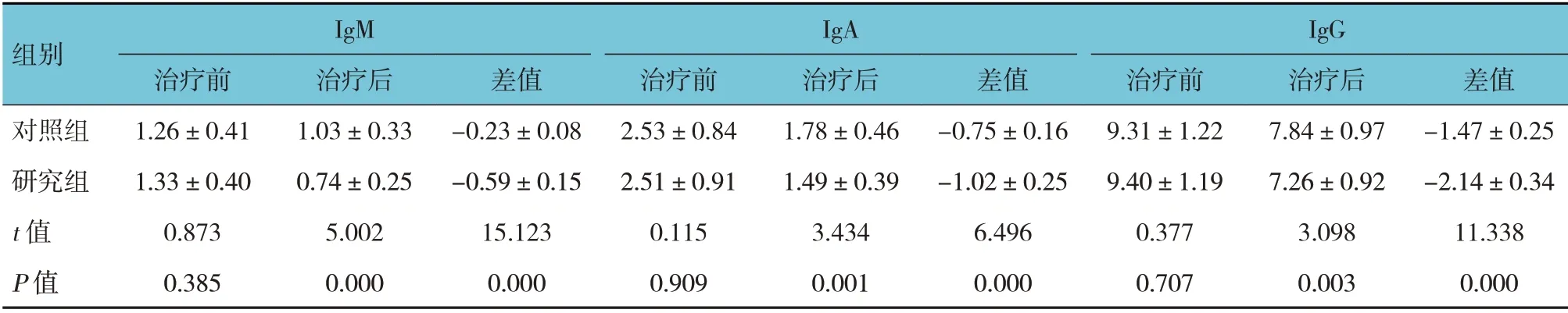
表5 两组患儿治疗前后免疫功能比较 (n=51,g/L,±s)
组别IgM IgA IgG治疗后1.03±0.33 0.74±0.25 5.002 0.000治疗前1.26±0.41 1.33±0.40 0.873 0.385对照组研究组t 值P 值差值-0.23±0.08-0.59±0.15 15.123 0.000治疗前2.53±0.84 2.51±0.91 0.115 0.909治疗后1.78±0.46 1.49±0.39 3.434 0.001差值-0.75±0.16-1.02±0.25 6.496 0.000治疗前9.31±1.22 9.40±1.19 0.377 0.707治疗后7.84±0.97 7.26±0.92 3.098 0.003差值-1.47±0.25-2.14±0.34 11.338 0.000
表6 两组患儿治疗前后外周血抑制性免疫细胞比较 (n=51,%,±s)
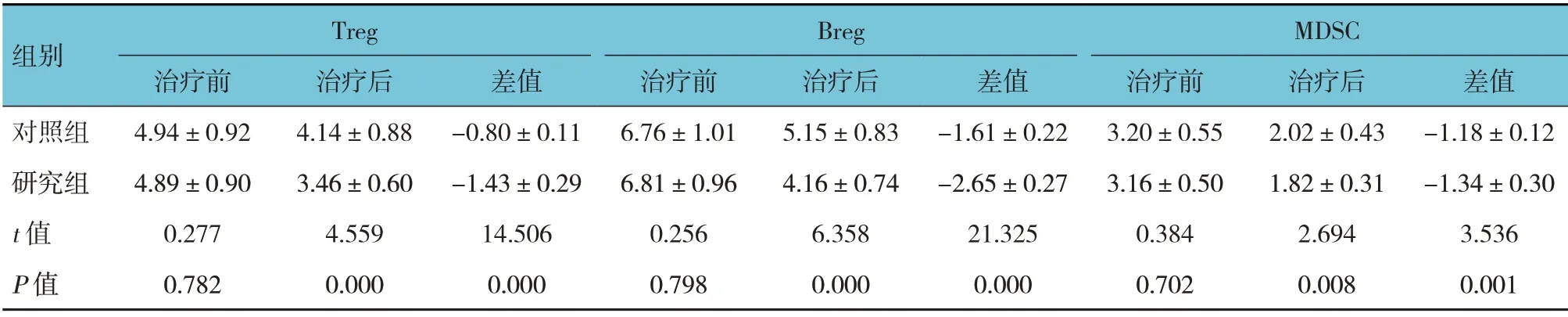
表6 两组患儿治疗前后外周血抑制性免疫细胞比较 (n=51,%,±s)
组别Treg Breg MDSC治疗后4.14±0.88 3.46±0.60 4.559 0.000治疗前4.94±0.92 4.89±0.90 0.277 0.782对照组研究组t 值P 值差值-0.80±0.11-1.43±0.29 14.506 0.000治疗前6.76±1.01 6.81±0.96 0.256 0.798治疗后5.15±0.83 4.16±0.74 6.358 0.000差值-1.61±0.22-2.65±0.27 21.325 0.000治疗前3.20±0.55 3.16±0.50 0.384 0.702治疗后2.02±0.43 1.82±0.31 2.694 0.008差值-1.18±0.12-1.34±0.30 3.536 0.001
2.6 两组患儿不良反应比较
研究组和对照组不良反应总发生率比较,经χ2检验,差异无统计学意义(χ2=0.102,P=0.750)。见表7。
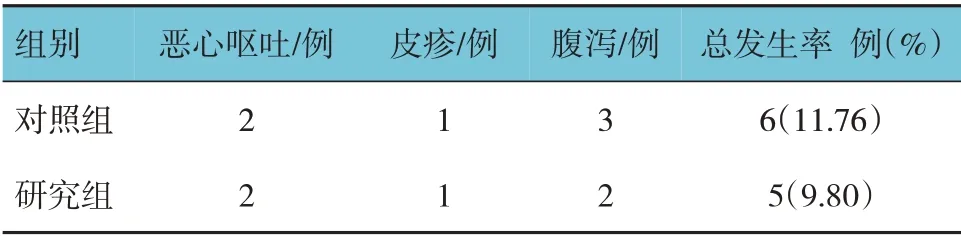
表7 两组患儿不良反应比较 (n=51)
3 讨论
目前临床治疗过敏性紫癜主要以激素类药物为主,如泼尼松、氢化可的松等,并辅以止血、肠道黏膜保护药物,可取得一定效果,但激素类药物易出现出血、溃疡等并发症,影响治疗效果[7]。随着微生态制剂的不断发展和成熟,部分学者将治疗过敏性紫癜的方向转向了微生态制剂。微生态制剂也叫生菌剂或活菌制剂,运用“以菌治菌”理念调节肠道,恢复肠道微生态平衡[8]。
人体肠道具有屏障功能,可减少有害物质通过肠道入侵机体,对机体起到保护作用[9]。血浆DOA 是存在于肠黏膜绒毛上皮细胞的细胞内酶,活性较高,可反映小肠结构和功能变化,其水平异常增高提示肠屏障受损[10]。内毒素是一种脂多糖成分,主要来源于革兰阴性细菌细胞壁,肠黏膜屏障功能受到破坏,肠道内内毒素向肠腔外渗透,致使血液中内毒素升高,故内毒素水平可间接反映肠黏膜屏障功能[11]。D-乳酸是肠道细菌发酵的代谢产物,在肠道黏膜受损时,肠道内D-乳酸通过受损黏膜进入血液循环,故D-乳酸可有效反映肠黏膜受损情况[12]。本研究结果显示,研究组治疗总有效率为94.12%,比对照组80.39%高,研究组腹泻时间、皮疹时间、便血时间、住院时间均比对照组短,研究组治疗后乳杆菌、双歧杆菌比对照组高,肠球菌、肠杆菌比对照组低,研究组治疗后DAO、D-乳酸、内毒素水平均比对照组低,提示微生态制剂辅助治疗儿童腹型过敏性紫癜的临床疗效确切,可纠正肠道菌群紊乱,有效改善患儿肠黏膜屏障功能,缓解临床症状。其原因在于,Th1/Th2 细胞失衡与过敏性紫癜的发生、进展密切相关,双歧杆菌四联活菌片可直接补充肠道双歧杆菌等有益菌数量,纠正菌群紊乱,进而恢复Th1/Th2 细胞平衡状态,阻碍病情的进展;且菌群紊乱得以纠正,有助于肠黏膜上皮修复损伤细胞,进而改善肠黏膜功能[13-14]。双歧杆菌还可在肠黏膜表面通过磷脂酸特异性结合肠黏膜上皮细胞,连同其他厌氧菌覆盖肠黏膜表面,构成一道阻碍致病菌入侵、抑制炎症反应的生物学屏障[15]。双歧杆菌还可调节肠道通透性,改善肠道微生态环境,进而提高肠道免疫应答,对局部或全身性变态反应的致炎细胞因子产生一定的抑制作用,从而起到缓解症状的效果[16]。
过敏性紫癜的血管炎症主要由IgA 介导,在过敏性紫癜患儿急性发作期,肠道黏膜受损,肠道免疫屏障遭到破坏,IgA 与补体C3 结合形成复合物并沉积于毛细血管壁,进而导致生理和病理出现各种症状[17]。IgG 抗体在免疫应答中起着激活补体、中和多种毒素的作用。IgM 抗体是免疫应答中率先分泌的抗体,感染后水平陡升,一段时间后IgM 抗体量逐渐减少而消失。MDSC、Treg、Breg 等多种抑制性免疫细胞亚群可在免疫应答中发挥一定作用,其中MDSC 可通过加速降解精氨酸达到免疫抑制的作用;Breg 可通过分泌IL-10 等抗炎因子或细胞间接触等方式,对机体免疫产生抑制作用,属机体免疫的负调控因子;Treg 是以表达CD4、CD25为细胞表型特征的T 细胞亚群,可对其他细胞的免疫应答产生抑制,Treg 的缺失或者功能异常会导致自身免疫性疾病的发生[18]。本研究结果显示,研究组治疗后IgM、IgA、IgG、Treg、Breg、MDSC 均比对照组低,提示微生态制剂辅助治疗儿童腹型过敏性紫癜可有效改善免疫应答。分析原因可能与以下几点机制有关:①微生态制剂可调节肠道菌群,促进益生菌的繁殖,其中双歧杆菌是微生态制剂中常见的益生菌,可生成胆酸水解酶并与胆酸结合游离,对病原菌的生长繁殖可起到抑制作用[19]。②微生态制剂可直接补充双歧杆菌、乳酸杆菌等菌群数量,而这些优势菌群可对上皮细胞产生刺激并使其分泌黏蛋白,进而加速帕内特细胞对分泌型IgA 的分泌,对肠道局部甚至全身性免疫起到调节作用[20]。③微生态制剂可通过巨噬细胞、树突状细胞刺激激活并调节免疫反应,并可增强T细胞、B 细胞对抗原刺激的反应性,提高肠黏膜内淋巴组织活性并诱导其产生细胞因子,发挥特异性免疫作用,进而改善免疫功能[21]。
综上所述,微生态制剂辅助治疗儿童腹型过敏性紫癜的临床疗效确切,可有效纠正肠道菌群紊乱,改善患儿肠黏膜屏障功能和免疫应答,缓解临床症状。
