血管周围脂肪组织与动脉粥样硬化的关系
2022-08-09胡艳波高峰刘尚奇张慧明王敏杰
胡艳波,高峰,刘尚奇,张慧明,王敏杰
(内蒙古医科大学a.基础医学院,b.药学院,呼和浩特 010110)
动脉粥样硬化(atherosclerosis,As)是冠心病、脑梗死、外周血管病的主要原因。其主要危险因素有高血脂、高血压和大量吸烟以及糖尿病、肥胖、免疫损伤和遗传因素等。随着我国经济发展不断加快和老龄化人口的增多,As所致各种心血管疾病的发病率也随之上升,对我国人民的健康生活造成严重威胁。因此,亟须寻找防治As新的、有效的干预靶标及药物。目前,As被认为是血管内炎症性病变。而血管外环境一直被忽视。近年来,研究发现血管周围脂肪组织(perivascular adipose tissue,PVAT)与As有密切联系,其通过分泌一系列脂肪因子、细胞因子和气态分子等发挥细胞间通信和控制血管功能的作用[1],对As的发生发展产生一定作用。另一方面,PVAT中的棕色脂肪组织(brown adipose tissue,BAT)在As的防治中有一定积极作用,因此PVAT中的白色脂肪组织(white adipose tissue,WAT)向BAT转化(即WAT米色化)成为研究热点。但其影响因素较多,目前对其研究尚未成熟,还需深入研究。现就PVAT与As的关系予以综述,以为As的后续研究提供帮助。
1 PVAT的生理功能
PVAT即贴近血管外膜层的脂肪组织,主要由脂肪细胞、成纤维细胞、干细胞等构成。除脑血管外,全身各处血管周围均存在脂肪组织。它不仅具有结缔组织的机械作用,可为大多数动脉结构提供支撑作用,使其免受邻近组织的伤害[2-3],还是维持血管内稳态的重要内分泌组织。人体中脂肪组织分布广泛,与其他脂肪组织相比,PVAT具有明显的表型特征。与皮下和肾周脂肪细胞相比,PVAT细胞的分化程度低,形状不规则,体积更小[4]。在人体内,PVAT由两种类型的脂肪组织混合组成:BAT和WAT,其中BAT具有产热功能,WAT是储存多余能量的组织[5]。但在小鼠中,胸主动脉主要由BAT组成,髂内动脉由WAT和BAT组成,而腹主动脉和肠系膜动脉主要由WAT组成[6]。大鼠的脂肪分布与小鼠相似,同样BAT发挥产热和能量消耗的作用,WAT具有存储能量的作用[4]。
2 PVAT分泌因子与As的关系
PVAT分泌因子是PVAT分泌的一系列具有调节血管功能的因子,包括脂肪因子、细胞因子、气态分子等。早在20世纪90年代就有PVAT具有抗收缩功能的报道。21世纪初,又有研究者发现了PVAT能释放血管活性因子。近年来对PVAT的研究不断深入,发现PVAT产生的各种因子在As的发生发展中均发挥一定作用[7]。目前,研究较多的因子包括脂联素[8]、内脂素[9]、瘦素[10]、一氧化氮[11]、硫化氢[12]、信号转导及转录活化因子(signal transducer and activator of transcription,STAT)4[13]、肿瘤坏死因子(tumor necrosis factor,TNF)-α[2]等,各个因子在As中的作用见图1。
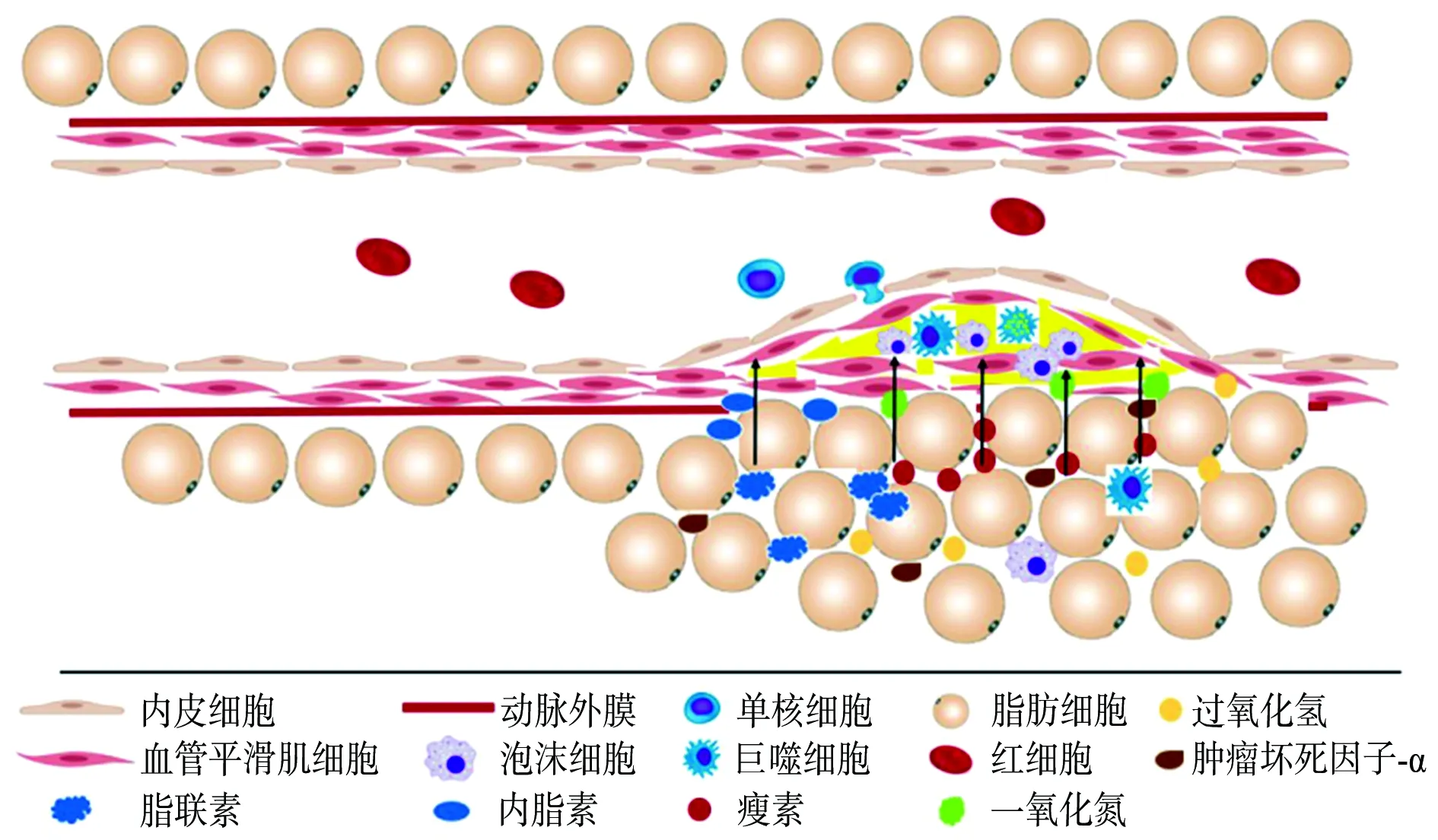
图1 血管周围脂肪组织分泌因子对动脉粥样硬化斑块的作用
2.1脂联素 脂联素是脂肪组织产生的主要脂肪因子,占血浆蛋白总量的0.01%[3]。其是一种有效的血管扩张剂,升高血浆脂联素水平可以抑制As的发展。研究发现,脂联素是通过抗炎、诱导巨噬细胞自噬、促进一氧化氮释放发挥抗As作用[8]。
Okamoto等[14]通过给予载脂蛋白E(apolipoprotein E,ApoE)基因敲除(ApoE-/-)小鼠14 d脂联素处理发现,与对照小鼠相比,ApoE-/-小鼠主动脉窦中的病变形成减少,脂滴更小,说明脂联素能通过减轻炎症抑制ApoE-/-小鼠As的发展。Li等[15]使用脂联素处理巨噬细胞发现,其减少了蛋白激酶B的磷酸化,更重要的是抑制了叉头框转录因子O3a(forkhead box O3a,FOXO3a)基因的激活,而FOXO3a基因是巨噬细胞自噬的关键调节因子,所以PVAT分泌的脂联素可以通过蛋白激酶B/FOXO3a信号通路增加巨噬细胞的自噬,从而抑制高脂饮食喂养小鼠颈动脉周围As病变的形成[16]。另有研究表明,脂联素通过旁分泌机制刺激邻近脂肪细胞释放一氧化氮,抑制白细胞-内皮细胞的相互作用,在As早期发挥作用[17]。
2.2内脂素 内脂素是一种脂肪因子,也被称为前B细胞克隆增强因子。作为一种新的脂肪因子,它主要在内脏脂肪中表达和分泌。在肥胖患者中,内脂素在体循环和局部PVAT中表达增加[9]。大鼠胸主动脉PVAT中的内脂素表达量高于皮下脂肪组织和内脏脂肪组织,分别是其表达量的3.7倍和1.8倍[18]。此外,在PVAT培养基中检测到内脂素,表明PVAT也会产生内脂素。有文献报道,在血管平滑肌细胞中内脂素通过诱导核因子κB的表达调节蛋白激酶,以持续激活促进炎症反应[19]。同时,内脂素还会促进血管平滑肌细胞增殖,而血管平滑肌细胞的增殖和炎症与As斑块的发生、发展和破裂密切相关。但在定义内脂素在As中的潜在作用时,应考虑到它是一种多功能蛋白。巨噬细胞、血管平滑肌细胞和内皮细胞的功能障碍或死亡被认为是As发生和发展的关键过程,而内脂素能促进巨噬细胞、血管平滑肌细胞和内皮细胞的存活,提示内脂素在这些细胞中具有保护作用。因此,内脂素在As中的作用还有待进一步研究验证。
2.3瘦素 瘦素由肥胖基因编码合成,是一种重要的能源稳态调节剂[10],也是近年研究较多的脂肪因子。研究发现,瘦素可促进As的发展[20]。瘦素能刺激炎症反应、氧化应激、血栓形成等,从而促进As发展、内皮功能障碍和动脉僵硬等[21]。Singh等[10]研究发现,瘦素可上调小窝蛋白-1的表达,而小窝蛋白-1表达增加会损害瘦蛋白信号转导,从而使其在As的发生发展中起促进作用。另有实验证明,PVAT衍生的瘦素通过蛋白激酶C途径加重冠状动脉内皮功能障碍[22]。瘦素还可以通过促进单核细胞的募集,引起炎症因子和致As细胞因子的分泌,促使募集的单核细胞(单核细胞进入血管壁后分化为巨噬细胞)吞噬氧化型低密度脂蛋白形成泡沫化巨噬细胞,进而引发As[23]。上述一系列研究表明,瘦素在As中发挥促进作用。
2.4一氧化氮 一氧化氮是一种内皮源性舒张因子,对血管内侧壁功能和神经递质释放具有调节作用[11]。一氧化氮是目前所知的最强的血管舒张因子之一,体内多种细胞均可产生一氧化氮。Virdis等[24]通过去除健康个体的PVAT发现,小动脉的一氧化氮生成减少,舒张血管能力减弱;深入研究发现,PVAT来源的一氧化氮可能通过刺激环鸟苷酸合成、扩散至邻近平滑肌细胞来诱导血管舒张。另有研究表明,近年发现的脂肪细胞因子C1q/TNF相关蛋白9通过激活AMP活化的蛋白激酶(AMP-activated protein kinase,AMPK)促进一氧化氮合酶的磷酸化和一氧化氮的合成,保护内皮细胞,诱导血管舒张[25]。
2.5STAT4 STAT是一种能与DNA结合的蛋白质家族。而STAT4是STAT家族中一种在脂肪细胞和免疫细胞中表达的转录因子。在ApoE-/-小鼠中,敲除STAT4基因可减少主动脉周围脂肪组织和内脏脂肪组织中免疫细胞的浸润,促使巨噬细胞向M1促炎亚型极化,增加饮食诱导的As形成的风险[13]。许莉莉等[26]通过高脂饮食喂养ApoE基因与STAT4基因双敲除小鼠发现,与ApoE-/-组相比,STAT4基因双敲除组通过抑制磷脂酰肌醇-3-激酶/蛋白激酶B通路和上调酰基辅酶A-胆固醇酰基转移酶表达,增加M1型巨噬细胞分化,促进泡沫细胞形成,促进小鼠As斑块形成。
2.6TNF-α TNF-α是一种重要的脂肪因子,于1993年首次在啮齿动物的脂肪组织中被发现,可在肥胖动物模型中被显著诱导(基因和蛋白水平)[27]。TNF-α还可以诱导脂肪细胞中的其他炎症因子分泌,使脂肪组织中炎症因子分泌失衡,促进As的发展[28]。研究发现,在小鼠股动脉损伤模型中,血管内皮损伤显著上调PVAT内的炎症脂肪因子(单核细胞趋化蛋白1、TNF-α、白细胞介素-6和纤溶酶原激活物抑制物1)和下调抗炎症脂肪因子的表达[5,23]。当敲除小鼠的TNF-α基因后,PVAT中的炎症脂肪因子表达和血管损伤后的内膜增生减少[12]。可见,TNF-α促进了炎症和As的发生发展。
2.7硫化氢 硫化氢是目前已检测到的PVAT衍生的舒张因子,具有强大的抗氧化和抗炎作用[12],其能通过靶向血管壁的内皮细胞和血管平滑肌细胞诱导血管扩张,改善内皮功能,发挥抗As作用[27]。大鼠主动脉PVAT通过表达胱类酶(硫化氢产生的关键酶)释放硫化氢[28],抑制血管平滑肌细胞增殖和体外诱导的血管平滑肌细胞凋亡。内源性硫化氢还可以防止血管损伤后的As和新内膜增生[19]。在肥胖动物中,PVAT衍生的一氧化氮、硫化氢和脂联素减少,PVAT中脂肪细胞的肥大可促进内皮功能障碍[17]。然而,PVAT衍生的硫化氢与As发展的具体关系尚不清楚,有待进一步研究。
2.8其他 除上述PVAT分泌的脂肪因子外,还有一些PVAT分泌相关因子,它们可能是PVAT衍生的生长因子或抑制剂,但目前对As影响不明确的因子的研究较少,包括单核细胞趋化蛋白1、白细胞介素家族、抵抗素和巨噬细胞迁移抑制因子。目前的研究表明,它们与As的发生发展均有一定关联[19],但其发挥作用的具体机制还有待进一步研究。
3 PVAT炎症与As的关系
炎症是As发病的关键因素。其中,白细胞募集和炎症因子在As形成的早期阶段起关键作用[29]。特别是PVAT衍生的趋化因子诱导单核巨噬细胞和T细胞募集会产生额外的趋化因子,以正反馈机制增强炎症细胞的浸润[12,30]。近年越来越多的研究表明,PVAT可作为冠状动脉炎症的传感器促进As的发展[6,18,25]。在正常的动态平衡下,PVAT分泌的抗炎因子占主导地位,炎症因子分泌相对较少。PVAT功能障碍时,血管保护性脂肪细胞因子的产生减少,旁分泌炎症因子增加[31],如在肥胖小鼠体内,死亡的脂肪细胞释放出细胞DNA并招募免疫细胞,从而可能在脂肪组织中触发慢性炎症[32]。
肥胖主要由能量摄入和消耗的失衡引起,是代谢紊乱的危险因素[33]。肥胖会导致PVAT发生慢性全身性炎症反应,减少抗炎脂肪因子产生,并加剧细胞功能障碍、血管氧化应激和炎症[34],显著改变PVAT中炎症因子和趋化因子的分泌平衡,使其失去抗收缩作用,增加As的发生风险[35]。肥胖患者的C反应蛋白水平显著升高,其可以通过激活PVAT的炎症反应诱发动脉内皮功能障碍[36]。肥胖还会通过增加氧化应激、脂肪组织内缺氧等导致PVAT释放脂肪因子功能失调,从而导致PVAT抗收缩作用减弱甚至丧失[14]。在健康的条件下,WAT通过储存脂质起到脂质汇总的作用,防止脂质在循环中积累。但在肥胖期间,WAT的扩张会导致炎症、纤维化、缺氧、脂肪因子分泌失调等,致使WAT的功能失调,从而使脂肪因子分泌紊乱,促进As的形成[37-38]。同时,WAT还会导致基础脂解率升高,从而增加脂肪酸的释放,脂肪酸可以激活Toll样受体(Toll-like receptor,TLR)2和TLR4,而TLR2和TLR4可以激活巨噬细胞中的核因子κB,增加脂肪组织炎症,并导致组织和器官功能障碍[39]。因此,肥胖会引起PVAT中巨噬细胞浸润,巨噬细胞浸润是经典的巨噬细胞向M1型极化的特征,而脂肪组织中的常驻巨噬细胞是交替活化的M1型巨噬细胞。巨噬细胞包括两种基本功能表型,即经典激活的M1型促炎巨噬细胞和交替激活的M2型抗炎巨噬细胞。其中,M2型巨噬细胞通过抑制炎症和促进组织重塑来消除病变。M1型巨噬细胞则促进炎症的发生发展[40]。这些均是肥胖与心血管疾病相关的重要机制,不利于As的控制与治疗。
4 WAT米色化与As的关系
PVAT作为分泌器官,具有直接影响血管功能、结构和收缩性的能力[41]。PVAT主要由WAT、米色脂肪组织和BAT 3种脂肪组织组成。其中,WAT是储能脂肪,是成人脂肪组织的主要组成部分,主要位于皮下和内脏器官周围。WAT细胞是单房细胞,含有较大的脂滴和较少的线粒体[42]。米色脂肪组织,也称灰褐色脂肪组织,主要散布在白色脂肪库中。这些米色脂肪细胞在基础状态下类似于白色脂肪细胞[22],但在寒冷暴露或药物刺激下可以获得类似BAT的表型,有产热功能。BAT是多房细胞,脂滴较小,线粒体含量较高,其中解偶联蛋白1(uncoupling protein 1,UCP1)含量较高[43]。UCP1是产热过程中一个非常重要的调节因子,其促使葡萄糖和脂肪酸分解产生的能量不能转化为ATP(为生物体直接供能的物质),只能转化为热能[7]。同时,BAT还能介导三酰甘油的清除,被认为是三酰甘油代谢的关键分子。此外,BAT的激活还可以降低胆固醇水平,可能成为As的一个新的治疗靶点[42]。为了证明BAT在As中的作用,有学者进行了小鼠BAT萎缩实验,结果发现,BAT严重萎缩能加速As的进程,其特征是脂质储备显著增加,As的覆盖率、病变范围和复杂性、巨噬细胞浸润以及炎性标志物的表达均增加[44-45]。另有研究表明,BAT活化可通过肝组织增加血浆脂蛋白的代谢并加速清除其残留物,从而减少高胆固醇血症并防止As的发展[22]。
WAT米色化已成为As研究的热点。多项实验均表明,AMPK在此过程中起关键作用[6,39,46-47]。AMPK的激活和随后棕色脂肪细胞标记基因表达的增加表明,AMPK有诱导WAT米色化的作用。AMPK广泛表达于各种代谢器官,在调节能量代谢中起关键作用,不仅有助于能量代谢稳态,还能抑制炎症反应[39]。近年来,对于AMPK研究较多,学者发现AMPK在激活BAT和WAT米色化中均发挥关键作用[6],并发现许多药物均可以激活AMPK。如全反式视黄酸[6]、白藜芦醇、二甲双胍、A7669662、IMM-H007[46-47]通过激活AMPK抑制炎症、诱导WAT米色化,进而减轻As。过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR)介导米色化脂肪细胞出现的潜在机制包括线粒体数量的增加和功能增强以及BAT特异性基因UCP1、肉碱棕榈酰转移酶Ⅰ的上调[43]。PPARα是PPAR家族中的一员,在调节脂质稳态和氧化代谢中起关键作用。PPARα激活会导致UCP1等棕色脂肪标志物的表达增加[48]。铁硫域含蛋白1是一种线粒体外膜蛋白,可调节氧化能力和脂肪组织褐变。研究发现,与WAT相比,铁硫域含蛋白1在米色的PVAT和BAT中高表达[49]。另有研究显示,冷暴露可显著增加PVAT和BAT中铁硫域含蛋白1的表达,表明铁硫域含蛋白1的表达与BAT细胞的产热作用直接相关[50]。
综上可知,米色脂肪及WAT米色化是现阶段研究As的一个潜在靶标。目前,AMPK、PPARα、铁硫域含蛋白1等均是促进WAT米色化的潜在研究对象。
5 小 结
As的发病率、致残率和致死率均较高,应引起重视。尤其在现阶段,我国人口老龄化加剧,而As在老年人中的发病率较高。因此,As的预防与治疗成为一个亟待解决的问题。但目前As的发病机制尚不明确。随着研究人员对As研究的不断深入,多层面、多角度、多学科交叉使得研究的新切入点不断涌现,PVAT为从血管外途径治疗As提供了潜在的干预靶点。PVAT通过分泌脂联素、内脂素、一氧化氮等细胞因子减轻炎症、舒张血管减轻As。但在病理状态下(如肥胖)PVAT的分泌功能失衡,致使促炎因子、收缩因子所占比例增加,不利于As的治疗。另一方面,PVAT中的BAT在抗As中发挥积极作用,而米色脂肪在寒冷等刺激下可以发挥BAT的产热功能。目前能促进米色脂肪出现的靶点包括AMPK、PPAR家族等。综上所述,PVAT在As病理发生发展的过程中发挥一定的作用,为As的防治提供血管外的干预靶点,可能成为血管外防治As的一个潜在靶标。
