非标记定量蛋白质组学技术探讨不同透析龄患者腹膜透析流出液外泌体差异蛋白的研究
2022-08-09武云慧黄抱娣茅春霞李归雁邢昌赢
武云慧,黄抱娣,茅春霞,李归雁,邢昌赢,张 莉*
1南京医科大学第一附属医院肾内科,2营养科,江苏 南京 210029
腹膜透析(peritoneal dialysis,PD)是终末期肾脏病患者广泛使用的肾脏替代治疗方式之一,PD的全球年增长率约为8%,已高于血液透析的增长率(约6%~7%)[1]。随着透析时间的延长,腹膜结构和功能受损,限制了治疗并导致患者的不良结局。相关机制尚不明确,其中人腹膜间皮细胞的上皮⁃间充质转化(epithelial⁃mesenchymal transition,EMT)被认为是核心环节,EMT是上皮特征的逐步丢失和肌成纤维细胞样表型的获得[2]。腹膜活检仍然是识别腹膜病理改变的金标准,由于不易重复检查,并且存在创伤风险,在临床上难以推广。因此,寻找早期识别腹膜损伤的无创性生物标志物,指导个性化干预,能够延长患者的PD时间。
外泌体是一类直径为30~150 nm 的细胞外囊泡,可由多种细胞分泌,包裹着蛋白质、脂质、DNA和RNA 等物质,介导细胞间的信号转导,这些物质几乎参与了所有的生理和病理过程,可作为液体活检的重要标志物进行疾病诊断与治疗[3-4]。虽然研究证明腹膜透析流出液(peritoneal dialysis effluent,PDE)中存在外泌体[5],但对PDE来源外泌体所携带的蛋白质研究却少有报道。最新研究表明,PDE 中通过外泌体释放的水通道蛋白1 与腹膜超滤效率相关,可能是评估腹膜完整性的一种潜在生物标志物[6]。本研究通过非标记定量蛋白质组学技术对不同透析龄患者PDE 外泌体蛋白进行鉴定和定量分析,筛选差异蛋白,通过生物信息学分析差异蛋白功能及生物学过程,寻找腹膜损伤的生物标志物及探讨发病机制提供了参考依据。
1 对象和方法
1.1 对象
选取2020 年5—7 月于南京医科大学第一附属医院腹膜透析中心行稳定PD 治疗并规律随访的患者。透析方案为持续性非卧床腹膜透析(continu⁃ous ambulatory peritoneal dialysis,CAPD)或日间非卧床腹膜透析(daytime ambulatory peritoneal dialysis,DAPD)。排除标准:①年龄<18 岁或>80 岁;②PD<1个月;③恶性肿瘤或严重创伤患者;④自身免疫性疾病患者;⑤有肝炎、肝纤维化或结核病史患者;⑥1 个月内发生过腹膜炎症或其他严重感染患者。根据透析龄分为两组:初始腹透组(newly enrolled pa⁃tients group,NEP组)(1个月≤透析龄≤2个月);维持腹透组(maintenance peritoneal dialysis patients group,MPD组)(24个月≤透析龄≤28个月)。最后,纳入NEP组和MPD组各5例患者,收集这些患者的一般临床资料。本研究经医院伦理委员会批准(审批文号:2020⁃SR⁃294),并获得患者的知情同意。
SDS(上海生工),尿素(Bio⁃Rad 公司,美国),Tris(上海生工),HCl(北京国药),BCA 定量试剂盒(上海碧云天),30 kDa 超滤离心管(Sartorius 公司,德国),IAA(Sigma 公司,美国),胰蛋白酶(Promega公司,美国),Anti⁃CD63 抗体(Ab216130)、Anti⁃TSG101 抗体(Ab125011)(Abcam 公司,美国),辣根过氧化物酶标记山羊抗兔IgG(A0208,上海碧云天),C18Cartridge(Waters 公司,美国),低速离心机(湖南Cence TDZ5⁃WS),超速离心机(Himac CP80WX,德国),透射电子显微镜(FEI,Tecnai G2 Spirit,美国),纳米颗粒跟踪分析仪(Particle Metrix,ZetaView PMX 110,德国),电泳系统(Bio⁃Rad 公司,美国),Multiskcan FC 酶标仪、高效液相色谱仪(EASY⁃nLC System,美国)、质谱系统(Q⁃Exactive,Thermo Fisher Scientific公司,美国)。
1.2 方法
1.2.1 外泌体的分离
收集每例患者行腹膜平衡试验前1 d 100 mL留腹过夜的PDE,放入4 ℃预冷离心机,于300g离心10 min、2 000g离心10 min 去除死细胞后,取上清液转移至超速离心机配套的离心管中,在4 ℃下10 000g离心30 min 去除细胞碎片,100 000g离心70 min,取透明沉淀,并分别用磷酸盐缓冲液(phos⁃phate buffer solution,PBS)1 055、1 015、1 015 μL 重悬,-80 ℃保存以备下一步检测。
1.2.2 外泌体的鉴定
取15 μL样品在电镜测试的铜网上室温下静置1 min,滤纸吸去浮液,加入15 μL 2%醋酸双氧铀染色1 min,沉淀后吸去残液,白炽灯下烤10 min,TEM观察样本中有形物体的形态和大小;取2 μL样品置于新的离心管中,用PBS 稀释至1 mL,混匀后缓慢注入纳米颗粒跟踪分析仪中,进行粒径和浓度分析;免疫印迹法检测外泌体标志蛋白CD63 和TSG101,根据检测出的蛋白浓度,将样品原液稀释至所需的上样量,SDS⁃PAGE 电泳,转PVDF 膜。用5%脱脂牛奶室温摇床封闭1 h,分别加入单克隆抗体CD63、TSG101(均按照1∶1 500稀释),4 ℃摇床孵育1 h,TBST清洗,再分别加入山羊抗兔IgG二抗(均按照1∶5 000 稀释),室温下摇床孵育1 h,TBST 清洗,加入ECL发光液显影后采集图像。
1.2.3 蛋白的提取和酶解
取样品加入适量SDT裂解液(4%SDS,100 mmol/L Tris⁃HCl),沸水浴15 min 后,14 000g离心15 min,提取上清液中的蛋白。BCA 法测定蛋白质浓度。各样品取20 μg,行SDS⁃PAGE 电泳,考马斯亮蓝染色。蛋白样品取80 μg,分别加入50 mmol/L DTT还原,沸水浴5 min,用200 μL UA(8 mmol/L 尿素,150 mmol/L Tris⁃HCl)混匀,通过重复超滤除去洗涤剂、DTT 和其他低分子量组分。再加入100 μL IAA避光反应30 min,依次用100 μL UA、25 mmol/L NH4HCO3清洗过滤器。加入40 μL 胰蛋白酶,37 ℃放置16 h,离心收集酶解上清液。采用C18Cartridge对肽段进行脱盐,真空冻干,-20 ℃保存。
1.2.4 质谱数据采集
在与Easy⁃nLC 系统偶联的Q⁃Exactive 质谱仪上,采集液相色谱⁃串联质谱(LC⁃MS/MS)数据。配制流动相A 液(100%水、0.1%甲酸)和B 液(80%乙腈、0.1%甲酸)。色谱柱以100%的A液平衡,取2 μg样品进样,液质检测,液相色谱洗脱条件(表1)。使用Q⁃Exactive质谱仪,检测方式为正离子,质谱采用数据依赖型采集模式,全扫描范围为350~1 800 m/z,一级质谱分辨率设为70 000,C⁃trap 最大容量为3×106,最大注入时间为50 ms,每次全扫描后采集10个碎片图谱;二级质谱检测中,分辨率设为17 500,AGC target 为2×105,最大注入时间为45 ms,碎裂碰撞能量设为27%,生成质谱检测原始数据。

表1 液相色谱洗脱条件Table 1 Liquid chromatography elution conditions
1.2.5 蛋白的鉴定和定量分析
MaxQuant 是基于质谱的蛋白质组学数据分析最常用的平台之一,集成了多种算法用于高分辨率的定量质谱数据集[7]。Uniprot是目前国际上有关蛋白质信息最全面的非冗余数据库,具有丰富蛋白质序列和注释数据资源[8]。本研究产生的质谱原始文件导入MaxQuant软件(版本号1.6.14.0)进行处理,并通过数据库Uniprot_HomoSapiens_20367_20200226 检索鉴定,所得文件采用Perseus 1.3 软件以差异倍数>2或<0.5且P<0.05为标准筛选差异蛋白。
1.2.6 生物信息学分析
Blast2GO 数据库对筛选出的差异表达蛋白进行基因本体论(gene ontology,GO)功能富集;京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库软件进行通路分析。STRING和Cytoscape工具分析蛋白互作网络。
1.3 统计学方法
采用SPSS 26软件进行数据分析。正态分布的计量资料以均值±标准差()表示,两组间差异比较用t检验;非正态分布的计量资料以中位数(四分位数)[M(P25,P75)]表示,两组间比较用Mann⁃WhitneyU检验;计数资料组间比较采用Fisher精确概率检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料比较
本研究共纳入10 例PD 患者,NEP 组和MPD 组男女比均为3/2,两组患者在透析龄方面差异有统计学意义(P<0.05),在年龄、高血压、糖尿病、透析方案、腹膜平衡试验(peritoneal equilibration test,PET)值、估计肾小球滤过率(estimated glomerular filtration rate,eGFR)、尿素清除指数(urea clearance index,Kt/V)方面差异无统计学意义(P均>0.05,表2)。

表2 不同透析龄患者一般临床资料比较Table 2 Comparison of general clinical data of patients with different dialysis ages
2.2 PDE外泌体的鉴定
电镜下观察到茶托状的双层膜包裹的圆形囊泡,NTA对囊泡的粒径分析结果显示,大多数囊泡直径分布在30~150 nm,免疫印迹结果显示利用超速离心得到的细胞外囊泡存在外泌体的标志蛋白CD63 和TSG101。证明从PDE中提取到外泌体(图1)。
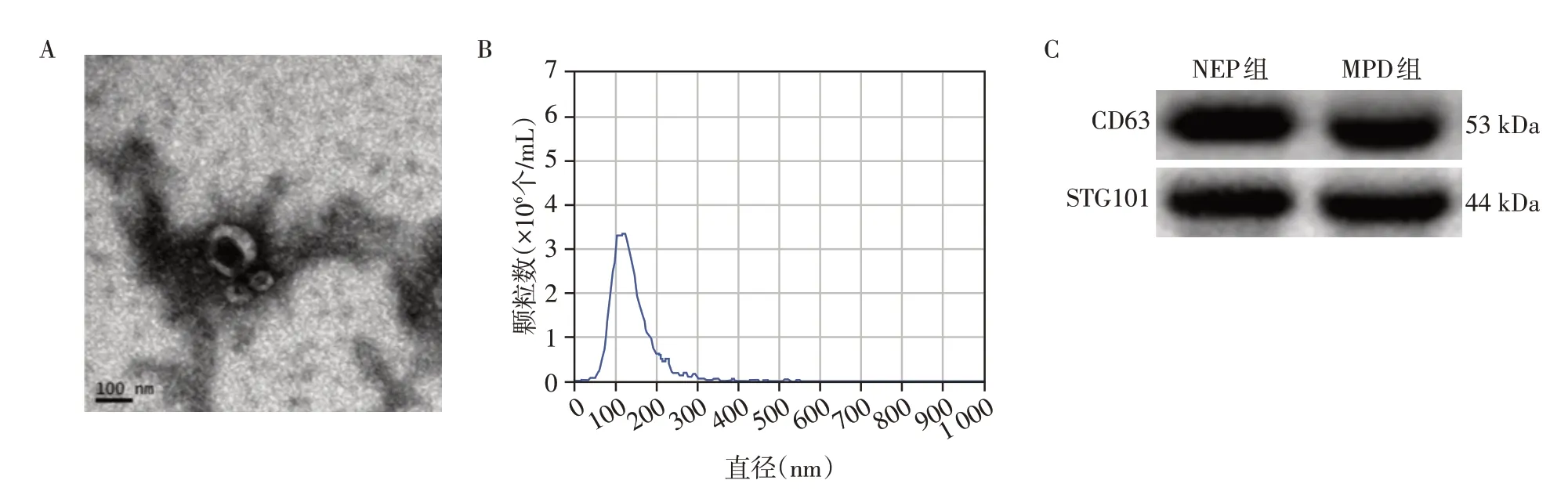
图1 腹透流出液中外泌体鉴定Figure 1 Identification of exosomes in peritoneal dialysis effluent
2.3 蛋白鉴定和定量分析结果
根据色谱分析及数据库比对,共鉴定出499 种蛋白。通过定量分析,共筛选出32 种差异表达蛋白,较NEP 组相比,17 种蛋白在MPD 组表达上调(表3),15种蛋白在MPD组表达下调(表4)。

表3 MPD组/NEP组上调差异蛋白Table 3 MPD group/NEP group up⁃regulated differential protein
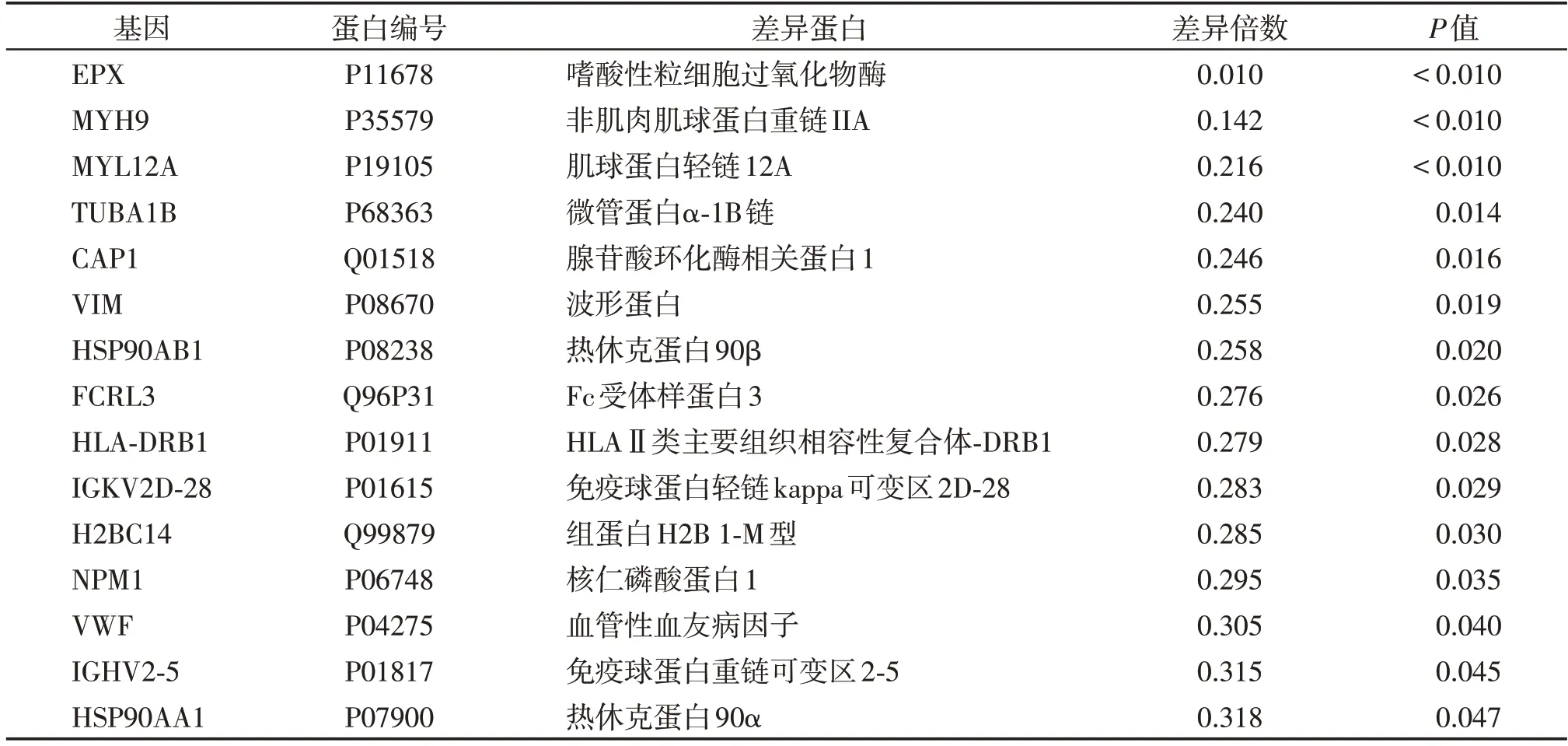
表4 MPD组/NEP组下调差异蛋白Table 4 MPD group/NEP group down⁃regulated differential protein
2.4 生物信息学分析结果
2.4.1 差异蛋白GO功能的富集分析
对差异蛋白进行GO 功能分析,结果显示主要参与对结合的正向调控、氧化应激反应、过氧化物酶反应、离子转运、胱甘肽结合反应等重要的生物学过程,分子功能则以结合与催化活性为主,如双链RNA 结合、谷胱甘肽转移酶活性、电压门控离子通道活性、氯离子通道活性等,同时还与氯离子通道复合物、细胞膜、细胞核基质区域、肌浆网、肌球蛋白复合物等细胞组分密切相关(图2)。
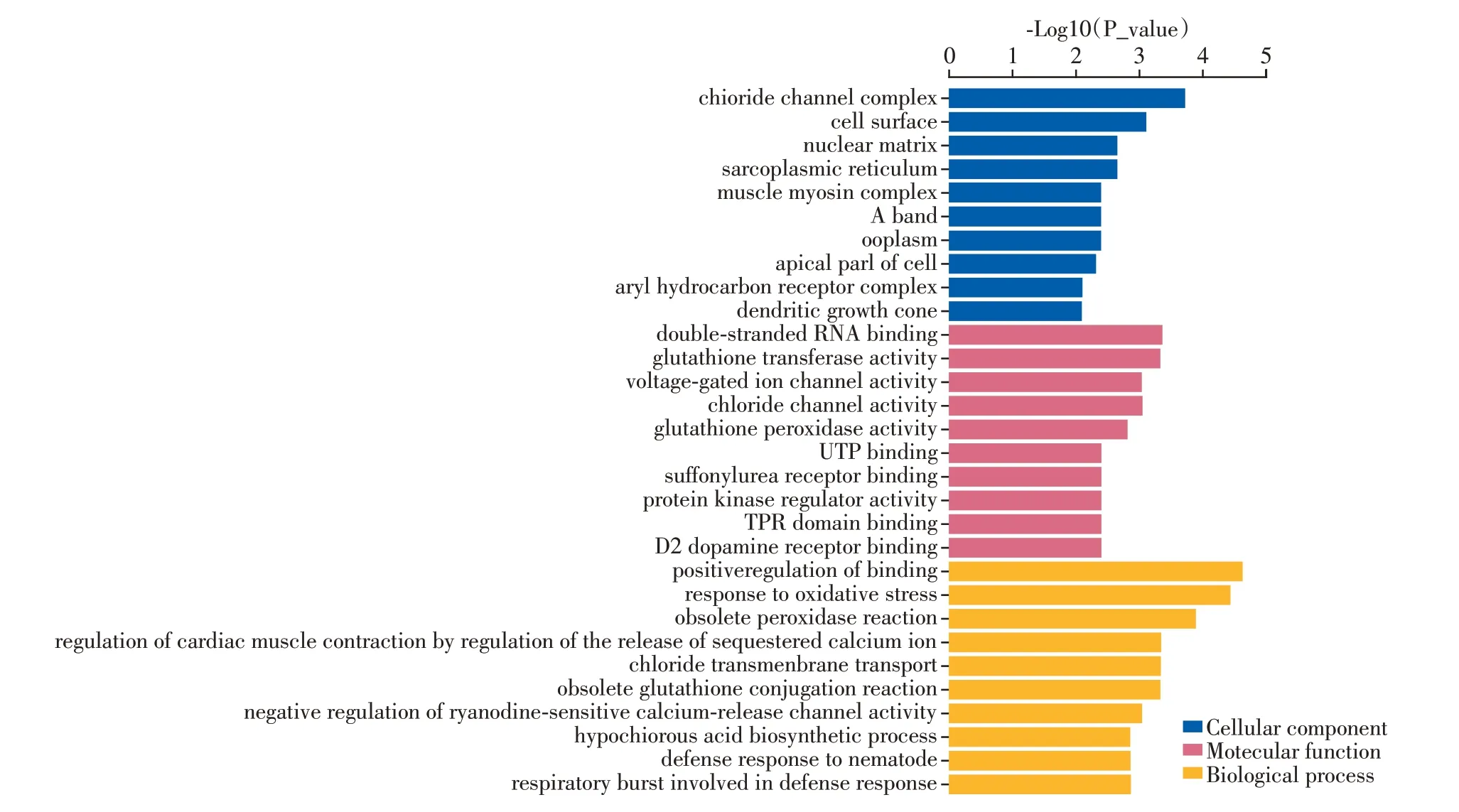
图2 GO功能富集分析Figure 2 GO function enrichment analysis
2.4.2 KEGG通路富集及差异蛋白互作分析
将组间PDE 外泌体差异蛋白进行互作网络分析(图3)。结果表明,鉴定到的PDE外泌体中有23个差异蛋白参与复杂调控网络,提示具有较好的生物学关联。KEGG 通路分析表明,共发现8 个有统计学意义的代谢通路,分别是IL⁃17信号通路、Th17细胞分化通路、吞噬体通路、植物⁃病原体相互作用、孕激素介导的卵母细胞成熟、前列腺癌、沙门氏菌感染、抗原处理和递呈相关通路,差异蛋白在吞噬体通路富集的蛋白数目最多(图4)。

图3 蛋白互作网络分析Figure 3 Protein interaction network analysis

图4 KEGG信号通路富集分析Figure 4 KEGG pathway enrichment analysis
3 讨论
PDE 代表了一种特别有吸引力的非侵入性临床样本,在透析液中浸泡的腹膜组织能够分泌或脱落一些物质,这些流出物有助于监测腹膜状态,更好地了解腹膜环境信息[5]。蛋白质是细胞和生物体功能的直接执行者,蛋白质组学近年来得到了飞跃发展,对生命科学领域方面的探索具有重要意义。本研究所使用的非标记技术优势在于不需核素标记,方法简便,可对多个临床样本分析,并提供了大量蛋白丰度的差别信息,已逐渐成为重要的蛋白质组学定量分析方法[9]。
PDE 中含有大量血浆蛋白,如白蛋白和免疫球蛋白,这可能掩盖了其他丰度较低但相关性较高的蛋白,如细胞因子和趋化因子,干扰了质谱鉴定[10]。外泌体是细胞间信息交流、物质传递的载体,既携带起源细胞内成分,又排除了高丰度杂质蛋白的干扰,为寻找特异性标志物提供了新思路。本研究通过对初始腹透组与维持腹透组的PDE 外泌体进行蛋白质组学比较,共筛选出17 种上调蛋白和15 种下调蛋白。通过查阅文献发现,若能及早监测到PDE 外泌体携带蛋白质的改变,这些信息将有可能帮助监测腹膜损伤,维持腹膜的最佳功能。
细胞内氯离子通道(chloride intracellular chan⁃nel,CLIC)蛋白家族是由6个进化保守的蛋白组成:CLIC1~6,以可溶性和膜结合性两种状态存在,并已被证明在细胞运动调节[11]、细胞凋亡[12]及小管生成[13]等多种过程中发挥重要作用。研究表明,CLIC 在线粒体损伤产生的活性氧诱导下能够迁移到细胞膜上,介导胞内氯离子外流,促进NLRP3 炎症小体组装、Caspase⁃1激活和IL⁃1β分泌[14]。此外,还有研究发现CLIC1-/-小鼠的腹腔巨噬细胞表现出吞噬体酸化缺陷、蛋白水解能力受损和活性氧产生减少[15]。本研究外泌体中携带的CLIC蛋白可能参与了腹膜改变中的慢性炎症反应,并且因PD 时间延长而表现为上调,通过调节CLIC活性可考虑作为开发抗炎药物的合适靶点。
嗜酸性粒细胞过氧化物酶(eosinophil peroxi⁃dase,EPX)和髓过氧化物酶(myeloperoxidase,MPO)是由炎症部位活化的免疫细胞所释放的含血红素的酶,除参与对病原微生物的氧化防御机制外,在刺激成纤维细胞迁移、血管生成和促进细胞外基质合成中也发挥着重要作用[16-17]。研究发现,由烟曲霉菌引起的肺曲霉菌病中,除中性粒细胞外,嗜酸性粒细胞缺乏会影响肺部对烟曲霉菌的防御。正常小鼠烟曲霉菌暴露后激发诱导CD11b+SinglecF+Ly⁃6GloLy⁃6CnegCCR3+嗜酸性粒细胞募集在肺部,伴随EPX mRNA 水平的升高。转录因子dblGATA1 缺乏的小鼠则显示嗜酸性粒细胞的选择性缺乏,表现烟曲霉菌清除受损和肺内病变[18]。随着透析时间的延长,PD 导管及透析液的长期刺激,机体免疫状态发生改变,本研究EPX在PDE外泌体中表达明显下降,可能与腹膜损伤加重有关。另有研究报道,结直肠癌干细胞信号活跃(Snail+IL8+)的大肠癌患者肿瘤中MPO+中性粒细胞浸润增加,提示中性粒细胞参与介导EMT和结直肠癌干细胞小生境,预示着患者生存不良[19]。在PD患者PDE外泌体中MPO的升高可能与上皮⁃间质稳态失衡相关。针对异常早期嗜酸性粒细胞和中性粒细胞激活策略可能被开发用于对抗腹膜损伤。
非肌肉肌球蛋白重链ⅡA(myosin⁃9,MYH9)属于肌球蛋白超家族,参与肌动蛋白纤维运动、骨架重组、细胞⁃细胞间黏附和蛋白转运等过程[20]。研究发现,干扰MYH9 可影响脂多糖刺激小胶质细胞释放外泌体。脂多糖可通过增加外泌体浓度,提高CD9和CD81蛋白阳性标记率和表达率,从而增强小胶质细胞的外泌体释放,将MYH9 siRNA 转染后会降低释放的外泌体浓度和粒径[21]。MYH9 在长期PD患者PDE外泌体中表达异常,可能是介导外泌体释放所需的潜在靶点。
热休克蛋白90(heat shock protein 90,HSP90)是一类三磷酸腺苷(adenosine triphosphate,ATP)依赖的分子伴侣,促进蛋白质折叠,参与蛋白质稳态和肿瘤发展等过程[22]。研究表明,转移性口腔癌来源的细胞外囊泡富集HSP90α、HSP90β和癌症起始细胞标志物CD326/EpCAM,显著促进了口腔癌细胞的迁移、侵袭和体外肿瘤起始,靶向这些分子的三重siRNA 显著降低了分子伴侣的水平并减弱了EMT,逆转了细胞外囊泡驱动的恶性肿瘤事件[23]。本研究发现,HSP90α、HSP90β在PD 患者PDE 外泌体中出现的差异性表达,可能与机体参与应激反应相关,是否能对腹膜改变进行判断和评估尚需要做进一步研究。
锌结合α2⁃糖蛋白(zinc⁃alpha⁃2⁃glycoprotein,AZGP1)是由脂肪细胞和上皮细胞合成的一种糖蛋白,在参与脂肪分解和能量消耗中有重要影响[24]。研究发现,AZGP1在非结核分枝杆菌肺病的乳腺癌患者的血清外泌体中明显表达,可能通过调节免疫功能和触发脂解增强易感性,有利于对疾病的风险评估和监测[25]。这一发现与本研究PDE 外泌体中AZGP1表达上调趋势一致,其水平可能与脂质代谢相关,需进一步验证。
中性粒细胞明胶酶相关脂质运载蛋白(neutro⁃phil gelatinase⁃associated lipocalin,LCN2)是一种急性时相反应蛋白,属于lipocalin超家族,在急性肾损伤中可能提供了对感染的必要保护[26]。既往研究报道,LCN2 在炎症状态和肾小管上皮细胞损伤时表达增加,被认为是预测肾小管损伤的新型生物标志物,与急性肾损伤、糖尿病肾病等多种肾脏疾病密切相关[27-28]。本研究结果发现,LCN2 蛋白在PD患者PDE 外泌体中表达升高,长期PD 引起过多炎症介质释放,造成腹膜间皮细胞损伤,进而影响腹膜功能,LCN2的升高可能与机体保护作用有关。
本研究在吞噬体通路富集的蛋白数目最多,吞噬过程作为重要的天然免疫防护机制,对维持机体稳态至关重要。从吞噬体产生,经过与溶酶体融合、酸化等一系列变化,最终降解抗原或杀死病原微生物的过程称为吞噬体成熟[29]。该成熟过程涉及蛋白质组成的变化,蛋白质组学已经成为吞噬体成熟研究的重要工具[30]。已有研究发现,在强直性脊柱炎病变髋关节的蛋白质组中,MPO被认为是参与吞噬体通路的关键蛋白,体外实验也进一步证实了上调的MPO 可能通过吞噬体通路促进成纤维细胞的炎症反应[31]。
通过比较不同透析龄患者PDE 外泌体差异蛋白,发现与IL⁃17 信号通路、Th17 细胞分化通路、吞噬体通路等密切相关,Th17 细胞介导的炎症反应,特别是细胞因子IL⁃17,已经被证明在腹膜损伤中起着关键作用[32]。PDE 外泌体中两个阶段差异蛋白的观察可能为PD相关腹膜损伤提供新的数据。PD是将腹膜透析液导入到患者腹腔中进行物质交换的人为操作技术,考虑其高渗、高糖和低pH等外源性因素刺激腹膜组织占主导作用,本研究共收集单中心一段时间内就诊的10 例PD 患者,年龄不匹配所出现的差异可能与初始腹透组患者整体年龄偏低,维持腹透组因腹透时间长而出现整体年龄偏高相关。本研究存在不足之处,包括样本量小,及其观察性和横断面性质,后续可通过扩大样本量来改进,使得年龄差异更小,并进一步探讨不同年龄段PDE 中外泌体蛋白的差异和评估其用于临床监测的实用性。综上所述,本研究发现的差异蛋白可能作为PD 患者腹膜损伤的候选标志物,也为揭示腹膜纤维化分子生物学机制提供线索。
