双功能菌群在金属矿区黄药、镉复合污染土壤修复中的应用
2022-08-08秦康佳董颖博侯学文唐亚鲁
林 海 秦康佳 董颖博,3 李 冰 侯学文 唐亚鲁
(1.北京科技大学能源与环境工程学院,北京 100083;2.工业典型污染物资源化处理北京市重点实验室,北京 100083;3.矿物加工科学与技术国家重点实验室,北京102628)
采矿和选矿活动对矿区周边土壤产生有机和无 机复合污染[1]。《全国土壤污染状况调查公报(2014)》显示,矿区超过33.4%的土壤受到过度污染。随着矿产资源的枯竭,贫、细、杂的难选矿已成为主矿源。该类矿石常采用浮选法进行提纯,不可避免地导致大量浮选药剂残留。而丁基黄药作为常见的金属硫化矿石捕收剂,对水生动物和土壤微生物活性具有显著的毒性作用[2]。同时,丁基黄药与重金属Cd之间的相互作用会急剧增加生物毒性,改变重金属和丁基黄药在环境中的迁移、转化和停留时间,从而使复合污染更加严重[3]。当前,矿山环境中有机污染物和重金属的共存现象已经非常普遍,这不仅增加了人类的健康风险,而且使矿山土壤的修复和处理更加困难。因此,修复金属矿区周边黄药和Cd复合污染的土壤迫在眉睫。
土壤修复技术有土壤置换法、土壤分离法、电动修复法、洗土法、固定法和生物法等,其中生物法因成本低、维护简单以及环境友好而更具有吸引力[4]。生物修复策略包括自然衰减、生物刺激和生物强化修复3种,根据污染物类型的不同进行选择,而生物修复法的关键是适宜微生物的选择。生丝微菌属(Hyphomicrobium)的细菌通常被认为是降解有机污染物的生态友好型微生物。研究表明,Hyphomicrobium对多种有机污染物(农药[5]、氯霉素[6]、卤素[7]、二甲基亚砜(DMSO)、二氯甲烷(DCM)、二甲基硫醚(DMS)等)均具有良好降解作用。而通过微生物诱导碳酸盐沉淀(MICP)对重金属进行生物矿化是一种新兴有效的重金属污染生物修复方法,巴氏芽孢杆菌属(Sporosarcina)可将尿素水解为NH4+和CO32-,产生的CO32-与重金属离子反应形成稳定的碳酸盐晶体,从而降低重金属生物毒性[8]。同时,在修复过程中,土壤中微生物群落也会针对不同环境变化调整自身代谢活动以及群落结构,其中微生物生物量、酶活性和微生物群落结构都可直接作为修复过程中土壤质量的生物指标[9-10],通过分析其响应变化,有助于对菌群修复效果进行生物调控。
本试验选取某金属矿尾矿库周边农田土壤,模拟复合污染土壤生物修复过程,研究双功能菌群SDMC修复丁基黄药和重金属Cd复合污染土壤的效果,分析其中微生物代谢和群落结构的响应变化,对金属矿区周边土壤生物修复提供技术理论指导。
1 试验材料与方法
1.1 供试土壤及菌群
采集某金属矿尾矿库周边农田土壤作为供试土壤,土壤理化性质见表1。

表1 供试土壤理化性质Table 1 Physical and chemical properties of the test soil
将部分土壤进行灭菌处理,每隔24 h在蒸汽灭菌锅中121 ℃下灭菌1 h,重复3次。根据研究区域周边土壤中丁基黄药和Cd离子的浓度,试验配制丁基黄药和Cd浓度分别为50 mg/kg、3 mg/kg的灭菌和非灭菌污染土壤,土壤在试验前熟化两周。熟化后土壤中丁基黄药少量自然降解,其浓度为46.67 mg/kg,采用固体废物毒性浸出试验(TCLP)浸出熟化土壤,Cd提取量为2.91 mg/kg。试验所用试剂中丁基黄药来自山东栖霞选矿试剂厂;其余均购自国药化学试剂有限公司,分析纯。
所用菌群为实验室已成功构建的菌群,该菌群是由丁基黄药和重金属污染沉积物中分离的丁基黄药降解菌与Cd矿化菌构建而成,其中巴氏芽孢杆菌属和生丝微菌属为主要菌属。培养基组分为:NH4Cl 1 g/L,MgSO4·7H2O 0.4 g/L,CaCl2·2H2O 3.675 g/L,尿素30 g/L以及豆粕提取物3 g/L。
1.2 试验方法
1.2.1 生物修复试验
本试验采用4种处理方式,具体试验设计见表2。

表2 各组试验处理方式Table 2 Experiment treatment methods of each group
每个处理设置3个平行试验组,研究不同处理对土壤修复效果的影响规律与差异。土壤接菌浓度为108CFU/kg,生物强化组每周进行1次接种处理,自然衰减组和生物刺激组分别添加同等体积的蒸馏水和培养基溶液。
1.2.2 种子发芽试验
为对比不同处理方式修复后土壤的生物毒性,对生菜(Lactuca sativa)进行种子发芽试验。将30颗种子放入无菌培养皿中,培养皿中含有15 g经28 d修复的土壤样品,(22±2) ℃下密封黑暗孵育5 d,在孵化期结束时,记录发芽种子的数量。
1.3 土壤采样及分析
1.3.1 土壤采集及污染物含量、形态分析
在第7、14、21、28 d接种前对所有土壤样品进行取样,共采样4次。采样后立即测定土壤中残余丁基黄药含量和TCLP浸出液中Cd离子浓度、可培养微生物数量、微生物酶活性。此外,28 d所取样品另需做重金属形态分析、微生物代谢活性、DNA提取和16S rRNA基因扩增测序。
土壤中丁基黄药的测定方法如下[11]:将5 g土壤转移到离心管中,与10 mL水-甲醇-硫化钠溶液(混合比例为4∶1∶5)混合,密封并振荡30 min。使用0.45 μm的滤膜将离心后的溶液过滤,并采用紫外分光光度法于波长301 nm处分别测定样品加酸前后的吸光度,由2次吸光度差值计算丁基黄药的浓度。
通过电感耦合等离子体质谱(ICP-MS,Perkin Elmer,美国)测量TCLP试验中可浸出Cd浓度。采用BCR顺序提取法分析土壤样品中重金属Cd的形态。丁基黄药降解率θ的计算公式为:

式中:C0为修复前土壤中丁基黄药总量,mg/kg;Ct为修复后土壤中丁基黄药残余量,mg/kg。
Cd矿化率δ的计算公式为:
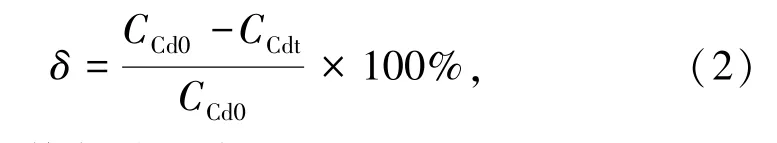
式中:CCd0为修复前土壤浸出液Cd含量,mg/L;CCdt为修复后土壤浸出液Cd含量,mg/L。
1.3.2 可培养微生物丰度
使用稀释平板计数法确定土壤中可培养微生物的数量[12]。将10 g新鲜土壤置于90 mL灭菌生理盐水中,于恒温摇床振荡30 min,逐级稀释后在LB固体培养基上孵育。在28 ℃下孵育5 d后,对具有30-300菌落形成单位(CFU)的固体培养基进行计数。每次测定进行3次,结果以CFU/g表示。
1.3.3 土壤微生物酶活性
通过比色法分析3种土壤酶活性,使用蔗糖溶液作为底物测定蔗糖酶活性;通过测定尿素和柠檬酸盐缓冲液24 h后所释放的铵盐来测定尿酶活性;通过测定苯二钠转化量测定碱性磷酸酶活性[13];通过高锰酸钾滴定法测定过氧化氢酶活性。
1.3.4 土壤微生物代谢
微生物群落的代谢特征试验使用Biolog-ECO微孔板(Biolog,美国)完成。该板由96个孔组成,其中包含31个碳源(12个碳水化合物、6 个氨基酸、1个羧酸类、4个多聚物类、6个酚酸类、2个胺类)和1个水空白。通过软件MicroStationTM每12 h自动读取590 nm和750 nm的光密度。其中,平均颜色变化率(AWCD)用于评估微生物代谢活性。
1.3.5 土壤微生物群落分析
土壤样品微生物群落多样性和结构均由上海美吉生物医药科技有限公司采用16S rRNA高通量测序技术进行表征,数据在生物云平台(www.majorbio.com)进行分析。
2 试验结果与讨论
2.1 双功能菌群特征
通过筛选和驯化丁基黄药降解菌和脲酶分解菌,成功构建了一个双功能复合菌群(SDMC),并分别对2种菌群进行16S rRNA高通量测序,明确功能菌属,结果见图1。
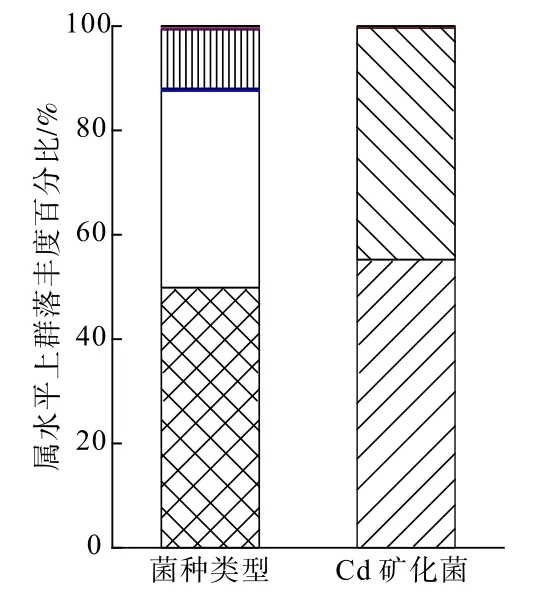
图1 丁基黄药降解菌与Cd矿化菌16S rRAN鉴定结果Fig.1 16S rRAN identification results of butyl xanthatedegrading bacteria and Cd-mineralizing bacteria
由图1可知,丁基黄药降解功能菌属为生丝微菌属(Hyphomicrobium),Cd矿化功能菌属为巴氏芽孢杆菌属(Sporosarcina)。同时,由图2可以看出,在50 mg/L丁基黄药和30 mg/L Cd复合污染的水溶液中,SDMC表现出了优异的降解和矿化效果,与ck下丁基黄药降解率和Cd矿化率相比,菌群处理5 h后,其降解率和矿化率分别达到100%和99.5%。因此,采用该菌群对丁基黄药和Cd复合污染土壤进行生物修复研究。
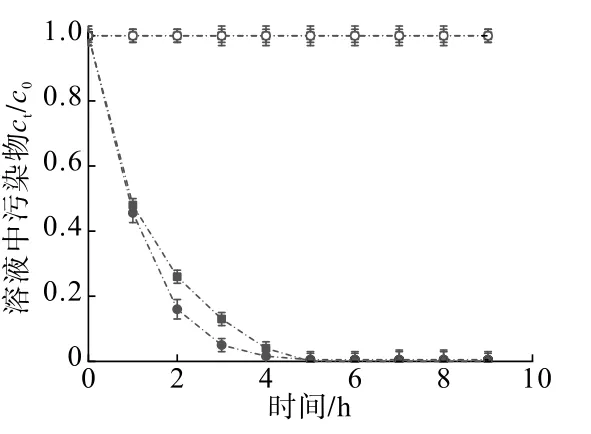
图2 双功能菌群降解和矿化效果Fig.2 Degradation and mineralization effects of bifunctional flora
2.2 复合污染土壤生物修复效果
2.2.1 生物修复方式对丁基黄药降解率、重金属矿化率及种子发芽率的影响
图3为4种不同生物修复方式下丁基黄药降解率、重金属矿化率及种子发芽率。

图3 4种生物修复方式下丁基黄药降解率、重金属矿化率和种子发芽率Fig.3 Degradation rate of butyl xanthate,heavy metal mineralization rate,and seed germination rate under four bioremediation methods
由图3(a)、(b)可知:接种菌群处理均表现出良好的降解丁基黄药和矿化Cd的效果,其中NE效果最为显著,丁基黄药降解率、Cd矿化率分别达到63.34%和71.83%。相较于NC,NE的丁基黄药降解率、Cd矿化率分别提高了60.22个百分点、69.69个百分点。但是同为接种处理,在灭菌土壤中菌群效果则略微较差,与NE对比,SE的丁基黄药降解率、Cd矿化率分别降低了16.13个百分点、14.71个百分点,这可能是因为非灭菌土壤具有更高的微生物代谢多样性,而土壤微生物的代谢多样性更有助于促进微生物的生长繁殖,通过细菌共享代谢物和信号分子,从而促进污染物的降解转化[14]。由图3(a)、(b)还可知,在非接种处理中,丁基黄药降解率和Cd矿化率均未观察到明显变化且效果均小于7%,表明其对土壤修复无明显贡献,这与NWANKWEGU等[15]人关于自然衰减和生物刺激的研究一致,证明了该菌群的生长代谢作用为污染物降解转化的主要驱动力,并且相较于灭菌土壤,该菌群在实际环境中应用效果更佳。
由图3(c)可知,NE种子发芽率高达82.38%,较NC提高了76.23个百分点。结果表明NE中生物毒性显著减小,污染土壤的生态可利用性大幅提高,说明对于矿区周边丁基黄药、Cd复合污染土壤,投加菌群SDMC进行生物强化修复方法可取得较好的修复效果。
2.2.2 生物修复方式对土壤中Cd形态的影响
菌群的矿化作用会改变土壤中Cd的存在形态,不同生物修复方式对土壤重金属Cd形态的影响如图4所示。

图4 生物修复方式对土壤重金属Cd形态的影响Fig.4 Effect of bioremediation methods on soil heavy metal Cd morphology
由图4可知,接种处理后残渣态Cd含量显著增加。相较于NC,NE与SE残渣态Cd含量分别提高了44.21个百分点、30.11个百分点,并且弱酸可提取态Cd含量明显下降了51.21个百分点、33.54个百分点。研究表明,矿化菌在水解尿素时产生的CO32-会吸附阳离子(如Cd2+和Ca2+)形成稳定的方解石晶体,推动重金属Cd从弱酸可提取态向残渣态转化[16]。另外,在接种处理中,与灭菌土壤相比,非灭菌土壤中弱酸可提取态Cd下降效果更为显著,降低了17.67个百分点,对于其他处理,Cd形态则无明显差异,其中弱酸可提取态均为主要存在形式,而重金属弱酸可提取态因其易溶出而生物毒性最大,残渣态因其抗性晶格结构可降低重金属的浸出潜力,从而降低其生物毒性[17-18]。以上结果表明,接种菌群SDMC极大降低了Cd的生物可利用性,对污染土壤表现出良好的修复效果,提高了土地利用的安全性。
2.3 土壤微生物代谢及群落特征响应变化
2.3.1 土壤可培养微生物丰度
图5显示了修复过程中土壤可培养微生物的丰度变化。

图5 生物修复方式对土壤可培养微生物种群丰度的影响Fig.5 Effect of bioremediation methods on the abundance of soil culturable microbial populations
由图5可知,在修复期间,接种处理的可培养微生物数量先增加后缓慢降低,其中NE丰度在前21 d内逐渐增加,在21 d达到最大值400×107CFU/g,较NC提高了9倍,SE则在14 d达到最大值340×107CFU/g。不同时期的非生物修复土壤微生物数量变化不大,NS微生物数量较少,NC表现出最低水平,仅为30×107CFU/g左右。非接种处理的微生物数量显著低于接种处理,且NE明显高于SE,这可能是由于菌群对丁基黄药和Cd的降解和矿化作用,降低了污染物的生物毒性。研究表明,添加功能微生物有利于调节污染土壤中微生物活动和生长机制,提高其代谢潜力以及它们对环境改变的反应能力[19]。同样,土壤中有毒物质会减少微生物的数量[20],然而NE中的微生物种群在前21 d迅速增加,这可能是由于丁基黄药以及弱酸可提取态Cd在微生物修复后迅速减少。此外,在菌群的修复作用下,土壤微生物在复合污染土壤中迅速生长,表明了菌群SDMC对污染物的高耐受性以及修复的高效性。
2.3.2 土壤酶活性
土壤酶活性是微生物驱动土壤养分循环和污染物变化的敏感指标,图6显示了不同生物修复方式下土壤酶活性。
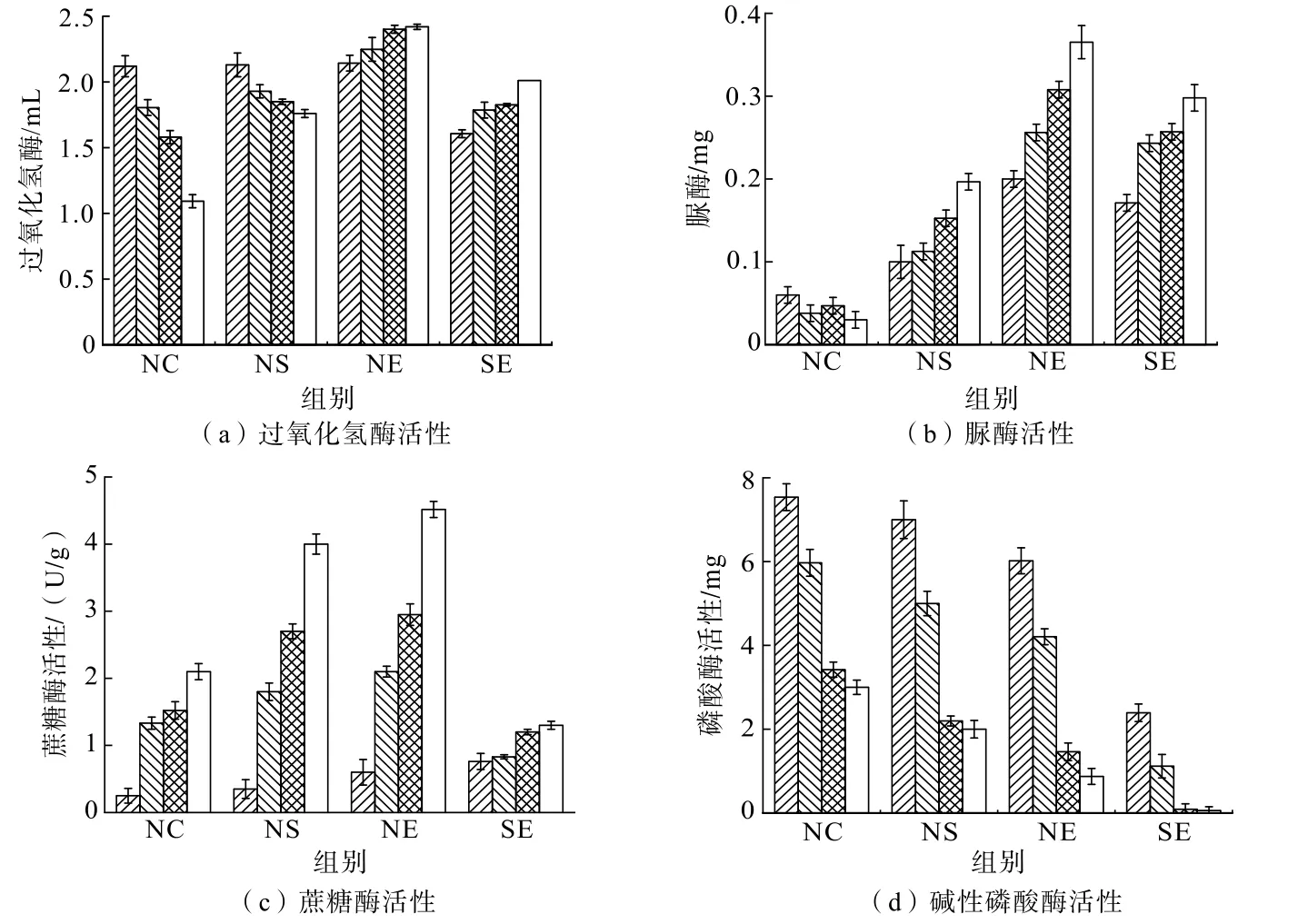
图6 生物修复方式对土壤酶活性的影响Fig.6 Effect of bioremediation methods on the soil enzyme activities
由图6(a)、(b)可知,接种处理后过氧化氢酶与脲酶活性均表现出随时间增加而增加的趋势。其中NE增加最为显著,相比于NC,2种酶28 d活性分别提高了1.22、5.92倍。已有研究表明,微生物过氧化氢酶和脲酶分别是有机污染物降解转化和重金属矿化的关键酶。过氧化氢酶可以降解土壤中有机污染物,其活性越高,降解污染物能力越强[21]。同时,脲酶活性与重金属含量呈显著负相关,因此可作为评价重金属毒性的指标[22]。这些结果表明,接种处理提高了土壤中过氧化氢酶和脲酶活性,促进了污染物的降解和矿化[23]。此外,土壤中高浓度的重金属和有机物可能会抑制酶的活性[24-25]。但是在本研究中,接种处理后,2种酶活性均得到明显提高,表明接种菌群SDMC对土壤酶活性的调控能力。同时,不断降低的污染物生物毒性也会减少对酶活性的抑制作用,这也是NE修复效果最为显著的原因。
土壤中蔗糖酶和碱性磷酸酶作为碳循环和有机磷转化的关键酶,其活性会影响土壤营养结构。已有研究表明,蔗糖酶可增加土壤中易溶性营养物质的含量,提高土壤肥力。而在缺磷环境下,磷酸酶活性则更高[26]。由图6(c)、(d)可以看出,接种处理后蔗糖酶活性随时间增加而增加,碱性磷酸酶则相反,相较于NC,NE中蔗糖酶28 d活性提高了1.15倍,碱性磷酸酶28 d活性降低了0.71倍。这可能是因为接种微生物后促进溶磷,提高了土壤磷含量。结果表明,接种菌群SDMC会影响土壤的理化性质,提高土壤肥力,进而影响土壤微生物群落结构。
2.3.3 微生物代谢活性和底物利用
图7显示了生物修复方式对微生物代谢活性和底物利用的影响。

图7 生物修复方式对微生物代谢活性和底物利用的影响Fig.7 Effect of bioremediation methods on microbial metabolic activity and substrate utilization
土壤微生物代谢活性通过平均颜色变化率AWCD进行评估,较高的AWCD表明较高的微生物代谢活性。由图7(a)可知,4种生物修复方式下AWCD曲线变化趋势随时间基本为先停滞后增加。在前期,AWCD几乎保持不变,这可能是由于微生物的滞后期[27]。随后微生物进入快速生长阶段,在175~200 h左右达到稳定,NE和SE的AWCD分别稳定在0.72和0.54左右,较NC分别提高了1.18和0.64倍。在未接种处理中,AWCD明显受到污染物的抑制作用,最高仅达到0.41。
由图7(b)可知,接种处理显著影响了土壤中微生物对不同碳源的利用能力。碳水化合物作为熟知的碳源之一,其占比始终位居前列。然而,在接种处理中,碳水化合物的百分比下降,这可能是由于碳源总利用率增加了。此外,未接种处理中胺类的占比始终保持在1%以下,但由于微生物的利用不同,接种处理中胺的微生物利用明显增强,NE中胺的利用分数含量提高了9个百分点。
微孔板中AWCD值代表了土壤微生物利用不同碳源的能力,是微生物功能多样性的重要指标。先前的研究表明,重金属和有机物的存在可以刺激微生物的代谢活动。此外,微生物群落的细菌数量会引起微生物代谢活动的动态变化[28]。在接种处理中,由于微生物丰度较高,AWCD增长迅速。在本研究中,NE的AWCD一直位于最高值,表明接种SDMC增加了土壤微生物的数量和自身代谢能力,有助于促进污染物的降解和矿化。碳源的利用在很大程度上受微生物种类和土壤理化特性的影响。在本研究中,这种差异有可能是由接种SDMC引起的,随着修复时间的增加,接种处理中污染物生物毒性下降,土壤酶活性变化,改变土壤营养结构,刺激了微生物的生命活动,导致底物利用谱发生变化。这些结果表明,接种菌群SDMC后有助于形成代谢多样化的土壤微生物群落,同时代谢多样化的微生物群落也会有助于污染物的降解转化,提高受污染的土壤中丁基黄药和Cd的修复效率[29]。
2.3.4 土壤微生物群落特征
采用Shannon指数和Simpson指数评价不同生物修复方式下土壤的Alpha多样性,结果见图8。

图8 生物修复方式对土壤Shannon指数和Simpson指数的影响Fig.8 Effect of bioremediation methods on Shannon and Simpson indices of the soil
由图8可知,接种处理使土壤微生物群落Shannon指数降低,Simpson指数升高,尤其NE达到显著水平,与NC相比,其Shannon指数降低了0.29倍,Simpson指数提高了4.67倍。微生物多样性指数的变化,说明接种菌群改变了土壤的微生物多样性,使得物种更均匀,这可能是因为所接种的菌群在修复土壤的过程中占据了主导地位,从而使微生物的多样性降低。
为了更好地了解土壤中的微生物群落组成,采用热图表示每个菌属的相对微生物丰度。结果表明,未接种处理主要集中在少数几种细菌上,表明当暴露于丁基黄药和重金属Cd复合污染时,敏感微生物的生物活性和种群数量都大大降低。接种处理后的细菌分布更加均匀,相对于NC,NE中部分菌属的相对丰度有明显的提高,例如芽孢杆菌属(Sporosarcina、Bacillaceae、Pseudogracilibacillus、Bacillus)均提高了43.75个百分点、7.91个百分点、3.96个百分点、6.43个百分点,生丝微菌属(Hyphomicrobium)、假单胞菌属(Pseudomonas)和包西氏属(Bosea)分别提高了21.32个百分点、4.25个百分点和2.10个百分点。研究表明,这些丰度明显增加的菌属均有助于环境修复,尤其是对土壤修复具有一定作用。芽孢杆菌属(Sporosarcina、Bacillaceae、Pseudogracilibacillus)常用于分解尿素矿化重金属[8,30]。芽孢杆菌属(Bacillus)、生丝微菌属(Hyphomicrobium)和假单胞菌属(Pseudomonas)对难降解有机物有极为广泛的代谢能力,如杀虫剂、农药等[31-32]。以上结果表明,接种处理后土壤微生物群落可降解或矿化污染物的细菌相对丰度明显增加,可以加速土壤中污染物的降解和矿化,有助于生态修复。
3 结 论
(1)菌群SDMC对金属矿区周边丁基黄药、Cd复合污染土壤具有良好的修复效果,其中丁基黄药降解率、Cd矿化率可分别达到63.34%、71.83%,同时相较于对照组,种子发芽率提高了76.23个百分点。
(2)菌群修复对土壤微生物丰度、酶以及代谢活性均表现出显著的促进作用,土壤微生物丰度、过氧化氢酶、脲酶、蔗糖酶活性以及AWCD分别提高了9、1.22、5.92、1.15和1.18倍,可明显改变土壤营养结构,提高土壤肥力,促进污染物降解矿化。
(3)具有降解矿化复合污染物作用的芽孢杆菌属(Sporosarcina)、生丝微菌属(Hyphomicrobium)和假单胞菌属(Pseudomonas)的相对丰度分别提高了43.75个百分点、21.32个百分点和4.25个百分点,表明该菌群已成为修复优势菌,可实现土壤修复长效性。
