基于网络药理学和分子对接探寻人参治疗特发性肺间质纤维化的关键靶标及作用机制
2022-08-05吕鹏刘晓明李芮
吕鹏,刘晓明,李芮※
(1.山东中医药大学,山东 济南 250014;2.山东中医药大学附属医院,山东 济南 250014)
肺间质纤维化(idiopathic pulmonary fibrosis,IPF)是各种原因引起的急慢性间质性肺病(interstitial lung disease,ILD)的最终结局,其病因多样,预后较差,发病机制复杂,目前认为IPF的发生与先天和获得性免疫反应的激活、炎症、上皮/内皮损伤、上皮间充质改变以及细胞凋亡有关[1-3]。西医主要采用激素制剂、吡非尼酮和尼达尼布等药物进行治疗,这些治疗方案仅能缓解IPF的症状或延缓病情进展,尚不能满足IPF患者的医疗需求[4],因此,在中医药宝库中探索治疗IPF的新药具有重要意义。当前,已有中医药研究者对疗效明确的单药和复方进行数据挖掘,发现补气药的累计频次最高,居各类药物之首[5],人参便是其中的重要代表,同时,国外多项研究也已经证实,多种人参皂苷具有抗纤维化的潜力,但机制尚不明确。所以,本研究通过运用网络药理学和分子对接技术对人参治疗IPF的关键靶标和潜在作用机制进行初步探索与验证,以期为后续研究提供可靠的科学依据。
1 资料与方法
1.1 研究路线与方法
研究路线与方法,见图1。

图1 研究路线与方法图Fig.1 Diagram of the research path and technique
1.2 人参中活性成分的筛选与ADME参数的确定
在中药系统药理学数据库与分析平台(TCMSP)中,对“renshen”进行检索,搜索得到人参的全部成分及其吸收、分布、代谢、排泄(ADME)信息。以药物口服生物利用度(oral bioavail,OB)与类药性(drug likeness,DL)作为本研究衡量化合物药效的主要依据,筛选条件参照TCMSP数据库“parameter information”中的建议,确定为OB≥30%,DL≥0.18,将筛选出的有效成分作为人参的活性成分进行后续研究。
1.3 构建人参已知的活性成分 靶标数据库
在TCMSP中搜索得到人参活性成分的对应靶标,对其中经DrugBank平台验证的靶标信息进行保留。此外,《中华人民共和国药典》2020版(一部)规定人参皂苷Rg1(C42H72O14)、人参皂苷Re(C48H82O18)和人参皂苷Rb1(C54H92O23)的含量是药材质量评价的重要指标[6],故本研究将对这一重要化合物的靶标信息加以补充,最终,将以上筛选出的所有化合物 靶标信息去重整合到构建好的人参活性成分 靶标数据库中。
1.4 人参皂苷潜在药靶筛选与分子对接验证
在PubChem数据库中下载人参皂苷(Ginsenoside Re、Ginsenoside Rg1及Ginsenoside Rb1)的2D-sdf模型文件,将文件导入Swiss target prediction平台,并对其潜在靶标进行预测,将probability≥0.06的靶标作为候选进行分子对接。在RCSBPDB数据库中下载候选靶标的PDB蛋白晶体模型文件,选择PDB文件的基本原则参考Yang等人的研究[7]。利用AutoDock vina重新进行原位点对接,通过计算均方根差(root mean square Dis-placement,RMSD)值以比较对接前后复合物的构象差异,若RMSD<[8],则证明对接方法可靠并保留相应靶蛋白以进行后续操作,将保留下来并去除原配体结构的靶标重新导入AutoDock vina中,经过分子加氢、除水等操作后,采用上述对接方法进行对接,研究假定结果中若蛋白与配体间的Affinity<0 kJ/mol[8],则说明人参皂苷能较好地与该蛋白进行自发结合,并将其视作人参皂苷的潜在有效靶标,利用PyMOL软件进行可视化分析。
1.5 构建已知的IPF疾病靶标数据库
在NCBI Gene Database、GeneCards、Disgenet、OMIM和DrugBank数据库中输入“idiopathic pulmonary fibrosis”或“IPF”进行已知疾病基因的获取,筛选出物种为智人(Homo Sapiens)的靶标,并将其去重添加至“IPF-靶标数据库”。
1.6 靶标互作网络与关键靶标的筛选
查询Uniprot数据库,将基因名称转换为Gene Symbol,将药靶和疾病靶标取交集以筛选出共同靶标,即人参中参与治疗IPF的靶标,在String数据库中进行PPI网络分析。本研究采用“Medium Confidence(0.400)”的条件对节点数据进行过滤,将处理后的数据导入Cytoscape3.8.1进行网络可视化展示,并对生成的网络图进行拓扑分析,按照degree值(与该节点相关联的边的条数)的高低顺序选择前10个基因作为人参治疗IPF的关键靶标。
1.7 GO、KEGG富集分析与构建生物调控网络
采用metascape数据库对人参 IPF共同靶标进行基因本体论(Gene Ontology,GO)富集分析和京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析,根据以上活性成分及其靶标、通路的对应关系,使用Cytoscape3.8.1构建活性成分 靶标 通路 疾病生物层次网络,对网络中重要节点的生物效应进行分析。
1.8 分子对接分析
基于1.7所作的生物网络图结果,对本研究中的关键靶标与除外人参皂苷的人参活性成分进行分子对接,方法同1.4。
2 结果
2.1 活性成分筛选结果
通过TCMSP数据库共筛选出包括人参皂苷、山柰酚、-谷甾醇和花生四烯酸等在内的22种活性成分,筛选结果详见表1。

表1 人参中活性成分ADME信息Table1 ADME information of active components in ginseng
2.2 人参皂苷潜在药靶与分子对接预测结果
经预测得到人参皂苷Rg1、Rb1、Re的潜在靶标有16个,见表2。对接后得到Affinity<0 kJ/mol的潜在有效靶标有3个,分别是IL2、LGALS8和LGALS3,见图2。

图2 潜在有效靶标对接示意图Fig.2 Diagram of potential effective targets docking

表2 人参皂苷Rg1、Rb1、Re潜在靶标预测Table 2 Prediction of potential targets of ginsenosides Rg 1、Rb1 and Re
2.3 人参化合物靶标与疾病靶标筛选结果
此次研究共发现人参相关靶标87个,IPF相关靶标1 641个,结果见表3。图3表示化合物靶标与疾病靶标交集结果,得到TNF、IL1B、PPARG、PTGS2和UN等25个共同靶标。

表3 人参化合物靶标与IPF疾病靶标筛选结果Table 3 Screening results of ginseng compound targets and IPF disease targets

图3 人参化合物靶标-肺间质纤维化基因交集图Fig.3 Venn plot of compositional targets and IPF-related targets in ginseng
2.4 PPI互作网络
将25个共同靶标导入STRING数据库,得到构建好的靶标互作网络,见图4。图中黄色节点代表节点度排名前10的关键靶标,即TNF、IL1B、PPARG、PTGS2、JUN、IFNG、VCAM1、IL2、HMOX1和NOS2,绿色表示其他靶标。整个网络中共存在115条边,其中边的粗细反映了置信度的高低。该网络的主要参数见表4,其中节点间的平均距离为1.753,意味着靶标在网络中可以迅速地传递信息,平均相邻节点数目为9.2,说明每个靶标平均与9.2个其他靶标密切联系,网络的整体密度为0.757,意味着任意两个靶标互作的发生概率为75.7%,这些都能在一定程度上反映人参中的活性成分能够通过多靶点、多通路的网络调控作用[9],改变IPF的疾病状态。
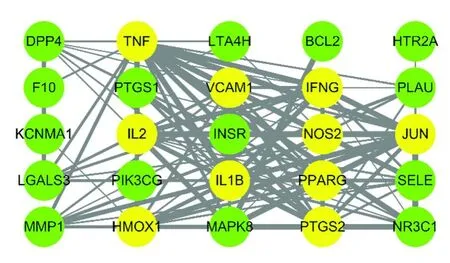
图4 人参靶标 蛋白互作网络Fig.4 Ginseng targets-protein interaction network

表4 人参靶标 蛋白互作主要参数Table 4 Main parameters of ginseng targets-protein interaction
2.5 GO与KEGG通路富集分析结果
对25个共同靶标进行GO分析共识别得到649条结果,其中发现615条生物过程(Biological Process,BP)信息,包括小分子代谢过程正调控、细胞迁移正调控、细胞粘附调控、凋亡信号通路、缺氧反应、蛋白磷酸化的正调控以及白细胞与细胞粘附的调节等功能;22条分子功能(molecular function,MF)信息,包括受体配体活性、信号受体激活剂活性、信号受体调节剂活性、血红素结合、四吡啶结合、氧化还原酶活性和细胞因子受体结合等;12条细胞组分(cellular component,CC)信息,包括小窝、膜筏、膜微域、质膜筏、质膜外侧和膜侧面等,按照lg(p value)由小到大的顺序,GOBP、GOMF以及GOCC的前10条富集结果见图5。KEGG通路富集分析共识别到25个基因,得到55条结果,包括流体切应力与动脉粥样硬化、IL-17信号通路、糖尿病并发症中AGE-RAGE信号通路、TNF信号通路、癌症中的通路、NF-kappaB信号通路、Th17细胞分化等,按照lg(p value)值由小到大排序,前20条通路结果见图6,各通路包含的靶基因见表5。
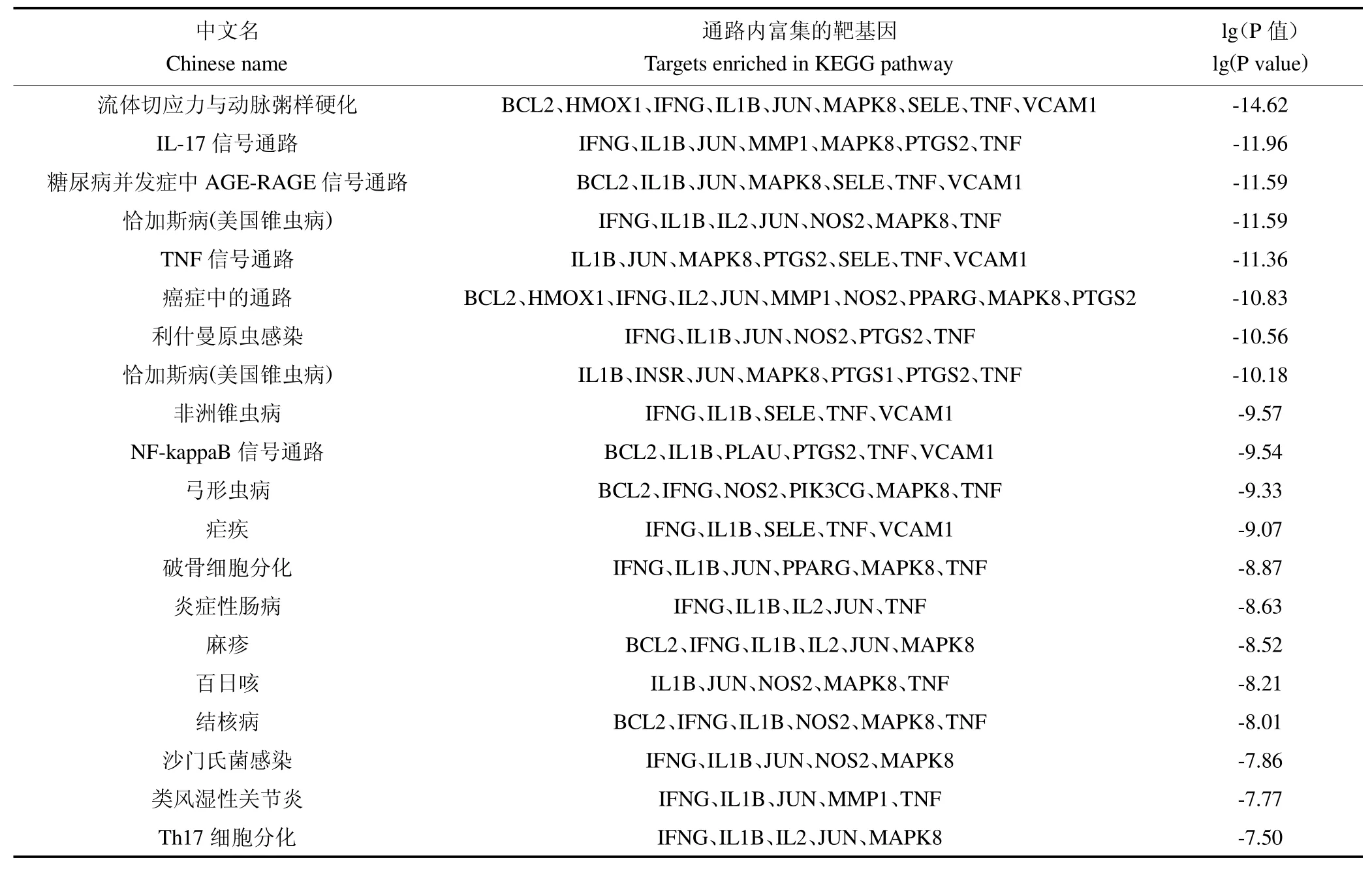
表5 人参影响KEGG信号通路(Top20)中包含的靶基因Table 5 Ginseng affects the targets contained in KEGG signal pathway(Top20)
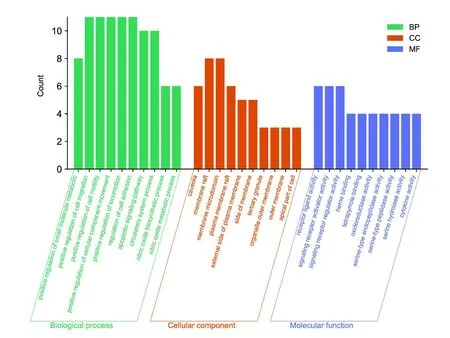
图5 GO功能富集分析图Fig.5 The GO function enrichment analysis diagram

图6 KEGG通路富集分析气泡图(Top20)Fig.6 The KEGG pathway enrichment analysis diagram(Top20)
2.6 生物网络构建结果
构建关于10个关键靶标、其关联的活性成分及信号通路的生物网络,见图7,其中10个关键靶标与5个活性成分、20条信号通路关联。网络分析显示,山柰酚、-谷甾醇、人参皂苷Rb1、人参皂苷Rh2与豆甾醇等活性成分能作用于网络中的多个靶标,而TNF、IL1B、PPARG、PTGS2、JUN、IFNG、VCAM1、IL2、HMOX1和NOS2等靶标也能与多个成分、多条通路发生作用,再次证明人参能够发挥多成分、多靶标、多通路的协同作用对IPF进行全面系统的治疗。

图7 人参10个关键靶标的活性成分 靶标 通路网络图Fig.7 Active component-10 key targets-pathway network diagram
2.7 分子对接验证
将前10位的关键靶标IL1B(PDBID:1T4Q)、TNF(PDB ID:5WJJ)、IFNG(PDB ID:4BZB)、JUN(PDB ID:4EBV)、NOS2(PDB ID:4NOS)、PTGS2(PDB ID:5IKQ)、VCAM1(PDB ID:IVCA)、IL2(PDB ID:1M48)、PPARG(PDB ID:6FZF)和HMOX1(PDB ID:3HOK)与Stigmasterol、Kaempferol及beta-sitosterol进行对接,对接的最佳结合力见图8。Best affinity越小,二者能更好地自主结合,由图8可知,Kaempferol(山柰酚)与各个靶标的结合能大部分都小于-29.2 kJ/mol,而当Affinity<-29.2 kJ/mol时,说明配体与受体强烈结合[10],在本研究中可以被视为最有可能在人参治疗IPF中发挥重要作用的活性成分。

图8 人参活性成分与关键靶点分子对接最佳结合力热图Fig.8 Heatmap of the best binding between the active components of ginseng and key targets
3 讨论
IPF属于中医的“肺萎”、“咳嗽”和“喘证”的范畴,病位在肺,久则及肾,其发病机理与虚、瘀、痰、毒相关[11],古今常见的治法有活血化瘀、益气养阴、清热化痰等等[12-14]。人参作为重要的补气药,早在《神农本草经》中就被视作“上品”,可以“补五脏,安精神,定魂魄,止惊悸,除邪气,明目开心,益智,久服轻身延年”[15]。现代药理研究也认为,人参具有抗肿瘤、抗衰老、抗疲劳、调节免疫力以及抗菌等作用[16]。
近年来,人参的抗纤维化作用也受到了广泛的重视与研究,本研究富集到的人参皂苷、-谷甾醇、山柰酚和豆甾醇等成分在实验研究中被证实具有较好地抗纤维化活性[17-19],如-谷甾醇可以通过TGF-/smad依赖的信号通路抑制上皮间充质转化,并减少细胞外基质的沉积[20];山柰酚可以通过调节自噬来减轻二氧化硅诱导的肺间质纤维化[21]等等。当然一些成分也同时存在于其他天然药物中,当与其他药物根据药物性味、七情理论配伍时,这些有效成分可能更好地表达,在协同减毒的基础上发挥更好的治疗效应[22],所以,筛选不同配比的人参药对研发抗纤维化药物颇具潜力。
本研究富集到的通路多数与环境信息处理、免疫等相关,见图9。其中,受影响最大的通路是流体切应力与动脉粥样硬化,该通路在血管生物学中起着核心作用。这一通路中控制血管内皮细胞(EC)基因表达的关键转录因子分别是KLF2、Nrf2、AP-1和NF-kappaB[23,24],围绕这些内皮转录因子进行的抗纤维化探索也是近几年的热点方向。其中关于激活Nrf2的研究较多,与纤维化中氧化应激这一病理机制有关。目前已批准治疗IPF的药物吡非尼酮就可以通过抑制Bach1和激活Nrf2,恢复Nrf2/Bach1平衡来发挥抗纤维化作用[25],并且人参中的活性成分也被证实可以通过上调Nrf2核转位来发挥抗肝纤维化作用[26,27]。但是,人参作为具有潜力的多器官组织抗纤维化药物,其有效成分通过调控Nrf2来抗肺间质纤维化的机制研究尚属空白,因此,填补这一空白具有重要意义。此外,IL-17信号通路是另一条重要的作用通路,它不仅在保护宿主抵抗细胞外病原体方面具有重要作用,还促进了自身免疫性疾病中的炎症病理[28]。本研究将富集到的关键靶标投射到IL-17通路中,可以发现,人参中的活性成分调控了这一通路中的13个靶点,其中的IL-17A经过实验证实可以促进肺间质纤维化的发生,而敲除它的受体则可以改善由博莱霉素诱导的肺间质纤维化中的急性炎症反应,抑制肺间质纤维化的发生[29],并且,有效诱导自噬,促进胶原的自噬降解和自噬相关的细胞死亡[30]。因此,IL-17A也是人参治疗肺间质纤维化的潜在治疗靶点。

图9 KEGG通路分类图Fig.9 KEGG path classification diagram
结合本研究的结果可以推测,人参中的人参皂苷、山柰酚可能通过Nrf2或IL-17A所在的信号通路介导氧化还原或者细胞自噬过程来发挥抗肺间质纤维化的作用,这一机制有待在未来的实验研究中进一步验证。
