氢生物医学效应在疏解自由基氧化应激的分子机制
2022-08-03陶鸽如秦树存
陶鸽如, 秦树存
山东第一医科大学(山东省医学科学院)泰山氢生物医学研究院,山东 泰安 271000
自由基是细胞代谢的中间产物或副产物,包括活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)等,其主要由线粒体在合成三磷酸腺苷(adenosine triphosphate,ATP)的过程中产生[1]。在生理条件下,ROS和RNS是参与信号转导、防御病毒感染、调节氧化还原等细胞生物学过程中的重要组成成分[2]。然而,自由基的过量积累会对细胞的结构和生理功能造成氧化应激,氧化应激实际上反映了ROS的生成与细胞降解有害中间产物能力之间的生理失衡,以及由此造成的损伤。氧化应激的产生与各种疾病相关,包括动脉粥样硬化、帕金森病、癌症等[1]。为了减少氧化自由基造成的组织损伤,人们陆续发现了一些抗氧化的药物,并由此诞生了自由基医学。但长期大量使用抗氧化药物带来的真实益处比较有限。近年来,有研究表明,人工合成的抗氧化剂在动物疾病模型中具有治疗作用[3],但这些抗氧化剂仍未广泛应用于临床。因此,如何探寻更适宜的抗氧化剂,既能有效清除有害自由基,又不干扰细胞固有的生理性氧化还原反应,已成为目前研究的难点。2007年,日本医科大学的Ohsawa等[4]发现H2是一种新型的选择性抗氧化剂,仅针对有害的氧化自由基,可有效避开对生理性氧化自由基的干扰。此外,吸入2%~4%安全剂量的H2即可对缺血性脑损伤起到保护作用。医用气体的生物安全性一直是其推广应用的前提,而H2的生物安全性在潜水医学中已得到认可[5]。
美国贝勒大学Bell等[6]早在1975年就报道过H2的生物医学效应作用,他们用8个大气压下的97.5%的H2吸入治疗动物模型的皮肤鳞癌,取得了明显的效果。近年来,多学科科学家相继开展了一系列的动物模型研究,为H2治疗提供了基础实验依据,并在关节炎[7]、代谢综合征[8]等领域进行了初步临床试验,并得到了较好的结果。H2能够减少呼吸道的阻力,从而提高氧气进入肺部的能力,在抗击新型冠状病毒肺炎疫情中,H2也发挥了重要的作用[9]。然而,解析H2缓解各类疾病的分子机制仍是一个难点。在多年的基础研究中,人们逐渐了解H2的作用并不是针对某个单一的分子,而是影响了复杂的信号转导网络,因此,阐明H2生物学效应的作用对于全面理解其生物医学作用具有重要意义。目前H2的研究主要集中于抗氧化应激、抗炎、抗凋亡、调节信号转导、细胞器保护和自噬方面的细胞保护作用等方面(图1)。基于此,本文归纳了近年来体外无细胞系统、细胞培养和动物模型的研究进展,并梳理了目前关于H2生物医学机制的相关研究进展,以期为该领域的深入研究奠定理论基础。
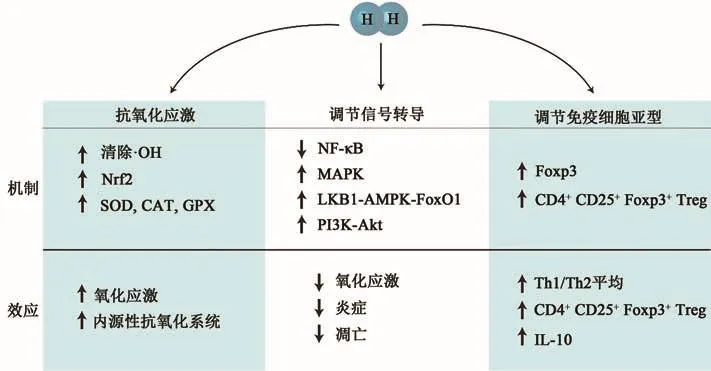
图1 H2应对氧化应激的主要生物学效应Fig.1 The main biological effects of hydrogen molecular under oxidative stress
1 H2的抗氧化作用
1.1 H2对氧化自由基的清除作用
在哺乳动物细胞中,自由基的形成主要发生在线粒体呼吸链、溶酶体吞噬消化、前列腺素合成和细胞色素P450系统活化的过程中,除信号调控作用外,超氧化物和过氧化氢等物质可以与多种大分子发生反应,包括膜脂、蛋白质和DNA等,因此,过量的氧化自由基会造成细胞损伤[10]。作为一种新型的抗氧化剂,H2被证实具有清除羟基自由基(·OH)的能力[4]。羟基自由基是O2-与H2O2在Fe2+或Cu+存在的情况下发生芬顿反应生成的毒性最大的活性氧自由基。由于·OH不能被酶清除,需要依赖螯合游离金属离子或将H2O2转化为其他化合物。有研究证明,H2在无细胞系统中能够与·OH直接反应,并通过对过氧化产物的定量,可以减小在老龄化[11]、缺血再灌注(ischemia/reperfusion,I/R)损伤[12]等动物模型中的氧化自由基。然而,因为·OH与H2的反应速率(·OH+H2=H2O+H·)较大多数自由基-自由基反应更慢,这种·OH消除作用是否通过简单的化学反应还有待进一步确定。以上研究表明,H2能够降低病理过程中细胞内的·OH等氧化自由基。
1.2 H2对内源性抗氧化系统的调控作用
研究表明,H2也可增强内源抗氧化酶的表达,从而进一步改善氧化应激,如超氧化物歧化酶(superoxide dismutase,SOD)将超氧化物阴离子(ROS的主要产物)转化为相对稳定的H2O2;过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)将H2O2还原为H2O,构成细胞抵御氧化应激的第一道防线[3]。研究表明,在高血压[13]和肾损伤[14]动物模型中,H2处理升高了SOD、CAT和GPx的表达。同时,在自发性高血压大鼠的肾损伤[14]和破骨细胞分化因子诱导的破骨细胞分化[15]研究中,H2能够降低某些类型免疫细胞在吞噬过程中由NADPH氧化酶(NADPH oxidases,NOX)的表达,从而减少其产生的自由基。线粒体ROS对促进细胞死亡至关重要,但仅由线粒体产生的ROS并不能引发细胞死亡,而是需要通过后续的NOX作用持续积累ROS。以上研究表明,H2可能并不仅是一种简单的自由基清除剂,还可能是一种信号调节因子。
1.3 H2对Nrf2抗氧化通路的激活作用
红系衍生核因子2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是氧化还原敏感的转录因子,可调节抗氧化能力,保护机体免受氧化应激和炎症引发的损伤。Nrf2通路的激活可启动抗氧化应激防御系统,包括通过SOD诱导超氧化物和过氧化物分解代谢、氧化辅助因子和蛋白再生、氧化还原转运增加等通过多种机制影响ROS和RNS的稳态[16]。在探索 H2改善动脉粥样硬化斑块稳定性[17]、败血症脑损伤[18]等机制的研究中,Nrf2通路在氧化应激条件下被激活,而H2处理能够进一步增强Nrf2的活化。H2可以提高Nrf2的表达,从而促进其细胞核转位[17]。因此,下游效应分子包括HO-1、SOD和过氧化氢酶的转录得到激活。此外,在体外研究中,利用小干扰RNA阻断Nrf2可恢复细胞内大量的ROS和器官损伤;同时,H2处理对Nrf2敲除小鼠的改善作用甚微,这表明H2的有益作用依赖于Nrf2通路的激活[18]。以上研究表明,H2能够通过激活Nrf2通路从而上调内源性抗氧化酶的表达。
2 H2对炎症和细胞死亡级联反应的改善作用
在一项关于H2的早期研究中,将患有血吸虫病相关慢性肝炎症的大鼠放置在含有0.7 MPa H2的高压室中2周,发现大鼠血浆中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)有所减少[19]。之后有研究者在烟雾吸入损伤[20]、结肠炎症[21]中,使用浓度较低的H2或富氢盐水均取得了相似的结果。TNF是一种多效细胞因子,可调节细胞生存、免疫应答和凋亡的多方面细胞生物学过程。因此,涉及核因子κB(nuclear factor kappa-B,NF-κB)活化、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)级联反应的复合物是功能上相互依赖的信号因子,它们在H2的作用下也会发生表达或活性变化。NF-κB是促炎细胞因子的主要调节因子,参与细胞的分化和凋亡,同时也是H2系统调控的关键组成部分。线粒体产生的ROS是TNF-α和白细胞介素-1(interleukin-1,IL-1)激活NF-κB的第2信使,能够上调NF-κB在细胞质中的活化、细胞核转位进而激活该信号转导通路[22]。H2处理能够降低 NF-κB的活化和NF-κB依赖性炎症因子的转录,使NF-κB p65的核转位减少,而驻留在细胞质中的核因子 κB 的抑制蛋白(inhibitor of NF-κB,IκB)增加[23]。动物实验表明,H2处理降低了促炎细胞因子和趋化因子的水平,包括IL-1β、IL-6以及高迁移率组框 1(high-mobility group box 1,HMGB-1)和趋化因子CCL2,并上调了抗炎细胞因子IL-10[23]。以上研究证实了H2的抗炎作用,这是氢生物医学最显著的生物学效应之一。
在使用多种人类疾病动物模型的研究中,通过脱氧核苷酸转移酶末端dUTP缺口末端标记(terminal deoxynucleotidyl transferase dUTP nick end labeling,TUNEL)检测和/或 Caspases的定量分析,使得H2的抗凋亡特性也得到了充分的证明,如在肾缺血再灌注损伤模型中,H2处理上调了Bcl-2/Bax(抗凋亡/促凋亡蛋白)的比值,并降低了Caspase-8(外源性途径)、Caspase-9(内源性途径)和Caspase-3(内源性途径的结局)的表达,改善了内源性及外源性的细胞凋亡[24]。同时,H2处理对线粒体也有保护作用:H2能够通过抑制JNK通路,保护线粒体膜电位、缓解线粒体肿胀,从而缓解骨关节炎中的细胞凋亡及人软骨细胞外基质的降解[25]。
肿瘤细胞中过量的ROS不会对细胞造成明显的伤害,过量的ROS甚至可能激活细胞增殖和代谢的信号通路,但H2对肿瘤细胞的影响是相反的,动物实验研究表明,用H2降低ROS水平,会抑制肿瘤细胞的生长[26]。有研究发现,60% H2可促进肺癌细胞株A549和H1975的凋亡,80% H2可诱导其快速凋亡[27]。
H2对自噬的影响在不同的病理条件下存在差异,如在大鼠血管性痴呆模型中,H2处理可降低LC3-Ⅱ/Ⅰ和Beclin-1表达,诱导p62表达,抑制Foxo1-Atg7依赖的自噬[28];在大鼠心肌 I/R 模型中,H2处理降低了Beclin-1和LC3-Ⅱ/Ⅰ的表达,电镜显示自噬体明显减少[11]。然而,在急性肾损伤诱导的肾纤维化模型的结果却完全相反,研究学者发现,小鼠双侧肾蒂阻塞35 min并随后腹腔注射富氢生理盐水,肾脏LC3-Ⅱ和Beclin-1的表达水平较模型组进一步上调[29]。此外,在非酒精性脂肪肝病的研究中,吸入H2也可通过促进自噬从而缓解肝脏的脂质蓄积[30]。一项利用H2和二甲双胍联合治疗糖尿病性心肌病的动物实验表明,H2通过抑制细胞焦亡(pyroptosis)起到了对心肌细胞的保护作用[31],表明H2可能参与其他细胞程序性死亡。以上研究表明,H2对病理情况下的细胞凋亡具有抑制作用,但可诱导肿瘤细胞的凋亡;H2有可能通过调控其他程序性死亡,缓解组织器官的损伤。
3 H2对细胞信号转导通路的调节作用
H2具有信号分子的功能,对包括丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)、腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)及磷酸肌醇 3-激酶(phosphoinositide 3-kinases,PI3k)/Akt等信号转导通路具有多方面的影响。
3.1 MAPK通路
包括氧化应激在内的细胞应激可能通过胞内激酶的氧化修饰或MAPK磷酸酶的失活激活ERKs、JNKs或p38 MAPKs。MAPK家族不同成员的活化能够导致多种生物反应。最近,关于I/R损伤的研究揭示了H2抑制MAPK通路的作用。在大鼠同种异体肾移植模型中,受体大鼠每日饮用富氢水,移植物的MAPKs包括JNK、p38、细胞外信号调节蛋白激酶(extracellular signal-regulated kinases,ERK)相比饮用普通水大鼠的移植物有所缓解[32]。H2可抑制ERK1/2、p38和JNK的磷酸化,减轻异丙肾上腺素诱导的心肌肥厚[33]。然而,有研究在大鼠动脉化静脉移植模型中,饮用富氢水的受体大鼠,其静脉移植物中发现了p38的激活,而没有ERK1/2的激活[34];在小鼠心脏I/R损伤模型中,H2降低了JNK磷酸化,但增加了p38 MAPK和ERK 磷酸化[35]。
3.2 AMPK和PI3K/Akt
AMPK在调节细胞生长、细胞代谢、自噬和细胞极性等方面发挥重要作用[36]。研究表明,H2可通过激活AMPK通路缓解氧化应激,从而促进线粒体保护和内源性抗氧化酶SOD、CAT的转录[37]。近期一项研究表明,H2通过抑制AMPK/mTOR/NLRP3通路,缓解了糖尿病小鼠的心肌损伤[31]。
PI3k-Akt通路是调节细胞周期的重要组成部分,通常在癌细胞、干细胞和心肌细胞中活化,促进其快速增殖[38]。在小鼠心脏 I/R损伤[35]及 LPS诱导的内皮祖细胞损伤[39]中发现,H2处理后PI3K/Akt通路的激活与损伤减轻存在相关性。
3.3 H2重塑免疫细胞亚型
除H2的抗炎特性外,H2对免疫细胞亚型,尤其是调节性T细胞(regulatory T cells,Tregs)和肥大细胞具有影响,如在L-精氨酸诱导的慢性胰腺炎小鼠模型中,H2治疗恢复了外周血单核细胞和脾单核细胞中CD25+Foxp3+Tregs的损失[40];在豚鼠过敏性鼻炎研究中,富氢生理盐水恢复了Th1/Th2细胞的失衡,并上调了CD4+CD25+Foxp3+Treg的水平,诱导白细胞介素10(interluekin-10,IL-10)、叉头蛋白 3(forkhead box P3,Foxp3)和转化生长因子β(transforming growth factor-β,TGR-β)的表达增加[41]。胶原酶诱导脑出血的特点是血脑屏障破坏,Manaenko等[42]研究表明,吸入H2能够通过抑制脑出血后肥大细胞的活化来维持血脑屏障的功能,且这种免疫调节作用可能是通过改变细胞的关键调节因子的表达实现的。H2处理增强了Foxp3的表达,而Foxp3不仅是CD4+CD25+Foxp3+Tregs的特异性分子标志物,而且还能够调节胸腺的分化和外周血的功能(图2)[41]。

图2 H2在氧化应激下调控信号通路的分子机制[41]Fig.2 The molecular mechanism of hydrogen regulating signaling pathway under oxidative stress[41]
4 H2调控的新机制
随着研究的不断深入,关于H2生理医学作用机制的基础研究不断取得新的突破,出现了氢的酶活化作用、氢改变离子通道作用以及氢的脂蛋白调节作用等理论。一项研究以胃蛋白酶为研究对象,采用酶促分析、原子力显微镜峰值力定量纳米力学作图和太赫兹时域光谱技术证实,富氢水能够改变胃蛋白酶的活性位点的空间构象,从而显著提高胃蛋白酶的活性[43]。对于其他生物酶如线粒体复合物Ⅰ、乙酰胆碱酯酶等,H2也可提高其生物学活性,从而影响线粒体及神经细胞的膜电位[44-45]。此外,有研究者对大鼠大脑皮层神经细胞动作电位进行检测,发现H2处理显著影响了皮层神经细胞的阈值电压、动作电位间隔和输入抗阻,而不改变神经递质的含量,表明H2可能是通过该表细胞膜钠、钾等离子通道,从而实现对神经细胞兴奋性的调节[46]。大量研究表明,H2对脂代谢的调节作用尤为突出[47],H2不仅能够降低血浆总胆固醇,还可有效降低低密度脂蛋白(low density lipoprotein,LDL)和极低密度脂蛋白(very low density lipoprotein,VLDL)的水平[7,17],改善高密度脂蛋白(high density lipoprotein,HDL)颗粒的功能,促进巨噬细胞的胆固醇外流并抑制低密度脂蛋白氧化[7,48-49]。H2还可通过降低脂蛋白相关酶的活性和表达,包括脂蛋白相关磷脂酶A2、对氧磷酶-1和卵磷脂胆固醇酰基转移酶,发挥其脂蛋白调节功能[50]。以上研究表明,H2有可能直接与生物大分子相互作用,改变其功能与活性,从而影响细胞生物学功能。
5 展望
截至目前,H2的生物医学作用已在细胞培养、动物模型、人类疾病中得以证实。首先,H2可通过清除氧化自由基、提高内源性抗氧化酶的表达,发挥其抗氧化应激作用。其次,H2可作为信号分子,对细胞凋亡、炎症等信号转导产生影响。同时,新的H2调控机制表明,H2可能通过与生物大分子,如酶的相互作用,增加其活性,进而调控细胞生物学过程。然而,由于H2分子质量小、扩散快、参与反应多等因素,H2作用的靶分子仍未明晰,这给继续深入研究和临床推广增加了难度。未来的研究需要利用新的理论和工具进一步解析其上游效应因子,来阐明H2恢复细胞和机体稳态的机制。
