PD-1抑制剂替雷利珠单抗治疗晚期恶性肿瘤的药理作用与临床评价
2022-07-30罗详冲王周清李琼艳毛贵兵朱家宏陶娥红孙丽飞王胜飞李高峰
罗详冲,王周清,李琼艳,毛贵兵,安 乐,朱家宏,陶娥红,孙丽飞,王胜飞,李高峰
1曲靖市第二人民医院心胸外科,云南曲靖 655000 2云南省肿瘤医院胸外二科,昆明 650118
恶性肿瘤是目前世界范围内严重威胁人类健康和生命的疾病之一。2020年美国最新癌症数据统计显示[1],1990—2017年恶性肿瘤死亡率整体下降了29%,其中2017年较2016年下降了2.2%,死亡例数减少了260万,这在一定程度上得益于基因靶向治疗和免疫治疗的兴起。随着对免疫治疗的深入研究和探索,以程序性死亡[蛋白]-1(programmed death-1,PD-1)/及其配体-1(programmed death ligand-1,PD-L1)和细胞毒性T淋巴细胞相关抗原-4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)等[2-3]为靶点的治疗广泛应用于临床,其相应的免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)如帕博利珠单抗(pembrolizumab)、纳武利尤单抗(nivolumab)、阿特珠单抗(atezolizumab)、特瑞普利单抗(toripalimab)、信迪利单抗(sintilimab)、卡瑞利珠单抗(camrelizumab)、替雷利珠单抗(tislelizumab)和伊匹单抗(ipilimumab)等[4-9],相继在中国获批上市,无论是单药治疗还是联合治疗均有获益,显著延长了肿瘤患者的总生存期(overall survival,OS),并彻底改变了恶性肿瘤的一线、二线和后线治疗选择,不断改写恶性肿瘤治疗的临床实践和指南。
替雷利珠单抗是我国自主研发的抗PD-1单克隆抗体。该药在经典型霍奇金淋巴瘤(classic Hodgkin’s lymphoma,cHL)、尿路上皮癌(urothelium carcino-ma,UC)、非小细胞肺癌(non-small cell lung cancer,NSCLC)、肝细胞癌(hepatocellular carcinoma,HCC)、食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和胃癌(gastric cancer,GC)/胃食管交界癌(esophagogastric junction cancer,EGJC)及鼻咽癌(nasopharyngeal carcinoma,NPC)等肿瘤治疗中均表现出良好的抗肿瘤潜力和安全性。本文就替雷利珠单抗的结构与作用机制、药效学与药代动力学、临床研究及不良反应等方面的最新进展进行阐述,以期为临床医师提供借鉴和参考。
1 结构与作用机制
替雷利珠单抗是一种人源化高亲和力的IgG4单克隆抗体,该抗体由两条相同的轻链和两条相同的重链组成,轻链和重链均由恒定区和可变区组成,其抗原结合片段(fragment of antigen binding,Fab)与靶点PD-1结合,可结晶片段(fragment crystallizable,Fc)与Fcγ受体(Fcγ receptor,FcγR)结合而产生药效动力学,同时轻链上的3个互补决定区域(complementarity determining regions,CDR)和重链上的CDR3与PD-1形成广泛的相互作用[10-11]。研究表明,替雷利珠单抗Fc段经基因工程改造,可减少与巨噬细胞表面表达的FcγR结合,有效避免抗体依赖的细胞吞噬效应,最大程度减少吞噬细胞对效应性T淋巴细胞的吞噬而保留其数量及抗肿瘤作用[12-13]。该抗体可特异性靶向结合表达于CD4+和CD8+T细胞、B淋巴细胞、树突状细胞及自然杀伤细胞等表面的PD-1,且其结构与抗原结合处的面积较大[14],可彻底阻断PD-1与表达于恶性肿瘤细胞、肿瘤浸润性淋巴细胞、抗原提呈细胞及肿瘤浸润性树突状细胞等表面的PD-L1的相互作用,解除PD-1通路介导的T细胞免疫抑制,恢复机体免疫系统监测和杀灭肿瘤的作用[15]。
2 药效学与药代动力学
不同PD-1抑制剂的药效学特征存在差异。其中,由结合位点、结合面积、结合面重叠率和抗原决定簇之间立体构型的合适度决定的亲和力是影响PD-1抑制剂临床疗效和最佳使用剂量的最重要因素[16]。PD-1抑制剂的亲和力可用平衡解离常数KD衡量,KD值越小,表示结合亲和力越大;也可用半数抑制浓度(50% inhibitory concentration,IC50)与半数最大效应浓度(concentration for 50% of maximal effect,EC50)表示,IC50及EC50值越低,亲和力越高,抗肿瘤活性越高。Feng等[17]利用表面等离子体共振技术测试研究表明,替雷利珠单抗可识别PD-1上的关键表位Gln75、Thr76、Asp77和Arg86,以较高的特异性和亲和力与PD-1结合,其与PD-1的结合面积为1112.2 A2,与PD-L1结合的重叠面高达82%,KD值为0.15 nmol/L[18],而纳武利尤单抗和帕博利珠单抗的KD值分别为3.06 nmol/L[19]和29 pmol/L[20]。替雷利珠单抗与PD-1结合的解离速率分别较纳武利尤单抗和帕博利珠单抗减慢约50倍和100倍[17],同时,替雷利珠单抗、纳武利尤单抗和帕博利珠单抗的IC50分别为0.066 mg/L、0.23 mg/L和0.089 mg/L[17],可以看出替雷利珠单抗具有较高的亲和力。
此外,群体药代动力学(population pharmacokinetics,popPK)模型分析显示[21],替雷利珠单抗的药代动力学(pharmacokinetic,PK)在0.5~10 mg/kg剂量范围内显示线性,无随时间变化的清除率(clearance,CL)。单次注射替雷利珠单抗200 mg后药物分布容积为4.41 L,稳态分布容积为5.247 L、CL为0.247 L/d,药物消除半衰期为13.3 d;重复给药后进行popPK分析,CL为0.171 L/d,终末半衰期为26 d[8]。因此,替雷利珠单抗良好的药代动力学研究数据为其疗效奠定了基础。
3 临床研究
3.1 经典型霍奇金淋巴瘤
cHL是一种治愈率较高的恶性淋巴瘤,一线首选方案为化疗联合放疗,大部分患者可获得完全缓解(complete response,CR)和较长的OS,但部分复发或难治性cHL患者的治疗仍是目前研究的难点和热点[21]。近年来,以PD-1抑制剂为代表的免疫治疗成为cHL治疗的新选择,有望打破cHL治疗的壁垒。目前获批用于治疗cHL的PD-1抑制剂包括纳武利尤单抗、帕博利珠单抗、信迪利单抗、卡瑞利珠单抗及替雷利珠单抗。一项中国自主开展的Ⅱ期单臂、多中心临床试验研究(NCT03209973)[22]评估了替雷利珠单抗用于治疗复发或难治性cHL的有效性和安全性,该研究共纳入70例接受自体干细胞移植(autologous stem cell transplantation,ASCT)后未达到缓解或出现疾病进展或既往经过至少二线系统化疗且不适合接受ASCT治疗的复发或难治性cHL患者,接受替雷利珠单抗治疗(200 mg静脉输注,3周1个疗程),直至出现疾病进展、不可耐受的毒性或研究终止;其主要研究终点为由独立审查委员会(independent review committee,IRC)评价的客观缓解率(objective response rate,ORR),次要研究终点为缓解持续时间(duration of response,DOR)、治疗起效时间(time to response,TTR)、无进展生存期(progression free survival,PFS)和安全性。结果表明,患者中位随访时间为9.8个月,61例(87.1%)达到ORR,其中44例(62.9%)达到CR,所有患者均未达到中位PFS和OS,9个月无进展生存率和总生存率分别为74.5%和98.6%;安全性方面,常见不良反应(adverse events,AEs)为甲状腺功能异常(21.4%)、皮肤不良反应(8.6%)、肺炎(5.7%)等,且多为1或2级,安全可控。该研究证实替雷利珠单抗用于ASCT治疗进展或不能接受ASCT治疗的cHL患者,疗效好且耐受性良好。基于上述研究结果,国家药品监督管理局(National Medical Products Administration,NMPA)批准替雷利珠单抗上市,用于治疗至少经过二线化疗的复发或难治性cHL患者[8]。
3.2 尿路上皮癌
UC是泌尿生殖系统最常见的恶性肿瘤之一,90% 以上为膀胱尿路上皮癌。尽管铂类联合化疗是晚期UC患者的一线标准治疗方案,但使用ICIs治疗UC已成为目前主要趋势[23]。基于IMvigor210-Cohort1研究[24]和KEYNOTE-052研究[25],阿替利珠单抗和帕博利珠单抗获美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于UC患者的一线治疗;基于CheckMate275研究[26]、Study1108研究[27]和JAVELIN研究[28],纳武利尤单抗、度伐利尤单抗和阿维单抗获FDA批准用于UC患者的二线治疗。
我国自主研发的替雷利珠单抗在UC治疗领域也取得了突破性进展。一项Ⅱ期单臂临床试验(NCT04004221、BGB-A317-204)[29]评估了替雷利珠单抗用于PD-L1表达阳性UC患者的安全性和有效性,该研究共纳入113例局部晚期或转移性UC患者,接受替雷利珠单抗治疗(200 mg静脉输注,3周1个疗程),直至出现疾病进展、不可耐受的毒性或研究终止;主要研究终点为ORR,次要研究终点为DOR、PFS、OS和安全性。结果表明,在104例可评估患者中,由IRC评估的ORR为24%(25例)、完全缓解率为10%(10例)、部分缓解(partial response,PR)率为14%(15例)、疾病控制率(disease control rate,DCR)为38%,中位OS为9.8个月,6个月和12个月的总生存率分别为67%和43%;中位PFS为2.1个月,6个月和12个月的无进展生存率分别为32%和20%;安全性方面,大部分与治疗相关的AEs为1~2级,3~4 级AEs的发生率为38%,最常见为贫血(27%)、发热(19%)和食欲减退(19%);免疫相关不良事件(immune related adverse events,irAEs)发生率为27%,3级以上irAEs的发生率仅为7%,无致死性irAEs发生。该研究表明,替雷利珠单抗在既往接受过含铂化疗的晚期UC患者中显示出良好疗效,且安全可控。基于BGB-A317-204研究,替雷利珠单抗在国内获批成为首个用于UC患者的PD-1抑制剂。
3.3 肺癌
肺癌是全球发病率和死亡率最高的恶性肿瘤[1]。随着基因靶向药物和免疫治疗的蓬勃发展,晚期肺癌治疗迈向了精准化和多元化格局。针对驱动基因突变阳性的晚期肺癌患者可选择相应的靶向药物;而驱动基因突变阴性的患者,可考虑免疫治疗。从纳武利尤单抗的二线治疗到帕博利珠单抗单药或联合化疗一线治疗局部晚期或转移性NSCLC,免疫治疗在晚期肺癌领域已实现全线覆盖[30]。国内自主研发的信迪利单抗、卡瑞利珠单抗、特瑞普利单抗和替雷利珠单抗在肺癌治疗领域取得了可喜成果。其中,替雷利珠单抗因其独特的药学特性成为晚期NSCLC免疫治疗领域的新星。目前多项临床研究评估了替雷利珠单抗联合化疗一线治疗NSCLC的疗效[31]。国内开展的开放标签Ⅱ期临床试验(BGB-A317-206)[32]探索替雷利珠单抗联合含铂双药化疗作为晚期肺癌一线治疗的疗效,该研究纳入54例经组织学/细胞学证实为晚期非鳞状非小细胞肺癌(nonsquamous non-small cell lung cancer,NSQ-NSCLC)、鳞状非小细胞肺癌(squamous non-small cell lung cancer,SQ-NSCLC)和广泛期小细胞肺癌(small cell lung cancer,SCLC)的患者,所有患者均接受替雷利珠单抗200 mg联合4~6个周期的含铂双药化疗,其中NSQ组采用培美曲塞联合铂类双药化疗4个周期,而后使用培美曲塞进行维持治疗;SQ组分别使用紫杉醇联合铂类双药化疗(SQ-A组)和吉西他滨联合铂类双药化疗(SQ-B组);SCLC采用依托泊苷联合铂类双药化疗,主要研究终点为ORR,次要研究终点为PFS和耐受性。结果表明,NSQ组、SQ-A组、SQ-B组和SCLC组的ORR分别为44%、80%、67%和77%;NSQ组、SQ-A组和SCLC组的中位PFS分别为9个月、7个月和6.9个月,SQ-B组的中位PFS未达到;除SCLC组的OS为15.6个月外,其余组的OS均未达到,NSQ组、SQ-A组、SQ-B组和SCLC组的1年总生存率分别为88%、93%、80%和76%。该研究表明,替雷利珠单抗联合铂类双药化疗用于晚期肺癌患者的一线治疗具有良好的抗肿瘤活性。
另一项Ⅲ期随机临床试验(RATIONALE 307)[33]比较了替雷利珠单抗联合化疗与单独化疗作为晚期SQ-NSCLC一线治疗的疗效,研究共纳入355例经组织学证实为ⅢB/Ⅳ期的SQ-NSCLC患者,按1∶1∶1 随机分为三组,其中替雷利珠单抗联合紫杉醇+卡铂为A组,替雷利珠单抗联合白蛋白紫杉醇+卡铂为B组,单纯紫杉醇联合卡铂为C组。主要研究终点为IRC评估的PFS,次要研究终点为OS、ORR、DOR和安全性。结果表明,中位随访时间为8.6个月,A组和B组患者的中位PFS均达到7.6个月,显著高于C组的5.5个月;与C组相比,A组和B组患者的疾病进展风险分别降低了47.8%和52.4%;此外,A组、B组和C组的ORR与DOR分别为72.5%、74.8%和49.6%与8.2个月、8.6个月和4.2个月,可以看出A组和B组的ORR和DOR均得到显著改善,且未观察到PD-L1表达水平与PFS或ORR间的关联。安全性方面,三组患者最常见的3级及以上AEs是中性粒细胞水平下降,与化疗毒副反应一致;6例患者因发生与治疗相关的AEs而死亡,但死亡未完全归因于替雷利珠单抗。该研究表明,无论PD-L1表达水平如何,替雷利珠单抗联合化疗相较于单纯化疗,可显著延长和提高SQ-NSCLC患者的PFS和ORR,且耐受性良好。基于该研究,2021年1月13日,NMPA批准替雷利珠单抗联合化疗用于局部晚期或转移性SQ-NSCLC的一线治疗,填补了晚期肺鳞癌领域的一线治疗空白。
此外,在中国人群中开展的开放性、多中心、随机Ⅲ期临床研究(RATIONALE 304)[34]评估了雷利珠单抗联合培美曲塞和铂类与单纯化疗一线治疗ⅢB或Ⅳ期NSQ-NSCLC患者的有效性和安全性。结果表明,中位随访时间为9.8个月,替雷利珠单抗联合化疗组与单纯化疗组的中位PFS、ORR与DOR分别为9.7个月与7.6个月、57.4%与36.9%、8.5个月与6.0个月,替雷利珠单抗联合化疗组相较于单纯化疗组可显著改善患者的PFS、ORR和DOR。安全性方面,替雷利珠单抗联合化疗组发生的AEs多为轻度或中度。基于RATIONALE 304的研究成果,2021年6月22日NMPA批准替雷利珠单抗联合培美曲塞和铂类用于表皮生长因子受体(epidermal growth factor receptor,EGFR)和间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)基因突变阴性的不可手术切除的局部晚期或转移性NSQ-NSCLC的一线治疗。
3.4 肝细胞癌
目前HCC的化疗敏感性差,以抗血管生成为主的靶向药物如索拉非尼(sorafenib)、仑伐替尼(lenvatinib)和瑞戈非尼(regorafenib)治疗是晚期HCC的主要治疗手段,但疗效十分有限[35]。近年来,ICIs在HCC临床治疗中展现出良好疗效,基于CheckMate-040研究[36]和KEYNOTE-224研究[37]的结果,纳武利尤单抗和帕博利珠单抗获FDA批准用于晚期HCC的二线治疗。替雷利珠单抗作为中国自主研发的创新药物在HCC领域也获得了良好的证据支持。一项替雷利珠单抗用于晚期实体瘤的Ⅰ/Ⅱ期临床研究(RATIONALE 102)[38]表明,经过中位8个月的随访,接受替雷利珠单抗治疗的HCC患者的ORR为17%,中位PFS为4.0个月。一项“头对头”Ⅲ期临床试验研究(RATIONALE 301、NCT03412773)[39]比较替雷利珠单抗与索拉非尼一线治疗不可切除HCC的疗效正在开展中,期待取得满意结果。因此,替雷利珠单抗在晚期HCC患者中显示出良好的抗肿瘤潜力,随着研究的不断深入,希望其在HCC一线、二线和后线治疗中均获得良好的疗效及安全性,为晚期HCC患者带来新的选择。
3.5 食管鳞状细胞癌和胃癌/胃食管交界癌
目前晚期消化道肿瘤如ESCC和GC/EGJC的主要治疗方法为化疗和放疗,但效果欠佳、复发率和转移率较高,患者总体预后较差[40]。随着免疫治疗在多个肿瘤治疗领域取到突破,其在消化道肿瘤领域也极具前景。一项Ⅱ期临床试验研究(NCT03469557)[41]评估了替雷利珠单抗联合化疗治疗局部晚期/转移性ESCC或GC/EGJC患者的安全性和抗肿瘤活性,该研究共纳入30例患者,其中15例ESCC患者接受替雷利珠单抗联合顺铂和5-氟尿嘧啶治疗,15例GC/EGJC患者接受替雷利珠单抗联合奥沙利铂和卡培他滨治疗。主要研究终点为安全性和耐受性,次要研究终点为ORR、DOR、DCR和PFS。结果表明,与治疗相关最常见的AEs为贫血、食欲减退、恶心和乏力;无论PD-L1表达水平如何,在ESCC和GC/EGJC患者中,替雷利珠单抗均可产生持久的临床应答。在ESCC和GC/EGJC队列中,患者的ORR和DCR均相同,分别为46.7%和80.0%;每个队列均有7例患者获得PR,ESCC队列中5例患者获得疾病稳定(stable disease,SD),GC/EGJC队列中3例患者获得SD。ESCC组的中位DOR为12.8个月,GC/EGJC组的中位DOR仍不成熟,ESCC组和GC/EGJC组的中位PFS分别为10.4个月和6.1个月。该研究显示,替雷利珠单抗联合化疗治疗ESCC和GC/EGJC显示出持久的疗效,且患者耐受性良好。
3.6 其他恶性肿瘤
替雷利珠单抗在NPC[42]、乳腺癌[43]等多种瘤体中均表现出良好的抗肿瘤活性和耐受性,一系列相关临床试验研究正在开展中(表1),期待获得满意的临床效果,为晚期恶性肿瘤患者带来希望。
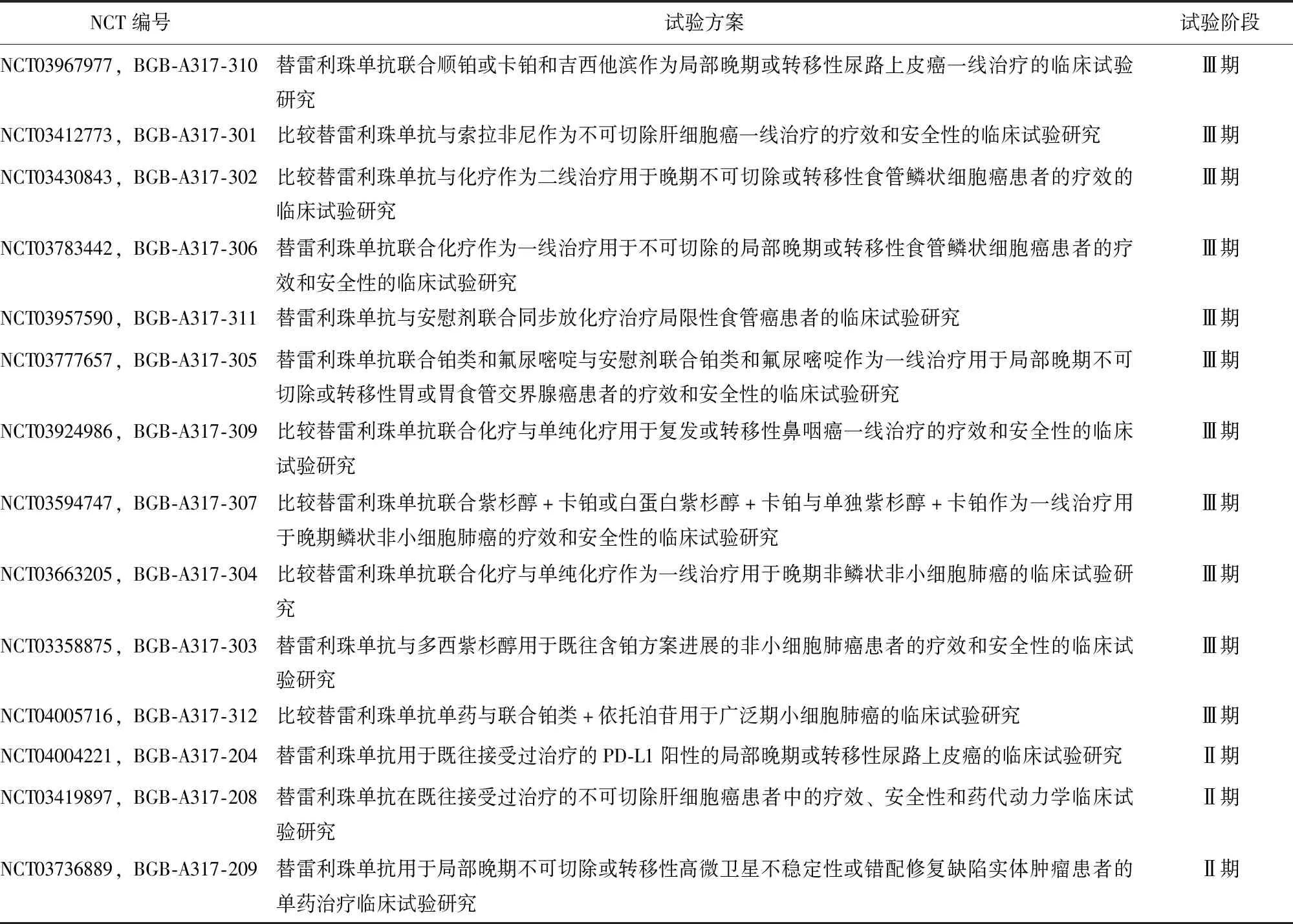
表1 正在开展的替雷利珠单抗治疗晚期恶性肿瘤患者的临床试验研究
4 不良反应
基于目前替雷利珠单抗的Ⅰ、Ⅱ及Ⅲ期临床试验研究结果,与替雷利珠单抗治疗相关的常见AEs多为1级或2级,且安全可控,主要包括发热、甲状腺功能减退症、体质量增加、瘙痒症、白细胞计数降低、上呼吸道感染、丙氨酸氨基转移酶升高、天门冬氨酸氨基转移酶升高、皮疹、中性粒细胞计数降低、咳嗽、疲乏、血胆红素升高等[24,30,33,39,41]。3级及以上常见AEs为重度皮肤反应、贫血、肺部炎症、高血压及肾上腺皮质功能不全等[24,30,44]。
5 小结与展望
免疫治疗是目前恶性肿瘤领域进展最快的治疗策略和方法,不同的免疫抑制剂联合化疗或抗血管生成药物治疗恶性肿瘤方面均取得了重要突破。替雷利珠单抗作为国内自主研发的PD-1抑制剂创新药,因其独特的结构和作用机制,在cHL、UC及肺癌等多种瘤体的治疗中取得了成功并获批上市,为恶性肿瘤患者提供了治疗新策略。与此同时,也面临诸多挑战。首先,如何根据个体化精准选择替雷利珠单抗或其他PD-1抑制剂;其次,目前联合治疗是恶性肿瘤治疗的重要选择,在多种治疗模式可选择的情况下,如何决策替雷利珠单抗联合化疗或抗血管生成药物或单药治疗是未来研究和探索的重点;再次,需进一步探索筛选替雷利珠单抗治疗获益人群的生物标志物;最后,需探索解决替雷利珠单抗的耐药问题,如替雷利珠单抗联合抗血管生成药物或其他免疫抑制剂以克服其免疫耐药。相信随着更多临床研究的开展和不断探索,替雷利珠单抗的应用将覆盖更多瘤种并取得良好疗效,造福更多恶性肿瘤患者。
作者贡献:罗详冲负责文献检索和论文撰写;王周清、李琼艳、毛贵兵、安乐、朱家宏、陶娥红、孙丽飞、王胜飞负责文献资料收集;李高峰负责写作指导和论文修订。
利益冲突:所有作者均声明不存在利益冲突
