不同盐胁迫对甘遂种子萌发的影响*
2022-07-28高紫云宋洪川徐武美郭嘉航李思民黄晶心官会林孙世中
高紫云, 宋洪川, 徐武美, 郭嘉航,李思民, 黄晶心, 官会林, 孙世中
(云南师范大学 能源与环境工程学院,高原特色中药材种植土壤质量演变退化与修复云南省野外科学观测研究站,云南省农村能源工程重点实验室,云南 昆明 650500)
土壤盐渍化是制约农业发展的重要因素之一,不仅严重干扰植物正常的生长发育进程,同时对区域内植物地理分布产生了巨大的不利影响.调查显示,在全球范围内,盐渍化的土地面积约有9.5×108hm2,而仅我国就已有9×107hm2的土地遭到了盐渍化的严重侵袭[1];且随着全球气候的变化以及近年来诸多不当的农业耕作及灌溉措施的施行,预计未来土壤盐渍化的问题将会持续加重,盐渍化的土地面积也将进一步扩大[2].
盐碱胁迫作为影响作物生长发育的重要的非生物胁迫之一,通过形成的渗透胁迫和离子胁迫干扰植株内部的物质合成及外部的形态构建[3];种子萌发期是植株整个生命进程中最复杂也是最关键的时期,此时植株对外界盐碱环境的变化最为敏感,反应也最为明显和强烈[4].因此,植株对某种盐碱环境的耐受能力能够从种子萌发阶段时的萌发表现以及胚芽的生长特征上得以体现[5].
甘遂是我国独有的一种药用草本作物,广泛分布于我国陕西、山西、甘肃及河南等地,甘遂入药具有利尿、引产、泻下及消肿等显著效用[6],因其优秀的逐水特性,在医药界享有“泻水圣药”的美誉[7-8].
目前,国内医药行业对甘遂的需求量激增,但由于室内种植甘遂生长缓慢且产量不佳,甘遂的栽培和生产还是以野外自然条件下种植为主[9],但山西、陕西和河南等甘遂主产区日益加重的土壤盐渍化极大地制约了甘遂的产出并影响了药材品质[10].且甘遂在盐胁迫环境下的萌发特性尚未有前人进行系统性的研究探讨,因此此次试验采用方差分析以及拟合回归线的方法,通过使用不同浓度的NaCl、Na2SO4及NaHCO3溶液对甘遂种子进行盐胁迫处理,观察并分析在三种不同盐胁迫环境下甘遂种子的萌发表现和响应特征,进而总结甘遂种子的耐受机制和抑制其萌发的盐溶液浓度范围,旨在为甘遂的土壤选择、科学栽培以及耐盐品种选育提供一定的理论依据.
1 材料与方法
1.1 试验材料
甘遂种子购自山西运城四季药材种苗站,所用钠盐为分析纯NaCl、Na2SO4及NaHCO3.挑选颗粒饱满、大小一致且无病虫害的甘遂种子3 000粒,使用1%次氯酸钠溶液充分浸泡20 min后,再用无菌蒸馏水冲洗干净,最后使用无菌滤纸吸干种子表面水分,静置备用.
1.2 试验方法
分别设置0、50、100、150、200、250 mmol·L-1和300 mmol·L-1的NaCl(pH 7.0)、Na2SO4(pH 7.0)和NaHCO3(pH 8.3)溶液[11-12].种子萌发采用培养皿滤纸芽床法,即在直径为9 cm的培养皿中铺设两层定性滤纸,每个培养皿中均匀放置50粒备用的种子,并分别倒入5 mL对应浓度的盐溶液,每个处理设6组重复.将培养皿加盖后放置入25 ℃且相对湿度为60%~70%的恒温培养箱中培养,利用称重法每天补充蒸发掉的水分,保证各个处理组中对应盐溶液浓度不变,每天定时统计当日种子萌发数量,以胚芽露出种皮1 mm为萌发标准,以第4天作为萌发高峰计算发芽势;待种子萌发全部停止时,将全部未萌发的种子用蒸馏水洗净,放入蒸馏水中复水,每天定时统计复水后各处理组种子的新增萌发数.经前期甘遂种子萌发预实验可知,12 d内种子萌发过程已全部结束,故在此次试验中取12 d作为萌发试验总时长.
1.3 指标测定方法
种子的发芽率=(萌发数量/供试数量)×100%;
种子的发芽势=(从开始至发芽高峰的萌发数量/供试数)×100%;
发芽指数=∑(GT/DT),
式中,DT为萌发相应天数,GT为相应天数种子的发芽数;
活力指数=发芽指数×平均每皿总胚芽长[13-14];
相对发芽率=(处理组发芽率/对照组发芽率)×100%;
相对盐害率=(对照组发芽率-处理组发芽率)/对照组发芽率×100%;
萌发恢复率=[(A-B)/(C-B)]×100%,
式中,A为全部时间的发芽种子数,B为盐溶液中的发芽种子数,C为该处理全部种子数;
终萌发率=(胁迫下萌发的种子数+复水后萌发的种子数)/供试种子数×100%;
将种子相对发芽率与相应的盐溶液浓度建立回归关系,耐盐适宜浓度、耐盐半致死浓度和耐盐极限浓度分别为相对发芽率为75%、50%和25%时对应的盐溶液浓度.
1.4 数据分析与处理
使用Microsoft Excel 2019软件整理试验数据并绘制图表,使用IBM SPSS Statistics 25软件对数据进行可重复双因素方差分析与单因素ANOVA检验,并进行显著差异检验(P<0.05).
2 结果与分析
2.1 盐胁迫对甘遂种子萌发动态的影响
由表1可以得出,各NaCl浓度处理下甘遂种子萌发率随时间延长稳步提升,总体而言,同一时间段内,甘遂种子萌发率随NaCl浓度升高而降低,150~300 mmol·L-1NaCl胁迫下甘遂种子萌发率在任何时间段均显著低于对照(P<0.05);另外,当NaCl浓度达到200 mmol·L-1时,开始萌发时间较对照组推迟了1 d,浓度为250 mmol·L-1及300 mmol·L-1时,萌发开始时间均推迟了2 d.
可重复双因素方差分析表明,处理时间和NaCl浓度以及两者交互作用均能够对甘遂种子发芽率产生极其显著的影响(P< 0.01).
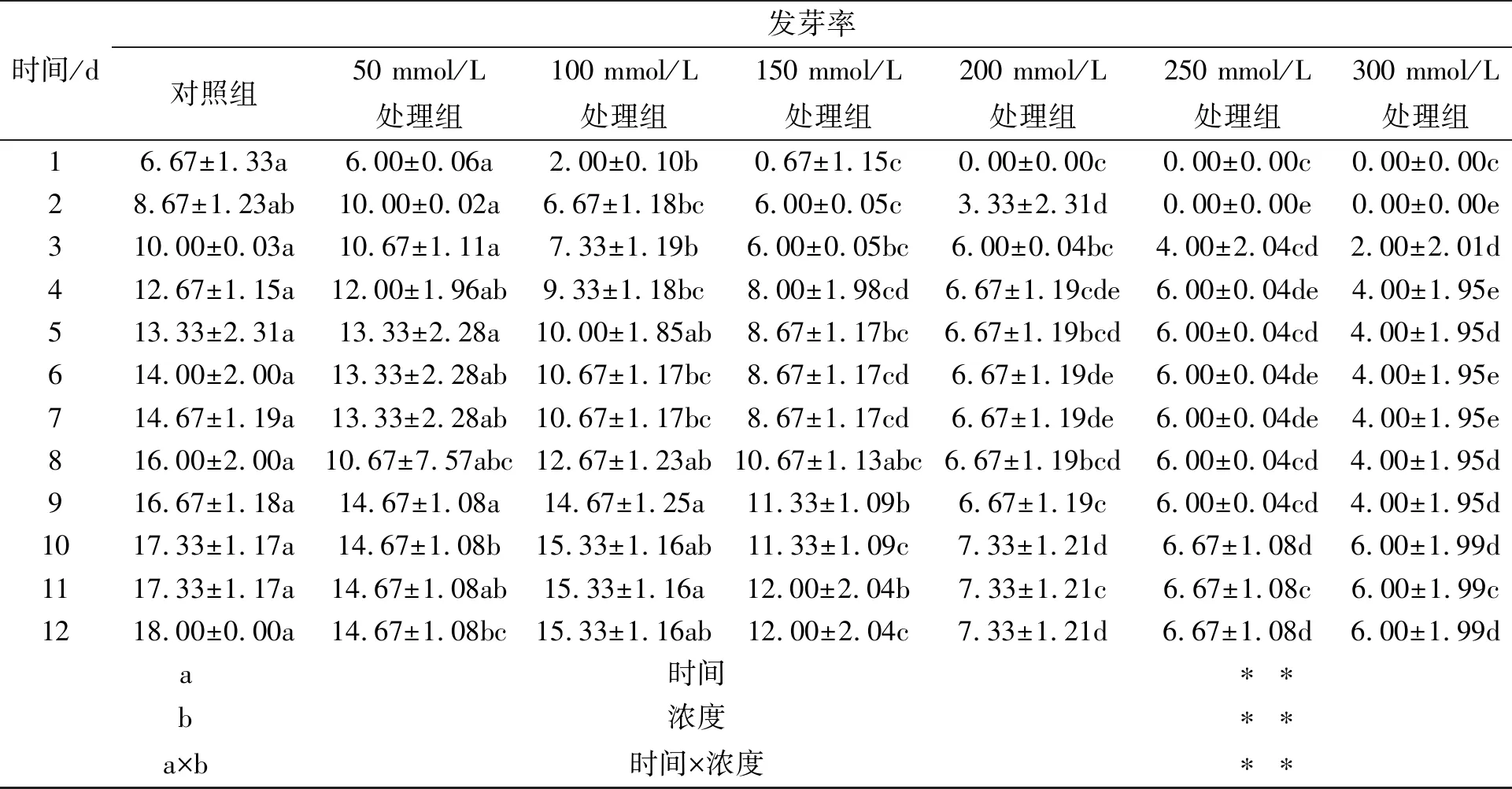
表1 NaCl处理对甘遂种子萌发动态影响
同行不同小写字母表示在P<0.05水平上差异显著;**表示在0.01水平差异显著,*表示在0.05水平差异显著,ns 表示无显著性差异,下同.
如表2所示,经不同浓度Na2SO4处理下的各组,第1~4天内,300 mmol·L-1Na2SO4处理组萌发率显著低于对照组(P< 0.05);第5~12天内,随Na2SO4浓度升高,甘遂种子萌发率呈先升高后降低的趋势.
可重复双因素方差分析表明,处理时间和Na2SO4浓度均能够对甘遂种子发芽率产生极其显著的影响(P< 0.01),处理时间和Na2SO4浓度交互作用对甘遂种子发芽率无显著性影响.

表2 Na2SO4处理对甘遂种子萌发动态影响
如表3所示,经不同浓度NaHCO3处理下的各组,总体而言,在同一时间段内,萌发率随NaHCO3浓度的升高而降低;当NaHCO3浓度达到250 mmol·L-1时,种子开始发芽时间推迟了1 d,当盐分浓度达到300 mmol·L-1时,种子开始萌发时间推迟了2 d,且250 mmol·L-1和300 mmol·L-1NaHCO3处理组萌发率在任何时间段均显著低于对照组(P<0.05).
可重复双因素方差分析表明,处理时间和NaHCO3浓度以及两者交互作用均能够对甘遂种子发芽率产生极其显著的影响(P<0.01).
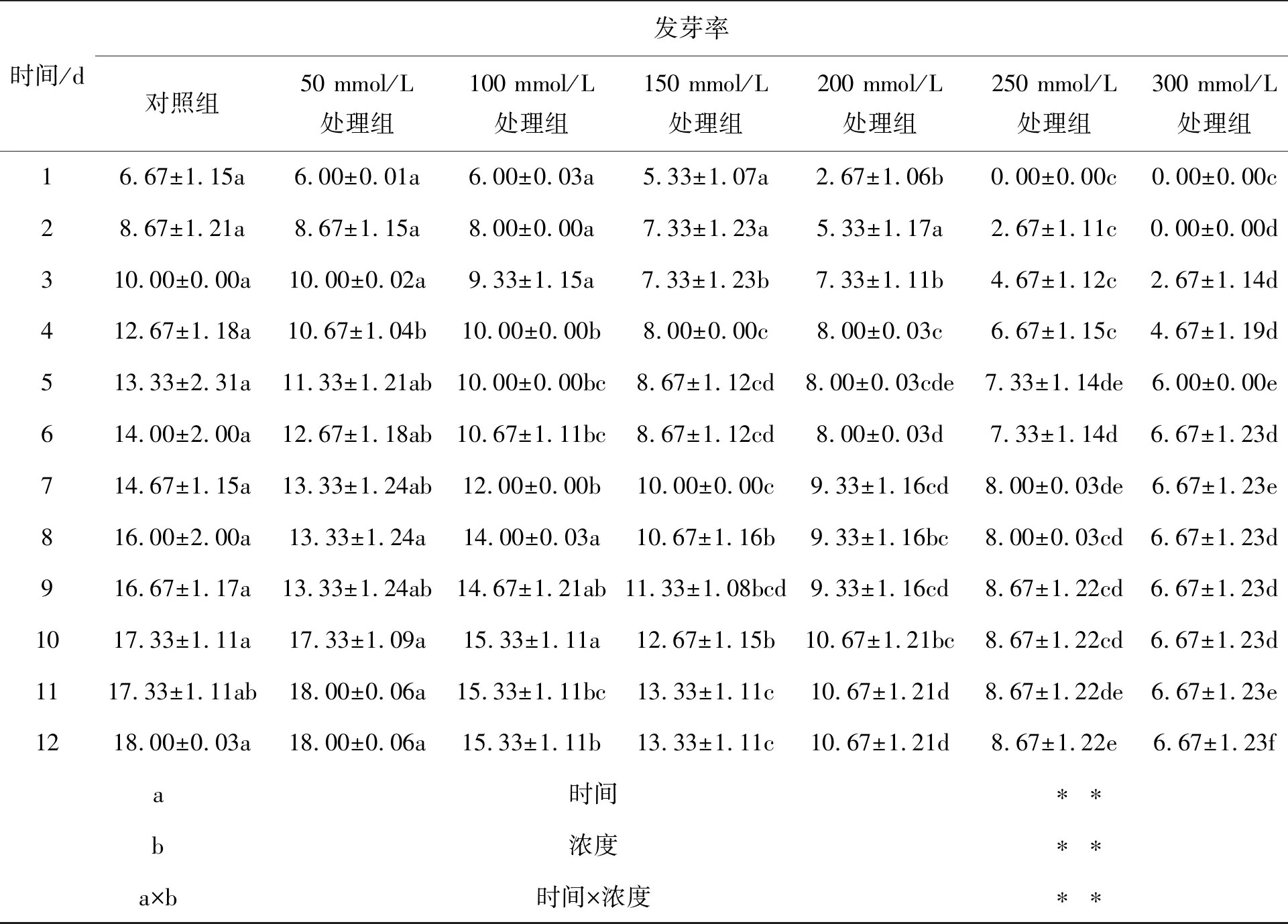
表3 NaHCO3处理对甘遂种子萌发动态影响
2.2 盐胁迫对甘遂种子相关萌发指标的影响
由表4可知,经不同浓度的NaCl溶液和NaHCO3溶液处理后的甘遂种子各发芽指标均呈现随浓度升高而不断降低的趋势,当盐溶液浓度达到300 mmol·L-1时,NaCl处理组和NaHCO3处理组发芽率、发芽势、发芽指数以及活力指数均达到最低,显著低于对照组(P<0.05).而Na2SO4盐溶液处理组发芽率与发芽指数均呈现随盐溶液浓度先升高后降低的趋势,其中发芽率在200 mmol·L-1时达到顶峰,比对照组高25.89%,发芽指数在150 mmol·L-1时达到顶峰,比对照组高4.91%;发芽势总体呈现先下降,后升高,又下降的变化趋势,在浓度为200 mmol·L-1时与对照组持平;活力指数随Na2SO4浓度的升高不断下降,到300 mmol·L-1时,活力指数达到最低,仅为对照组的10.23%.由此可见,甘遂种子对Na2SO4的耐受性强于NaCl和NaHCO3,并且低浓度的Na2SO4在一定程度上可以促进种子的萌发,但又仅限于促进种子萌动与破壳,盐溶液的刺激依然会导致种子整体生活力的下降.
可重复双因素方差分析表明,盐溶液种类、盐溶液浓度以及盐溶液种类和浓度的交互作用均能够对甘遂种子发芽率、发芽势、发芽指数和活力指数产生极其显著的影响(P<0.01) .
2.3 复水对甘遂种子恢复萌发的影响
由图1-3可见,NaCl盐溶液处理组种子复水后,最终萌发率较复水前萌发率均有不同程度的增长,且随着盐溶液浓度的逐渐升高呈现先增高后降低的趋势,当盐溶液浓度达到100 mmol·L-1时,最终萌发率达到顶峰,比对照组高11.10%(P<0.05).萌发恢复率整体呈现先升高后下降的趋势,且在NaCl浓度为150 mmol·L-1时达到最高;Na2SO4盐溶液处理组复水后,复水后萌发恢复率与最终萌发率均随浓度的升高先升高而后降低,且前者在不同浓度盐溶液处理组间差异不显著,后者在盐溶液浓度为50~250 mmol·L-1时显著高于对照组(P<0.05),当浓度达到200 mmol·L-1时,最终萌发率达到顶峰,比对照组高44.44%.NaHCO3溶液处理组复水后,最终萌发率与复水后萌发恢复率均在盐溶液浓度为50 mmol·L-1时显著升高随后不断降低,50 mmol·L-1时最终萌发率比对照高7.44%(P<0.05).

图1 甘遂种子在NaCl胁迫下的发芽率、萌发恢复率和最终发芽率

图2 甘遂种子在Na2SO4胁迫下的发芽率、萌发恢复率和最终发芽率
2.4 甘遂种子对不同盐胁迫的耐受性
由表5可知,处理组种子萌发进程受到的盐分伤害随盐浓度的升高而愈发剧烈,而相同盐溶液浓度下,Na2SO4处理组相对盐害率显著低于其余两种盐溶液处理组,且在50~250 mmol·L-1浓度区间内,相对盐害率与对照组无显著性差异(P<0.05).NaCl处理组与NaHCO3处理组相比,除100 mmol·L-1处理组外,在相同盐浓度下,NaCl处理组相对盐害率显著高于NaHCO3处理组(P<0.05).由此可见,甘遂种子对Na2SO4的耐受性最好,对NaCl耐受性最差,三种盐对甘遂种子萌发进程的抑制作用从强到弱顺序依次为NaCl>NaHCO3>Na2SO4.
可重复双因素方差分析表明,盐溶液种类、盐溶液浓度以及盐溶液种类和浓度的交互作用均能够对种子相对盐害率产生极其显著的影响(P< 0.01).
如表6所示,依据盐浓度与发芽率之间的显著相关性建立两者间的回归直线方程式.由表中公式可知,甘遂种子对NaCl、Na2SO4及NaHCO3的耐盐适宜浓度分别为109.00、318.00 mmol·L-1和140.00 mmol·L-1,半致死浓度分别为221.50、396.57 mmol·L-1和277.50 mmol·L-1,临界浓度分别为334.00、446.57 mmol·L-1和365.00 mmol·L-1.

表6 甘遂种子发芽率与盐分浓度回归分析结果
3 讨论
种子萌发期是植物整个生命周期中对外界环境刺激响应最为强烈和脆弱的时期[15].种子萌发期对不同盐的应激表现往往最能够反映出此种植物对该盐的耐受性[16].而盐分对种子萌发的影响往往和盐的种类、浓度以及种子类型,甚至同一种种子的采收年份有密切关联[17].盐胁迫对种子萌发的影响一般通过渗透调节和离子毒害作用实现,前者一般通过改变细胞内外溶液环境的渗透压来抑制细胞对水分的汲取和利用,进而干扰细胞的正常生命活动;后者一般是无机盐离子进入细胞,影响细胞膜结构的渗透调节,进一步紊乱细胞内部的代谢活动,使得呼吸作用无法正常进行[18].
研究使用不同浓度的NaCl、Na2SO4和NaHCO3对甘遂种子萌发阶段进行胁迫,结果表明,不同浓度的NaCl和NaHCO3均会对甘遂种子的萌发产生抑制作用,发芽率、发芽势、发芽指数以及萌发指数均呈下降趋势,并且随盐溶液浓度的升高,抑制作用逐渐加强.说明NaCl和NaHCO3能够通过渗透胁迫和离子毒害作用抑制甘遂种子的萌发潜力和发芽整齐度,推迟发芽高峰和开始萌发的时间,影响种子生长和物质积累.而Na2SO4处理组在低浓度条件下表现出对种子萌发的促进,高浓度才表现出抑制,这与朱毅等[12]的研究结果一致.这可能是由于甘遂种子对Na2SO4的耐受性强,低浓度的Na2SO4溶液作用下,部分钠离子进入细胞内,使得细胞内渗透压升高,细胞吸水能力提升,促进了细胞内部代谢反应的进行;也可能是微量的钠离子激活了细胞中相关呼吸酶,进而促进了细胞内营养物质的转化和利用的缘故[19].
值得注意的是,NaHCO3处理组活力指数显著低于同等浓度下的NaCl和Na2SO4处理组,表明NaHCO3能够显著的抑制种子胚芽的伸长和生长,并且抑制作用显著强于同浓度的NaCl和Na2SO4,此种结果应该由于NaHCO3作为一种碱性盐(pH 8.3),不仅通过渗透作用和离子毒害对种子萌发产生负面影响,而且还造成了过高pH的不良环境[20],碱性环境下,细胞的结构和功能遭到进一步破坏,离子平衡被打破,细胞为了维持正常的生命活动不得已需要消耗更多的物质和能量去对抗pH过高产生的逆环境,进而抑制了胚芽的生长进程[21].因此,在对种植了甘遂的土壤进行浇灌时应注意避免碱性水源,以规避过高pH对甘遂生长发育所产生的不良影响.
对不同处理组种子复水试验后的数据进行分析,可以看出脱离盐胁迫环境后,低浓度的盐溶液处理组最终萌发率与对照组有显著性差异(P<0.05),100 mmol·L-1NaCl、50 ~250 mmol·L-1Na2SO4和50 mmol·L-1NaHCO3处理组最终萌发率显著高于对照组,说明低浓度的盐溶液主要通过渗透胁迫使得种子吸水困难来暂时抑制种子萌发,并未破坏种子内部的生理结构和膜系统,在外界渗透环境回复到正常水平后,种子细胞仍然能保持正常的萌发能力,这与前人研究结果相吻合[22].此外由于植物体不同的补偿和超补偿机制[23-24],在盐胁迫解除后,外界渗透环境和离子环境发生激烈变化,相关代谢酶受到刺激,活性增强,也进一步打破了种子休眠,提高了发芽率[25].同时从试验结果可以看到,250 mmol·L-1和300 mmol·L-1NaHCO3处理组种子最终萌发率与复水前萌发率没有显著性差异,这可能是由于过高的盐分胁迫对细胞产生了严重的离子毒害,使得细胞膜系统失去了控制离子进出的能力,导致细胞异变和吸涨,对细胞正常的生理代谢造成了不可逆转的损伤,使得种子即使解除了盐胁迫也永久丧失了继续萌发的能力[4,26].
通过对甘遂种子的耐盐性评价,可知低浓度的Na2SO4对甘遂种子萌发呈现出促进作用,相对盐害率为零,另外从回归方程可得Na2SO4的耐盐适宜浓度、半致死浓度和临界浓度均为最高,NaCl最低,NaHCO3居中.综上,甘遂种子对Na2SO4具有较强的耐受性,对NaCl和NaHCO3的刺激则较为敏感,且对NaCl的耐受性最差.这与张丽平等[27]得出的结果不一致,可能的原因是不同植物代谢反应进程不同,对不同类型盐胁迫的响应表现也有差别.因此,在甘遂种子实际栽培过程中,应针对土壤中含盐量和盐分组成差异有选择地种植,进而保证甘遂植株的健康生长.
4 结语
随盐浓度的升高,NaCl与NaHCO3处理组的甘遂种子发芽率、发芽势、发芽指数和活力指数等发芽指标均总体呈下降趋势,Na2SO4处理组发芽率、发芽势和发芽指数总体呈先上升后下降趋势,活力指数则持续下降,表明低浓度Na2SO4对甘遂种子萌发有一定促进作用.复水后,各盐处理组最终萌发率均有不同程度回升,低浓度盐处理下,最终萌发率显著大于对照,表明低浓度盐胁迫对种子萌发的抑制作用主要来源于渗透胁迫,具有暂时性.耐盐性评价结果表明,甘遂种子对三种盐的耐受性由强到弱顺序依次为Na2SO4>NaHCO3>NaCl.
