NADPH氧化酶4抑制剂对贝伐单抗诱导人RPE细胞上皮-间质转化的抑制作用
2022-07-26谢超慧郝相慧杨玲玲徐海峰
谢超慧 郝相慧 杨玲玲 徐海峰
1青岛大学医学部,青岛 266071;2山东省第一医科大学附属眼科研究所 山东第一医科大学附属青岛眼科医院 山东省眼科学重点实验室-省部共建国家重点实验室培育基地,青岛 266071
目前,眼底新生血管性疾病的一线治疗方法是玻璃体腔内注射抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物。然而,随着抗VEGF制剂临床应用的日益广泛及随访时间的延长,发现抗VEGF治疗后无论是脉络膜还是视网膜新生血管均可发生严重纤维化,尤其是视网膜新生血管纤维化,短期内即可造成牵拉性视网膜脱离,脉络膜新生血管纤维化也严重影响视功能的恢复。因此,在抗VEGF治疗的同时如何减轻新生血管纤维化引起了广泛关注。本课题组前期研究证实,贝伐单抗对纤维化发生过程有调控作用,抗VEGF处理后纤维化及炎性因子的表达水平发生变化。有研究表明,抗VEGF处理后,RPE细胞中活性氧簇(reactive oxygen species,ROS)水平也明显升高,抗氧化功能降低,ROS水平升高与细胞纤维化发生直接相关。ROS在视网膜色素上皮(retinal pigment epithelium,RPE)细胞的上皮-间质转化(epithelial-mesenchymal transition,EMT)中起到促进作用。机体细胞中产生ROS的一个主要来源是还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶介导的氧化应激反应。NADPH氧化酶(NADPH oxidase,NOX)表达于血管内皮和血管平滑肌等多种细胞内,是血管系统ROS的主要来源。本课题组前期研究发现NOX4的过度表达使ROS水平升高,而抑制NOX4活性仅降低了ROS产生的基础水平,这表明NOX4并非刺激内皮细胞产生ROS的主要酶。已有研究发现,缺氧可引起细胞中NOX高表达,也可诱导肾小管上皮细胞纤维化。抑制NOX表达可抑制血管内皮细胞增生。这些发现提示NOX4的表达在细胞纤维化中发挥重要作用。EMT的特征之一在于诱导上皮基因的丢失以及多种细胞外基质蛋白的表达。闭锁小带蛋白-1(zonula occludens-1,ZO-1)是细胞紧密连接重要组成蛋白之一,其穿梭于质膜和细胞核或细胞质之间,参与信号传导途径。EMT发生期间,ZO-1分子受到破坏,其参与细胞骨架构成和维持细胞极性的特性减弱,细胞发生形态学变化。纤维连接蛋白(fibronectin,FN)作为一种高分子量糖蛋白,主要以3种形式存在,其中1种是由成纤维细胞和早期间充质细胞分泌合成,并在EMT过程中生成量增加。波形蛋白(Vimentin)是中间丝的其中1种蛋白质,其与微管及肌动蛋白微细丝组成细胞骨架,可锚定和支撑间充质细胞胞质内的细胞器,可作为EMT的标志物。与此机制相似的因子还有α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)。NOX在促进视网膜血管纤维化中有潜在作用,已有研究证实NOX可调节VEGF的表达,然而至今尚无NOX调控RPE细胞发生EMT的直接证据。本研究拟探讨NOX4抑制剂对抗VEGF治疗导致的人RPE细胞发生EMT的影响。
1 材料与方法
1.1 材料
1
.1
.1
细胞来源 ARPE-19细胞系购于上海赛百慷生物科技有限公司。1
.1
.2
主要试剂及仪器 DMEM/F-12培养基、胎牛血清、青霉素-链霉素(美国Gibco公司);贝伐单抗(瑞士Genentech公司);NOX4抑制剂VAS2870和GKT137831(美国MCE公司);驴血清蛋白、高效RIPA细胞快速裂解液、苯甲基磺酰氟(北京索莱宝科技有限公司);PCR试剂盒(南京诺唯赞生物科技股份有限公司);Trizol、4,6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)、兔抗人ZO-1一抗(40-2300)(美国Invitrogen公司);兔抗人Vimentin一抗(10366-1-AP)、488标记山羊抗兔IgG(H+L)(SA00013-2)(美国Proteintech公司);兔抗人α-SMA一抗(ab32575)、兔抗人FN一抗(ab2413)、兔抗人NOX4一抗(ab133303)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗(ab8245)、生物素标记羊抗兔二抗(ab150077)(英国Abcam公司);化学发光液(美国Millpore公司)。T75细胞培养瓶及6孔板(美国Corning公司);激光扫描共聚焦显微镜(日本Nikon公司);荧光定量PCR仪、Western blot电泳仪(美国Bio-Rad公司)。1.2 方法
1
.2
.1
细胞培养及分组 采用含有体积分数10%胎牛血清、100 U/ml(商品单位)青霉素和链霉素混合液的DMEM培养基、在37 ℃、体积分数5% CO培养箱中培养ARPE-19细胞,3~4 d传代。将传代后的RPE细胞按1×10个/ml接种于6孔板中,达到60%~70%融合时更换为含有2%胎牛血清的DMEM/F-12培养基,并将细胞分为空白对照组、贝伐单抗组、贝伐单抗+VAS2870组和贝伐单抗+GKT137831组,其中空白对照组不做任何处理,贝伐单抗组、贝伐单抗+VAS2870组和贝伐单抗+GKT137831组培养基中分别加入0.25 g/L贝伐单抗、0.25 g/L贝伐单抗+3 μmol/L VAS2870、0.25 g/L贝伐单抗+20 μmol/L GKT137831继续培养72 h。1
.2
.2
实时荧光定量PCR法检测各组细胞中FN、Vimentin、α-SMA、ZO-1及NOX4 mRNA的表达 收集各组细胞,用Trizol提取细胞中的总RNA,按照试剂盒说明逆转录为cDNA。引物由青岛德罗海达生物技术有限公司设计并合成。FN正向引物序列:5'-GGGACCGTCAGGGAGAAAA-3',反向引物序列:5'-CGAGATATTCCTTCTGCCACTGTT-3';Vimentin正向引物序列:5'-GCAGGAGGCAGAAGAATGGTA-3',反向引物序列:5'-GGGACTCATGGTTCCTTTAAGG-3';α-SMA正向引物序列:5'-GGTGACGAAGCACAGAGCAA-3',反向引物序列:5'-CAGGGTGGGATGCTCTTCAG-3';ZO-1正向引物序列:5'-AGGATCCATATCCCGAGGAAA-3',反向引物序列:5'-CGAGGTCTCTGCTGGCTTGT-3';NOX4正向引物序列:5'-CAACTGTTCCTGGCCTGACA-3',反向引物序列:5'-GCAACGTCAGCAGCATGTAGA-3';GAPDH正向引物序列:5'-CATGTTCGTCATGG GTGTGAA-3',反向引物序列:5'-GGCATGGACTGT GGTCATGAG-3'。采用ABI7500 Real-Time PCR系统,按照Real Master Mix(SYBR green)试剂盒说明书加入试剂进行PCR反应。反应条件:95 ℃预变性30 s,1个循环;95 ℃变性5 s,60 ℃退火30 s,扩增40个循环。实验独立重复3次,以GAPDH为内参,采用2法计算目的基因的相对表达量。1
.2
.3
Western blot法检测各组细胞中FN、Vimentin、α-SMA、ZO-1及NOX4蛋白的表达 将各组细胞用裂解缓冲液在冰上裂解30 min后收集超声10 s,离心半径10 cm,4 ℃、12 000 r/min离心10 min后收集上清,采用BCA蛋白测定试剂盒定量蛋白浓度。将提取的总蛋白30 μg在上样缓冲液中煮沸10 min,质量分数10%聚丙烯酰胺凝胶电泳,转印至硝酸纤维素膜,50 g/L脱脂牛奶室温封闭1 h,一抗4 ℃孵育过夜(FN和NOX稀释比例均为1∶ 1 000,Vimentin、α-SMA和ZO-1稀释比例均为1∶ 2 000);洗膜,滴加相应二抗(1∶ 2 000)在室温下孵育1 h,再次洗膜并使用Gel-Del凝胶成像系统(美国Bio-Rad公司)使蛋白信号可视化。以GAPDH作为内参蛋白,采用ImageJ软件分析条带灰度。1
.2
.4
细胞免疫荧光染色检测FN、Vimentin、α-SMA和ZO-1蛋白表达的分布 将ARPE-19细胞接种到6孔板中,按照实验分组处理细胞后,弃去培养基,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤3次,室温下用40 g/L多聚甲醛固定20 min。PBS洗涤3次,检测α-SMA和Vimentin时用体积分数0.2% Triton X-100透化细胞1 min,检测NOX4时用0.5% Triton X-100透化细胞30 min,检测ZO-1和FN时不透化,再次PBS洗涤3次后,将细胞用体积分数10%驴血清蛋白在37 ℃封闭30 min,1∶ 200稀释一抗,并在4 ℃条件下孵育过夜,PBS洗涤后在室温下将细胞用FITC标记的驴抗兔IgG(1∶ 200)避光孵育1 h,PBS洗涤细胞并用DAPI复染细胞核,使用激光扫描共聚焦显微镜捕获图像。1.3 统计学方法
采用SPSS 19.0统计学软件进行统计分析。本研究中计量资料经Shapiro-Wilk检验证实呈正态分布,以表示,空白对照组、贝伐单抗组、贝伐单抗+VAS2870组、贝伐单抗+GKT137831组间总体比较采用单因素方差分析,组间两两比较采用SNK-q
检验。P
<0.05为差异有统计学意义。2 结果
2.1 各组细胞中FN、Vimentin、α-SMA、ZO-1及NOX4 mRNA相对表达量比较
空白对照组、贝伐单抗组、贝伐单抗+VAS2870组和贝伐单抗+GKT137831组细胞中FN、Vimentin、α-SMA、ZO-1和NOX4 mRNA相对表达量组间总体比较差异均有统计学意义(F
=97.07、195.40、722.40、38.56、70.81,均P
<0.001),其中贝伐单抗组FN、Vimentin、α-SMA和NOX4 mRNA相对表达量明显高于空白对照组,ZO-1 mRNA相对表达量明显低于空白对照组,差异均有统计学意义(均P
<0.05)。贝伐单抗+VAS2870组和贝伐单抗+GKT137831组细胞中FN、Vimentin、α-SMA和NOX4 mRNA相对表达量明显低于贝伐单抗组,ZO-1 mRNA相对表达量明显高于贝伐单抗组,差异均有统计学意义(均P
<0.05)(表1)。表1 各组细胞中FN、Vimentin、α-SMA、ZO-1及NOX4 mRNA相对表达量比较 (x±s)Table 1 Comparison of mRNA expression of FN,vimentin,α-SMA,ZO-1 and NOX4 in cells among various groups (x±s)组别样本量不同基因mRNA相对表达量FNVimentinα-SMAZO-1NOX4空白对照组30.670±0.0460.768±0.0110.751±0.0291.277±0.0140.446±0.011贝伐单抗组31.002±0.086a1.000±0.030a1.000±0.022a1.003±0.091a1.007±0.089a贝伐单抗+VAS2870组30.605±0.025b0.630±0.021b0.345±0.018b1.662±0.007b0.297±0.057b贝伐单抗+GKT137831组30.272±0.008b0.559±0.019b0.241±0.010b1.674±0.129b0.259±0.008bF值97.07195.40722.4038.5670.81P值<0.001<0.001<0.001<0.001<0.001 注:与空白对照组比较,aP<0.05;与贝伐单抗组比较,bP<0.05(单因素方差分析,SNK-q检验) FN:纤维连接蛋白;Vimentin:波形蛋白;α-SMA:α-平滑肌肌动蛋白;ZO-1:闭锁小带蛋白-1;NOX:还原型烟酰胺腺嘌呤二核苷酸氧化酶 Note:Compared with blank control group,aP<0.05;compared with bevacizumab group,bP<0.05 (One-way ANOVA,SNK-q test) FN:fi-bronectin;α-SMA:α-smooth muscle actin;ZO-1:zonula occludens-1;NOX:nicotinamide adenine dinucleotide phosphate oxidase
2.2 不同分组细胞中FN、Vimentin、α-SMA、ZO-1和NOX4蛋白相对表达量比较
Western blot检测结果显示,空白对照组FN、Vimentin、α-SMA及NOX4条带灰度弱于贝伐单抗组,ZO-1条带灰度强于贝伐单抗组;贝伐单抗+VAS2870组和贝伐单抗+GKT137831组的FN、Vimentin、α-SMA和NOX4条带灰度弱于贝伐单抗组,ZO-1条带灰度强于贝伐单抗组(图1)。空白对照组、贝伐单抗组、贝伐单抗+VAS2870组和贝伐单抗+GKT137831组中FN、Vimentin、α-SMA、ZO-1和NOX4的蛋白相对表达量总体比较差异均有统计学意义(F
=23.09、64.58、58.19、26.97、63.19,均P
<0.001),其中贝伐单抗组FN、Vimentin、α-SMA和NOX4蛋白相对表达量明显高于空白对照组,ZO-1蛋白相对表达量明显低于空白对照组,差异均有统计学意义(均P
<0.05)。贝伐单抗+VAS2870组和贝伐单抗+GKT137831组FN、Vimentin、α-SMA和NOX4蛋白相对表达量明显低于贝伐单抗组,ZO-1蛋白相对表达量明显高于贝伐单抗组,差异均有统计学意义(均P
<0.05)(表2)。
图1 各组细胞EMT标志物蛋白及NOX4蛋白表达电泳图 1:空白对照组;2:贝伐单抗组;3:贝伐单抗+VAS2870组;4:贝伐单抗+GKT137831组 FN:纤维连接蛋白;Vimentin:波形蛋白;α-SMA:α-平滑肌动蛋白;ZO-1:闭锁小带蛋白-1;NOX:还原型烟酰胺腺嘌呤二核苷酸氧化酶;GAPDH:甘油醛-3-磷酸脱氢酶Figure 1 Electrophoretogram of EMT markers and NOX4 expression among various groups 1:blank control group;2:bevacizumab group;3:bevacizumab+VAS2870 group;4:bevacizumab+GKT137831 group FN:fibronectin;α-SMA:α-smooth muscle actin;ZO-1:zonula occludens-1;NOX:nicotinamide adenine dinucleotide phosphate oxidase;GAPDH:glyceralde-3-phosphate dehydrogenase
表2 各组细胞中FN、Vimentin、α-SMA、ZO-1及NOX4蛋白相对表达量比较(x±s)Table 2 Comparison of FN,vimentin,α-SMA,ZO-1 and NOX4 expression in cells among various groups (x±s)组别样本量不同蛋白相对表达量FNVimentinα-SMAZO-1NOX4空白对照组30.622±0.0650.466±0.0850.570±0.0321.695±0.2090.519±0.042贝伐单抗组31.002±0.016a1.003±0.021a1.000±0.022a1.002±0.041a1.007±0.089a贝伐单抗+VAS2870组30.423±0.157b0.566±0.041b0.529±0.058b1.932±0.112b0.448±0.099b贝伐单抗+GKT137831组30.305±0.155b0.655±0.039b0.452±0.077b2.032±0.074b0.275±0.076bF值23.0964.5858.1926.9763.19P值<0.001<0.001<0.001<0.001<0.001 注:与空白对照组比较,aP<0.05;与贝伐单抗组比较,bP<0.05(单因素方差分析,SNK-q检验) FN:纤维连接蛋白;Vimentin:波形蛋白;α-SMA:α-平滑肌肌动蛋白;ZO-1:闭锁小带蛋白-1;NOX:还原型烟酰胺腺嘌呤二核苷酸氧化酶 Note:Compared with blank control group,aP<0.05;compared with bevacizumab group,bP<0.05 (One-way ANOVA,SNK-q test) FN:fi-bronectin;α-SMA:α-smooth muscle actin;ZO-1:zonula occludens-1;NOX:nicotinamide adenine dinucleotide phosphate oxidase
2.3 各组细胞EMT标志物蛋白表达情况比较
免疫荧光染色结果显示,FN主要表达于细胞外基质,呈绿色荧光。贝伐单抗组FN荧光强度明显强于空白对照组,贝伐单抗+VAS2870组和贝伐单抗+GKT137831组FN荧光强度均明显减弱。Vimentin和α-SMA主要表达于细胞质,均呈绿色荧光。贝伐单抗组Vimentin和α-SMA荧光强度明显强于空白对照组,贝伐单抗+VAS2870组和贝伐单抗+GKT137831组较贝伐单抗组荧光强度明显减弱。ZO-1主要表达于细胞膜,呈绿色荧光。贝伐单抗组ZO-1荧光强度明显弱于空白对照组,贝伐单抗+VAS2870组和贝伐单抗+GKT137831组荧光强度明显强于贝伐单抗组(图2)。
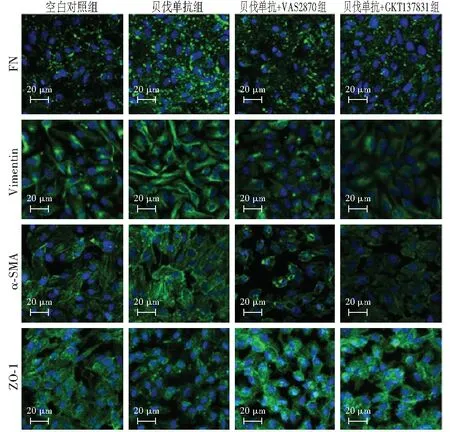
图2 各组细胞中EMT标志物蛋白的免疫荧光染色表现(DAPI ×200,标尺=20 μm) FN主要表达于细胞外基质,Vimentin、α-SMA主要表达于细胞质,ZO-1主要表达于细胞膜,均呈绿色荧光,细胞核呈蓝色荧光。贝伐单抗组FN、Vimentin、α-SMA荧光强度强于空白对照组;ZO-1荧光强度弱于空白对照组;贝伐单抗+VAS2870组和贝伐单抗+GKT137831组FN、Vimentin、α-SMA荧光强度弱于贝伐单抗组,ZO-1荧光强度强于贝伐单抗组 FN:纤维连接蛋白;Vimentin:波形蛋白;α-SMA:α-平滑肌肌动蛋白;ZO-1:闭锁小带蛋白-1Figure 2 Immunofluorescence staining of EMT markers among various groups (DAPI ×200,bar=20 μm) FN mainly expressed in extracellular matrix,vimentin and α-SMA in cytoplasm,and ZO-1 in cell membrane,all of which showed green fluorescence,and the nuclei presented blue fluorescence (DAPI).The immunofluorescence intensity of FN,vimentin and α-SMA were stronger and the immunofluorescence intensity of ZO-1 was weaker in bevacizumab group than those in blank control group.The immunofluorescence intensity of FN,vimentin and α-SMA were weaker and the immunofluorescence intensity of ZO-1 was stronger in bevacizumab+VAS2870 and bevacizumab+GKT137831 groups than bevacizumab group FN:fibronectin;α-SMA:α-smooth muscle actin;ZO-1:zonula occludens-1
2.4 空白对照组和贝伐单抗组细胞NOX4免疫荧光染色情况比较
免疫荧光染色结果显示,NOX4主要表达于细胞质,呈绿色荧光。与空白对照组相比,贝伐单抗组中NOX4荧光强度明显较强(图3)。
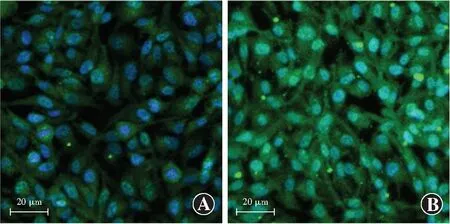
图3 贝伐单抗组和空白对照组细胞中NOX4的免疫荧光染色表现(DAPI ×200,标尺=20 μm) NOX4主要表达于细胞质,呈绿色荧光,细胞核呈蓝色荧光(DAPI)。可见贝伐单抗组NOX4表达强于空白对照组 A:空白对照组 B:贝伐单抗组Figure 3 Immunofluorescence staining of NOX4 in bevacizumab group and blank control group(DAPI ×200,bar=20 μm) NOX4 was mainly expressed in cytoplasm,showing green fluorescence.Nuclei presented blue fluorescence (DAPI).The immunofluorescence intensity of NOX4 was higher in bevacizumab group than blank control group A:blank control group B:bevacizumab group
3 讨论
抗VEGF治疗使众多眼部新生血管性疾病患者视力得以提高,但新生血管的纤维化影响了患者的视力获益,RPE细胞对于维持正常视觉功能至关重要,其EMT与视网膜纤维化发病机制有关。RPE细胞经EMT过程形成成纤维细胞样细胞,并产生细胞外基质成分,参与视网膜纤维化组织的形成。因此在抗VEGF治疗同时抑制纤维化的发生具有重要意义。
许多疾病的发生与氧化应激有关。ROS是氧正常代谢的天然副产物,其包括超氧化物和HO,在细胞信号转导和维持体内平衡中具有重要作用,但在氧化应激状态下,ROS产生增多则会导致细胞损伤并危害机体健康。本课题组前期研究发现,贝伐单抗处理细胞后可使ROS和纤维化相关因子水平升高,因此ROS在RPE细胞的EMT过程中起到促进作用。
NOX是调控ROS产生的重要上游信号,NADPH氧化还原酶的NOX家族在ROS参与转化生长因子β介导的EMT发生过程中具有重要作用。NOX家族由NOX1、NOX2、NOX3、NOX4、NOX5、双重氧化酶1(Duox1)和Duox2共7个亚型组成。其中,NOX4是表达丰富、分布广泛的NOX亚型之一。与其他NOX成员不同,即使在没有胞质调节剂的情况下,NOX4也具有结构活性,这使得NOX4在控制内皮细胞的氧化还原状态和细胞内信号转导方面具有重要作用。在此之前的研究中,我们发现NOX4通过ROS机制调节信号通路促进视网膜新生血管的生成,但NOX抑制剂对EMT的影响未见直接证据。了解NOX抑制剂能否抑制及逆转抗VEGF抑制剂诱导的EMT对于新生血管的防治具有重要意义。
本研究观察了贝伐单抗对ARPE19细胞中NOX4表达水平的影响,发现培养基中加入贝伐单抗后,在EMT标志物发生变化的同时,细胞中NOX4 mRNA和蛋白表达水平均增高,而加入NOX4抑制剂GKT137831或VAS2870后,NOX4呈低表达状态,EMT标志物中FN、Vimentin和α-SMA表达水平降低,ZO-1表达水平升高,表明由贝伐单抗引起的EMT发生了逆转,NOX4的表达与EMT密切相关,下调NOX4对贝伐单抗引起的ARPE19细胞的EMT有抑制作用,验证了NOX4可能参与EMT的调控。有研究发现NOX4在大鼠晶状体上皮细胞、人胸膜间皮细胞和人肾小管上皮细胞EMT过程中发挥一定作用,而NOX4抑制剂可以减轻纤维化程度,与本研究结果一致。本研究使用了2种不同的NOX4抑制剂,体外实验观察了NOX4的表达,均使贝伐单抗诱发的EMT发生逆转。由此可以推测多种NOX4抑制剂具有成为临床有效纤维化抑制剂的可能。
综上所述,NOX4在视网膜纤维化形成中可能发挥重要的调节作用,NOX4抑制剂可能减少抗VEGF治疗所诱发的新生血管过度纤维化的发生,这可能为年龄相关性黄斑变性等脉络膜新生血管疾病的治疗提供新的思路。但本实验仅观察了2种NOX4抑制剂处理RPE细胞的生物学行为,并未在动物模型中证实,因此需要在下一步的研究中进行相关动物实验,进一步检测参与调控发生纤维化过程的诱导因子VEGF及各类炎性因子变化,并探讨不同NOX抑制剂在不同浓度时在体内相关通路中不同程度的影响。
利益冲突
所有作者均声明不存在任何利益冲突作者贡献声明
徐海峰:参与选题和研究设计、研究过程指导、数据和资料分析、文章主要内容修改和定稿;谢超慧:参与研究设计和实验实施、收集和分析数据、论文撰写及修改和定稿;郝相慧:参与研究实施、收集和分析数据;杨玲玲:实验指导,对文章知识性内容的审阅和智力性内容的修改